还原型谷胱甘肽对C57BL/6J小鼠体外受精的影响
赵 晨, 张双琴, 王利凤, 李 薇(上海交通大学实验动物中心, 上海 200240)
还原型谷胱甘肽对C57BL/6J小鼠体外受精的影响
赵 晨, 张双琴, 王利凤, 李 薇
(上海交通大学实验动物中心, 上海 200240)
[摘要]目的 探讨受精液中添加还原型谷胱甘肽(GSH)对C57BL/6J小鼠体外受精的影响。 方法 以体外受精液(HTF)作为对照, 在HTF液中添加不同浓度(0.25 mmol/L、0.50 mmol/L、0.75 mmol/L、1.00 mmol/L、1.25 mmol/L和1.50 mmol/L)的GSH,对C57BL/6J近交系小鼠进行体外受精实验,观察体外受精和早期胚胎发育情况。同时,用5种C57BL/6J小鼠背景的基因工程小鼠加以验证。结果 与对照组相比,实验组的体外受精率显著升高,浓度为0.50 mmol/L时,体外受精率提高显著(P<0.05),浓度在1.25 mmol/L时,体外受精率最高(P<0.01)。受精卵的体外囊胚发育率实验组与对照组无显著性差异(P>0.05)。C57BL/6J背景的基因工程小鼠的体外受精率和体外囊胚发育率与C57BL/6J近交系小鼠相似。结论 在HTF中添加一定浓度的GSH能够提高C57BL/6J小鼠及C57BL/6J背景的基因工程小鼠的体外受精效果。
[关键词]还原型谷胱甘肽(GSH); C57BL/6J小鼠; 体外受精
E-mail: zhaochenjnpy@163.com
C57BL/6J小鼠为近交系小鼠,由于其具有遗传信息稳定等特点,基因工程小鼠多以C57BL/6J小鼠为遗传背景[1-5]。近年来,随着CRISPR/Cas9等基因编辑技术的发展,越来越多的基因工程小鼠模型应用于科学研究[6-8]。然而很多基因工程小鼠由于多方面的原因出现难以生育或濒临死亡等问题,直接影响了科研工作的正常进行。针对这种情况,以体外受精为代表的辅助生殖技术受到广泛关注[9-11]。体外受精中,透明带是精子最难穿越屏障,Cohen等[12]和Gorden等[13]分别通过物理方法或化学方法,解决了上述问题,但因其操作复杂、设备昂贵等原因而难以推广。谷胱甘肽(GSH)对人、牛等动物体外受精起促进作用的报道已有很多[14-16], 本研究通过在体外培养液中添加不同浓度的GSH,探讨其在阻止卵母细胞透明带硬化,提高C57BL/6J小鼠体外受精率中的作用,同时用5种以C57BL/6J小鼠为遗传背景的基因工程小鼠进行验证。
1 材料与方法
1.1 实验动物
SPF级C57BL/6J小鼠, 4周龄雌性103只, 12周龄雄性7只,购自上海斯莱克实验动物有限责任公司[SCXK(沪)2012-0002]。5种基因工程小鼠购自美国Jackson实验室, 在上海交通大学实验动物中心屏障环境中[SYXK(沪)2013-0052]繁殖扩群获得SPF级后代。温度为21~25 ℃,相对湿度为40%~60%,小鼠自由采食和饮水。光照明暗周期为12 h∶12 h (8∶00 am~8∶00 pm,为光照时间)。
1.2 试剂与仪器
试剂: 还原型谷胱甘肽(美国Sigma, G6013-5G);注射用孕马血清素(PMSG)(生产批号:140825),规格为1 000 IU/支,注射用人绒毛促性腺激素(hCG)(生产批号: 140220),规格为500 IU/支,均为宁波第二激素厂生产,冻干粉剂, 保存于4 ℃,使用前用生理盐水配置成稀释液; 矿物油(美国Sigma,M5310-500ML),KSOM培养基(Millipore,MR-020-5F)、体外受精液(HTF)培养基由本实验自行配制(参考《小鼠胚胎操作实验指南》),配置后用0.22 mm的滤器过滤。
仪器: 超净工作台, CO2恒温培养箱(Thermo),显微镜(Zeiss), 超纯水仪(Millipore),高压灭菌锅(Zealway),培养皿(Falcon),自制洗卵针,显微镊,移液枪,酒精灯等。
1.3 方法
1.3.1 GSH受精液配制 分别配置含0.25 mmol/L、0.50 mmol/L、0.75 mmol/L、1.00 mmol/L、1.25 mmol/L和1.50 mmol/L GSH的HTF培养基,用0.22 mm的过滤器过滤后作为受精液备用。以不含GSH的HTF培养基为对照组。
1.3.2 精子采集、超数排卵及采卵 参照Nagy等[17]方法,采用颈椎脱臼法处死雄鼠,取其附睾尾,将附睾尾移至HTF培养基中,用显微镊刺破附睾尾,迫使精子流出,获能1 h。
雌鼠腹腔注射7.5 IU的PMSG,48 h后再腹腔注射7.5 IU的hCG,注射后14~15 h取卵。取双侧输卵管放入HTF中,用显微镊将卵子团拖出。
1.3.3 体外受精 采用Nagy等[17]方法进行体外受精, 次日早晨统计2-细胞胚胎数和体外受精率(2-细胞胚胎数/分离的卵母细胞总数×100%)。
1.3.4 胚胎发育至囊胚 将上述形态正常的2-细胞期胚胎在KSOM培养基中洗3次, 然后转移至KSOM培养基中, 放入37 ℃、体积分数5% CO2恒温培养箱中培养至囊胚期。观察各组胚胎形成数目, 统计囊胚形成率(囊胚数/2-细胞胚胎数×100%)。
1.4 统计分析
2 结果
2.1 GSH对体外受精率和囊胚形成率的影响
与对照组比较,GSH浓度达到0.50 mmol/L时即可观察到体外受精效率的显著提高(P<0.05)。当GSH浓度介于0.25 mmol/L至1.25 mmol/L时, 随着GSH浓度增高, 体外受精效率也随之提高, 详见表1。
2.2 GSH对5种以C57BL/6J小鼠为遗传背景的基
因工程小鼠体外受精率和囊胚形成率的影响
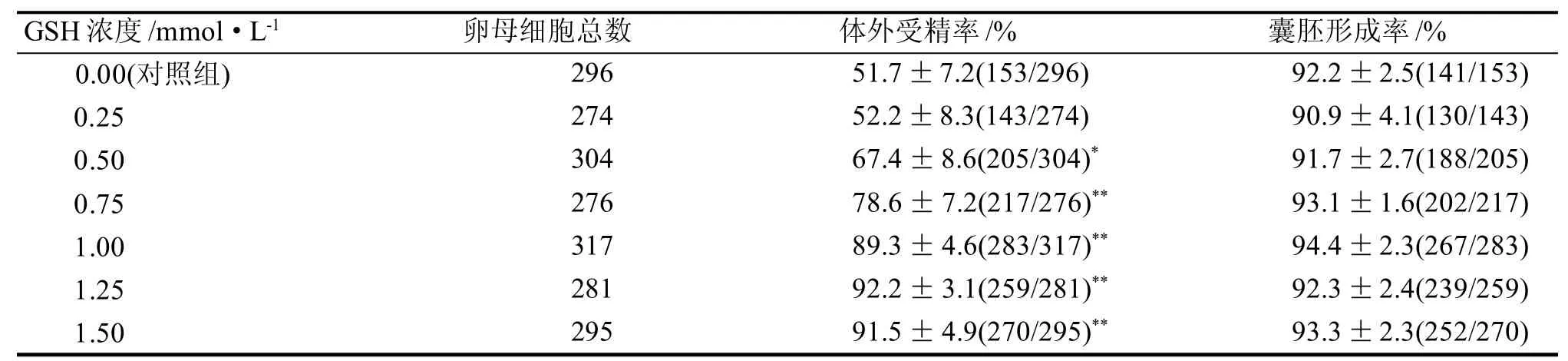
表1 GSH对C57BL/6J小鼠体外受精率和囊胚形成率的影响
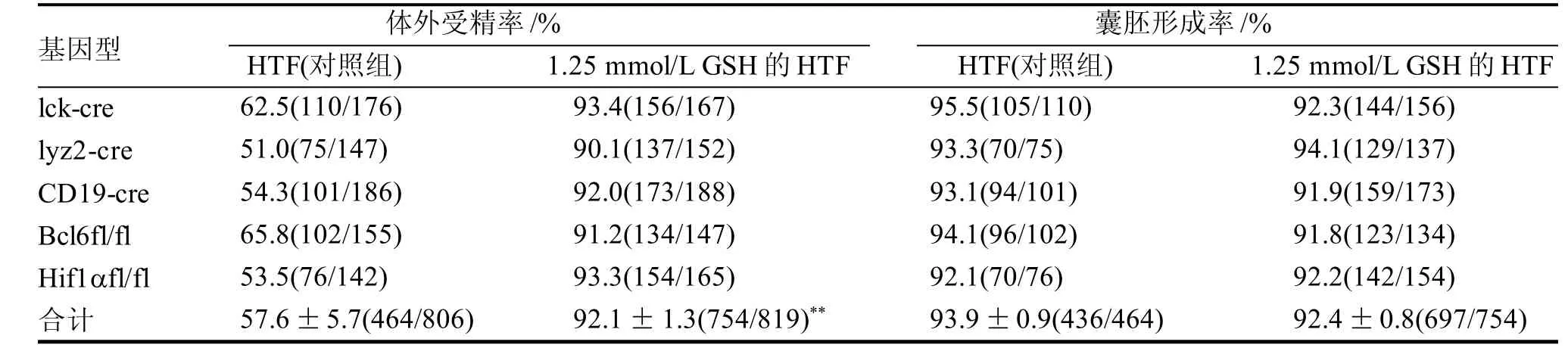
表2 GSH对基因工程小鼠体外受精率和囊胚形成率的影响
3 讨论
关于实验小鼠体外受精技术的研究报道很多,其结果大多与小鼠的体外受精与体外受精培养液、实验动物的遗传背景、实验人员操作技术、实验条件等多种因素有关。徐平等[18]曾报道13个品系小鼠的体外受精率为15.1%~87.9%; 赵丹凤等[19]研究了35个品系小鼠的体外受精率,结果显示受精率为15.2%~97.2%; 朱佳伟等[20]曾报道,昆明鼠体外受精率为81.7% ,表明遗传背景不同的小鼠体外受精率有显著差异。相关研究中有关C57BL/6J近交系小鼠的体外受精率的报道存在不同的结果,徐平等[18]的研究结果显示C57BL/6J小鼠体外受精率为83.6%,Takeo等的研究结果为85.7%[21],而吴红等[22]的结果为34%,本研究的结果为51.7%,表明不同实验条件、HTF试剂来源等方面的差异是造成C57BL/6J小鼠体外受精率结果不同的主要原因。
GSH是一种生物抗氧化剂, 包含一个巯基基团。当GSH与二硫键发生作用时, 它可使二硫键成为两个巯基[23,24], 因此它对细胞外源性和内源性化合物的解毒和抗氧化起着重要作用[25-27]。Perreault等[28]报道在仓鼠的受精过程和雄原核形成过程中有GSH的参与。Iwamoto等[29]报道牛卵母细胞受精过程中伴随透明带上半胱残基的氧化,巯基基团变为二硫键参与了卵母细胞透明带的硬化过程,并且阻止精子穿过透明带。GSH可使透明带上的二硫键转化为巯基。本实验中GSH对C57BL/6J小鼠体外受精的促进作用,可能是由于其阻止卵母细胞透明带的硬化, 促进精子穿过透明带, 进而提高了受精效率。
朱佳伟等[20]报道,在昆明鼠体外受精液中添加300 mmol/L GSH,能够显著提高受精率。本研究以梯度浓度(0.25mmol/L, 0.5mmol/L, 0.75mmol/L,1.00mmol/L,1.25mmol/L,1.50mmol/L)添加GSH 到HTF液中,探讨GSH对C57BL/6J小鼠的体外受精的影响,结果显示体外受精率的提高依赖于GSH浓度,与上述报道基本一致,当在体外受精液中添加GSH浓度为1.00 mmol/L至1.50 mmol/L时,其受精率达到89%以上,与对照组相比,受精率显著提高,且体外受精时添加的GSH并未影响胚胎由2-细胞期胚胎发育至囊胚期,表明一定浓度的GSH能够提高C57BL/6J小鼠体外受精率,且不影响早期胚胎发育。在5种基因工程小鼠体外受精液中添加浓度为1.25 mmol/L的GSH, 进行5种基因工程小鼠的体外受精实验, 证实了添加GSH能够提高以C57BL/6J小鼠为遗传背景的基因工程小鼠体外受精率,验证了其在实际应用中的可行性。参考文献:
[1] Kazuyuki M, Kuniya A, Ayumi M, et al. Genetic differences among C57BL/6 substrains [J]. Exp Anim, 2009, 58(2):141-149.
[2] Frazer KA, Eskin E, Kang HM, et al. A sequenced-based variation map of 8.27 million SNPs in inbred mouse strains [J]. Nature, 2007, 448(7157):1050-1053.
[3] Yoichi G. Trends in large-scale mouse mutagenesis: from genetics to functional genomics [J]. Nat Rev Genet, 2008, 9 (10):803-810.
[4] Tracy H. Knockout science: massive mouse project to provide window into human diseases [J]. JAMA, 2011, 306(18): 1968.
[5] Alison A. Mouse project to find each gene’s role [J]. Nature, 2010, 465(7297):410.
现阶段我国部分地区中出现中小微企业招工困难的问题,而与此同时随着教育普及化的不断深入发展,高校毕业生的数量逐年增多,大学生的职业生涯发展成为亟待解决的问题。企业的招工难及大学生就业难问题是多种因素影响下的结果,也是社会经济发展迅速与社会就业需求供给结构矛盾的重要反应,因此应着重解决我国就业结构中的矛盾性问题。
[6] Jinek M, Chylinski K, Fonfara I, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity [J]. Science, 2012, 337(6096):816-821.
[7] Cong L, Ran FA, Cox D, et al. Multiplex genome engineering using CRISPR/Cas systems [J]. Science, 2013, 339(6121): 819-823.
[8] Wang H, Yang H, Shivalila CS, et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Casmediated genome engineering [J]. Cell, 2013, 153(4):910-918. [9] Nakagata N, Takeo T, Fukumoto K, et al. Applications of cryopreserved unfertilized mouse oocytes for in vitro fertilization [J]. Cryobiology, 2013, 67(2):188-192.
[10] Sztein JM, Farley JS, Mobraaten LE. In vitro fertilization with cryopreserved inbred mouse sperm [J]. Biol Reprod, 2000, 63 (6):1774-1780.
[11] Takahashi H, Liu C. Archiving and distributing mouse lines by sperm cryopreservation, IVF, and embryo transfer [J]. Methods Enzymol, 2010, 476:53-69.
[12] Cohen J, Malter H, Fehilly C, et al. Implantation of embryos after partial opening of oocyte zona pellucida to facilitate sperm penetration [J]. Lancet, 1988, 2(8603):162.
[13] Gordon JW, Talansky BE. Assisted fertilization by zona drilling: a mouse model for correction of oligospermia [J]. J Exp Zool, 1986, 239(3):347-354.
[14] Gadea J, Molla M, Selles E, et al. Reduced glutathione content in human sperm is decreased after cryopreservation: effect of the addition of reduced glutathione to the freezing and thawing extenders [J]. Cryobiology, 2011, 62(1):40-46.
[15] 魏红芳, 张长兴, 昝林森, 等. 谷胱甘肽(GSH)对牛卵母细胞体外受精胚胎发育的影响 [J].安徽农业科学, 2009, 37 (33):16398-16404.
[16] De Mercado E, Hernandez M, Sanz E, et al. Evaluation of l-glutamine for cryopreservation of boar spermatozoa [J]. Anim Reprod Sci, 2009, 115(1-4):149-157.
[17] Nagy A, Gertsenstein M, Vintersten K, et a1. Manipulating the Mouse Embryo: A Labomtory Manual [M]. 3rd edition. New York: Cold Spring Harbor Laboratory Press, 2003:411-434.
[18] 徐平, 山村绫子, 唐一岷. 不同品系小鼠的体外受精、胚胎冷冻及移植的比较研究 [J]. 中国实验动物学报, 2004, 12(3):147-151.
[19] 赵丹凤, 刘丽均, 赵立虎, 等. 不同遗传背景小鼠的超排与体外受精率的比较研究 [J]. 上海交通大学学报, 2006, 24 (5):465-470.
[20] 朱佳伟, 周佳勃. GSH对小鼠卵母细胞体外成熟体外受精的影响[D]. 哈尔滨: 东北农业大学, 2008.
[21] Takeo T, Nakagata N. Combination medium of cryoprotective agents containing l-glutamine and methyl-{beta} -cyclodextrin in a preincubation medium yields a high fertilization rate for cryopreserved C57BL/6J mouse sperm [J]. Lab Anim, 2010, 44(2):132-137.
[22] 吴红, 孙强, 范士明, 等. 不同品系小鼠体外受精方法的研究 [J]. 扬州大学学报, 2004, 25(1):18-21.
[23] Sies H. Glutathione and its role in cellular functions [J]. Free Radic Biol Med, 1999, 27(9-10):916-921.
[24] Gilbert HF. Catalysis of thiol/disulfide exchange: singleturnover reduction of protein disulfide-isomerase by glutathione and catalysis of peptide disulfide reduction [J]. Biochemistry, 1989, 28(18):7298-7305.
[25] Bath ML. Inhibition of in vitro fertilizing capacity of cryopreserved mouse sperm by factors released by damaged sperm, and stimulation by glutathione[J]. PLoS One, 2010, 5 (2):e9387.
[26] Pastore A, Federici G, Bertini E, et al. Analysis of glutathione:implication in redox and detoxification [J]. Clin Chim Acta, 2003, 333(1):19-39.
[27] Maher P. The effects of stress and aging on glutathione metabolism [J]. Ageing Res Rev, 2005, 4(2):288-314.
[28] Perreault SD, Barbee RR, Slott VL. Importance of glutathione in the acquisition and maintenance of sperm nuclear decondensing activity in maturing hamster oocytes [J]. Dev Biol, 1988, 125(1):181-186.
[29] Iwamoto K, Ikeda K, Yonezawa N, et al. Disulfide formation in bovine zona pellucida glycoproteins during fertilization: evidence for the involvement of cysteine cross-linkages in hardening of the zona pellucida [J]. J Reprod Fertil, 1999, 117 (2):395-402.
Influence of Reduced Glutathione Added Medium on in vitro Fertilization in C57BL/6J Mouse
ZHAO Chen, ZHANG Shuang-qin, Wang Li-feng, LI Wei
(Laboratory Animal Center, Shanghai Jiao Tong University, Shanghai 200240, China)
[Abstract]Objective To study the influence of reduced glutathione (GSH) in fertilization medium on the in vitro fertilization (IVF) in C57BL/6J mouse. Methods The fertilization medium without reduced glutathione was prepared as control group, and the different concentrations of GSH (0.25 mmol/L, 0.50 mmol/L, 0.75mmol/L, 1.00mmol/L, 1.25mmol/L and 1.50mmol/L) were added to the fertilization medium during IVF, which were divided into 6 experimental groups, to investigate its effect on the fertilization and early embryo development of C57BL/6J inbred mice. In addition, 5 strains of genetically engineered mice having a genetic background of C57BL/6J were chosen to verify the influence of GSH. Results Compared with the control, GSH increased the fertilization rate in a dose-dependent manner. Statistically significant increased fertilization was first observed at 0.5 mmol/L GSH (P<0.05), reaching maximum values at 1.25 mmol/L(P<0.01). The blastocyst developmental rates have no significant difference from that of the control group (P>0.05). Fertilization and development rates of the genetically engineered mice were similar to those of C57BL/6 inbred mice. Conclusion In a certain range of concentration of GSH during the IVF procedure, it can enhance the fertility of C57BL/6J mouse and the genetically engineered mice having a genetic background of C57BL/6J.
[Key words]Reduced glutathione(GSH); C57BL/6J mouse; In vitro fertilization (IVF)
[中图分类号]Q95-33
[文献标识码]A
[文章编号]1674-5817(2016)03-0208-04
doi:10.3969/j.issn.1674-5817.2016.03.010
[收稿日期]2016-01-05
[作者简介]赵 晨(1987-), 男, 硕士研究生, 从事专业: 体外受精和基因工程小鼠的制作。
[通讯作者]李 薇, 高级工程师, 从事专业: 实验动物相关技术与管理。E-mail: liweishen@sjtu.edu.cn

