利谷隆对大鼠Leydig细胞睾酮合成影响及其机制研究*
丁宏伟,阳志文,胡曦尹,胡斌丽,李 岩
(遵义医学院公共卫生学院卫生毒理学教研室,贵州遵义 563099)
利谷隆对大鼠Leydig细胞睾酮合成影响及其机制研究*
丁宏伟,阳志文,胡曦尹,胡斌丽,李岩△
(遵义医学院公共卫生学院卫生毒理学教研室,贵州遵义 563099)
[摘要]目的探讨利谷隆对SD大鼠体外培养睾丸间质细胞(Leydig细胞)睾酮合成的影响及其可能的机制。方法采用SD大鼠睾丸间质细胞体外原代培养体系,利谷隆染毒剂量为0、50、100、200 μmol/L。放射免疫法测定睾酮水平,实时荧光定量PCR(Real-time qPCR)检测Leydig细胞的细胞色素P450侧链裂解酶(P450scc)、3β-羟基固醇脱氢酶(3β-Hsd)的mRNA表达,ELISA检测利谷隆染毒24 h后Leydig细胞P450scc、3β-Hsd蛋白表达情况。结果利谷隆染毒各组睾酮水平下降,其中100、200 μmol/L组与对照组比较差异有统计学意义(P<0.05),并有剂量依赖趋势。与对照组比较,利谷隆染毒各组P450scc和3β-Hsd mRNA表达降低,差异有统计学意义(P<0.05),有剂量依赖趋势。利谷隆染毒各组3β-Hsd的蛋白表达降低,与对照组比较差异均有统计学意义(P<0.05);但P450scc蛋白表达与对照组比较,利谷隆染毒各组差异均无统计学意义(P>0.05)。结论利谷隆可导致大鼠Leydig细胞睾酮分泌量下降,其可能是通过抑制P450scc和3β-Hsd基因的表达,从而影响睾酮合成所致。
[关键词]利谷隆;间质细胞;睾酮;P450侧链裂解酶;3β-羟基固醇脱氢酶
近几年来,环境抗雄激素(antiandrogens)物质对人类的生物学效应已经受到了广泛关注,越来越多的实验结果及流行病学资料表明:环境抗雄激素物质具有生殖与发育毒性,主要表现为男性精子质量下降及数量减少、生殖系统发育异常、生殖肿瘤等,但对其作用机制的认识很有限[1-3]。利谷隆(linuron)是一种广泛使用在种植大豆、玉米、棉花、胡萝卜、小麦、花生、甘蔗、果树等地里的取代脲类低毒农药除草剂,是一种比较弱的抗雄激素物质[4]。白建伟等[5]实验发现,大鼠孕期暴露利谷隆可导致雄性子代永久性的性分化和性发育异常,包括肛门与生殖器距离缩短、附睾畸形等。睾丸间质细胞(Leydig细胞)合成和分泌雄激素,它是男性生殖系统发生、分化和成熟的基础。已知雄激素依赖的信号和下游事件不仅涉及发育过程,也涉及疾病过程,诸如先天性尿道下裂和前列腺癌。最近,循环雄激素对诱导沃尔夫管(Wolffian duct)稳定性和接着形成的附睾及前列腺形成、生殖结节的雄性化和其他雄性特征也显示有重要作用[6]。因此,本研究在建立大鼠Leydig细胞体外培养模型的基础上,观察利谷隆对Leydig细胞睾酮合成的影响,测定睾酮生成过程中起非常重要作用的细胞色素P450侧链裂解酶(cytochrome P450 side chain cleavage,P450scc)和3β-羟基固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-Hsd)基因的表达情况。目的是探讨利谷隆是否影响Leydig细胞合成睾酮、睾酮合成是否与P450scc和3β-Hsd两种酶基因表达有关,为进一步的机制研究提供依据。
1材料与方法
1.1材料实验动物:清洁级雄性SD 大鼠,体质量200 g左右,由第三军医大学实验动物中心提供。主要仪器与试剂:倒置显微镜(日本Olcanon公司),Fisher scientific培养箱(美国Thermo公司),DU-600型紫外分光光度计(德国BECKMAN公司),FTC2000实时荧光定量基因扩增仪(加拿大FUNGLYN公司),ELX800型酶标检测仪(美国BIO-TEK公司),中科大GC-2010型γ计数器。改良Eagle培养基购于美国Gibco公司,利谷隆购于Chemservice公司,二甲基亚砜(DMSO)、烟酰胺腺嘌呤二核苷酸(NAD)、氮蓝四唑(NBT)、雄甾烷、胶原酶I、胰蛋白酶均购于Sigma公司,Real-time qPCR相关试剂盒均购于宝生物工程(大连)有限公司,ELISA试剂盒购于上海西唐生物科技有限公司,睾酮放射免疫试剂盒购于北京北方生物技术研究所,其他实验室常备试剂均为国产分析纯。
1.2方法
1.2.1实验分组与利谷隆染毒液的配制准确称取0.40 mol(0.099 6 g)利谷隆,加1 mL DMSO溶解后再加培养液定容至10 mL即为40 mmol/L的利谷隆液,再取1 mL 40 mmol/L的利谷隆液用培养液定容至100 mL,即为400 μmol/L的利谷隆液,再分别稀释成200、100、50 μmol/L的3个实验组,对照组为0.1% DMSO。
1.2.2Leydig细胞的分离培养与纯化
1.2.2.1Leydig细胞分离培养Leydig细胞的分离培养方法参照文献[7]。取清洁级雄性SD大鼠,颈椎脱臼法处死。鼠体置于75%乙醇中浸泡5 min,然后置于超净台里预先备好的培养皿中,用中剪剪开下腹部皮肤,用眼科剪从附睾部剪断精索,取出睾丸,放入含预冷PBS液的培养皿中洗涤2次,在冰面上剥除睾丸被膜和较大血管,保持睾丸形态的完整和曲细精管的连续性。置于锥形瓶中,加入适量的0.1%胶原酶Ⅰ。37 ℃、100次/分振荡消化至睾丸组织形状刚好消失,曲细精管间组织松散,但曲细精管连续而无明显断裂。加入等体积的培养液终止消化,用400目(30 μm)不锈钢滤网过滤。滤液经1 500 r/min离心5 min,去上清液,细胞沉淀于离心管底。DMEM-F12培养液重悬沉淀,充分吹打,使细胞悬液混匀。取一滴细胞悬液,用0.4%的台盼蓝染液染色,计数活细胞数量。接种细胞于25 mL培养瓶中(37 ℃、5%CO2)。
1.2.2.2Leydig细胞纯化采用2 h差速贴壁法,即:细胞培养2 h后,弃去培养液,PBS 液冲洗2次。加入DMEM/F12培养液(含5%胎牛血清)5 mL 每瓶,37 ℃、5%CO2培养箱中培养24 h。倒置显微镜下观察Leydig细胞贴壁情况。
1.2.2.3Leydig细胞纯度鉴定将20 mg NAD、2 mg雄甾烷和2 mg NBT用PBS溶液配成10 mL 3β-Hsd染色剂。Leydig细胞培养24 h后,将培养液吸出,加入3β-Hsd染色剂,培养箱孵育1 h后倒置显微镜下观察并摄片。分离细胞成活率为97%以上,培养24 h后其存活率在95%以上,Leydig细胞的纯度在90%以上。
1.2.3检测指标与方法(1)放射免疫法检测Leydig细胞睾酮分泌水平,操作严格按照试剂盒说明书进行。(2) ELISA检测Leydig细胞P450scc和3β-Hsd蛋白表达,严格按照各试剂盒说明书提供的检测步骤进行检测。(3)实时荧光定量PCR(Real-time qPCR)检测Leydig细胞P450scc和3β-Hsd mRNA的表达(表1)。结果分析处理(相对定量法),以Ct值为统计参数依次计算下列数据:
Ct平均值=(Ct1+Ct2)/2(重复管)
(1)
△△Ct=(Ct目的-Ct内参)实验组-(Ct目的-Ct内参)对照组
(2)
目的基因相对于某基因的表达量=2-△△Ct
(3)

表1 Real-time PCR的引物序列表
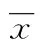
2结果
2.1原代培养间质细胞的形态学观察及纯度鉴定结果倒置显微镜下观察,经差速贴壁法获得的Leydig细胞贴壁铺展后主要为长梭形、圆形和多角形(图1)。采用3β-Hsd特异性酶学染色后,Leydig细胞在伸展状态下均可见细胞质内蓝黑色阳性反应,且任意视野下计数Leydig细胞超过90%,见图2。

A:Leydig细胞(×100);B:Leydig细胞(×400)。

A:Leydig细胞(×100);B:Leydig细胞(×400)。
2.2利谷隆对Leydig细胞睾酮分泌水平的影响各组间做方差分析,总体差异有统计学意义(F=6.982,P=0.003)。与对照组比较,利谷隆50 μmol/L组睾酮分泌水平相近(P>0.05);100、200 μmol/L组睾酮分泌水平下降(P<0.05),见图3。经线性相关分析,睾酮水平与利谷隆染毒剂量呈负相关(r=-0.732,P<0.05)。

a:P<0.05,与对照组比较。
2.3利谷隆对Leydig细胞P450scc mRNA表达的影响各组间做方差分析,总体差异有统计学意义(F=14.113,P<0.001)。与对照组比较,利谷隆50 μmol/L组P450scc基因表达相近(P>0.05);100、200 μmol/L组P450scc基因表达下降(P<0.05),见图4。
2.4利谷隆对Leydig细胞3β-Hsd mRNA表达的影响各组间做方差分析,总体差异有统计学意义(F=3.334,P=0.04)。与对照组比较,利谷隆各剂量组3β-Hsd基因表达下降,差异有统计学意义(P<0.05),见图5。

a:P<0.05;b:P<0.01,与对照组比较。
2.5利谷隆对Leydig细胞P450scc蛋白表达的影响各组间做方差分析,总体差异无统计学意义(F=0.90,P=0.458),见图6。

图6 各组Leydig细胞的P450scc蛋白表达比较
2.6利谷隆对Leydig细胞3β-Hsd蛋白表达的影响各组间做方差分析,总体差异有统计学意义(F=7.179,P=0.02)。与对照组比较,利谷隆各剂量组3β-Hsd蛋白表达均下降(P<0.05),见图7。经线性相关分析,3β-Hsd蛋白表达量与利谷隆染毒剂量之间呈负相关(r= -0.703,P<0.05)。

a:P<0.05;b:P<0.01,与对照组比较。
3讨论
Juul等[8]研究表明,利谷隆能引起受孕的雄性子代性分化异常,并且可使性发育异常加重,主要表现为尿道下裂、隐睾等。已知小鼠在孕12.5 d(E12.5)~13.5 d(E13.5)时由间质细胞分化为Leydig细胞,并合成睾酮[6]。短期体内实验利谷隆能降低双氢睾酮(dihydrotestosterone,DHT)和睾酮依赖组织质量,并改变由雄激素调节的腹侧前列腺基因表达[9]。
本研究通过整体动物实验发现胚胎期染毒利谷隆能够干扰雄性子代体内睾酮的代谢,导致睾酮分泌不足。为进一步探讨及验证利谷隆对Leydig细胞分泌睾酮的影响,采用原代培养的大鼠Leydig细胞作为实验对象,观察利谷隆作用后其睾酮分泌功能的变化。本实验发现,随着利谷隆染毒剂量的增加,Leydig细胞睾酮分泌量下降,且在利谷隆100、200 umol/L组开始显著下降,与对照组比较差异有统计学意义(P<0.05)。本研究中利谷隆对Leydig细胞合成睾酮的影响与上述整体动物实验结果相符。
研究表明,睾酮是由胆固醇经一系列酶催化而生成[10-13]。胆固醇从线粒体外膜转运至线粒体内膜(StAR在此过程中起着重要调节作用),接着胆固醇裂解为孕烯醇酮(由P450scc催化),进而孕烯醇酮由3β-Hsd催化变成孕酮,这3个反应是睾酮合成的限速步骤。Raucci等[14]研究表明,P450scc活性降低可能引起睾酮合成水平下降。为了进一步揭示睾酮合成下降的机制,本研究利用Real-time qPCR法测定利谷隆染毒对Leydig细胞P450scc和3β-Hsd mRNA表达的影响。实验结果表明,利谷隆各染毒组Leydig细胞的P450scc和3β-Hsd mRNA表达都明显低于对照组,说明利谷隆能够降低睾丸Leydig细胞中睾酮合成关键酶基因P450scc和3β-Hsd活性表达。进一步用ELISA方法表明利谷隆还可影响3β-Hsd的蛋白表达,使3β-Hsd 蛋白表达明显下降。尽管利谷隆对Leydig细胞的P450scc基因表达有抑制作用,但P450scc蛋白表达与对照比较差异无统计学意义(P>0.05),这可能与观察时间不够有关。陶晓倩等[15]在研究膜联蛋白5对大鼠睾丸Leydig细胞睾酮合成相关蛋白和酶表达的影响时也观察到3β-Hsd表达改变较P450scc蛋白表达早。因此,推测进一步延长观察时间可能对P450scc蛋白也有抑制作用。本实验结果表明,利谷隆可影响体外培养的大鼠睾丸Leydig细胞睾酮的合成,其机制可能是通过抑制雄激素合成代谢酶P450scc和3β-Hsd 的表达,从而降低睾酮激素水平。至于利谷隆是如何抑制雄激素合成代谢酶基因表达的机制有待进一步研究。
参考文献
[1]王惠萍,徐斯凡.环境抗雄激素乙烯菌核利的生殖毒性研究进展[J].环境与健康杂志,2012,29(9):861-863.
[2]Wilson VS,Blystone CR,Hotchkiss AK,et al.Diverse mechanisms of anti-androgen action:impact on male rat reproductive tract development[J].Int J Androl,2008,31(2):178-187.
[3]Luccio-Camelo DC,Prins GS.Disruption of androgen receptor signaling in males by environmental chemicals[J].J Steroid Biochem Mol Biol,2011,127(1/2):74-82.
[4]Chen G.Linuron[J].Encyclopedia of Toxicology,2014,41(1):83-84.
[5]白建伟,李岩.利谷隆致SD雄性子代大鼠的生殖发育毒性影响[J].大家健康(中旬版),2013,15(8):2-3.
[6]Murashima A,Kishigami S,Thomson A,et al.Androgens and mammalian male reproductive tract development[J].Biochim Biophys Acta,2015,1849(2):163-170.
[7]赵为民,杨建英,代涛,等.小鼠睾丸间质细胞体外原代培养方法的建立[J].中国组织工程研究与临床康复,2011,15(46):8665-8667.
[8]Juul A,Almstrup K,Andersson AM,et al.Possible fetal determinants of male infertility[J].Nat Rev Endocrinol,2014,10(9):553-562.
[9]Hogan NS,Gallant MJ,Van Den Heuvel MR.Exposure to the pesticide linuron affects androgen-dependent gene expression in the three-spined stickleback (Gasterosteus aculeatus)[J].Environ Toxicol Chem,2012,31(6):1391-1395.
[10]Matzkin ME,Yamashita S,Ascoli M.The ERK1/2 pathway regulates testosterone synthesis by coordinately regulating the expression of steroidogenic genes in Leydig cells[J].Mol Cell Endocrinol,2013,370(1/2):130-137.
[11]Stojkov NJ,Janjic MM,Bjelic MM,et al.Repeated immobilization stress disturbed steroidogenic machinery and stimulated the expression of cAMP signaling elements and adrenergic receptors in Leydig cells[J].Am J Physiol Endocrinol Metab,2012,302(10):e1239-1251.
[12]Beattie,MC,Adekola L,Papadopoulos V,et al.Leydig cell aging and hypogonadism[J].Experimental Gerontology,2015(68):87-91.
[13]Bica LB,Lezha ML,Kuka NK,et al.Relation of serum testosterone levels to high density lipoprotein cholesterol and triglyceride in men[J].J Am Coll Cardiol,2013,62(18):C181.
[14]Raucci F,D′aniello A,Fiore MM.Stimulation of androgen production by D-aspartate through the enhancement of StAR,P450scc and 3β-HSD mRNA levels in vivo rat testis and in culture of immature rat Leydig cells[J].Steroids,2014(84):103-110.
[15]陶晓倩,王大勇,柳海燕,等.膜联蛋白5对大鼠睾丸间质细胞睾酮分泌及3β-羟基类固醇脱氢酶表达的影响[J].医学研究生学报,2010,23(4):342-346.
doi:·经验交流·10.3969/j.issn.1671-8348.2016.18.027
基金项目:贵州省科技厅自然科学基金资助项目(C-341);贵州省教育厅重点课题资助项目(C-413);贵州省省长基金资助项目(C-351);遵义市科技局资助项目(E-144);遵义医学院博士启动基金项目资助(F-205)。
作者简介:丁宏伟(1991-),硕士研究生,主要从事金属与生殖毒理学研究。△通讯作者,E-mail:liyan067321@sina.com。
[中图分类号]R114
[文献标识码]B
[文章编号]1671-8348(2016)18-2535-04
(收稿日期:2015-12-28修回日期:2016-03-03)

