一患青年型糖原贮积症Ⅱ型姐弟的家系GAA基因新突变分析*
徐玲玲,唐 雯△,梁玉坚,张 成,黄雪琼,张丽丹,裴瑜馨,程玉才
(中山大学附属第一医院:1.PICU;2.神经内科,广州 510080)
一患青年型糖原贮积症Ⅱ型姐弟的家系GAA基因新突变分析*
徐玲玲1,唐雯1△,梁玉坚1,张成2,黄雪琼1,张丽丹1,裴瑜馨1,程玉才1
(中山大学附属第一医院:1.PICU;2.神经内科,广州 510080)
[摘要]目的鉴定一患青年型糖原贮积症Ⅱ型(GSD Ⅱ)姐弟的家系酸性α-葡萄糖苷酶(GAA)基因的新致病性突变。方法对因“反复呼吸道感染、呼吸衰竭伴全身肌无力”就诊的一姐弟俩的临床及家系资料进行分析,均经α-1,4 GAA活性测定确诊为青年型GSD Ⅱ,并提取先证者及其父母的外周血脱氧核糖核酸(DNA),聚合酶链反应(PCR)扩增GAA基因的全部20个外显子及剪接位点序列,对PCR产物进行直接测序。结果弟弟GAA基因有2个复合杂合性突变,为遗传自父亲的外显子8的c.1216G>A(p.Asp406Asn)错义突变和遗传自母亲的外显子14的c.1935C>A(p.Asp645Glu)错义突变。结论GAA基因的c.1216G>A和c.1935C>A复合杂合性突变导致了该患儿出现以呼吸困难及心肌肥厚为特征的青年型GSD Ⅱ,新的突变c.1216G>A突变可能与青年型GSD Ⅱ相关。
[关键词]糖原贮积症Ⅱ型;pompe病;青年型;酸性α-葡萄糖苷酶;新突变;c.1216G>A;c.1935C>A
糖原贮积症Ⅱ型(glycogen storage disease Ⅱ,GSD Ⅱ)又称Pompe病,是一种由于酸性α-葡萄糖苷酶(acid alpha-glucosidase,GAA)或酸性麦芽糖酶(EC 3.2.1.20,Swiss-Prot P10253)缺陷引起的常染色体隐性溶酶体储积症。根据发病年龄,GSDⅡ可分为婴儿型和晚发型;其中婴儿型又可分为经典及非经典两类,晚发型可进一步分为青少年及成年起病型[1]。婴儿型症状最为严重,快速进展的骨骼肌无力所致呼吸衰竭及心肌肥大所致心力衰竭为其特征性表现;如不及时治疗,多在1岁内死亡。青年型患者表现为缓慢进展的肌无力或进行性肌营养不良,常累及呼吸肌需要机械通气,极少累及心肌[2]。GAA酶活性下降程度与发病年龄及GSDⅡ疾病的严重程度有关[3]。GAA 酶活性降低是由GAA 基因(NM_000152)突变引起的。GSDⅡ的确诊依赖于GAA酶活性的测定或GAA 基因分析。GSDⅡ普遍发病率大约为1∶40 000[4]。中国台湾GSDⅡ新生儿的发病率为1∶20 000~40 000[5]。中国台湾婴儿型GSDⅡ的发病率大约为1∶33 333[6]。迄今中国大陆仅有少数几篇关于GAA 突变分析的报道[7-14]。本文对一患有青年型GSDⅡ的姐弟俩的家系GAA基因的新致病性突变(c.1216G>A,c.1935C>A)进行分析。
1资料与方法
1.1一般资料本项目研究对象为临床诊断为 GSDⅡ的一家系(二代人,共5人)一患病姐弟及健康的父母和姐姐(图1)。该家系来自福建三明市,汉族。先证者父母为非近亲婚配,其母孕期体健,先证者父母和姐姐有均无心脏、骨骼或肌肉的异常表现,血缘亲属中无相应病史。先证者1:男,弟弟,2岁,2012 年12月出生,足月顺产,出生体质量4.7 kg,出生时无窒息抢救史,因“咳嗽、呼吸困难并全身肌肉无力2个月余”于2014 年12 月27日入住中山大学附属第一医院儿童重症监护病房抢救。患儿3个月抬头,6个月坐,1岁能扶站,1岁8个月能独立行走。入院查体: 机控呼吸20次/分,体质量9.0 kg(-3.0SD),身高95 cm(0.2SD),消瘦,身高别体质量-3.2SD[15],未见明显的肝脾肿大及舌体肥大。神经系统检查双上肢肌力2或3级,双下肢肌力2级,膝腱及跟腱反射消失。血肌酸激酶升高为201~1 766 U/L(正常值25~200 U/L)。心脏彩超提示肥厚性心肌病。肌电图显示左侧股直肌、左侧肱二头肌、双侧胫骨前肌及右侧腓肠肌神经源性损伤。先证者2:女,姐姐,4岁,2010 年12月出生,足月顺产,出生体质量3.9 kg,出生时无窒息抢救史,因“反复呼吸道感染、呼吸困难并全身肌肉无力1个月余”于2014 年12 月30日入住中山大学附属第一医院儿童重症监护病房抢救。患儿3个月抬头,6个月坐,1岁能扶站,1岁2个月能独立行走。入院查体:机控呼吸20次/分,体质量12.0 kg(-3.5SD),身高95 cm(-2.0SD),消瘦,身高别体质量-2.2SD[15],未见明显的肝脾肿大及舌体肥大。神经系统检查双上肢肌力4级,双下肢肌力3级,膝腱及跟腱反射减弱。血肌酸激酶升高(237~803 U/L)。心脏彩超提示左心室肥大。肌电图显示左侧腓肠肌、双侧肱二头肌及胫骨前肌神经源性损伤。
1.2方法
1.2.1GAA酶活性测定用外周血白细胞法检测[16]。
1.2.2提取DNA基因组DNA的提取经患者家属知情同意,并经中山大学伦理委员会批准后,取先证者1及其父母外周血2 mL,应用过柱法(QIAamp Blood DNA Mini Kit, QIAGEN公司,美国)提取外周血DNA。
1.2.3对患者及其父母和姐姐的GAA基因序列分析基因的全部20个外显子及剪接位点进行直接序列分析。应用Primer Premier 5.0软件针对GAA基因的外显子编码区设计引物,应用2 X PCR MasterMix聚合酶(TIANGEN,天根)进行PCR扩增(ABI9700型PCR仪,Life technology,美国),然后对PCR产物进行直接测序(ABI3500测序仪,Life technology,美国),与参考序列(NG_009822.1与NM_000152.3)进行比较,从而发现可能存在的基因突变。变异位点的描述按人类基因组变异协会所推荐的命名法则(http://www.Hgvs.org/mutnomen/)[17]。
2结果
2.1先证者GAA酶活性水平先证者1的GAA酶活性为1.45 nmol·h-1·mg-1(正常值为大于14.00 nmol·h-1·mg-1),先证者2的GAA酶活性为1.03 nmol·h-1·mg-1,均诊断为青年型GSDⅡ。
2.2先证者1的GAA基因先证者1的GAA 基因有两个复合杂合性突变:c.1216G>A 和c.1935C>A。其中位于第8外显子的c.1216G>A突变,使第406位密码子GAC变为AAC,导致正常的天门冬氨酸(Asp)变为天冬酰胺(Asn),即p.Asp406Asn错义突变(图2A);位于第14外显子的c.1935C>A突变,使第645位密码子GAC变为GAA,导致正常的天门冬氨酸(Asp)变为谷氨酸(Glu),即p.Asp645Glu错义突变(图2B)。其中c.1216G>A 突变来自父亲,父亲为该突变的杂合子;c.1935C>A 突变来自母亲,母亲为该突变的杂合子。先证者2及未患病的姐姐因其父母不同意,未行基因检测。由于GAA 基因位于常染色体上,该突变在此家系中的传递符合孟德尔遗传规律,遗传方式符合常染色体隐性遗传病的特征。GAA 基因的c.1216G>A 和c.1935C>A复合杂合性突变导致了姐弟俩出现以呼吸困难及心肌肥大为特征的青年型GSDⅡ。先证者父母因社会因素拒绝给先证者2及未患病姐姐行基因学检查。两位先证者住院期间予小潮气量机械通气,抗生素静滴控制肺部感染,加强翻身拍背吸痰,营养神经、护心、护肝等对症支持治疗后,均很快撤离呼吸机,感染控制后出院。现姐姐可自行爬楼梯,弟弟可自行行走。两者因为社会因素均未使用酶治疗。
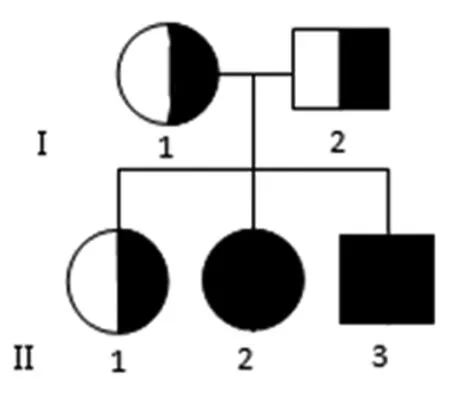
图1 一个青年型GSDⅡ的家系
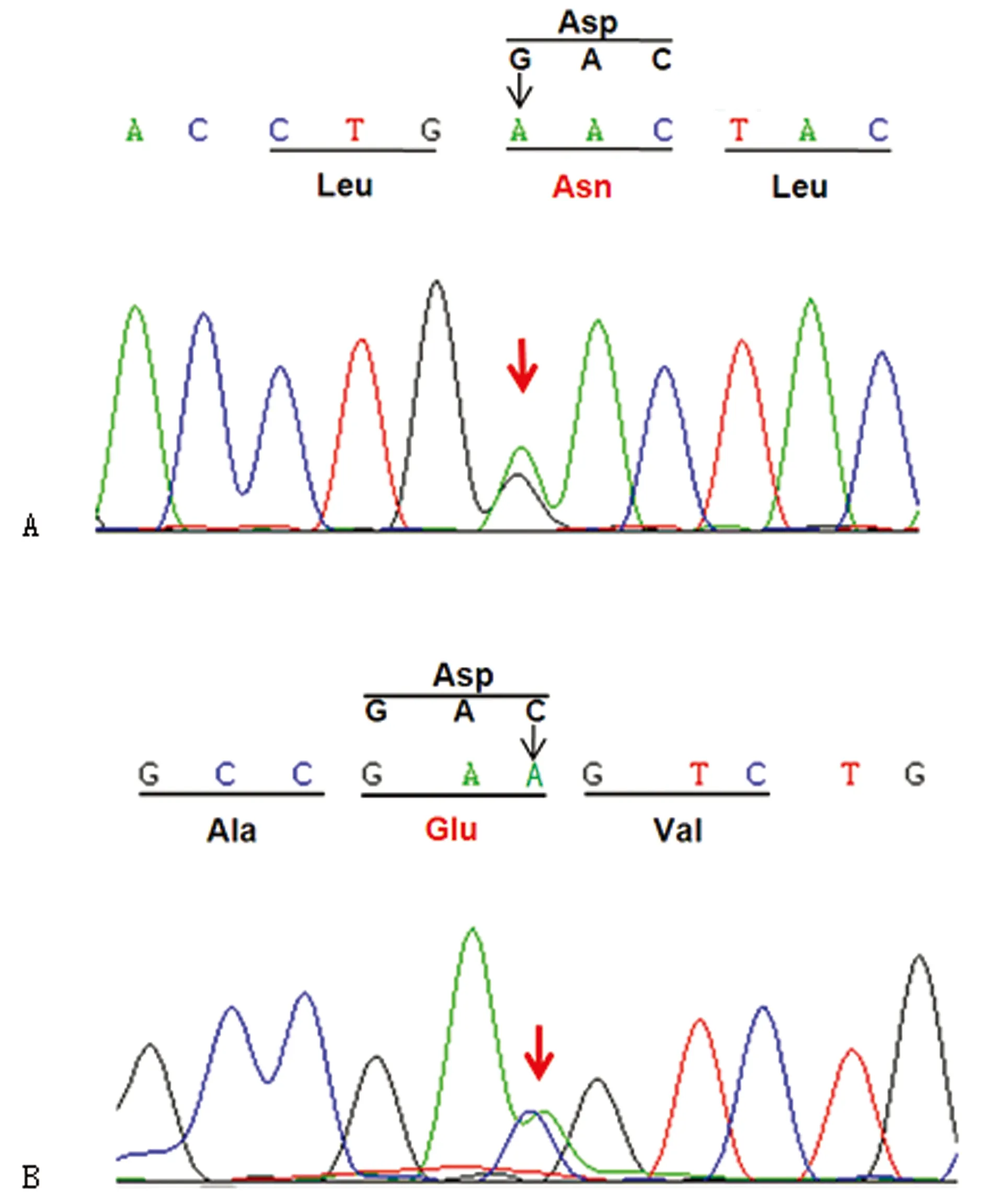
A:患者及其父亲的 c.1216G>A(p.Asp406Asn)基因突变;B:患者及其母亲的 c.1935C>A(p.Asp645Glu)基因突变。
3讨论
GSDⅡ是由于α-1,4葡萄糖苷酶缺乏引起一种常染色体隐性遗传病[18]。目前GSDⅡ在世界范围内均有发病,约为1∶40 000~1∶146 000[4];中国大陆地区仅见散发病例报道。GAA基因是GSDⅡ的致病基因4,位于17q25.3,长约28 Kb,包含20个外显子。GAA酶是由952个氨基酸组成(http://genome.ucsc.edu)的相对分子质量为105 000 U的酶蛋白,包含7个不同部位的树状结构,其前体需经过广泛的翻译后修饰,才成为成熟的酶[18]。
迄今全世界已发现的引起GSDⅡ的GAA基因突变500种(http://www.hgmd.cf.ac.uk,HGMD Professional,2014.09)。GAA基因突变主要集中在基因的3个临界区域:包含起始密码子的外显子2,包含酶催化部位的外显子10和11,及与蛋白高度保守区域相对应的14号外显子[19]。突变类型主要为错义突变及无义突变等[20]。GAA基因突变具有种族差异。如最常见的突变为高加索患者的c.-32-13T>G突变[21]。然而c.1935C>A(p.Asp645Glu)和c.2238G>C(Trp746Cys)是中国台湾患者常见的突变类型[8,22],但这两突变不存在日本人中[23]。在中国大陆GAA突变所致GSDⅡ仅见散发病例报道。Fu等[8]学者对18例中国婴儿型GSDⅡ的患儿进行基因分析,发现中国大陆6种新突变(c.1356delC,c.378G>A,c.1827C>G,c.859-2 A>T,c.1551+2T>G,and c.1465G>T)。本研究报道中国大陆一青年型GSDⅡ家系的两个新突变基因c.1935C>A(p.Asp645Glu)和c.1216G>A(p.Asp406Asn)。c.1216G>A突变尚少见在国内外患者中报道。c.1935C>A突变已被证实可引起突变等位基因编码的蛋白残存的GAA酶活性严重减少。
本研究报道的这一青年型GSDⅡ的姐弟除了有反复呼吸道感染、呼吸困难、呼吸肌及四肢肌肉无力主要表现这些症状外,同时合并心肌的受累。呼吸困难是青年型GSDⅡ常见的临床表现,常常进展为呼吸衰竭,需要呼吸机辅助通气治疗[24]。有研究表明,晚发型(青年型和成年型)小于10%的患者出现心血管受累,如心电生理的异常和心肌肥大[25]。本研究患病姐姐存在左心室肥大;患病弟弟存在肥厚型心肌病。这在晚发型中是少见的。本研究在治疗上予小潮气量机械通气、抗生素抗感染、加强翻身拍背吸痰,同时营养神经、护心、护肝等对症支持治疗,患儿很快撤离呼吸机。由于社会因素,两例患儿均未予酶替代治疗。
本研究发现,先证者(即弟弟)遗传了母亲的c.1935C>A(p.Asp645Glu)突变基因和父亲的c.1216G>A(p.Asp406Asn)突变基因。其父母均为无症状的携带者。错义突变c.1216G>A,位于第8外显子,可能为不全或低外显率突变基因,需注意基因的多态性,但结合临床可以确诊为GSDⅡ,且目前尚未被报道。另一个错义突变c.1935C>A,位于外显子14,已在台湾患者中发现[26]。现在在中国大陆已有早发型和晚发型患者发现c.1935C>A突变基因文献[8,27]。错义突变被报道与酶的合成、转运、翻译后修饰及功能有关[28]。Shieh等[29]报道中国患儿80%存在Asp-645→Glu改变。基因突变导致Asp-645→Glu被证实影响合成α葡萄糖苷酶前体的转运、磷酸化和蛋白酶加工的过程,最终导致α葡萄糖苷酶活性下降67%[30]。c.1216G>A基因突变导致患病的可能原因有几种。(1)在多重序列比对分析中发现,在数种哺乳动物中该酶均存在氨基酸高度保守区域,该保守区域改变可能导致患病。(2)该突变导致带电荷的天门冬氨酸变为不带电荷的天冬酰胺,可能导致蛋白质构象的改变从而影响酶的活性。研究也发现许多错义突变产生单一的氨基酸的改变在迟发型GSDⅡ患者中多见[31]。
本研究中,患儿父亲携带c.1216G>A基因突变,母亲携带c.1935C>A,均为杂合状态,临床上无症状。弟弟有c.1935C>A(p.Asp645Glu)和c.1216G>A(p.Asp406Asn)两个基因突变。不幸的是,健康姐姐及患病姐姐的基因因社会因素未能检测。结合患病的情况,推测患病姐姐携带同弟弟一样的两个基因突变。健康姐姐的基因突变可能与父亲或母亲的一样。文献报道GAA酶活性下降程度与发病年龄与GSDⅡ疾病的严重程度有关[32]。但临床上发现弟弟较患病姐姐发病早,病情重,GAA酶活性较姐姐的高。已有的报道发现中国患者c.1935C>A基因突变所致的临床表型存在变异性。而且文献报道,GSDⅡ的临床表型除了受基因型影响,还受其他因素,如生后的环境因素来影响疾病的临床表现及疾病病程[33]。因此,c.1216G>A基因突变导致Pompe病的临床表型难以确定。
Myozyme(重组GAA酶)替代治疗是目前婴儿型及晚发型GSDⅡ的惟一特异性治疗方法;治疗越早,疗效越显著[34-35]。但治疗费用极其昂贵、部分患者存在免疫反应及神经肌肉的不可修复损害等。
总之,本研究通过酶学及基因学确诊了中国大陆一患青年型GSD Ⅱ姐弟,发现一新的杂合GAA基因突变c.1216G>A和c.1935C>A。这对迟发型GSD Ⅱ来说,该基因突变的发现,对以后早期诊断具有重要意义。
参考文献
[1]Turaça LT,De Faria DO,Kyosen SO,et al.Novel GAA mutations in patients with Pompe disease[J].Gene,2015,561(1):124-131.
[2]Crescimanno G,Modica R,Lo Mauro R,et al.Role of the cardio-pulmonary exercise test and six-minute walking test in the evaluation of exercise performance in patients with late-onset Pompe disease[J].Neuromuscul Disord,2015,25(7):542-547.
[3]Todd AG,Mcelroy JA,Grange RW,et al.Correcting neuromuscular deficits with gene therapy in pompe disease[J].Ann Neurol,2015,78(2):222-234.
[4]Martiniuk F,Chen A,Mack A,et al.Carrier frequency for glycogen storage disease type Ⅱ in New York and estimates of affected individuals born with the disease[J].Am J Med Genet,1998,79(1):69-72.
[5]Lin CY,Shieh JJ.Molecular study on the infantile form of Pompe disease in Chinese in Taiwan[J].Zhonghua Min Guo Xiao Er Ke Yi Xue Hui Za Zhi,1996,37(2):115-121.
[6]Chien YH,Chiang SC,Zhang XK,et al.Early detection of Pompe disease by newborn screening is feasible:results from the Taiwan screening program[J].Pediatrics,2008,122(1):e39-45.
[7]Liu X,Wang Z,Jin W,et al.Clinical and GAA gene mutation analysis in mainland Chinese patients with late-onset Pompe disease:identifying c.2238G>C as the most common mutation[J].BMC Med Genet,2014,15(1):141.
[8]Fu L,Qiu W,Yu Y,et al.Clinical and molecular genetic study of infantile-onset Pompe disease in Chinese patients:identification of 6 novel mutations[J].Gene,2014,535(1):53-59.
[9]傅立军,窦薇,周爱卿,等.糖原累积病Ⅱ型的临床分析和基因学检测[J].临床儿科杂志,2006,24(12):962-965.
[10]操基清,张成,刘友章,等.糖原贮积症Ⅱ型一家系的临床特点及基因突变分析[J].中华神经科杂志,2013,46(1):32-36.
[11]陈素琴,陈路明,田秋红,等.婴儿肥厚型心肌病一家系GAA基因的突变分析[J].中山大学学报(医学科学版),2014,35(1):139-143.
[12]仇佳晶,魏珉,张为民,等.幼年起病的2例晚发型糖原贮积症Ⅱ型/Pompe病临床和基因分析[J].中华儿科杂志,2007,45(10):760-764.
[13]曾敏慧,邱文娟,顾学范,等.一个糖原累积病Ⅱ型家系的酸性-α-葡萄糖苷酶及其产前基因诊断[J].中华医学遗传学杂志,2011,28(3):261-265.
[14]曾敏慧,邱文娟,顾学范,等.1例糖原累积病患儿酸性-α-葡萄糖苷酶基因的新无义突变p.W738X[J].临床儿科杂志,2011,29(5):401-406.
[15]李辉,季成叶,宗心南等.中国0~18岁儿童、青少年身高、体重的标准化生长曲线[J].中华儿科杂志,2009,47(7):487-492.
[16]Jack RM,Gordon C,Scott CR,et al.The use of acarbose inhibition in the measurement of acid alpha-glucosidase activity in blood lymphocytes for the diagnosis of Pompe disease[J].Genet Med,2006,8(5):307-312.
[17]Den Dunnen JT,Antonarakis SE.Mutation nomenclature extensions and suggestions to describe complex mutations:a discussion[J].Hum Mutat,2000,15(1):7-12.
[18]Sugawara K,Saito S,Sekijima M,et al.Structural modeling of mutant alpha-glucosidases resulting in a processing/transport defect in Pompe disease[J].J Hum Genet,2009,54(6):324-330.
[19]Fernandez-Hojas R,Huie ML,Navarro C,et al.Identification of six novel mutations in the acid alpha-glucosidase gene in three Spanish patients with infantile onset glycogen storage disease type Ⅱ (Pompe disease)[J].Neuromuscul Disord,2002,12(2):159-166.
[20]Kroos M,Hoogeveen-Westerveld M,Van Der Ploeg A,et al.The genotype-phenotype correlation in Pompe disease[J].Am J Med Genet C Semin Med Genet,2012,160C(1):59-68.
[21]Kroos MA,Pomponio RJ,Hagemans ML,et al.Broad spectrum of Pompe disease in patients with the same c.-32-13T->G haplotype[J].Neurology,2007,68(2):110-115.
[22]Amarinthnukrowh P,Tongkobpetch S,Kongpatanayothin A,et al.p.D645E of acid α-glucosidase is the most common mutation in thai patients with infantile-onset pompe disease[J].Genet Test Mol Biomarkers,2010,14(6):835-837.
[23]Raben N,Plotz P,Byrne BJ.Acid alpha-glucosidase deficiency (glycogenosis type Ⅱ,Pompe disease)[J].Curr Mol Med,2002,2(2):145-166.
[24]Smith BK,Collins SW,Conlon TJ,et al.Phase Ⅰ/Ⅱ trial of adeno-associated virus-mediated alpha-glucosidase gene therapy to the diaphragm for chronic respiratory failure in Pompe disease:initial safety and ventilatory outcomes[J].Hum Gene Ther,2013,24(6):630-640.
[25]Van Der Beek NA,Soliman OI,Van Capelle CI,et al.Cardiac evaluation in children and adults with Pompe disease sharing the common c.-32-13T>G genotype rarely reveals abnormalities[J].J Neurol Sci,2008,275(1/2):46-50.
[26]Amarinthnukrowh P,Tongkobpetch S,Kongpatanayothin A,et al.p.D645E of acid α- glucosidase is the most common mutation in thai patients with infantile-onset pompe disease[J].Genet Test Mol Biomarkers,2010,14(6):835-837.
[27]Yang CC,Chien YH,Lee NC,et al.Rapid progressive course of later-onset Pompe disease in Chinese patients[J].Mol Genet Metab,2011,104(3):284-288.
[28]Hermans MM,De Graaff E,Kroos MA,et al.The effect of a single base pair deletion (delta T525) and a C1634T missense mutation (pro545leu) on the expression of lysosomal alpha-glucosidase in patients with glycogen storage disease type Ⅱ[J].Hum Mol Genet,1994,3(12):2213-2218.
[29]Shieh JJ,Wang LY,Lin CY.Point mutation in Pompe disease in Chinese[J].J Inherit Metab Dis,1994,17(1):145-148.
[30]Hermans MM,De Graaff E,Kroos MA,et al.The conservative substitution Asp-645——>Glu in lysosomal alpha-glucosidase affects transport and phosphorylation of the enzyme in an adult patient with glycogen-storage disease type Ⅱ[J].Biochem J,1993,289(Pt 3):687-693.
[31]Pittis MG,Montalvo AL,Miocic S,et al.Identification of four novel mutations in the alpha glucosidase gene in five Italian patients with infantile onset glycogen storage disease type Ⅱ[J].Am J Med Genet A,2003,121(3):225-230.
[32]Remiche G,Ronchi D,Magri F,et al.Extended phenotype description and new molecular findings in late onset glycogen storage disease type Ⅱ:a northern Italy population study and review of the literature[J].J Neurol,2014,261(1):83-97.
[33]Wens SC,van Gelder CM,Kruijshaar ME,et al.Phenotypical variation within 22 families with Pompe disease[J].Orphanet J Rare Dis,2013,8(1):182.
[34]Case LE,Beckemeyer AA,Kishnani PS.Infantile Pompe disease on ERT:update on clinical presentation,musculoskeletal management,and exercise considerations[J].Am J Med Genet C Semin Med Genet,2012,160(1):69-79.
[35]Chien YH,Hwu WL,Lee NC.Pompe disease:early diagnosis and early treatment make a difference[J].Pediatr Neonatol,2013,54(4):219-227.
Analysis on novel mutations in GAA gene of a Chinese family with two siblings affected with juvenile onset form glycogen storage disease Ⅱ*
XuLingling1,TangWen1△,LianYujiang1,ZhangCheng2,HuangXueqiong1,ZhangLidan1,PeiYuxin1,ChengYucai1
(1.PediatricIntensiveCareUnit;2.DepartmentofNeurology,FirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou,Guangdong510080,China)
[Abstract]ObjectiveTo identify a novel pathogenicity mutation of acid alpha-glucosidase(GAA) gene in a Chinese family with two siblings affected with juvenile onset form glycogen storage disease Ⅱ(GSD Ⅱ).MethodsThe clinical and family data of two siblings presenting recurrent respiratory tract infections,respiratory failure associated with systemic muscle weakness,were analyzed and diagnosed with GSDⅡ by detecting alpha-1,4-glucosidase activity.DNA was extracted from peripheral blood of the proband,younger brother and his parents.All 20 exons and the intron-exon splice sites of GAA gene were amplified by polymerase chain reaction (PCR).Mutations were detected by direct sequencing the PCR products.ResultsThe younger brother was found to be compound heterozygous for two mutations in the GAA gene:c.1216G>A (p.Asp406Asn) missense mutation in the exon 8 from his father and c.1935C>A (p.Asp645Glu) missense mutation in the exon 14 from his mother.ConclusionThe compound heterozygous c.1216G>A and c.1935C>A mutations caused the juvenile onset form GSDⅡ characterized by dyspnea and cardiac hypertrophy.The novel c.1216G>A mutation may be related to the juvenile onset form GSDⅡ.
[Key words]glycogen storage disease Ⅱ;pompe disease;juvenile onset;acid alpha-glucosidase;novel mutation;c.1216G>A;c.1935C>A
doi:·论著·10.3969/j.issn.1671-8348.2016.18.004
基金项目:2010年国家临床重点专科建设项目(部183)。
作者简介:徐玲玲(1985-),主治医师,硕士研究生,主要从事儿童内分泌及重症医学的研究。△通讯作者,E-mail:tangwen@mail.sysu.edu.cn。
[中图分类号]R394.3
[文献标识码]A
[文章编号]1671-8348(2016)18-2460-04
(收稿日期:2015-11-27修回日期:2016-03-11)

