肿瘤靶向治疗抗体药物的研究进展
曹睿,邵荣光,李亮
(中国医学科学院&北京协和医学院医药生物技术研究所 肿瘤室,北京 100050)
肿瘤靶向治疗抗体药物的研究进展
曹睿,邵荣光,李亮Δ
(中国医学科学院&北京协和医学院医药生物技术研究所 肿瘤室,北京 100050)
近年来,随着人类对癌症的细胞生物学和遗传学方面的认识达到分子生物学水平,新的治疗理念和方法被不断的提出,其中关于肿瘤的分子靶向性治疗药物的研发与应用受到了广泛的关注。抗体药物以其靶向性强,副作用小,疗效显著等优点,迅速成为了肿瘤靶向治疗领域中的热点药物。目前已有20多种抗肿瘤抗体药物经过批准应用于临床,并取得了显著的疗效。本文总结了靶向肿瘤的单克隆抗体药物的发展历程和现状,及其抗肿瘤作用的机制。同时总结了单抗药物在肿瘤研究领域中取得的新进展,并对其应用前景以及存在的不足做了概述。
肿瘤;单克隆抗体;分子靶向治疗;抗体药物
以抗体为基础研发的药物统称为抗体药物。近年来,抗肿瘤抗体药物的研发与应用受到了广泛的关注。最初,抗肿瘤抗体主要是通过抗原免疫动物而获得抗血清。通过此途径获得的抗体,称之为多克隆抗体。由于抗血清中含有众多针对不同抗原的抗体分子,这些抗原不仅存在于病变的肿瘤细胞上,同时存在于正常细胞的表面。因而多克隆抗体存在着严重的交叉反应,在临床应用中不仅未获得确切的疗效,反而会引发一系列不良反应。而单克隆抗体的出现,大大减少了机体与正常组织之间的交叉反应,降低了抗体治疗的不良反应,为肿瘤治疗带来了新的希望。目前,用于制备抗体药物(抗体治疗剂)的抗体均属于单克隆抗体[1]。
1 单克隆抗体药物的发展历程
利用抗体治疗疾病已经有近百年的历史。1960年诺贝尔奖得主Burnet提出克隆选择学说,认为每个B淋巴细胞表面的抗原受体只识别一种抗原决定簇(抗原表位),并产生针对该抗原决定簇的抗体,这一学说为治疗级单克隆抗体的研发奠定了理论基础[2]。1975年诺贝尔奖得主Milstein和Kohler发明了杂交瘤细胞技术,通过特定抗原筛选出表达特定抗体的B淋巴细胞系,使得该细胞与骨髓瘤细胞杂交,实现了杂交瘤细胞的体外存活,并筛选和培养出了阳性的克隆细胞。杂交瘤技术的成熟为单克隆抗体的体外短时间大规模培养提供了可能。
1986年全球第一个单抗治疗肾移植排斥反应的鼠源化抗体OTK-3宣告上市,虽然治疗效果并不乐观,且容易触发人抗鼠免疫反应,但该药获得批准用于临床标志着单抗药物时代的开始[3]。1997年第一个治疗肿瘤的嵌合抗体利妥昔单抗(Rituximab),被用于非霍奇金氏淋巴瘤的治疗,获得了临床上的一致认可。单抗药物的发展由此得到了极大的改善。1998年全球第一个人源化单抗帕利珠(Palivizumab)用于防治呼吸道合胞病毒(RSV)引起的下呼吸道疾病[4]。同时FDA批准了用于肿瘤治疗的多个单抗,如人源化单抗曲妥珠(Trastuzumab)上市,用于Her2阳性的乳腺癌治疗,自此单抗产业进入高速发展期。虽然人源化抗体能够大大降低抗体药物的免疫原性,但仍会出现人抗人源抗体的反应。2002年全球第一个全人源单抗,即用于治疗类风湿性关节炎的阿达木单抗(Adalimumab),是目前全球最畅销的药物之一。2013年T-DM1(Trastuzumabemtansine)被用于治疗HER-2阳性的乳腺癌,并获准上市[5]。它是由赫赛汀(Herceptin)与一种化疗药物emtansine偶联在一起制备的首个抗体药物偶联物(antibody drug conjugates,ADC)。自此单抗药物随之向着更低的免疫原性以及更高的特异性方向发展。
2 单克隆抗体药物的发展现状
目前研制与应用的单克隆抗体药物基本上是以由细胞工程技术和基因工程技术为主体的抗体工程技术制备的药物。临床研究表明,单独应用单抗在肿瘤治疗中是有效的,且在多数情况下,单抗药物与常规的放射疗法、化疗药物和免疫调节药物等联合应用时也能表现出协同作用,这使得单抗药物的研发一直处于热潮中。自1997年以来,抗体药物在肿瘤治疗领域取得了突破性进展。近年来,由于DNA重组技术的飞速发展,其被应用于抗体的结构改造中,各种形式的重组抗体相继出现。如人源化抗体,单价小分子抗体,多价小分子抗体以及抗体融合蛋白等大批抗体药物涌入市场,截至2014年12月,用于癌症治疗的抗体药物总计20多种[6]。迄今为止,美国FDA批准上市的靶向肿瘤的抗体药物已有26种,见表1。除此之外,尚有160多种抗肿瘤抗体药物处于临床研究阶段[7]。
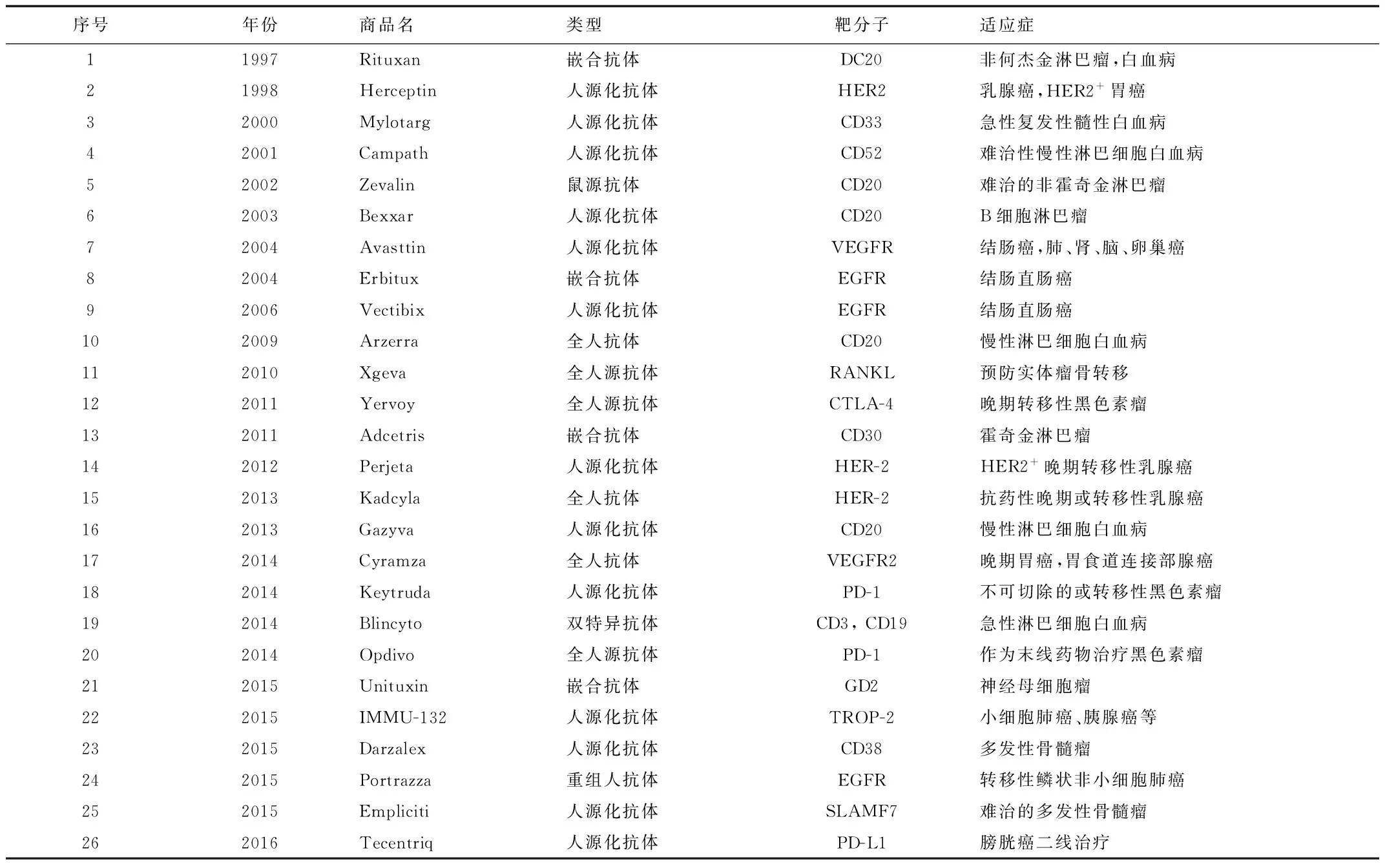
表1 美国FDA批准上市的抗肿瘤抗体药物
基于抗体的疗法其关键在于寻找合适的靶向抗原。一个理想的单抗,其靶点应该是在肿瘤细胞表面特异性表达或高表达,而在正常组织中不表达或低表达的抗原。近些年来,科研界对于肿瘤靶点的研究也取得了突破性的进展,随着分子生物学的发展和许多肿瘤新靶点的出现,为抗体药物的研发提供了新的方向。目前上市的单抗药物的靶点涵盖了血液分化抗原(CD20,CD30,CD33和CD52等),细胞生长因子(CEA,EGFR,HER-2,HER-3,MET和IGFR1等),肿瘤坏死因子配基(TRAIL-R1,TRAIL-R2和TANKL等)和血管内皮生长因子(VEGF)等[8]。
3 新型抗肿瘤抗体的发展
随着抗体工程技术的发展以及免疫检查点药物靶点的发现,新型抗肿瘤抗体药物的作用机制与疗效都显著区别于传统抗体药物,不再局限于通过结合肿瘤特异性蛋白或生长因子而发挥其靶向作用。
3.1 基于抗体的肿瘤免疫疗法 肿瘤细胞可以通过多种机制逃避免疫系统的监控,免疫疗法旨在增强机体正常的免疫系统对抗肿瘤的能力。机体的T细胞表面的共刺激因子可以通过与相应配基结合而提供激活细胞免疫的“第二信号”,而这种激活效应细胞所需的共刺激因子,称之为免疫检查点蛋白,可以作为抗体药物的新型靶点。其中包括免疫球蛋白超家族(如CTLA-4、PD-1等)和肿瘤坏死因子超家族(如4-1BB、OX40、GITR等)。通过设计“共抑制因子”的拮抗剂或“共刺激因子”的激动剂,可以启动机体的细胞免疫治疗恶性肿瘤[9]。2014年靶向PD-1的Nivolumab[10]和Pembrolizumab[11]先后在日本和美国上市,而靶向PD-L1的抗体MPDL3820A成为30年来对转移性膀胱癌唯一有效的抗体药物[12]。
3.2 抗体药物偶联物(ADCs) 抗体药物偶联物是将抗体与细胞毒药物进行偶联,通过抗体的靶向作用将药物直接传送至肿瘤细胞,而减少其对正常组织器官的药物分布,从而提高疗效,降低不良反应的一种新型抗体药物。通过这种设计方法可以提高抗体药物的杀伤能力,同时扩大了小分子化疗药物的治疗窗。目前有3种抗体药物偶联物获得批准上市,尚有超过30种ADC药物处于临床研究阶段[13]。例如2001年由FDA获准上市的Gemtuzumabozogamicine,是由抗CD33的单抗与加里奇霉素偶联而得,用于治疗复发性急性髓系淋巴瘤,但该药在2010年由于其安全性和有效性受到质疑而自动退市[14]。2013年抗体药物偶联物T-DM1被成功应用于HER-2阳性的转移性乳腺癌治疗中,它是由曲妥珠单抗与美登素衍生物偶联而成,具有良好的疗效与药动学特征,且患者的耐受良好。T-DM1的成功应用,促进了针对各种实体瘤和血液癌症的ADC药物的快速发展。并且随着肿瘤新靶点的发现,高效化疗药物分子的发展以及新型连接子(linker)的不断开发,相信ADC药物的疗效和安全性会得到进一步的提高。
4 抗体药物的作用机制
4.1 抗体药物治疗肿瘤的作用机制 临床上应用的抗肿瘤抗体药物(未偶联的裸抗体),其抗肿瘤作用机制主要是通过抗体的2种功能。其一是亲和性,即与肿瘤表面靶抗原特异性结合,而后发挥其效应功能,杀伤肿瘤细胞。抗体分子通过与靶抗原结合,能够阻断肿瘤生长因子信号通路,诱导细胞凋亡或是抑制肿瘤微环境中新生血管的形成。其二,对肿瘤细胞的杀伤作用也可依靠免疫系统来介导细胞死亡,如抗体恒定区介导的抗体依赖性细胞介导的细胞毒作用ADCC(antibody-dependent cellular cytotoxicity),补体依赖的细胞毒作用CDC(complement-dependent cytotoxicity)以及抗体依赖的细胞吞噬作用ADPC(antibody-dependent cellular phagocytosis)等机制实现对肿瘤细胞的杀伤作用[15]。抗体药物偶联物的作用机制一般是通过偶联抗体与靶向抗原的特异性亲和,将高效的小分子化药或放射性分子携带至靶位点,从而抑制或者杀死肿瘤细胞[16]。
针对同一个靶点的不同单抗药物,其作用机制并不一定完全相同,临床的疗效与不良反应也有所差异[17]。例如,Trastuzumab和Pertuzumab均可以靶向表皮生长因子受体家族中的HER-2受体,但是2者的抗原识别表位不同,前者可抑制HER-2受体的同源二聚化和异源二聚化,而后者只抑制HER-2与EGFR或者HER-3的异源二聚化,因而2者在临床上的联合用药也能表现出一定的“协同效应”[18]。Cetuximab、Panitumumab和Nimotumab都是靶向EGFR的单克隆抗体,而且它们所识别的抗原结合表位虽然相同,但是由于亲和力和lgG亚型的差异,在临床上引起的皮肤毒性也有所差异[19]。
4.2 抗体药物治疗肿瘤的作用特点
4.2.1 与肿瘤细胞的特异性结合:抗体药物能够与肿瘤细胞表面的靶抗原进行特异性亲和,从而使得到达肿瘤部位的抗体药物多而进入正常组织细胞的抗体药物少,这是单抗药物可以用于靶向治疗的基础。
4.2.2 抗体药物的多样性:主要表现为靶向抗原的多样性、抗体结构的多样性、作用机制的多样性以及在抗体药物偶联物中“弹头”药物的多样性[1,20]。
4.2.3 在体内能够实现特异性分布:抗肿瘤抗体药物能够在肿瘤局部聚集,显示特异性的定位,而在非肿瘤区域分布较少。
4.2.4 制备抗肿瘤抗体药物的定靶性:可以针对特定的靶向分子而定向制备相应的抗体药物,或者是可以根据特定的效应分子来制备相应的偶联物或融合蛋白等[20]。
4.3 抗体药物应用注意事项及缺点
4.3.1 筛选适用病患:抗体作为靶向治疗药物,靶标敏感性筛选已经成为抗体治疗是否可行的常规步骤。如乳腺癌,只有HER-2高表达的患者(约20%)才可能对trastuzumab治疗有效;又如针对EGFR的靶向治疗,KRAS基因突变的肠癌患者用cetuximab或panitumumab治疗均无效。
4.3.2 注意抗体的免疫原性:作为一种大分子生物制剂,抗体同时也是一种免疫原,可能诱发排斥反应,使机体生成与抗体药物相对应的抗体,导致药物疗效下降或失效。临床医生需要在用药过程中随时检测患者体内的免疫排斥反应。
4.3.3 昂贵的治疗费用:抗体生产工艺复杂,涉及许多环节,包括高表达细胞株筛选、培养基研发、纯化技术研发等诸多方面。通常而言,抗体药物的研发周期长达数十年,成本高达数十亿美元,因而其价格昂贵,如何缩短研发周期,降低生产成本是抗体药研发的重要因素。
5 抗体药物的设计策略和趋势
5.1 靶点的选择
5.1.1 特异性:靶分子在肿瘤细胞中高表达,而在正常组织细胞尤其是重要器官内无显著性表达。
5.1.2 对于肿瘤生长的重要性:该分子靶点对于肿瘤的恶性表型具有关键性的作用,一旦受到阻断,能够干扰肿瘤的生长和转移等。
5.1.3 由单一靶点向多靶点方向发展:早期,针对单靶点的抗体药物在应用一段时间之后,肿瘤细胞会通过产生突变等途径来实现对此类药物的耐药。为此开发出多靶点类的抗体药物来克服上述耐药情况。2009与2011年,Genentech公司基于“two-in-one”策略,相继研发了同时可以靶向VEGR与HER-2,以及同时靶向EGFR与HER-3的双特异性抗体,疗效明显优于针对单个靶标的单抗药物[21-23]。
5.2 抗体的人源化 由于鼠源化抗体在人体内可以诱发人抗鼠抗体反应,不仅影响其疗效,同时也引发一系列的不良反应。故对鼠源化抗体的人源化改造一直是抗体发展领域的研究热点。人们通过制备嵌合抗体和人源化抗体等,逐步的降低了抗体药物在人体内的免疫原性,并在临床上取得了良好的效果。随着PCR技术的发展,利用基因工程技术可以将全套的人抗体重链和轻链V区基因克隆出来,并在噬菌体表面表达分泌,经过筛选获得特异性抗体,即噬菌体抗体库技术[24],该技术的出现使得人工合成全抗体成为可能。近几年又发展了核糖体展示抗体库技术[25],可构建高容量、高质量的抗体库,从而筛选具有更高亲和力的抗体。此外,Lonberg[26]的研究表明除了利用单细胞生物构建的人源化抗体筛选库获得全人源抗体外,转基因动物也是此类抗体的重要来源。值得注意的是,有报告指出,完全的人抗体在临床使用中尚未确定优于人源化抗体,这表明了人源化程度不一定是越高越好。
5.3 抗体药物的小型化 抗体及其偶联物均为大分子物质,这使得其难以通过毛细血管内皮层和细胞外间隙而到达肿瘤的实体部位。通过酶切方法获得的Fab片段,其分子量相当于完整抗体的1/3,通过基因工程技术制备的单链抗体scFv或单域抗体(VH,VL)的分子量更小,约分别相当于完整抗体的1/6或1/12。通过制备Fab片段、单链抗体、双特异性抗体、三价抗体和微型抗体等手段可以实现抗体的小型化,从而提高其对实体瘤的穿透性。但需要注意的是设计过程中需根据其药代动力学特点而进行适度的小型化,以防止抗体药物与靶抗原亲和力的减弱和半衰期的下降,从而研发出更适用于临床的小型化抗体药物。
5.4 抗体药物的高效化 提高抗体药物对于靶向细胞的杀伤作用,可以降低药物的用量,从而节省治疗费用。通过在抗体分子上连接具有高效杀伤力的“弹头”药物,制成抗体药物偶联物或是基因工程融合蛋白,可以实现抗体药物的高效化。中国医学科学院北京协和医学院医药生物技术研究所自主研发的抗肿瘤抗生素力达霉素,对肿瘤细胞具有强烈的杀伤作用,体外研究中对大部分肿瘤细胞的IC50值在pmol/L的水平,通过将其与靶向抗体偶联制成抗体药物偶联物或是通过基因工程的手段,将其与抗体制备成相应的融合蛋白,目前已取得一些成果,同时部分研究正在进行中。
6 结语
肿瘤的发生是多因素、多阶段、多基因和相互作用的结果。功能基因组学和蛋白质组学的发展将为肿瘤的治疗提供新的分子靶点,而针对这些新靶点,有可能研发出新的抗体药物。同时,对已有靶点新功能的发现和多靶点之间相互作用关系的阐明,也为抗体药物的研发提供了新的方向,如双(多)特异性抗体药物等。基于单克隆抗体的肿瘤免疫疗法也在近几年中得到迅速发展,相信在不久的将来,抗体药物将会为人们的健康带来更多的福音。
[1] ZhenY.Antibody-durg and tumor targeted therapy[J].J Med Res,2007,36(2):1-2.
[2] Wolchok JD,Kluger H,Callahan MK,et al.Nivolumab plus ipilimumab in advanced melanoma[J].N Engl J Med,2013,369(2):122-133.
[3] Sis B,Mengel M,Haas M,et al.Banff 09 meeting report: antibody mediated graft deterioration and implementation of Banff working groups[J].Am J Transplant,2011,10(3):464-471.
[4] Sliwkowski MX,Mellman I.Antibody therapeutics in cancer[J].Science,2013,341(6151):1192-1198.
[5] Verma S,Miles D,Gianni L,et al.Trastuzumabentansine for HER-2 positive advanced breast cancer[J].N Engl Med,2012,367:1783-1791.
[6] Guo YJ.Progress in momoclonal antibody-based immunotherapy for cancer treatment[J].Chin J Biotech,2015,31(6):857-870.
[7] Kovaleva M,Ferguson L,Steven J,et al.Shark variable new antigen receptor biologics-a novel technology platform for therapeutic drug development[J].Expert Opin Biol ther,2014,14(10):1527-1539.
[8] Reichert JM,Dhimolea E.The future of antibodies as cancer drugs[J].Drug Discov Today,2012,17(17/18):954-963.
[9] Pardoll DM.The blockade of immune checkpoints in cancer immunotherapy[J].Nat Rev Cancer,2012,12(4):252-264.
[10] Topalian SL,Hodi FS,Brahmer JR,et al.Safety,activity,and immune correlates of anti-PD-1 antibody in cancer[J].N Engl J Med,2012,366(26):2443-2454.
[11] Hamid O,Robert C,Daud A,et al.Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma[J].N Engl J Med,2013,369(2): 134-144.
[12] Powles T,Eder JP,Fine GD,et al.MPDL3280A (anti-PD-1) treatment leads to clinical activity in metastatic bladder cancer[J].Nature,2014,515(7528):558-562.
[13] Sassoon I,Blanc V.Antibody-drug conjugate (ADC) clinical pipeline: a review//DucuyL,Ed.Antibody-Drug Conjugates.Methods in Molecular Biology Volume 1045[M].Humana: Humana Press,2013: 1-27.
[14] Castaigne S,Pautas C,Terre C,et al.Effect of gemtuzumaboaogamicin on survival of adult patients with de-novo acute myeloid leukaemia(ALFA-0701): a randomized,open-label,phase 3 study[J].Lancet,2012,379(9825): 1508-1516.
[15] Hagenbeek A,Gadeberg O,Johnson P,et al.Frist clinical use of ofatumumab,a novel fully human anti-CD20 monoclonal antibody in relapsed or refractory follicular lymphoma: results of a phase 1/2 trial[J].Blood,2008,111(12):5486-5495.
[16] Casi G,Neri D.Antibody-durg conjugates: Basic concepts,examples and future perspectives[J].J Control Release,2012,161(2):422-428.
[17] Shim H.Onetarget,different effects: a comparison of distinct therapeutic antibodies agsinst the same targets[J].Exp Mol Med,2011,43(10):539-549.
[18] Sakai K,Yokote H,Murakami-Murofushi K,et al.Pertuzumab,a novel HER dimerization inhibitor,inhibits the growth of human lung cancer cells mediated by the HER-3 signaling pathway[J].Cancer Sci,2007,98(9):1498-1503.
[19] Ramakrishnan MS,Eswaraiah A,Crombet T,et al.Nimotuzumab,a promising therapeutic monoclonal for treatment of tumors of epithelial origin[J].mAbs,2009,1(1):41-48.
[20] Douthwaite J,Jerutus L.Exploiting directed evolution for the discovery of biological[J].Nat Biotechnol,2005,23(9):1073-1078.
[21] Parrent PW,Buton DR.Immunology.Two-in-one designer antibodies[J].Science,2009,323(5921):1567-1568.
[22] Bostrom J,Yu SF,Kan D,et al.Variants of the antibody Herceptin that interact with HER2 and VEGF at the antigen binding site[J].Science,2009,323(5921):1610-1614.
[23] Zuo MH,Jin HJ,Li J,et al.Construction of Fc fusion protein EVP1 targeting members of VEGF-EGFR and its binding affinity[J].Chinese Journal of Cancer Biotherapy,2012,19(3):239-246.
[24] Osbourn J,Jermutus L,Duncan A.Current methods for the generation of human antibodies for treatment of autoimmune diseases[J].Drug Discov Today,2003,8(18):845-851.
[25] Lonberg N.Human monoclonal antibodies from transgenic mice[J].HandbExpPharmacol,2008(181):69-97.
[26] Lonberg N.Human antibodies from transgenic animals[J].Nat Biothchnol,2005,23(9):1117-1125.
(编校:吴茜)
Advances in antibody drug for cancer targeted therapy
CAO Rui, SHAO Rong-guang, LI LiangΔ
(Department of Oncology, Institute of Medicinal Biotechnology of Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China)
With the recent understanding of cancer biology, physiopathology, and cancer genetics & genomics, new treatments and methodologies are constantly developed, including on the development and application of molecular targeted drugs for cancer therapy have been widespread concerned.Antibody-based drugs targeting over-expressed oncogenes or other functional proteins in cancer with its high specificity, less side-effects and significant clinical efficacy became rapidly the hot-spot of anti-tumor drug research.Currently, there are already more than 20 of anti-tumor antibody-based drugs approved for clinical application, and achieved remarkable results.This article summarizes the development and current situation of monoclonal antibody-based drug research for cancer therapy, as well as their anti-tumor mechanism of action.At the same time summarizes the new advances in cancer research in the field of monoclonal antibody drugs made,and its prospects as well as shortcomings were outlined.
anti-tumor; monoclonal antibody; molecular targeted therapy; antibody-based drugs
10.3969/j.issn.1005-1678.2016.06.04
国家“重大新药创制”科技重大专项(2014ZX09201042)
曹睿,男,博士在读,研究方向:肿瘤药理与药物基因组学,E-mail: songwp920@163.com;李亮,通信作者,女,博士,研究员,研究方向:肿瘤药理与药物基因组学,E-mail:liliang@imb.pumc.edu.cn。
R730.5
A

