高效液相色谱法同时测定发酵液中木糖醇和L-木酮糖的含量
葛驰宇,蒋洁,翁旭,张君丽
(1.江苏食品药品职业技术学院 药学院,江苏 淮安 223003; 2.江苏省蛋白质类药物工程实验室,江苏 淮安 223003)
高效液相色谱法同时测定发酵液中木糖醇和L-木酮糖的含量
葛驰宇1,蒋洁1,翁旭1,张君丽2Δ
(1.江苏食品药品职业技术学院 药学院,江苏 淮安 223003; 2.江苏省蛋白质类药物工程实验室,江苏 淮安 223003)
目的 建立高效液相色谱(HPLC)同时测定发酵液中底物木糖醇和产物L-木酮糖含量的方法。方法 采用C18色谱柱 (250 mm×4.6 mm),柱温35 ℃,以乙腈-水(体积比为85:15)为流动相,流速0.8 mL/min。用示差折光检测器检测木糖醇,检测器温度为33 ℃。用紫外检测器在室温下检测L-木酮糖,检测波长为210 nm。结果 所得木糖醇的线性范围为0.50~30.00 g/L,相关系数为0.9995,最低检出限为0.18 g/L,最低定量限为0.58 g/L;所得L-木酮糖的线性范围为0.30~30.00 g/L,相关系数为0.9986,最低检出限0.15 g/L,最低定量限为0.40 g/L;木糖醇的日内和日间相对标准偏差(RSD)均分别小于0.64%和 0.80%,L-木酮糖的日内和日间RSD均分别小于0.31%和0.59%;回收率均在99.00%~101.00%之间。结论 建立的HPLC法不受发酵液中其他组分的干扰,可同时测定底物木糖醇和产物L-木酮糖的含量,并实时监控发酵的全过程。
高效液相色谱;同时测定;木糖醇;L-木酮糖;发酵液
L-木酮糖是一种在多种原核和真核生物代谢途径发现的代谢物,是一种稀有糖[1]。口服L-木酮糖可以通过抑制α-葡萄糖苷酶来有效控制餐后血糖升高,此外L-木酮糖用于肿瘤治疗时能显著抑制恶性肿瘤细胞的生长[2-4]。目前生产L-木酮糖的传统方法是以D-山梨糖醇为原料的化学合成法,但该方法合成路线繁琐,产量很低,且有异构体污染[5]。微生物转化法是通过利用菌体静息细胞氧化木糖醇生产L-木酮糖,该法反应条件温和,环境友好,成本较低且产品纯度高[6-7]。目前,以廉价的木糖醇为底物,通过生物转化法生产L-木酮糖,已成为获取昂贵的稀有糖的重要方法。
发酵过程中需要建立底物和产物的含量检测方法来监测发酵的全过程,以便确定发酵终点。木糖醇属于多元醇,其检测方法主要是碘量法[8-9]。在发酵后期,由于产物L-木酮糖的干扰,需要将木糖醇单独从发酵液中纯化出来进行检测,分离过程复杂会导致结果误差较大;L-木酮糖主要是半胱氨酸咔唑法和斐林试剂法[7-12],半胱氨酸咔唑法试剂配制繁琐,且存在一定的危险性;斐林试剂法属于滴定分析法,操作繁琐,容易出现误差,准确度不高。此外,刘宇鹏等[13-14]对L-木酮糖的同系物L-赤藓酮糖的含量测定使用了紫外分光光度法,但是该法只有吸光值在 0.3~0.7之间数据才准确可靠,往往发酵液需要经过多次稀释才能达到该范围,因此测定过程会产生较大的误差;对于HPLC法,目前仅有只针对木糖醇或L-木酮糖的含量进行测定的HPLC方法的报道[15-16]。为此,本实验旨在建立可以同时测定发酵液中底物木糖醇和产物L-木酮糖的HPLC法。
1 材料与方法
1.1 材料 木醋杆菌(中国工业微生物菌种保藏管理中心)。
L-木酮糖对照品(HPLC纯度为95%)和木糖醇对照品(含量≥99%)均购自美国Sigma公司;乙腈(色谱纯,南京化学试剂有限公司);葡萄糖、蛋白胨、酵母粉均为分析纯(英国Oxoid公司)。
分析天平,发酵罐,Agilent 1260高效液相色谱仪,紫外检测器和示差折光检测器(美国Agilent有限公司)。
1.2 方法
1.2.1 色谱条件
色谱柱:Aglient C18(250 mm×4.6 mm);柱温:35 ℃;流动相:乙腈-水(85:15,v/v);流速:0.8 mL/min。用示差折光检测器检测木糖醇,检测器温度为33 ℃。用紫外检测器在室温下检测L-木酮糖,检测波长为210 nm。
1.2.2 供试品溶液的制备:将木醋杆菌接种至30 mL种子液(10 g/L酵母粉,80 g/L葡萄糖)中培养24 h,再按3%的比例接种至100 mL发酵培养基(30 g/L木糖醇、5 g/L酵母粉、5 g/L蛋白胨、5 g/L NaCl,pH调至7.0)中。取发酵18 h的发酵液样品1 mL,4000 r/min离心10 min,收集上清液,用孔径0.22 μm滤膜过滤,收集滤液用流动相稀释至1 mL,即为供试品溶液。
1.2.3 标准溶液的配制及标准曲线的绘制:精密量取木糖醇和L-木酮糖的对照品溶液适量,分别定容于10 mL容量瓶中,用流动相制成浓度为30.00 g/L 的储备液,再将其分别稀释成0.00、3.00、6.00、12.00、18.00、24.00、30.00 g/L的标准溶液,每一浓度分别进样20 μL,测定3次,取峰面积平均值。以峰面积平均值为纵坐标(y),以标准溶液浓度为横坐标(x),得到线性方程、相关系数和线性范围。以信噪比(S:N)为3时对照品的浓度为最低检测限(LOD),S:N为10时对照品的浓度确定最低定量限(LOQ)。
1.2.4 专属性考察:在发酵过程中,由于发酵液中成分比较复杂,需要考察这些成分是否会对木糖醇和 L-木酮糖的含量测定产生干扰。为此,分别对空白发酵培养基(不含木糖醇和L-木酮糖)、木糖醇对照品、L-木酮糖对照品和供试品溶液进行专属性考察。
1.2.5 精密度实验:在木糖醇和L-木酮糖的标准曲线的线性范围里选择低、中、高3个质量浓度,配制各浓度的对照品溶液样品。每个浓度样品分别在同一天内和不同天内连续测定6 次,分别考察每一浓度样品同一天内测定结果的相对标准偏差(RSD),获得日内精密度;分别考察每一浓度样品不同天之间测定结果的RSD,获得日间精密度。
1.2.6 回收率实验:在木糖醇和L-木酮糖标准曲线的线性范围里选择低、中、高3个质量浓度,配制各质量浓度的对照品溶液样品,每个浓度样品配制6份,分别加入空白发酵培养基,计算每一浓度的加样平均回收率。
1.2.7 发酵终点的确认:取发酵0、6、12、18、24、30 h 6个时间点的供试品溶液分别进样,根据木糖醇和L-木酮糖的标准曲线计算木糖醇和L-木酮糖的含量,并根据各个时间段木糖醇与L-木酮糖的含量变化趋势确定发酵终点。
2 结果
2.1 专属性考察结果 由图1可见,空白培养基无杂质峰出现(a),示差检测器均可以检测到木糖醇对照品(b)与L-木酮糖对照品(c),供试品溶液在木糖醇与L-木酮糖的保留时间位置处无明显杂质出现(d);由图2可见,空白培养基无杂质峰出现(a),紫外检测器无法检测到木糖醇对照品(b),只能检测到 L-木酮糖对照品(c),供试品溶液在L-木酮糖保留时间处也无明显杂质峰出现(d)。表明本文建立的HPLC法木糖醇与L-木酮糖分离度高,且不受发酵液中其它组分干扰,可用于木糖醇与L-木酮糖的含量测定。
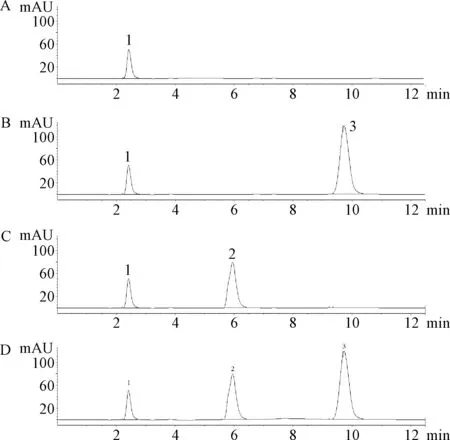
图1 示差折光检测器色谱图a:空白培养基;b:木糖醇对照品溶液;c:L-木酮糖对照品溶液;d:样品溶液1:溶剂峰;2:L-木酮糖;3:木糖醇Fig.1 Chromatograms detected by refractive index (RI) detector a:blank fermentation broth sample;b:xylitol standard;c:L-xylulose standard;d:fermentation broth sample 1:solvent peak;2:L-xylulose;3:xylitol

图2 紫外检测器检测色谱图a:空白培养基;b:木糖醇对照品溶液;c:L-木酮糖对照品溶液;d:样品溶液1:溶剂峰;2:L-木酮糖Fig.2 Chromatograms detected by ultraviolet(UV) detector a:blank fermentation broth sample;b:xylitol standard;c:L-xylulose standard;d:fermentation broth sample 1:solvent peak;2:L-xylulose
2.2 标准曲线结果 木糖醇和L-木酮糖标准曲线测定结果见表1。

表1 木糖醇和L-木酮糖的回归方程、相关系数、线性范围、
2.3 精密度试验 取同一份木糖醇对照品溶液,准确稀释至5.00、15.00、25.00 g/L 3 个质量浓度,按1.2.1色谱条件进行检测,测得日内RSD分别为 0.27%、0.41%、0.64%。测得日间RSD分别为0.32%、0.80%、0.35%。
取同一份L-木酮糖的对照品溶液,准确稀释至5.00、15.00、25.00 g/L 3个质量浓度,按1.2节色谱条件进行检测,测得日内RSD分别为0.16%、0.08%、0.31%,测得日间RSD分别为0.28%、0.20%、0.59%。
木糖醇与L-木酮糖的RSD均小于2.00%,符合检测要求。
2.4 回收率试验结果 分别配制5.00、15.00和25.00 g/L的木糖醇和L-木酮糖对照品溶液,加入空白发酵培养基,回收率结果见表2。可见高、低、中3个浓度的木糖醇和L-木酮糖的加样回收率都在99.00%~101.00%之间,符合检测要求。
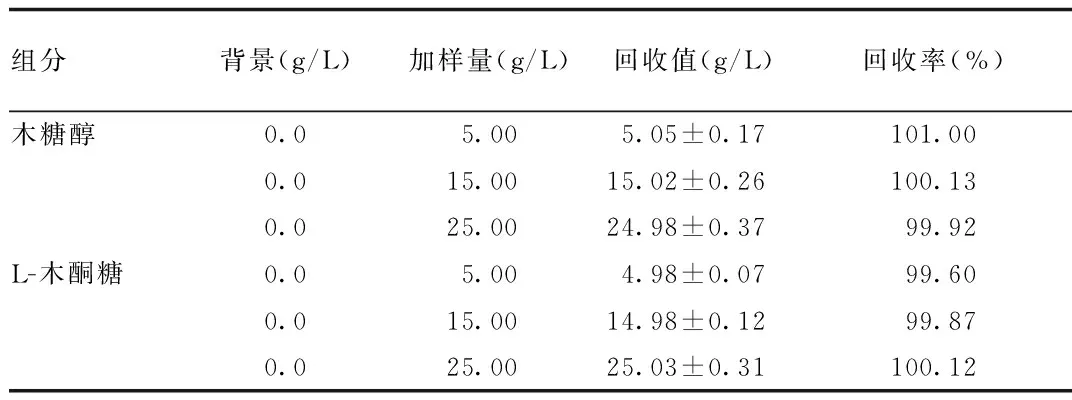
表2 发酵培养基中木糖醇与L-木酮糖的回收率

图3 发酵过程中木糖醇和L-木酮糖含量的变化情况Fig.3 The content changes between xylitol and L-xylulose in the fermentation broth during the fermentation process
2.5 发酵终点的确认 由图3可知,随着发酵时间的增加,底物的含量逐渐减小,产物的含量逐渐增多。当发酵进行到24 h时,约86%的底物木糖醇转化成为产物L-木酮糖,约10%左右的木糖醇在发酵过程中作为木醋杆菌生长的碳源,发酵24 h与发酵30 h的产物含量几乎没有变化,但与发酵18 h相比,却存在显著性差异,因此判定发酵24 h为木糖醇转化生产L-木酮糖的发酵终点。
3 讨论
木糖醇和L-木酮糖的折光率不同,可以使用示差折光检测器来进行测定,但木醋杆菌在发酵过程中会产生较多的代谢产物,且发酵培养基中除了蛋白胨和酵母粉外,还含有部分杂质,这些代谢产物和杂质中如果存在结构或保留时间与木糖醇或 L-木酮糖相似的物质,单用示差折光检测器难以发现。此外,木糖醇属于糖醇类物质,几乎没有紫外吸收,因此引入紫外检测器来提高实验结果的可靠性。对L-木酮糖进行全波长扫描发现,其结构中的酮基的最大紫外吸收峰在210 nm左右,因此以210 nm作为L-木酮糖的测定波长。
使用HPLC对糖类物质进行测定常用的色谱柱是C18柱,流动相是乙腈-水或甲醇-水系统,乙腈和甲醇的紫外吸收峰的截止波长分别在190 nm和205 nm附近,如果使用甲醇作为流动相,其背景吸收较大,会对L-木酮糖测定产生干扰。为此选择乙腈-水作为流动相。
柱温太低,会导致色谱柱内压力升高,样品分离度会变差;柱温过高,会降低色谱柱的使用寿命。C18色谱柱规定的最高温度为50 ℃左右,经反复验证,本实验的色谱柱最佳柱温在35 ℃,可以使流动相黏度变小,提高样品的溶解度,较好地保证了峰形与分离度。
流速低于0.8 mL/min时,样品的峰形变宽,保留时间延长,甚至有色谱峰拖尾现象产生,降低测定效率;高于0.8 mL/min时,峰形变窄,保留时间过短,影响对样品的定量与定性分析。经反复调整后选择流速为0.8 mL/min。
本文建立的方法可以同时测定发酵液中的L-木酮糖与残余木糖醇的含量,分辨率高、线性范围广,且发酵液中的其它组分对这2种物质的测定均不产生影响,可以实时反映木糖醇发酵生产L-木酮糖的全过程,结果准确可靠。
[1] Meng Q,Zhang T,Jiang B,et al.Advances in applications,metabolism,and biotechnological production of L-xylulose[J].Appl Microbiol Biotechnol,2016,100(2):535-540.
[2] Usvalampi A,Turunen O,Valjakka J,et al.Production of L-xylose from L-xylulose using Escherichia coli L-fucose isomerase[J].Enzyme Microb Technol,2012,50(1):71-76.
[3] Usvalampi A,Kiviharju K,Leisola M,et al.Factors affecting the production of L-xylulose by resting cells of recombinant Escherichia coli[J].J Ind Microbiol Biotechnol,2009,36 (10):1323-1330.
[4] Tamburini E,Costa S,Marchetti MG,et al.Optimized production of xylitol from xylose using a Hyper-acidophilic Candida tropicalis[J].Biomolecules,2015,5(3):1979-1989.
[5] 李良智,胡学东,胡翠英.L-核酮糖的合成研究进展[J].食品工业,2014,35(10):217-222.
[6] 沐万孟,江波,程丽芳.戊糖类物质生物转化生产的研究进展[J].食品与发酵工业,2007,33(11):93-97.
[7] 张玉宝,赵祥颖,杨丽萍,等.一株产L-木酮糖菌株的分离筛选及鉴定[J].食品科学,2014,35(1):199-203.
[8] 张松青,游鹏程.木糖醇在医药领域的应用[J].中国医院药学杂志,2007,27(11):1582-1584.
[9] 汪邯郸,熊阳,何维维,等.木糖醇注射液中木糖醇的含量测定[J].现代医药卫生,2005,21(16) :2115-2116.
[10] 张惟杰 主编.糖复合物生化研究技术[M].2版.杭州:浙江大学出版社,1999:12-20.
[11] 章银良.食品检验教程[M].北京:化学工业出版社,2006:250.
[12] 张永勤,王哲平,宋雨梅,等.还原糖测定方法的比较研究[J].食品工业科技,2010,31(6):321-323,326.
[13] 刘宇鹏,潘龙,郑小娟,等.发酵液中L-赤藓酮糖的紫外法测定[J].江苏农业科学,2014,42(8):281-283.
[14] 潘龙,靳魁奇,刘宇鹏.静息细胞转化赤藓糖醇生产L-赤藓酮糖条件优化[J].食品与发酵工业,2014,40(12):72-76.
[15] 张玉宝.转化木糖醇生产L-木酮糖菌株的筛选[D].泰安:山东农业大学,2013:20.
[16] 赵光辉,王成福,李俊萍.采用高效液相色谱法测定木糖醇产品中各组分含量[J].食品与发酵工业 2004,30 (7):117-119.
(编校:吴茜)
Simultaneous determination of xylitol and L-xylulose in fermentation broth with high performance liquid chromatography
GE Chi-yu1, JIANG Jie1, WENG Xu1, ZHANG Jun-li2Δ
(1.School of Pharmacy, Jiangsu Food and Pharmaceutical Science College, Huai’an 223003, China;2.Jiangsu Protein Drug Engineering Laboratory, Huai’an 223003, China)
ObjectiveA high performance liquid chromatographic (HPLC) method was established for the simultaneous determination of xylitol and L-xylulose in fermentation broth.MethodsThe chromatographic conditions were as follows:C18 column (250 mm×4.6 mm) with the temperature 35 ℃, acetonitrile-water (85:15,v/v)as mobile phase with the flow rate of 0.8 mL/min.Xylitol was detected by refractive index (RI) detector at 33 ℃ and L-xylulose was determined by ultraviolet (UV) detector at 210 nm at room temperature.ResultsThis method showed good linearity over the range from 0.50~30.00 g/L with a correlation coefficient of 0.9995 for xylitol and 0.30~30.00 g/L with a correlation coefficient of 0.9986 for L-xylulose. Moreover, the limit of quantification (LOQ) for xylitol and L-xylulose were 0.58 and 0.40,respectively.The limit of determination (LOD) for xylitol and L-xylulose were 0.18 and 0.15,respectively.The relative standard deviations (RSDs) of intraday and interday for xylitol were less than 0.64%and 0.80%,respectively.The intraday and interday RSDs for L-xylulose were less than 0.31%and 0.59%.The recoveries of xylitol and L-xylulose in fermentation broth were between 99.00%-101.00%.ConclusionThere was no interference from other constitutes in the fermentation broth by this method.The methods were suitable for the simultaneous determination of the substrate xylitol and the product L-xylulose in fermentation process.
high performance liquid chromatographic (HPLC); simultaneous determination; xylitol; L-xylulose; fermentation broth
10.3969/j.issn.1005-1678.2016.06.58
江苏省高等学校大学生创新创业训练计划项目(201513104018X)
葛驰宇,男,博士,工程师,研究方向:微生物与生化药学,E-mail:gechiyu2002@163.com;通信作者,张君丽,女,工程师,研究方向:微生物与生化药学,E-mail:junli0009@163.com。
O658
A

