TGF-β1和N-cadherin在精原细胞瘤中的表达及二者的关系
张恩溥,郑文忠,陈剑波,张士强,刘 冲,李明华,李贤新
(1北京大学深圳医院泌尿外科,广东深圳 518036;2中山大学肿瘤防治中心泌尿外科,广东广州 510060;3北京大学深圳医院妇产科,广东深圳 518036)
·基础研究·
TGF-β1和N-cadherin在精原细胞瘤中的表达及二者的关系
张恩溥1,郑文忠1,陈剑波1,张士强2,刘冲3,李明华1,李贤新1
(1北京大学深圳医院泌尿外科,广东深圳518036;2中山大学肿瘤防治中心泌尿外科,广东广州510060;3北京大学深圳医院妇产科,广东深圳518036)
摘要:目的检测转化生长因子-β1(TGF-β1)及神经-钙粘素(N-cadherin)在精原细胞瘤中的表达并探讨二者关系。方法采用SP免疫组化法检测34例精原细胞瘤及15例正常睾丸中TGF-β1、N-cadherin的表达水平。构建N-cadherin 质粒载体,转染NCCIT精原细胞瘤细胞系,经外源性人重组TGF-β1干预,荧光法检测N-cadherin的表达。结果免疫组织化学染色结果显示,正常睾丸间质细胞、生精上皮细胞、长形精子及支持细胞间紧密连接处均可见TGF-β1表达,N-cadherin则表达于支持细胞间紧密连接处。精原细胞瘤中未见N-cadherin表达,但TGF-β1表达水平较正常睾丸显著增高,且差异有显著性(P<0.05);TGF-β1可降低精原细胞瘤细胞株中N-cadherin的表达水平。结论精原细胞瘤中TGF-β1高表达,N-cadherin低表达,且重组TGF-β1可降低精原细胞瘤细胞系N-cadherin表达,提示 TGF-β1可能通过下调N-cadherin在精原细胞瘤癌变过程中起重要作用。
关键词:TGF-β1;N-cadherin;精原细胞瘤;NCCIT精原细胞瘤细胞系
睾丸恶性肿瘤占男性全身恶性肿瘤的1%,其中精原细胞瘤占30%~40%[1]。精原细胞瘤起源于睾丸原始生殖细胞,恶性程度较低,可沿淋巴管转移。目前就精原细胞瘤发生及转移的分子机制仍未阐明。近期研究发现,转化生长因子-β1(transforming growth factor-β1, TGF-β1) 在精原细胞瘤发生发展过程中起重要作用[2]。TGF-β是一种多肽类细胞因子,现发现5种不同亚型,其中TGF-β1的研究最多。现认为TGF-β1在肿瘤早期起抑制作用,而在肿瘤进展期起促进作用[3-4]。多项研究结果表明,TGF-β1可通过调控上皮-间质转换(epithelial mesenchymal transition,EMT)在恶性肿瘤发展过程中起重要作用[5-6]。为探讨精原细胞瘤中TGF-β1是否通过调控EMT起作用,本研究通过免疫组化方法检测TGF-β1及N-cadherin在正常睾丸及精原细胞瘤中的表达,并验证TGF-β1在NCCIT细胞系中对N-cadherin的调控作用。
1材料与方法
1.1标本收集制备收集2005年6月至2013年10月北京大学深圳医院泌尿外科手术切除的精原细胞瘤组织34例,年龄28~50(45.2±7.0)岁,病理诊断结果为睾丸精原细胞瘤。正常睾丸标本15例,年龄在38~64(49.5±6.4)岁。标本选自2006年9月至2013年10月我院泌尿外科收治因前列腺癌而接受睾丸去势手术治疗的患者,经2名病理科医师鉴定为正常睾丸组织。列腺癌患者术前未经放、化疗处理。本课题经北京大学深圳医院及深圳北京大学/香港科技大学大学医学中心伦理委员会审核批准,且参与实验研究患者均确认填写《患者知情同意书》。
1.2主要试剂及仪器N-cadherin鼠抗人单抗(武汉博士德生物科技有限公司);TGF-β1 兔抗单抗(武汉博士德生物科技有限公司);UltraSensitive TM SP(鼠/兔)试剂盒(福州迈新生物科技有限公司);山羊血清工作液(福州迈新生物科技有限公司);DAB显色剂(福州迈新生物科技有限公司);重组TGF-β1细胞因子(美国Selleck公司);引物设计(Primer Primer 5.0软件);引物合成(上海invitrogen 公司);新生牛血清(杭州四季清生物科技有限公司);DMEM培养液(美国Gibco 公司);cDNA逆转录试剂盒(TaKaRa 公司);人精原细胞瘤细胞株NCCIT系本实验室冷冻保存(源自中国科学院上海细胞生物学研究所)。其他常规试剂由北京大学深圳医院广东省男性生殖与遗传重点实验室供应。
1.3免疫组化(SP法)石蜡标本切片4 μm/片,室温干燥48 h。切片经二甲苯脱蜡及梯度乙醇水化处理,0.3%过氧化氢耗竭组织内源性过氧化物酶20 min,抗原修复方法为pH 9.0 Tris-EDTA微波修复20 min,室温条件下自然冷却。山羊血清工作液室温孵育45 min降低非特异性染色,一抗4 ℃冰箱孵育过夜,二抗室温孵育50 min,经辣根过氧化物标记生物素37 ℃温箱孵育45 min,显微镜下观察DAB显色效果,复染细胞核,水化透明处理,中性树胶封片。
1.4NCCIT-N-cadherin细胞构建N-cadherin引物序列为:上游5′-CCGCTCGAGGCCACCCTATGTGCCGGATAGCGGGAGC-3′,下游5′-GGAATTCTTGGCAGGATCAGACAATTTTGTG-3′。酚氯仿法提取睾丸总RNA,逆转录成cDNA,以上述引物扩增出N-cadherin 的CDS区。构建N-cadherin- pEGFP-C1真核表达质粒,转染NCCIT细胞株,培养基中加入不同浓度TGF-β1(0 ng/mL,5 ng/mL,10 ng/mL,15 ng/mL),48 h后检测N-cadherin荧光强度。
2结果
2.1免疫组织化学染色结果正常睾丸间质细胞、生精上皮细胞、长形精子及支持细胞间紧密连接处均可见TGF-β1表达。精原细胞瘤TGF-β1表达水平较正常睾丸显著增高,且差异有显著性(P<0.05)。支持细胞间紧密连接处及生精上皮细胞均可见N-cadherin表达,但精原细胞瘤中未见N-cadherin表达(图1)。
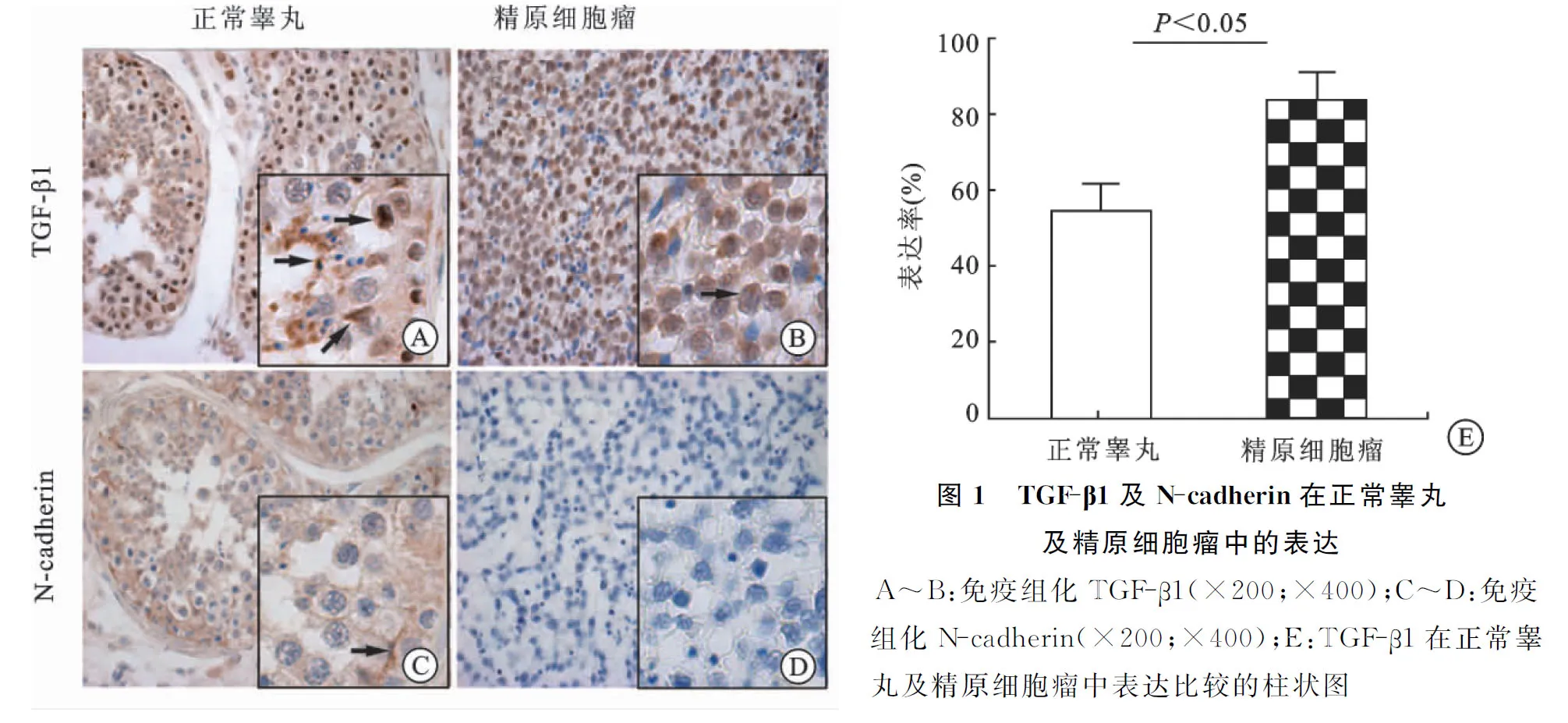
2.2NCCIT中TGF-β1对N-cadherin表达的影响IPP6.0软件计算荧光强度值,不同浓度TGF-β1(0、5、10、15 ng/mL)对应荧光强度值分别为0.67±0.21、1.10±0.17、1.28±0.34、1.67±0.20。其中TGF-β1为15 ng/mL培养基时,N-cadherin下降最明显,且差异有显著性(P<0.05,图2)。

图2 在NCCIT细胞系中TGF-β1对N-cadherin表达的调控(×200;×400)
A:未加TGF-β1的空白对照;B:空白对照与核共染;C:TGF-β1浓度为15 ng/mL时N-cadherin的表达;D:实验组与核共染。
3讨论
TGF-β1是一种肽类生长因子,可由多种细胞产生,其分子质量约为25 ku,由相同两条肽链组成,在物种间具有高度保守性[7]。TGF-β1最初由血小板中提取,可促进细胞增殖、分化、胞外蛋白合成,并参与调节机体免疫力。正常睾丸有TGF-β1表达,并可通过自分泌及旁分泌的方式调节睾丸发育及精子发生[8]。研究发现,TGF-β1参与睾丸恶性肿瘤发病过程,而其在精原细胞瘤中作用仍未阐明[2]。多种恶性肿瘤中,TGF-β1通过诱导EMT,从而使肿瘤细胞获得浸润及转移的能力[9]。EMT系指上皮细胞在特定程序作用下转化为间质表型,是上皮细胞源性恶性肿瘤细胞获得侵袭及转移能力的重要生物学过程。通过EMT,上皮细胞极性丢失,降解细胞外基质能力增强,进而使肿瘤细胞获得较高的侵袭及转移能力[10]。EMT分子表型改变主要表现为间质表型N-cadherin上升[11]。
N-cadherin为钙依赖介导细胞间粘附的一类分子,正常生精过程密切相关。正常生精过程中,精原细胞分裂及各级生精细胞有基底部向腔内迁移的过程需要N-cadherin[12]。研究发现,在多种肿瘤中N-cadherin上调,并增强肿瘤细胞侵袭性[13-14]。为探讨精原细胞瘤中TGF-β1及EMT的关系,本研究通过免疫组化分析正常睾丸及精原细胞瘤TGF-β1、N-cadherin的表达与分布。与文献报道一致,我们发现正常睾丸间质细胞、生精细胞及支持细胞间紧密连接处均可见TGF-β1表达。睾丸间质主要包括莱氏细胞(Leydig cells)、树突状细胞、巨噬细胞及其他免疫细胞。形态学分析表明TGF-β1主要表达于Leydig cells细胞。提示Leydig cells细胞可通过分泌TGF-β1参与睾丸免疫微环境及正常生精的调控。研究表明,TGF-β1在精子顶体后区、颈部及尾中部均有表达[15]。睾丸生精上皮细胞表达TGF-β1,说明精子在进入附睾成熟前已有表达。支持细胞间紧密连接可见TGF-β1表达,提示TGF-β1可能在维持精曲小管结构稳定性中起重要作用。实验发现,精原细胞瘤胞核及胞质均有TGF-β1表达,表达水平较正常睾丸显著升高(P<0.05)。N-cadherin主要表达于正常睾丸近基底部支持细胞间紧密连接处,提示其在维系生精小管结构稳定性及各级生精细胞由基底部向腔内迁移过程中起重要作用。精原细胞瘤未见N-cadherin表达,表明精原细胞瘤癌变过程中无典型EMT现象,提示精原细胞瘤侵袭及转移的生物学过程可能存在一种不同于EMT的途径。近期研究表明,恶性卵巢肿瘤中N-cadherin表达水平下调[16]。体外实验结果显示,N-cadherin为卵巢上皮细胞存活因子,并抑制卵巢肿瘤的形成[17-18]。由此,我们推测睾丸N-cadherin作用与卵巢上皮细胞类似:即正常睾丸N-cadherin作为生精细胞及支持细胞的存活因子,并在维持睾丸支持细胞极性、精子发生及腔内迁移等过程起重要作用;在睾丸肿瘤发生过程中N-cadherin下调,睾丸支持细胞极性平衡打破,进而影响精曲小管稳定性。
在过表达N-cadherin的NCCIT精原细胞瘤细胞系中,TGF-β1显著下调N-cadherin,且TGF-β1浓度为15 μg/mL时N-cadherin下降最明显。提示TGF-β1可能过调节N-cadherin在精原细胞瘤癌变过程中发挥作用。在乳腺癌及其他常见恶性肿瘤中,TGF-β1通过诱导EMT使细胞极性散失,进而促进肿瘤发生及转移[19]。
我们通过实验发现正常睾丸处于EMT状态,说明EMT现象对正常生精具有重要意义。TGF-β1及N-cadherin均表达于正常睾丸支持细胞间紧密连接处,提示二者平衡对维系精曲小管正常结构具有重要作用。在精原细胞瘤发生时EMT现象被逆转,精曲小管结构破坏、生精细胞极性消失,肿瘤细胞向管腔及间质浸润。
综上所述,通过分析正常睾丸及精原细胞瘤中TGF-β1及N-cadherin的表达与分布,本实验发现精原细胞瘤TGF-β1表达水平显著上调, 而N-cadherin显著下调,且在过表达的NCCIT细胞系中TGF-β1可降低N-cadherin表达。提示TGF-β1可通过下调N-cadherin参与精原细胞瘤癌变过程。此外,精原细胞瘤侵袭及转移的生物学过程可能存在一种不同于EMT的途径。本研究描述了TGF-β1及N-cadherin在精原细胞瘤中表达与分布,并初步证实TGF-β1对N-cadherin的调控作用,此对进一步深入理解TGF-β1、EMT在正常生精过程及精原细胞瘤发生发展过程中起重要作用,并为生精功能障碍及精原细胞瘤患者个性化治疗提供理论基础。
参考文献:
[1] 刘仁伟, 吴志清, 冯丰坔, 等.睾丸精原细胞瘤的MRI表现[J].中国医学影像技术, 2012,10(05):982-985.
[2] NETTERSHEIM D, GILLIS AJ, LOOIJENGA LH, et al.TGF-beta1, EGF and FGF4 synergistically induce differentiation of the seminoma cell line TCam-2 into a cell type resembling mixed non-seminoma[J].Int J Androl, 2011, 34(4): 189-203.
[3] GIANNELLI G, VILLA E, LAHN M.Transforming growth factor-beta as a therapeutic target in hepatocellular carcinoma[J].Cancer Res, 2014,74(7):1890-1894.
[4] ZARZYNSKA JM.Two faces of TGF-beta1 in breast cancer[J].Mediators Inflamm, 2014, 2014: 141-747.
[5] BI WR, YANG CQ, SHI Q.Transforming growth factor-beta1 induced epithelial-mesenchymal transition in hepatic fibrosis[J].Hepatogastroenterology, 2012,59(118):1960-1963.
[6] SKEEN VR, PATERSON I, PARASKEVA C.TGF-beta1 signalling, connecting aberrant inflammation and colorectal tumorigenesis[J].Curr Pharm Des, 2012,18(26):3874-3888.
[7] 闫永平, 高婕, 吕卫华.转化生长因子在睾丸中的表达研究进[J].畜牧兽医杂志, 2007(1):30-31.
[8] 李秀华, 高福禄, 张雪峰, 等.人睾丸发生过程中TGF β1表达的研究[J].中国组织化学与细胞化学杂志, 2001(04): 403-405.
[9] MORI S, KODARIRA M, ITO A, et al.Enhanced Expression of Integrin αvβ3 Induced by TGF-β Is Required for the enhancing effect of fibroblast growth factor 1(FGF1) in TGF-β-induced epithelial-mesenchymal transition(EMT)in mammary epithelial cells[J].PLoS One, 2015,9(10): 1932-6203.
[10] OMBRATO L,MALANCHI I.The EMT universe: space between cancer cell dissemination and metastasis initiation[J].Crit Rev Oncog, 2014, 19(5):349-361.
[11] CAVALLARO U, SCHAFFHAUSER B, CHRISTOFORI G, et al.Cadherins and the tumour progression: is it all in a switch?[J].Cancer Let, 2002, 176(2): 123-128.
[12] MRUK DD, XIAO X, LYDKA M et al.Intercellular adhesion molecule 1: recent findings and new concepts involved in mammalian spermatogenesis[J].Semin Cell Dev Biol, 2014,5(29):43-54.
[13] 冉立峰, 杨炜.TGF-β1通过EMT促进肝癌细胞株MHCC97L的转移[J].免疫学杂志, 2014(09): 800-803.
[14] 刘栗丽, 吴继锋, 祝迎锋, 等.TGF-β1对胃癌细胞BGC-823侵袭性的影响[J].安徽医科大学学报, 2009(01): 18-22.
[15] BOURGUIBA S, GENISSEL C, LAMBARD S, et al.Regulation of aromatase gene expression in Leydig cells and germ cells[J].J Steroid Biochem Mol Biol, 2003, 86(3-5):335-343.
[16] GALLO D, FERLINI C, SCAMBIA G, et al.The epithelial mesenchymal transition and the estrogen-signaling in ovarian cancer[J].Curr Drug Targets, 2010, 11(4):474-481.
[17] YI BR, KIM TH, KIM YS, et al.Alteration of epithelial-mesenchymal transition markers in human normal ovaries and neoplastic ovarian cancers[J].Int J Oncol, 2015 46(1):272-280.
[18] PON YL, AUERSPERG N, WONG AS.Gonadotropins regulate N-cadherin-mediated human ovarian surface epithelial cell survival at both post-translational and transcriptional levels through a cyclic AMP/protein kinase A pathway[J].J Biol Chem, 2005, 280(15): 15438-15448.
[19] BECK TN, CHIKWEM AJ, SOLANKI NR, et al.Bioinformatic approaches to augment study of epithelial-to-mesenchymal transition in lung cancer[J].Physiol Genomics, 2014, 46(19):699-724.
(编辑何宏灵)
收稿日期:2015-05-26修回日期:2015-10-26
作者简介:张恩溥(1988-),男(汉族),硕士研究生在读.研究方向:泌尿生殖系肿瘤.E-mail:zepfill116218@163.com
中图分类号:R691.9
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.02.017
The expression and correlation of TGF-β1 and N-cadherin in seminoma
ZHANG En-pu1,ZHENG Wen-zhong1, CHEN Jian-bo1, ZHANG Shi-qiang2, LIU Chong3, LI Ming-hua1, LI Xian-xin1
(1.Department of Urology,Shenzhen Hospital of Peking University, Shenzhen 518036, China; 2.Department of Urology, Cancer Center of Sun Yat-sen University, Guangzhou 510060, China; 3.Department of Gynaecology and Obstetrics, Shenzhen Hospital of Peking University, Shenzhen 518036, China)
ABSTRACT:ObjectiveTo investigate the expression and correlation of transforming growth factor-β1(TGF-β1) and N-cadherin in seminomas.MethodsThe expressions of TGF-β1 and N-cadherin in 34 seminoma tissues and 15 normal testicular specimens were detected with immunohistochemical staining.Plasmid vector of N-cadherin was constructed, and NCCIT cells were transfected.The NCCIT cells were cultured for 2 days with TGF-β1 nutrient medium and the expression of N-cadherin was detected with fluorescence technique.ResultsTGF-β1 was detected in Leydig cells, seminiferous epithelial cells, sperms and sertoli cells of testis tissues.N-cadherin was detected in tight junctions(TJs) and adherin junctions(AJs) between sertoli cells.Immunohistochemical staining did not detect N-cadherin in seminomas.Immunohistochemical staining results showed that the expression of TGF-β1 was significantly increased in seminoma compared with that in normal testis tissues(P<0.05).Immunofluorescence staining results showed that TGF-β1 could significantly down-regulate the expression of N-cadherin in NCCIT.ConclusionsUP-regulated TGF-β1 and down-regulated of N-cadherin are detected in seminomas, which indicates that TGF-β1 plays an important role in tumorigenesis of seminomas by regulating the expression of N-cadherin.
KEY WORDS:transforming growth factor-β1; N-cadherin; seminomas; NCCIT seminomas cell line

