多西他赛单药或联合血管内皮生长因子抑制剂治疗去势抵抗性前列腺癌疗效和安全性的Meta分析
谭 政,宋争放 ,雷乃军,2,毛 顿, 廖 洪, 李 曾,肖英明,吴 毅,杨盛柯
(1.四川省肿瘤医院泌尿外科,四川成都 610041;2.巴中市中心医院肿瘤科,四川巴中 636000)
·临床研究·
多西他赛单药或联合血管内皮生长因子抑制剂治疗去势抵抗性前列腺癌疗效和安全性的Meta分析
谭政1,宋争放1,雷乃军1,2,毛顿1, 廖洪1, 李曾1,肖英明1,吴毅1,杨盛柯1
(1.四川省肿瘤医院泌尿外科,四川成都610041;2.巴中市中心医院肿瘤科,四川巴中636000)
摘要:目的系统评价多西他赛联合血管内皮生长因子抑制剂治疗去势抵抗性前列腺癌的疗效和安全性。方法计算机检索EMbase、PubMed、Cochran,查找多西他赛单独与联合血管内皮生长因子抑制剂(inhibition of VEGF Agents)比较治疗前列腺癌的随机对照试验(RCT),检索时限均从建库至2014年9 月1日。按照纳入/ 排除标准对纳入研究进行资料提取、方法学质量评价后,采用RevMan 5.2 软件进行Meta分析,并采用Jadad评分进行文献质量评估。结果共纳入4 个RCT,2 386例患者。Meta分析结果显示,多西他赛联合血管内皮生长因子抑制剂治疗组与多西他赛单药组比较,前列腺特异性抗原(PSA)反应率 [RR=0.94, 95%CI(0.77,1.15), P=0.56],客观反应率 [RR=0.91, 95%CI(0.46,1.80), P=0.79],在中位总生存时间方面[HR=0.94, 95%CI(0.85,1.04), P=0.23],和无疾病进展时间 [HR=1.13,95%CI(0.53,2.38), P=0.76],两组差异无统计学意义;但治疗相关病死率[RR=2.70,95%CI(1.51,4.85), P=0.0009]联合组高于单药组,血栓发生率[RR=0.55, 95%CI(0.39, 0.78), P=0.0008],联合组低于单药组。结论目前有限证据显示多西他赛联合血管内皮生长因子抑制剂用于治疗去势抵抗性前列腺癌患者方面,并不能提高患者中位总生存和无疾病进展时间,且可能增加治疗相关病死率。上述结论尚需更多高质量大样本RCT加以验证。
关键词:多西他赛;血管内皮生长因子抑制剂;去势抵抗性前列腺癌;随机对照试验;Meta分析;
前列腺癌是威胁男性健康的常见肿瘤。据美国肿瘤学会评估,2014年前列腺癌新发病例为233 000,死亡病例为29 480[1]。我国发病率较低。但多数患者在获得诊断时肿瘤已处于中晚期,虽然内分泌治疗可以使大多数患者的病情得到控制和改善,但在经过中位时间为18~30个月的缓解期后,绝大多数患者会发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC)。1996年,美国FDA批准了米托蒽醌与强的松的联合治疗方案,但临床试验结果显示,与强的松单药治疗相比,却不能改善整体生存率[2],因而很大程度上限制了该方案的推广。TAX327 Ⅲ期试验结果显示,与米托蒽醌相比,多西紫杉醇联合泼尼松(强的松)治疗不仅可以改善患者的生活质量,并且可以延长患者2.5 个月中位生存期[3]。2004 年,美国FDA(Food and Drug Administration)批准的以多西紫杉醇为基础的化疗方案,成为CRPC 的一线标准治疗。现多西他赛联合其他药物治疗成为研究热点,在一个多西他赛单独与联合雌氮芥的Meta分析中,总生存及3或4级不良事件方面无明显统计学差异,但在PSA反应率方面有统计学意义[4]。目前国际上有多个多西他赛联合血管内皮生长因子抑制剂(inhibition of vascular endothelial growth factor agents)的随机对照试验(randomized controlledtrial,RCT),但显示出不同的结果,因此我们采用系统评价方法评价多西他赛联合血管内皮生长因子抑制剂治疗去势抵抗性前列腺癌的疗效和安全性,以期为临床决策提供依据。
1资料与方法
1.1纳入和排除标准
1.1.1研究类型临床Ⅱ期或Ⅲ期RCT,无论是否采用盲法。
1.1.2研究对象经穿刺或手术病理明确诊断为前列腺癌患者,且经过内分泌治疗后复发或转移的患者,种族和区域不限,心脑肺肝肾等重要器官无严重病变。去势抵抗性前列腺癌定义:①睾酮在血清中浓度小于50 ng/mL;②间隔两周连续3次PSA升高;③内分抗雄治疗结束4周以上;④二线内分泌治疗期间前列腺癌特异性抗原进展;⑤原有病变较前有所进展或者新发转移灶。
1.1.3干预措施多西他赛联合血管内皮生长因子抑制剂vs.多西他赛单药。
1.1.4结局指标中位生存时间、无疾病进展时间、PSA反应率、客观反应率、治疗相关不良反应、治疗相关病死率。
1.1.5排除标准①试验设计不严谨、有缺憾的伪随机试验;②重要数据及相关资料不全且无法准确获得者;③对相关结果多次发表者,选取方法学报告更严谨及数据资料同质和更全者。
1.2检索策略计算机检索EMbase、PubMed、Cochran,检索时限均从从建库至2014 年9 月1日。所有检索均采用主题词与自由词相结合的方式,检索语种为英语,其检索词包括:“prostate cancer, prostatic carcinoma, carcinoma of prostate, chemotherapy, docetaxel, randomized controlled trial”,并根据相应数据库调整,此外根据所查到的相关文献的参考文献追查符合条件的相关文献资料。如试验报告相关资料不全或无法获得全文者,通过电子邮件与作者进行联系获取。
1.3文献筛选和资料提取由2名相关专业人员单独进行文献筛选,若有分歧商讨解决。对纳入文献仍由2名相关专业人员进行文献质量评价和文献资料提取,并相互核对,若存在较大分歧,可通过讨论解决或者由第三位专业人员协助商讨解决,对于数据缺失或报告不详的资料通过电子邮件与文献的通讯作者或者其他作者联系获取。
1.4文献质量评价文献质量评估采用的是Jadad评分[5],每一项随机试验研究都将根据下面3个方面进行评估并获得一个分值,其包括:研究是否随机(0~2分),研究是否双盲(0~2分),对退出和失访有无处理(1分)。
1.5统计分析釆用Meta分析软件RevMan5.2进行相关结局指标数据统计分析。计数资料患者PSA反应率、治疗相关不良反应、治疗相关病死率采用风险比(odds ratio,OR)及其95%CI为疗效分析统计;时间事件结局指标患者中位生存时间及无疾病进展时间采用效益比(hazard ratio,HR) 及其95%CI为疗效分析统计。异质性检验采用I2及χ2卡方检验,只要I2不大于50%及P>0.10,其异质性可以接受,采用固定效应模型进行分析;如各研究结果间存在异质性,经专业知识综合判断无明显临床异质性,采用随机效应模型进行统计分析,若临床异质性较大且无法进行相关合并分析,可予仅行描述。
2结果
2.1纳入研究的基本特征通过网络检索初步获得2 086篇相关文献,利用文献管理软件(EndNote X6)剔除重后获得1 816篇相关文献,查看标题和摘要通过纳入和排除标准共排除非多西他赛联合靶向药物随机试验相关文献1 801篇,初步获得多西他赛联合靶向药物相关随机试验文献15篇[6-20],进一步详细阅读全文,因数据不全,排除会议摘要1篇[10],排除其他靶向药物10篇[11-20],最终纳入4篇多西他赛联合血管内皮生长因子抑制剂vs.多西他赛单药的随机试验。所有纳入研究的多西他赛单药组与多西他赛联合治疗组基线可比并无统计学差异(表1)。
表1患者基本情况
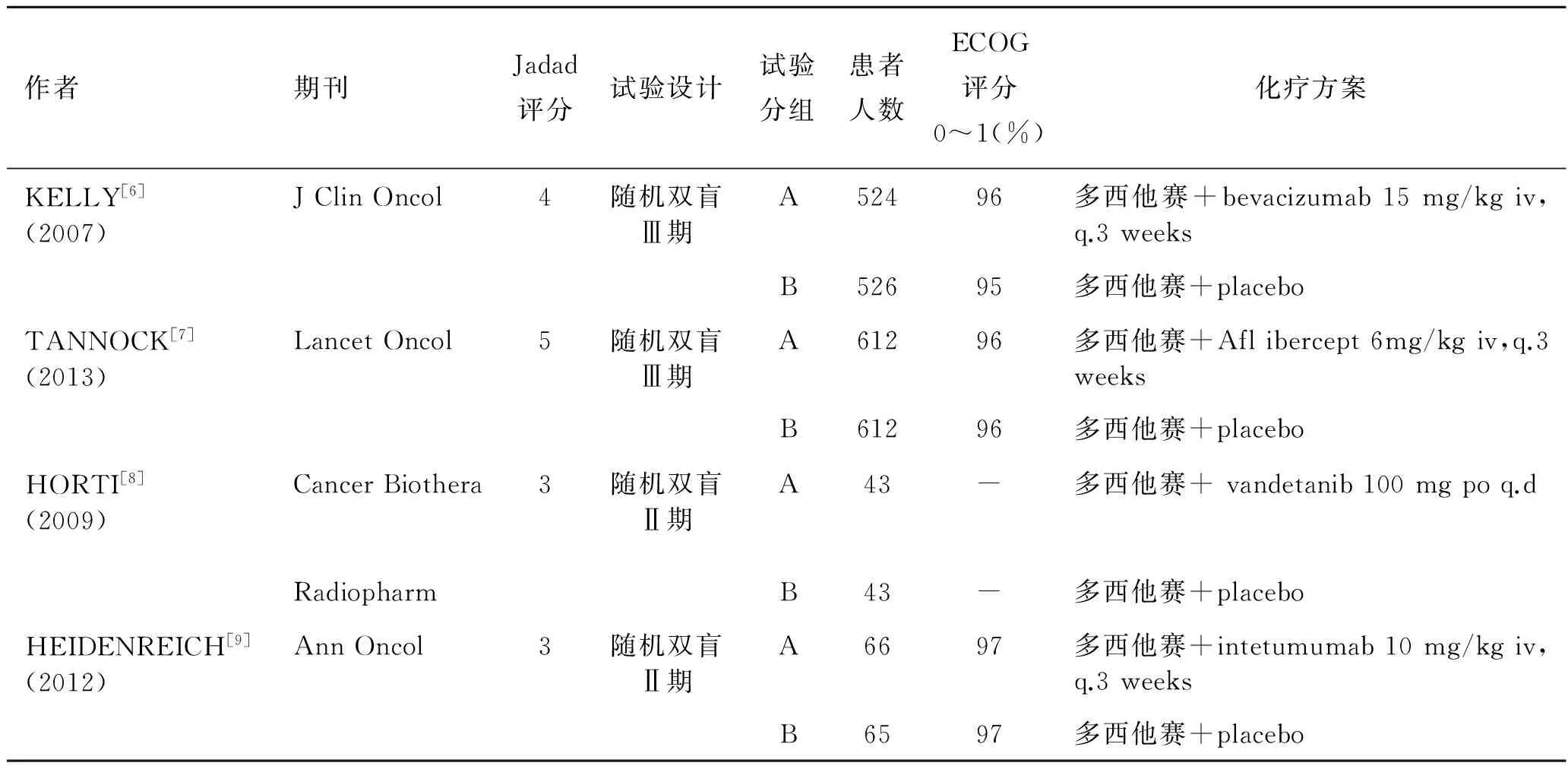
作者期刊Jadad评分试验设计试验分组患者人数ECOG评分0~1(%)化疗方案KELLY[6](2007)JClinOncol4随机双盲Ⅲ期A52496多西他赛+bevacizumab15mg/kgiv,q.3weeksB52695多西他赛+placeboTANNOCK[7](2013)LancetOncol5随机双盲Ⅲ期A61296多西他赛+Aflibercept6mg/kgiv,q.3weeksB61296多西他赛+placeboHORTI[8](2009)CancerBiothera3随机双盲Ⅱ期A43-多西他赛+vandetanib100mgpoq.dRadiopharmB43-多西他赛+placeboHEIDENREICH[9](2012)AnnOncol3随机双盲Ⅱ期A6697多西他赛+intetumumab10mg/kgiv,q.3weeksB6597多西他赛+placebo
A:多西他赛抗血管靶向药物组; B:多西他赛单药组;多西他赛:75 mg/m2iv.q.3 weeks。
2.2纳入研究的质量评价纳入的4个RCT 中,均对患者的基线情况进行了报道,4个RCT均采取“随机双盲”,其中2个Ⅲ期临床试验[6-7],2个Ⅱ期临床试验[8-9]。均为多中心临床随机试验,覆盖欧洲、非洲、亚洲等数个国家。采用Jadad评分,均大于或等于3分。
2.3Meta分析结果
2.3.1PSA反应率4个研究[6-9](共2 386例患者)比较了多西他赛单药组与多西他赛+血管内皮生长因子抑制剂的PSA反应率。所纳入研究结果间异质性检验为(I2=86%,P=0.000 1),统计学上存在异质性,采用随机效应模型进行Meta分析,结果显示两组差异无统计学意[RR=0.94,95%CI(0.77,1.15),P=0.56]。结果表明两组在PSA反应率上无差异(图1)。
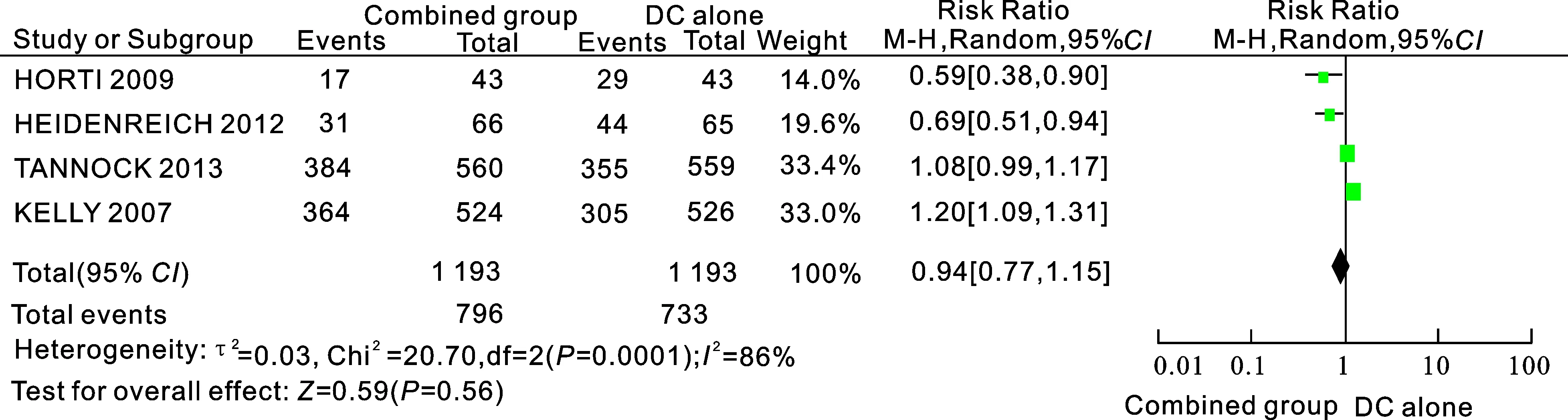
图1多西他赛单药组与多西他赛+血管内皮生长因子抑制剂组的PSA反应率比较
Combined group:多西他赛联合抗血管靶向药物组; DC alone:多西他赛单药组。
2.3.2 客观反应率3个研究[7-9](共829例患者)比较了多西他赛单药组与多西他赛+血管内皮生长因子抑制剂的客观反应率。所纳入研究结果间异质性检验为(I2=62%,P=0.07),统计学上存在异质性,采用随机效应模型进行Meta分析,结果显示两组差异无统计学意[RR=0.91, 95%CI(0.46,1.80),P=0.79]。结果表明两组在PSA反应率上无差异(图2)。
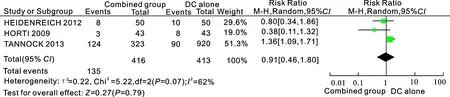
图2多西他赛单药组与多西他赛+血管内皮生长因子抑制剂组的客观反应率比较
Combined group:多西他赛+抗血管靶向药物组; DC alone:多西他赛单药组。
2.3.3中位总生存时间3个研究[6-7,9](共2 300例患者)报道了多西他赛单药组与多西他赛+血管内皮生长因子抑制剂的中位总生存时间。据效应值通过Meta分析,所纳入研究结果间异质性检验为I2=30%,P=0.24,统计学上无异质性,采用随机效应模型进行分析,结果显示两组差异无统计学意义[RR=0.94,95%CI(0.85,1.04),P=0.23],结果表明多西他赛联合组与多西他赛单药在中位总生存时间上无差异(图3)。
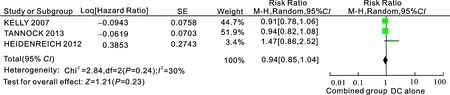
图3多西他赛单药组与多西他赛+血管内皮生长因子抑制剂组的中位总生存时间
Combined group:多西他赛联合抗血管靶向药物组; DC alone:多西他赛单药组。
2.3.4无疾病进展时间(progression-free survival,PFS)2个研究[6,9](共1 181例患者)报道了多西他赛单药组与多西他赛+血管内皮生长因子抑制剂的无疾病进展时间。据效应值行Meta分析,所纳入研究结果间异质性检验为I2=87%,P=0.005,统计学上存在异质性,采用随机效应模型进行分析,结果显示两组差异无统计学意义[HR=1.13,95%CI(0.53,2.38),P=0.76],结果表明多西他赛联合组与多西他赛单药在无疾病进展时间上无差异(图4)。
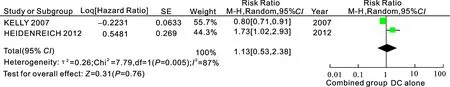
图4多西他赛单药组与多西他赛+血管内皮生长因子抑制剂组的无疾病进展时间比较
combined group:多西他赛联合抗血管靶向药物组; DC alone:多西他赛单药组。
2.3.5不良反应所有研究均报道了不良反应,在3~4级中性粒细胞减少、贫血、腹泻、疲乏方面结果显示两组差异无统计学意义。然而在血栓发生方面,所纳入研究结果间异质性检验为I2=0%,P=0.95,统计学上无异质性,采用固定效应模型进行分析,结果显示血栓发生方面差异有统计学意义[RR=0.55,95%CI(0.35,0.78),P=0.000 8],表明多西他赛+血管内皮生长因子抑制剂治疗组在血栓发生率上低于多西他赛单药治疗组(表2)。
2.3.6前列腺癌相关病死率2个研究[6-7](共2 218例患者)报道了多西他赛单药组与多西他赛+血管内皮生长因子抑制剂治疗的前列腺癌相关病死率。所纳入研究结果间异质性检验为I2=0%,P=0.53,统计学上无异质性,用固定效应模型进行分析,结果显示两组前列腺癌相关病死率差异有统计学意义[RR=2.70,95%CI(1.51,4.85),P=0.000 9],表明在安全性方面多西他赛单药组治疗较多西他赛+血管内皮生长因子抑制剂治疗组高(图5)。
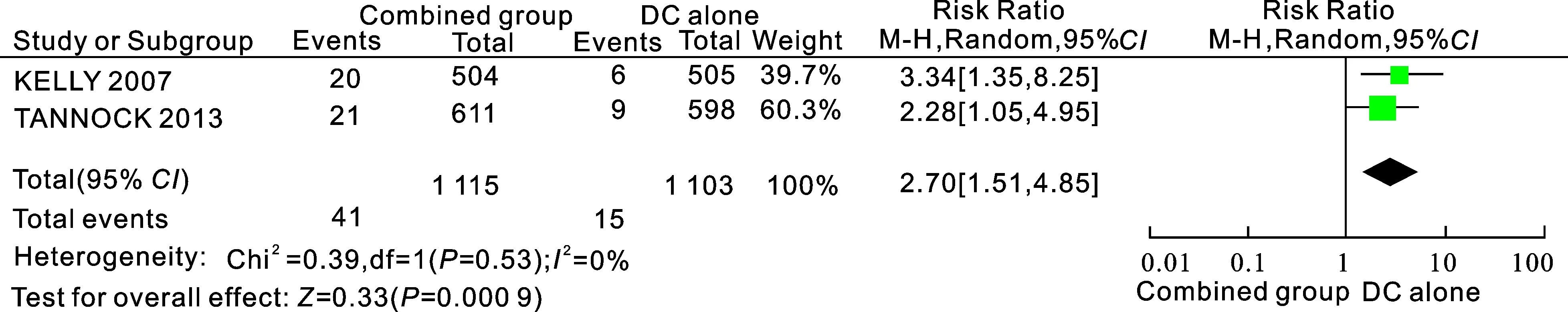
图5多西他赛单药组与多西他赛+血管内皮生长因子抑制剂组的相关死亡率比较
Combined group:多西他赛联合抗血管靶向药物组; DC alone:多西他赛单药组。
表2多西他赛单药组与多西他赛+血管内皮生长因子抑制剂的不良反应比较
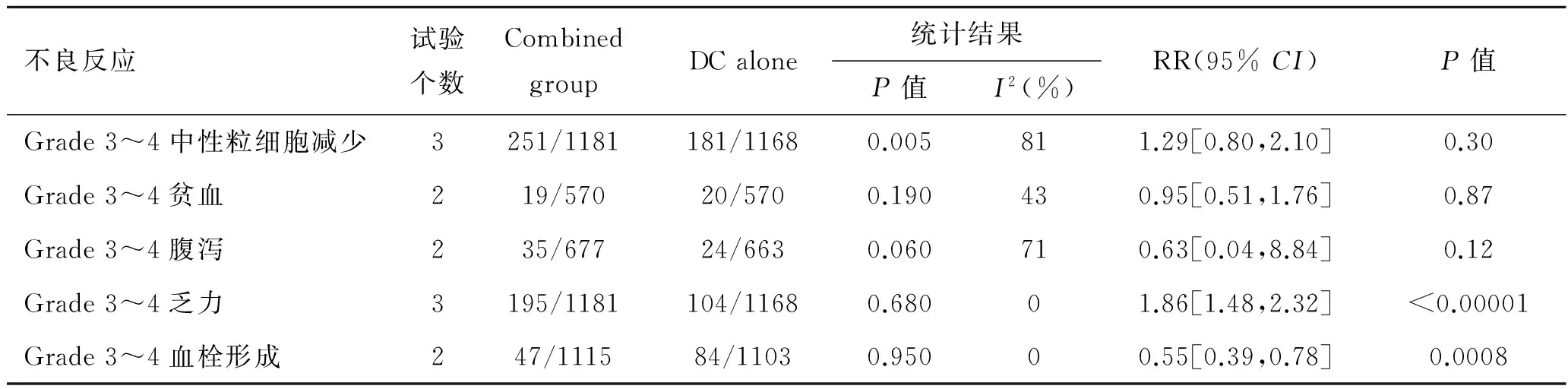
不良反应试验个数CombinedgroupDCalone统计结果P值I2(%)RR(95%CI)P值Grade3~4中性粒细胞减少3251/1181181/11680.005811.29[0.80,2.10]0.30Grade3~4贫血219/57020/5700.190430.95[0.51,1.76]0.87Grade3~4腹泻235/67724/6630.060710.63[0.04,8.84]0.12Grade3~4乏力3195/1181104/11680.68001.86[1.48,2.32]<0.00001Grade3~4血栓形成247/111584/11030.95000.55[0.39,0.78]0.0008
Combined group:多西他赛联合抗血管靶向药物组;DC alone:多西他赛单药组。
3讨论
本Meta分析结果显示,在疗效方面,中位总生存时间、无疾病进展时间、PSA反应率以及客观反应率方面两组之间无差异;其中两个研究[7-8]报道了疼痛进展时间,但两个研究中联合组和单药组之间比较均无统计学意义,同时也行了骨相关性事件的报道,且两个研究中两组比较均无统计学意义。
在一个随机试验中[12],多西他赛使用方法为30 mg/ m2第1、8、15天,iv.q.3周,而本Meta分析所有随机试验中多西他赛使用方法为75 mg/ m2(iv.q.3周),其结果显示30 mg/m2剂量中位总生存单药组为4.2月,联合组为4.2月,明显低于本Meta分析所有随机试验中的结果。TAX327 III 期试验结果显示[21],多西他赛使用方法为75 mg/ m2.iv.q.3周优于30 mg/ m2iv.每周,然而在另一个随机试验中[22],多西他赛使用方法为50 mg/m2第1天、15天, iv.q.4周优于75 mg/ m2第1天, iv.q.3周。其结果提示多西他赛用法及用量与结果可能存在相关性。
本Meta分析结果显示,在安全性方面,3~4级常见不良反应方面,如中性粒细胞减少[RR=1.29, 95%CI(0.80, 2.10),P=0.30]、贫血[RR=0.95, 95%CI(0.51, 1.76),P=0.87]、腹泻[RR=0.63, 95%CI(0.04, 8.84),P=0.73]、疲乏[RR=1.86, 95%CI(1.48, 2.32),P<0.000 01]方面两组之间无统计学差异。治疗相关性死亡率方面[RR=2.70,95%CI(1.51,4.85),P=0.000 9]显示多西他赛单药组优于多西他赛联合组,表明多西他赛联合血管内皮生长因子抑制剂治疗前列腺癌增加死亡风险;然而在血栓形成方面[RR=0.55, 95%CI(0.39, 0.78),P=0.000 8],结果显示多西他赛联合组优于多西他赛单药组,表明多西他赛联合血管内皮生长因子抑制剂治疗前列腺癌减少血栓形成风险。
在恶性肿瘤患者中自身凝血亢进,具有血栓形成高危因素,然而此Meta分析中血栓形成方面[RR=0.55, 95%CI(0.39, 0.78),P=0.000 8],结果显示多西他赛联合组优于多西他赛单药组,表明多西他赛联合血管内皮生长因子抑制剂治疗前列腺癌减少血栓形成风险;报道血栓形成不良反应的各研究中均未分析血栓形成相关信息,然而多个研究[23-25]提示血管内皮生长因子抑制剂的不良反应常见有血栓形成,造成此结果的原因尚不明确,故还需进一步的基础研究及临床研究予以证实。
本Meta分析中两组在治疗相关性死亡率方面[RR=2.70,95%CI(1.51,4.85),P=0.000 9]有统计学意义,表明多西他赛联合血管内皮生长因子抑制剂治疗前列腺癌增加死亡风险,且报道死亡率的各个研究中均进行了死亡原因分析,其中两个独立研究相关性死亡率的组间差异有统计学意义[6-7],分析其差异原因,在联合组主要为粒细胞减少引起的肺部感染以及部分血管事件如出血、梗塞等其他原因,单药组则主要是血管事件及其他原因。上述研究两组中性粒细胞减少的差异也有统计学意义,单药组中性粒细胞减少较联合组低。上述证据表明两组相关性死亡率方面的差异可能为联合组用药导致肺部感染等相关并发症所致。
在本Meta分析中,多西他赛单药对比多西他赛联合血管内皮生长因子抑制剂在主要观察指标中位总生存时间、无疾病进展时间、PSA反应率无明显统计学差异,但明显增加了治疗费用,以多西他赛(泰素蒂)联合Bevacizumab(罗氏公司)为例,以四川省肿瘤医院2014年药品价格为参照标准,其每周药品成本费用约为非联合组成本费用5倍(53526元比11142元)。
参考文献:
[1] SIEGE R, MA J, ZOU ZH, et al.Cancer Statistics, 2014[J].Ca Cancer J Clin,2014,64(1):9-29.
[2] TANNOCK IF, OSOBA D, STOCKLER MR, et al.Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomized trial with palliative end points[J].J Clin Oncol,1996,14(6):1756-1764.
[3] TANNOCK IF, WIT R, BERRY WR,et al.Docetaxel plus Prednisone or Mitoxantrone lus Prednisone for Advanced Prostate Cancer[J].N Engl J Med,2004,351(15):1502-1512.
[4] QI WX,SHEN Z AND YAO Y.Docetaxel-based therapy with or without estramustine as Wrst-line chemotherapy for castration-resistant prostate cancer:a meta-analysis of four randomized controlled trials[J].J Cancer Res Clin Oncol,2011,137(12):1785-1790.
[5] JADAD AR, MOORE RA, CARROLL D, et al.Assessing the quality of reports of randomized clinical trials: Is blinding necessary?[J].Control Clin Trials,1996,17(1): 1-12.
[6] KELLY WK, HALABI S, CARDUCCI M, et al.Randomized, Double-Blind, Placebo-Controlled Phase Ⅲ Trial Comparing Docetaxel and prednisone with or without bevacizumab in men with metastatic castration-resistant prostate cancer: CALGB 90401[J].J Clin Oncol,2012,30(13):1534-1540.
[7] TANNOCK IF, FIZAZI K, JVANOV S, et al.Aflibercept versus placebo in combination with docetaxeland prednisone for treatment of men with metastatic castration-resistant prostate cancer(VENICE): a phase 3,double-blind randomised trial[J].Lancet Oncol,2013,14(8): 760-768.
[8] HORTI J, WIDMARK A, STENZL A, et al.A randomized, double-blind, placebo-controlled phase II study of vandetanib plus docetaxel/prednisolone in patients with hormone-refractory prostate cancer[J].Cancer Biother Radiopharm,2009,24(2):175-180.
[9] HEIDENREICH A, RAWAL SK, SZKARLAT K, et al.A randomized, double-blind, multicenter, phase 2 study of a human monoclonal antibody to human am integrins(intetumumab) in combination with docetaxel and prednisone for the first-line treatment of patients with metastatic castration-resistant prostate cancer[J].Ann Oncoly,2013,24(2): 329-336.
[10] HEATH EI,MANNUEL HD,LIU G, et al.Randomized phase II trial of docetaxel(Doc) and prednisone(Pred) with or without AZD2171(cediranib), in chemotherapy-naive, metastatic castrate-resistant prostate cancer(mCRPC)(NCI 7451) [J].J Clin Oncol,2013,31(6).
[11] WIECHNO PJ,CHLOSTA P,PIKIEL J, et al.Randomized phase II study with window-design to evaluate anti-tumor activity of the survivin antisense oligonucleotide(ASO) ly2181308 in combination with docetaxel for first-line treatment of castrate-resistant prostate cancer(CRPC) [J].J Clin Oncol,2013,31(15).
[12] MATHEW P, THALL PF, BUCANA CD, et al.Platelet-derived growth factor receptor inhibition and chemotherapy for castration-resistant prostate cancer with bone metastases[J].Clin Cancer Res,2007, 13(19):5816-5824.
[13] FIZAZI KS, HIGANO CS,NELSON JB, et al.Phase III,Randomized,placebo-controlled study of docetaxel in combination with zibotentan in patients with metastatic castration-resistant prostate cancer[J].J Clin Oncol, 2013,3(14) 1:1740-1747.
[14] QUINN DI, TANGEN CM, HUSSAIN M, et al.Docetaxel and atrasentan versus docetaxel and placebo for men with advanced castration-resistant prostate cancer(SWOG S0421): a randomised phase 3 trial[J].Lancet Oncol,2013,14(9):893 -900.
[15] DREICER R, GARCIA J, RINI B, et al: A randomized, double-blind, placebo-controlled, Phase II study with and without enzastaurin in combination with docetaxel-based chemotherapy in patients with castration-resistant metastatic prostate cancer[J].Invest New Drugs,2013,31(4):1044-1050.
[16] PILI R, ROSENTHAL MA, MAINWARING PN, et al.Phase II study on the addition of ASA404(Vadimezan; 5,6-Dimethylxanthenone-4-Acetic Acid) to docetaxel in CRMPC[J].Clin Cancer Res,2010, 16(10):2906-2914.
[17] STERNBERG CN, DUMEZ H, POPPEL HV, et al.Docetaxel plus oblimersen sodium(Bcl-2 antisense oligonucleotide): an EORTC multicenter, randomized phase II study in patients with castration-resistant prostate cancer[J].Ann Oncol,2009, 20(7): 1264-1269.
[18] CHI KN, HOTTE SJ, YU EY, et al.Randomized phase Ⅱ study of Docetaxel and Prednisone with or without OGX-011 in patients with metastatic castration-resistant prostate cancer[J].J Clin Oncol,2010, 28(27):4247-4254,2010.
[19] DAHUT WL, GULLEY JL, ARLEN PM, et al.Randomized phase II Trial of docetaxel plus thalidomide in androgen-independent prostate cancer[J].J Clin Oncol,2004,22(13):2532-2539.
[20] SONPAVDE G, MATVEEV V, BURKE JM, et al.Randomized phase II trial of docetaxel plus prednisone in combination with placebo or AT-101, an oral small molecule Bcl-2 family antagonist, as first-line therapy for metastatic castration-resistant prostate cancer[J].Ann Oncol,2012,23(7): 1803-1808.
[21] BERTHOLD DR,POND GR,SOBAN F, et al.Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer: updated survival in the TAX 327 study[J].J Clin Oncol,2008,26(2):242-245.
[22] KELLOKUMPU-LEHTINEN PL, HARMENBERG U, JOENSUU T,et al.2-Weekly versus 3-weekly docetaxel to treat castration-resistant advanced prostate cancer: a randomised, phase3 trial[J].Lancet Oncol,2013,14(2):117-124.
[23] HUANG HX, ZHENG YY, ZHU JH, et al.An UpdatedMeta-Analysis of fatal adverse events caused by bevacizumab therapy in cancer patients[J].PLoS One,2014, 9(3):e89960.
[24] CSAKY K, DO DV.Safety implications of vascular endothelial growth factor blockade for subjects receiving intravitreal anti-vascular endothelial growth factor therapies[J].Am J Ophthalmol, 2009,148(5):647-656.
[25] TEW WP,GORDON M,MURREN J, et al.Phase 1 Study of Aflibercept Administered Subcutaneously to Patients with Advanced Solid Tumors[J].Clin Cancer Res, 2010,16(1):358-366.
(编辑王玮)
收稿日期:2015-07-02修回日期:2015-09-19
通讯作者:宋争放.硕士,主任医师.E-mail: zfsong@sina.com
作者简介:谭政(1966-),男(汉族),副主任医师.E-mail:doctortanz@163.com
中图分类号:R737.2
文献标志码:A
DOI:10.3969/j.issn.1009-8291.2016.02.013
Docetaxel-based therapy with or without inhibitor of VEGF agents as first-line chemotherapy for castration-resistant prostate cancer: a Meta-analysis of four randomized controlled trials
TAN Zheng1, SONG Zheng-fang1, LEI Nai-jun1,2, MAO Dun1, LIAO Hong1, LI Zeng1, XIAO Ying-ming1, WU Yi1, YANG Sheng-ke1
(1.Department of Urology, Sichuan Cancer Hospital, Chengdu 610041; 2.Department of Oncology, Central Hospital of Bazhong, Bazhong 636000, China)
ABSTRACT:ObjectiveTo assess the efficacy and safety of docetaxel-based chemotherapy combined with inhibitor of VEGF agents(combined therapy) and docetaxel-based chemotherapy without inhibitor of VEGF agents(single therapy) for the treatment of castration-resistant prostate cancer.MethodsData bases such as EMbase, PubMed, and Cochrane were searched to retrieve randomized controlled trials(RCT) which compared docetaxel-based therapy with or without inhibitor of VEGF in the treatment of prostate cancer.The searching time limit was from the establishment of the database to Sept.1st, 2014.After data were extracted and evaluated, Meta-analysis was conducted with RevMan 5.2, and quality of literature was evaluated with jadad method.ResultsA total of 4 RTCs involving 2 386 patients were included.Meta-analysis showed, prostate-specific antigen(PSA) response rate was [RR=0.94, 95%CI(0.77,1.15),P=0.56], objective response rate was [RR=0.91, 95%CI(0.46,1.80), P=0.79], overall survival(OS) [HR=0.94, 95%CI(0.85,1.04), P=0.23], progression-free survival time(PFS) was [HR=1.13, 95%CI(0.53,2.38),P=0.76], and there was no statistical difference between the two types of treatment.The combined therapy had higher treating-related mortality [RR=2.70, 95%CI(1.51, 4.85), P=0.000 9], while single therapy has higher incidence of thrombus [RR=0.55, 95%CI(0.39, 0.78),P=0.000 8].ConclusionsWhen docetaxel with inhibitor of VEGF agents is used to treat castration-resistant prostate cancer, it may not increase patients’ overall survival time and progression-free survival time, whereas may increase the related mortality in treating progress.Further RCTs with big samples should be conducted to verify the results.
KEY WORDS:docetaxel;inhibition of VEGF;castration-resistant prostate cancer;randomized controlled trial; Meta-analysis

