多西他赛为主的联合化疗方案治疗转移性乳腺癌
刘静 陈开杰
[摘 要] 目的:分析多西他赛为主的联合化疗方案治疗转移性乳腺癌的临床疗效与安全性。方法:选取我院2013年7月—2015年7月收治的82例无手术指征的ⅢC/Ⅳ期转移性乳腺癌患者,按照随机数字表法分为观察组、对照组,各41例。观察组接受多西他赛+环磷酰胺+氟尿嘧啶化疗,对照组接受吡柔比星+环磷酰胺+氟尿嘧啶化疗,21d为1周期。于治疗2周期后检测两组患者肿瘤标志物变化,评价其临床疗效与不良反应。结果:两组患者治疗后CA153、CEA均降低,观察组降低更为明显,差异有统计学意义(P<0.05)。观察组客观有效率、临床受益率分别为53.66%、85.37%,均高于对照组的21.95%、48.78%,差异有统计学意义(P<0.05)。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。结论:应用多西他赛为主的联合化疗方案治疗转移性乳腺癌有着良好的疗效,且不良反应可耐受。
[关键词] 多西他赛;化疗;转移性乳腺癌;疗效;不良反应
中图分类号:R97 文献标识码:A 文章编号:2095-5200(2016)06-117-03
DOI:10.11876/mimt201606043
化疗在乳腺癌的治疗中占据着重要地位[1],对于失去手术机会的转移性乳腺癌患者而言,化疗是控制病灶进展唯一手段[2]。因此,化疗方案的选择十分重要,欧美国家已批准多西他赛用于局部晚期或伴有远处转移的晚期乳腺癌的临床治疗[3]。为了解多西他赛为主的联合化疗方案治疗转移性乳腺癌的临床疗效与安全性,本研究选取82例患者进行了前瞻性对照分析。
1 资料与方法
1.1 一般资料
选取我院2013年7月—2015年7月收治的82例转移性乳腺癌患者,按照随机数字表法分为观察组、对照组,各41例。观察组年龄(41.37±4.46)岁;ⅢC期16例、Ⅳ期25例;浸润性导管癌26例,小叶癌7例,其他8例;ER阳性19例,阴性22例。对照组年龄(41.25±4.51)岁;ⅢC期18例、Ⅳ期23例;浸润性导管癌24例,小叶癌8例,其他9例;ER阳性20例,阴性21例。两组患者一般临床资料比较,差异无统计学意义(P>0.05),本临床研究具有可比性。
1.2 选取标准及排除标准
选取标准:1)经穿刺活检确诊的ⅢC/Ⅳ期转移性乳腺癌,且失去手术指证[4];2)病灶直径可测量,Kamofsky评分≥60分,预期生存期≥3个月;3)入组前1个月内无其他抗癌药物治疗史或放疗史;4)血常规、心电图指标基本正常,肝肾功能指标≤1.5倍正常上限;5)明确此次研究内容,知情同意且自愿参与。排除标准:1)临床资料不完整或临床、影像学观察指标无法评价;2)既往有其他恶性肿瘤史;3)治疗时间<2个周期;4)合并骨髓受累或严重脏器功能损伤。
1.3 研究方法
1.3.1 治疗方案 观察组:80 mg/m2多西他赛加入500 mL生理盐水静脉滴注,4 h滴注完毕;600 mg/m2环磷酰胺加入20 mL生理盐水中静脉推注;400 mg/m2氟尿嘧啶静脉滴注。化疗时间d1、d8,21 d为1周期,持续2~6个周期。对照组:50 mg/m2吡柔比星加入500 mL生理盐水静脉滴注,4 h滴注完毕,其他化疗药物及化疗时间同观察组[5]。在化疗基础上,实施综合支持疗法。
1.3.2 观察指标 于治疗2个疗程后实施肿瘤标志物检测与疗效评价。抽取两组患者治疗前、治疗后清晨空腹肘静脉血检测糖类抗原153(CA153)、CA125、癌胚抗原(CEA),检测结果正常参考值[6]:CA153:0~35 kU/L;CA125:0~35 kU/L;CEA:0~5 ng/mL。
疗效评价根据两组患者治疗后病灶最大直径、肿瘤标志物变化[7]:完全缓解(CR):全部靶病灶消失,肿瘤标志物水平处于正常范围内且持续≥4周;部分缓解(PR):靶病灶最大直径较治疗前减小≥30%,肿瘤标志物水平较治疗前降低≥65%且持续≥4周;疾病进展(PD):靶病灶最大直径较治疗前减小≤20%或增大<20%,肿瘤标志物水平较治疗前增大≥40%;疾病稳定(SD):介于PR、PD之间。临床受益率=(CR+PR+SD)/总例数×100%;客观有效率=(CR+PR)/总例数×100%
安全性评价参照世界卫生组织(WHO)制定的急性、亚急性毒性标准[8]。
1.4 统计学分析
数据采用SPSS20.0进行分析,计数资料以(n/%)表示,并采用χ2检验,计量资料以(x±s)表示,满足正态分布且方差齐性则采用独立样本t检验,若方差不齐,则采用校正t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 肿瘤标志物
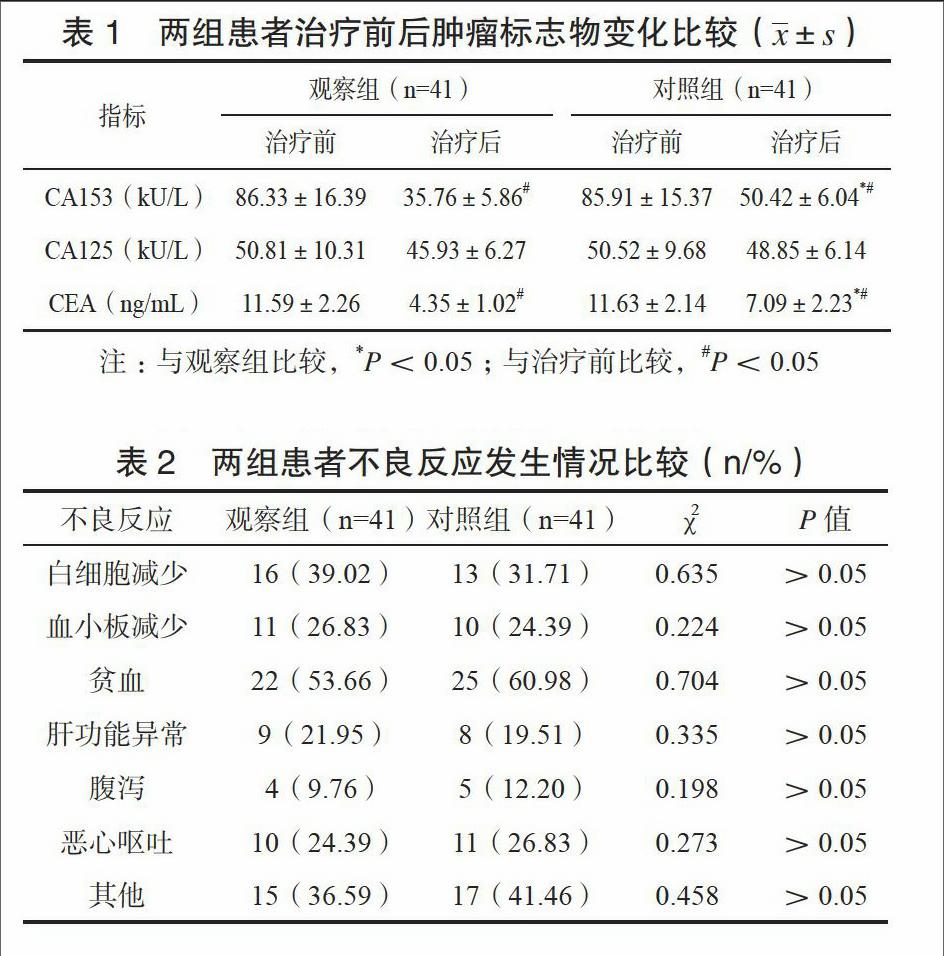
两组患者治疗后CA153、CEA均降低,观察组降低更为明显,差异有统计学意义(P<0.05),见表1。
5
2.2 临床疗效及不良反应
观察组PR22例、SD13例、PD6例,对照组PR9例、SD11例、PD21例,观察组客观有效率、临床受益率分别为56.10%、85.37%,均高于对照组的21.95%、48.78%,差异有统计学意义(P<0.05)。两组患者不良反应发生率比较,差异无统计学意义(P>0.05),见表2。其不良反应多集中于贫血、白细胞减少,且以I~II级为主,经停药或支持治疗后均恢复。
3 讨论
尽管对于乳腺癌的治疗已取得了较大进展,但转移性乳腺癌预后欠佳,与此同时,我国约有5%~15%的患者确诊时已出现远处转移,为临床治疗方案的选择提出了更高的要求[9]。
联合化疗的毒性反应及不稳定的治疗效果一直是困扰临床的一大难题[10]。在保证耐受性的前提下,尽可能缓解肿瘤的快速生长、延长患者生存周期、提高患者生存质量是转移性乳腺癌治疗的首要原则[11]。多西他赛是一种强效紫杉醇类药物,可结合游离微管蛋白,发挥促进小管聚合为稳定的微管、抑制微管解聚等作用,从而抑制细胞有丝分裂,达到抗癌效果。其优势在于不会影响微管束中原丝数量,故与临床中大多数纺锤体毒性抗癌药物作用机制存在差异,对正常细胞的影响更小[12]。
吡柔比星属蒽环类抗肿瘤药物,可通过干扰碱基对配对过程,阻断mRNA形成,发挥抗肿瘤作用[13-15]。
本研究就两种药物治疗转移性乳腺癌的效果与安全性进行了比较,结果表明,以多西他赛为主的联合化疗方案在降低患者血清肿瘤标志物,提高客观有效率、临床受益率方面发挥了良好效果。血清CA153、CEA水平与转移性乳腺癌患者的预后具有密切关联[16],其水平的升高预示着患者肿瘤转移、浸润风险升高,预后不良,本研究两组患者治疗后CA153、CEA水平均降低,观察组降低更为明显,提示观察组患者有望获得更佳的远期预后质量,鉴于本研究随访时间有限,未能对患者远期疗效予以评价,这是此次研究的局限性所在。
安全性方面,两组患者不良反应差异无统计学意义,且未对治疗依从性造成明显影响。同时,本研究患者于用药前、用药后均分别接受地塞米松、止吐药物治疗,故可进一步降低不良反应发生风险及发生程度[17]。此外,Hancox等[18]发现,多西他赛除具有良好的安全性及特异性作用机制外,其淋巴结、肝脏等部位分布浓度较高,故对于淋巴结转移、肝转移乳腺癌患者而言,该方案的针对性更强、疗效更为确切。
综上所述,多西他赛为主的联合化疗方案可有效降低转移性乳腺癌患者血清肿瘤标志物,能在保持良好耐受性的前提下,显著提高客观有效率、临床受益率,其良好的近期疗效值得肯定。
参 考 文 献
[1] Swain S M, Kim S B, Cortés J, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA study): overall survival results from a randomised, double-blind, placebo-controlled, phase 3 study[J]. Lancet Oncol, 2013, 14(6): 461-471.
[2] 张丹华, 周恩相. 紫杉醇注射液、紫杉醇脂质体以及多西他赛治疗乳腺癌的疗效及安全性[J]. 中国癌症杂志, 2013, 23(12): 1014-1016.
[3] 王建逵. 吡柔比星和环磷酰胺联合多西他赛对乳腺癌的临床疗效观察[J]. 实用癌症杂志, 2015, 30(4): 537-540.
[4] Schott A F, Landis M D, Dontu G, et al. Preclinical and clinical studies of gamma secretase inhibitors with docetaxel on human breast tumors[J]. Clin Cancer Res, 2013, 19(6): 1512-1524.
[5] 吴志鹏. 吡柔比星和环磷酰胺联合多西他赛在乳腺癌新辅助化疗中的临床疗效观察[J]. 中国肿瘤临床与康复, 2014, 21(3): 304-306.
[6] Gianni L, Romieu G H, Lichinitser M, et al. AVEREL: a randomized phase III Trial evaluating bevacizumab in combination with docetaxel and trastuzumab as first-line therapy for HER2-positive locally recurrent/metastatic breast cancer[J]. Clin Oncol, 2013, 31(14): 1719-1725.
[7] 曾林文, 吴鸣, 宗兵. 环磷酰胺联合多西他赛用于乳腺癌术后化疗的近期疗效观察[J]. 山东大学学报:医学版, 2014, 52(z1): 111.
[8] Swain S M, Baselga J, Kim S B, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer[J]. N Engl J Med, 2015, 372(8): 724-734.
[9] 姚宇锋, 龚建平, 唐金海,等. 多西他赛联合洛铂新辅助化疗方案治疗三阴性乳腺癌的临床观察[J]. 临床肿瘤学杂志, 2013, 18(8): 723-725.
[10] Kolberg H C, Akpolat-Basci L, Stephanou M, et al. Neoadjuvant chemotherapy with docetaxel, carboplatin, and weekly trastuzumab (TCH) activity in HER2-positive early breast cancer: Results after a median follow-up of 4.5 years[C]//ASCO Annual Meeting Proceedings. 2015, 33(28 suppl): 140.
[11] Brahmer J, Reckamp K L, Baas P, et al. Nivolumab versus docetaxel in advanced squamous-cell non–small-cell lung cancer[J]. N Engl J Med, 2015, 373(2): 123-135.
[12] Miles D W, De Haas S L, Dirix L Y, et al. Biomarker results from the AVADO phase 3 trial of first-line bevacizumab plus docetaxel for HER2-negative metastatic breast cancer[J]. Br J Cancer, 2013, 108(5): 1052-1060.
[13] 王英哲,令狐锐霞,杨俊兰.乳腺癌靶向药物治疗进展[J].中华保健医学杂志,2015,17(1):74-78.
[14] Swain S M, Ewer M S, Cortés J, et al. Cardiac tolerability of pertuzumab plus trastuzumab plus docetaxel in patients with HER2-positive metastatic breast cancer in CLEOPATRA: a randomized, double-blind, placebo-controlled phase III study[J]. Oncologist, 2013, 18(3): 257-264.
[15] Coudert B, Pierga J Y, Mouret-Reynier M A, et al. Use of [18 F]-FDG PET to predict response to neoadjuvant trastuzumab and docetaxel in patients with HER2-positive breast cancer, and addition of bevacizumab to neoadjuvant trastuzumab and docetaxel in [18 F]-FDG PET-predicted non-responders (AVATAXHER): an open-label, randomised phase 2 trial[J]. Lancet Oncol, 2014, 15(13): 1493-1502.
[16] Singel S M, Cornelius C, Batten K, et al. A targeted RNAi screen of the breast cancer genome identifies KIF14 and TLN1 as genes that modulate docetaxel chemosensitivity in triple-negative breast cancer[J]. Clin Cancer Res, 2013, 19(8): 2061-2070.
[17] Murakami M, Ernsting M J, Undzys E, et al. Docetaxel Conjugate Nanoparticles That Target α-Smooth Muscle Actin–Expressing Stromal Cells Suppress Breast Cancer Metastasis[J]. Cancer Res, 2013, 73(15): 4862-4871.
[18] Hancox U, Cosulich S, Hanson L, et al. Inhibition of PI3Kβ signaling with AZD8186 inhibits growth of PTEN-deficient breast and prostate tumors alone and in combination with docetaxel[J]. Mol Cancer Ther, 2015, 14(1): 48-58.

