BAS-TRFIA法检测抗环瓜氨酸肽抗体方法学的建立
李 梅,叶 燕,胡志刚,张 健,俞 蕾,陈国千
(南京医科大学附属无锡市人民医院 医学检验科,江苏 无锡214023)
BAS-TRFIA法检测抗环瓜氨酸肽抗体方法学的建立
李梅*,叶燕*,胡志刚,张健,俞蕾,陈国千
(南京医科大学附属无锡市人民医院 医学检验科,江苏 无锡214023)
目的利用生物素-链霉亲和素放大系统建立一种可快速、灵敏地定量检测患者血清中抗环瓜氨酸肽(anticycliccitrullinatedpeptide,CCP)抗体的时间分辨荧光免疫分析法(time-resolvedfluoroimmunoassay,TRFIA)。方法将链霉亲和素同铕标记二乙烯三胺五乙酸酐结合制备铕标记链霉亲和素衍生物;生物素同兔抗人IgG抗体结合制备生物素化IgG抗体,后者在免疫检测系统中可联结铕标记亲和素和抗CCP抗体从而形成复合物。最后通过测量Eu3+-链霉亲和素在615nm的荧光值计算血清抗CCP抗体水平。结果该方法具有更宽的线性范围,其线性范围为0.58-9463U/ml,而应用ELISA试剂盒检测线性范围只有18.48-591.4U/ml。此外,该方法的抗CCP抗体检测限可达0.5U/mL。回收率为96.45-104.63%。用BAS-TRFIA和ELISA法测得的值具有很好的相关性(R2=0.892 7)。结论本研究数据表明我们的建立的BAS-TRFIA法在测定抗CCP抗体上较传统ELISA试剂盒有很大改进,为RA的诊断和治疗提供了一个更为理想的免疫方法学选择。
环瓜氨酸肽;类风湿关节炎;时间分辨荧光免疫分析
(Chin J Lab Diagn,2016,20:1250)
类风湿性关节炎(Rheumatoidarthritis,RA)是一种炎症性自身免疫性疾病,全球患病率为0.3-1%。RA可导致进行性关节侵蚀,治疗不及时情况下可致残并导致患者生活质量严重下降。因此,早期诊断对RA患者的预后十分关键。早期,一系列瓜氨酸相关自身抗体包括抗核周因子、抗角蛋白抗体等不断被发现,这些抗体被认为对早期的RA诊断具有较好的特异性[2]。1998年Schellekens等首次突破性证实含瓜氨酸的肽序列是RA特异的抗中间丝蛋白(filaggrin)相关蛋白抗体识别表位的必需组成。2000年Schellekens等报道将一条由19个氨基酸残基组成的瓜氨酸肽链中的两个丝氨酸替换为半胱氨酸,形成与β-转角具有相似结构的二硫键,合成CCP作为抗原用于ELISA法检测抗CCP抗体[3]。抗CCP抗体可以检测出高达80%的RA患者,特异性相当高,尤其对鉴别侵蚀性RA十分有用[4]。
TRFIA是一种非放射性免疫分析方法,由于该方法所采用的镧系元素具独特的荧光性质以及时间分辨测量模式,它比其他传统荧光免疫法具更高的灵敏度[5]。基于TRFIA技术的生物分析方法已对临床常规和研究领域产生重要影响[6]。
目前,Eu3+标记的链霉亲和素可作为一个很好的通用的间接标记物和时间分辨荧光系统相结合从而进一步放大信号且具有非特异性较低的特点。四聚体结构的链霉亲和素有4个生物素结合位点,从而可用于放大信号[7]。此外,铕元素作为通用荧光标记可用于大量生物活性物质的高通量筛查[8,9]。
本文中我们制备了Eu3+-链霉亲和素的铕螯合物,并将其作为结合生物素表面免疫基序的一个信号生成器。这是一种新的、快速的基于链霉亲和素-生物素放大技术的抗CCP抗体的BAS-TRFIA测定法。
1 材料与方法
1.1仪器与试剂芬兰AutoDELFIA1235全自动TRFIA检测仪、Eu3+标记的试剂盒以及Eu3+标记的增强液,芬兰Wallac公司产品;96孔聚苯乙烯板和重组CCP抗原,德国AESKU产品;单克隆兔抗人IgM抗体、二乙二胺四乙酸(DTTA),Sigma产品;牛血清白蛋白,卫生部上海生物制品研究所产品;SephadexG25,Pharmacia产品;浓缩洗涤液和增强液由江苏核医学研究所提供;其他试剂均为分析纯级试剂。
1.2ELISA试剂盒和抗CCP抗体标准品制备抗CCP抗体IgGELISA商品试剂盒分别为AESKU,Dr.Fenning和ORGENTEC产品,抗CCP抗体参考品来自AESKU。
1.3固相抗原制备
将重组CCP抗原用50mmoL/LNa2CO3-NaHCO3pH9.6缓冲稀释制备成包被液,加至聚苯乙烯微孔板上100μl/孔,然后4℃孵育过夜。弃去包被液,冲洗3次后加入250μl含3g/LBSA的磷酸盐缓冲液封闭未结合位点,4℃孵育过夜。弃去封闭液,将板条真空干燥,密封后置-20℃冷冻保存。
1.4生物素化抗人IgG抗体的制备
取1mgN-羟基琥珀酰亚胺生物素(BNHS)加至0.5mg的兔抗人IgG的pH7.2 0.05mol/LPBS缓冲液中,37℃反应 1h,然后用PBS透析24h,分装,使用前-20℃冷冻保存。
1.5Eu3+标记链霉亲和素的制备
铕标记链霉亲和素参照Eu3+标记盒说明书操作。将1mg克链霉亲和素加载在PD10柱上,洗脱液为pH8.5 50mmoL/LNa2CO3-NaHCO3缓冲液(含0.155moL/LNaCl)。然后将链霉亲和素混至0.2mgEu3+-二乙烯三胺五乙酸酐(DTPAA),30℃条件下剧烈搅拌反应20h。反应液经用pH7.8 80mmoL/LTris-HCl缓冲液平衡的SepharoseCL-6B柱(1×40cm)层析,分光光度仪280nm吸收波长检测下收集蛋白峰。纯化后,加等量AR甘油,分装,-20℃保存。
1.6抗CCP抗体检测
检测采用间接ELISA法。在包被了CCP抗原的微孔板内加100μl/孔经反应缓冲液稀释的血清或参考标准品,25℃反应震荡孵育30min。用洗涤液冲洗板条4次,然后加生物素化兔抗人IgG抗体100μl/孔,25℃震荡孵育30min。冲洗板条4次,然后加100μl/孔经缓冲液稀释的Eu3+标记的链霉亲和素,震荡孵育15min。洗涤6次后,加增强溶液100μl/孔,震荡5min。用AutoDELFIA1235测量Eu3+荧光强度(CPS)。最后根据标准曲线计算样品中抗CCP抗体的含量。
1.7方法学考核
①精密度检测:将分装储存在-20℃的低、中、高3份混合血清样品,混合血样,随样品测定并分别计算混合血清样品的变异系数(CV)值。②线性范围试验:取抗CCP抗体浓度最高的患者血清进行倍比稀释后,分别用本文建立的BAS-TRFIA和ELISA两种方法进行检测。以稀释倍数为横坐标,荧光计数为纵坐标,得到线性稀释浓度曲线图。③灵敏度测试:测定20孔零点标准品,±2s为其最小测定值,即其灵敏度。④临床应用:收集52例健康献血者血清标本以及32例系统性红斑狼疮、27例干燥综合征、10例硬皮病、20例混合性结缔组织病、23例多发性硬化症患者血清标本,检测这些血清标本中的抗CCP抗体水平,计算该检测法的临床特异性。⑤相关性实验:取32例阳性血清样品,分别用BAS-TRFIA和ELISA两种方法进行检测,计算其相关系数。⑥稳定性试验:将试剂盒置于37℃水浴箱7天,再与正常保存的试剂盒做对比。⑦回收率:三组含高浓度CCP抗体血清用样本稀释液稀释后然后测定其浓度值。
1.8统计学分析
数据采用SPSS13软件分析。分别用回归分析和方差分析来计算相关性和测试的线性。批间和批内变异采用CV计算。设定当P<0.05时有认为统计学意义。
2 结果
2.1线性范围将一CCP强阳性标本从9081稀释到0.55U/ml并同时采用BAS-TRFIA法和ELISA法检测。这两种方法检测的线性范围,如图1所示,我们看到了BAS-TRFIA法在9463-0.58U/ml有一个很好的线性范围,而使用ELISA法的线性范围落在591.4-18.48U/ml,表明我们建立的BAS-TRFIA法测定抗CCP抗体具有比ELISA法更宽的检测范围。
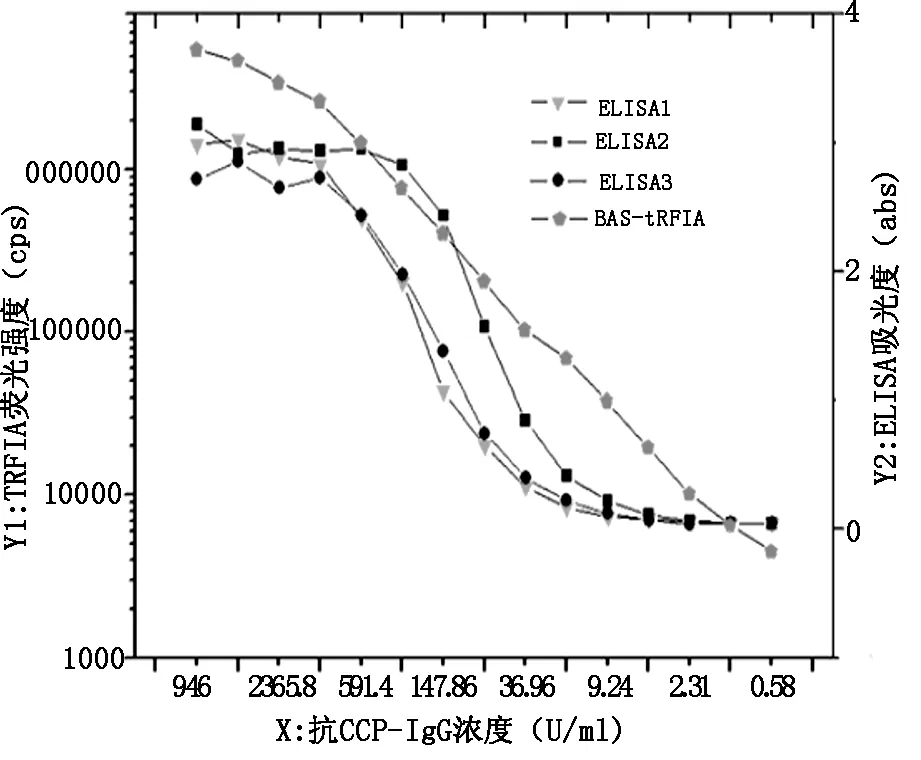
图1 用TRFIA和ELISA法分别检测一个抗CCP抗体阳性样品稀释浓度
2.2BAS-TRFIA法测定抗CCPIgG抗体的标准曲线如图2所示,时间分辨荧光强度与抗CCP抗体浓度成正比。抗CCP抗体IgG浓度是2365.8,591.44,147.86,36.96,9.24,0.58U/mL。抗CCP抗体对标准曲线方程为y=3.79071+0.79505x+0.01094x2,其中X是抗CCP抗体浓度(GPLU/ml)和Y是荧光强度。零点标准品值加2个平均值定义为灵敏度,该方法的灵敏度是0.5U/ml。

图2 抗CCP抗体TRFIA在不同浓度的标准曲线
2.3精密度试验检测高、中、低 3 种浓度混合血清的批内(n=20)精密度和批间(n=8)精密度,和通过ELISA法所获得的数据进行比较。如表1所示,采用TRFIA法检测抗CCP抗体浓度为241.5,72.7,14.15U/ml的批内CV值分别为3.16%,3.82%,4.24%,三种浓度的批间CV值分别为4.29%,4.68%,和4.97%。ELISA法检测242.8,72.6,14.32U/m的这三种浓度的批内CV值分别为6.12%,8.18%,和9.61%,批间CV值分别为7.268%,9.93%,和10.74%。显然,我们建立的抗CCP抗体的BAS-TRFIA分析法的批间和批内精密度比ELISA法高。

表1 批内和批间精密度分析
2.4临床应用通过检测52例健康献血者,32例系统性红斑狼疮,27例干燥综合征,10例硬皮病,20例混合性结缔组织病,23例多发性硬化症血清抗CCP抗体浓度来计算BAS-TRFIA法的特异性。交叉反应如表2所示。

表2 不同类型患者抗CCP抗体特异性
2.5与ELISA法的相关性用BAS-TRFIA法与ELISA法同时测定32份血清浓度,并比较结果。结果显示通过两个试验得到的散点图显示具有良好的相关性(如图3),相关系数是0.892 7。
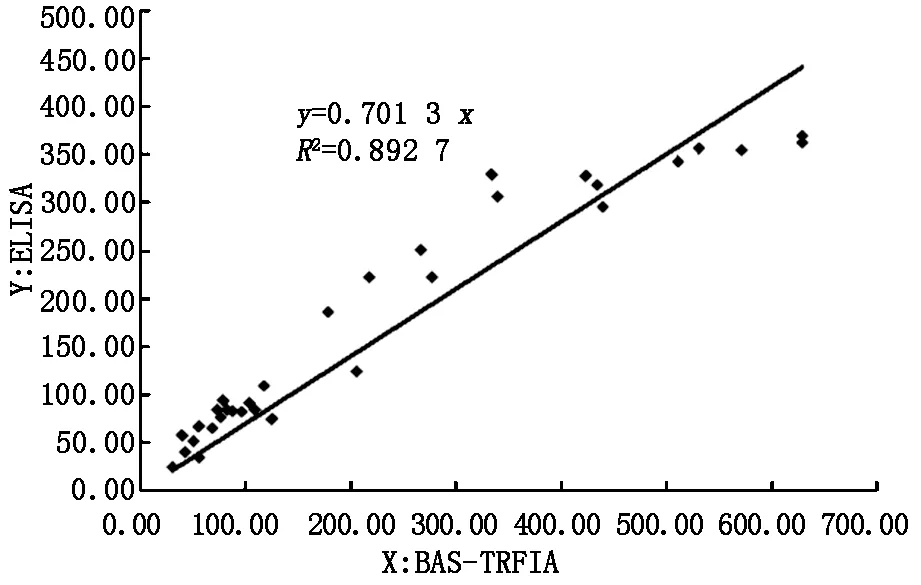
图3 BAS-TRFIA和ELISA的相关性
2.6BAS-TRFIA试剂盒的稳定性将试剂盒分别在4℃和在37℃水浴存储7天。然后比较BAS-TRFIA法与ELISA法的试剂盒的结合率(通过计算荧光计数值或吸光度的变化测得)。我们观察到与常规条件下相比,BAS-TRFIA法的结合率没有表现出明显的变化(仅下降了12.1%),ELISA试剂盒下降了17.7%,29.3%,36.3%。以上数据显示我们建立的检测试剂盒具有良好的稳定性(表3)。
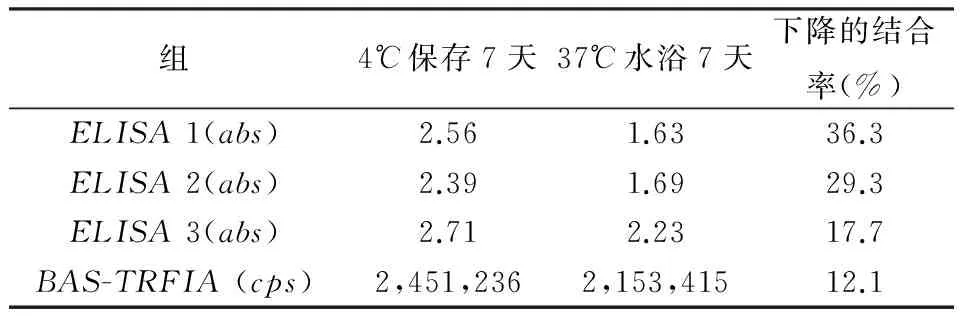
表3 BAS-TRFIA和ELISA的稳定性比较
2.7回收率回收率=观察到的浓度×100 /期望的浓度。第一个样本的回收率分别为100.98%,102.25%,和 96.45%。第二样本的回收率分别为100.46%,98.18%,和101.59%。第三个样本的回收率分别为104.63%,97.18%,和98.17%。平均回收率的计算是九组回收率的平均值,结果为99.98%(表4)。

表4 BAS-TRFIA试剂盒的回收率
3 讨论
为便于早期诊断,一个RA血清学标志能在疾病最早期就被检测到是非常必要的。最近的一些研究表明抗CCP抗体可在病程早期即被检测到,有助于该病的早期诊断。
在此,我们建立了应用BAS系统的新型夹心TRFIA法,可快速定量测量临床患者血清中抗CCP抗体水平,在传统TRFIA技术和生物素亲和素体高亲和力相结合下具有高灵敏度的优势。实验结果表明,新的TRFIA是一种很有前途的具高灵敏度和高特异性法的免疫荧光法,同时为检测提供了更宽的工作线性范围和更好的重复性。在图1中,BAS-TRFIA在9463-0.58U/ml良好的线性范围,相比之下,ELISA试剂盒在591.4-18.48U/ml的范围内。而扩大检测范围有利于提高RA早期诊断的灵敏度(10,11)。此外,新的方法与ELISA法具有良好的相关性相比,R2值为0.8927(图3)。与ELISA相比,我们的建立的BAS-TRFIA其稳定性能更好,这将保证更稳定的收益(表3)。总而言之,我们研究建立的检测抗CCP抗体的BAS-TRFIA法为RA的诊断和治疗提供了一个更为理想的免疫方法学选择。
[1]RaptopoulouA,SidiropoulosP,KatsourakiM,BoumpasDT.Anti-citrullineantibodiesinthediagnosisandprognosisofrheumatoidarthritis:Evolvingconcepts.CritRevClinLabSci2007;44(4):339-363.
[2]vanGaalenFA,Linn-RaskerSP,vanVenrooijWJ,etal.Autoantibodiestocycliccitrullinatedpeptidespredictprogressiontorheumatoidarthritisinpatientswithundifferentiatedarthritis:Aprospectivecohortstudy.ArthritisRheum2004;50(3):709-715.
[3]vanVenrooijWJ,vanBeersJJ,PruijnGJ.Anti-CCPantibodies:Thepast,thepresentandthefuture.NatRevRheumatol2011;7(7):391-398.
[4]ForslindK,Ahlm′enM,EberhardtK,Hafstr¨omI,SvenssonB;BARFOTStudyGroup.Predictionofradiologicaloutcomeinearlyrheumatoidarthritisinclinicalpractice:Roleofantibodiestocitrullinatedpeptides(anti-CCP).AnnRheumDis2004;63(9):1090-1095.
[5]DuL,ChengS,WangS.Determinationofdiethylstilbestrolbasedonbiotin-streptavidin-amplifiedtime-resolvedfluoroimmunoassay.Luminescence2012;27(1):28-33.
[6]HuZ,LiuJ,YeY,ZhouY,YuL.Detectionofanticardiolipinantibodyigmbysm(3+)-labeledtime-resolvedfluoroimmunoassay.JImmunoassayImmunochem2013;34(3):255-265.
[7]SuonpaaM,MarkelaE,St°ahlbergT,Hemmil¨aI.Europiumlabelledstreptavidinasahighlysensitiveuniversallabel.Indirecttime-resolvedimmunofluorometryofFSHandTSH.JImmunolMethods1992;149(2):247-253.
[8]QinQP,LovgrenT,PetterssonK.Developmentofhighlyfluorescentdetectionreagentsfortheconstructionofultrasensitiveimmunoassays.AnalChem2001;73(7):1521-1529.
[9]HuhtinenP,SoukkaT,L¨ovgrenT,H¨arm¨aH.Immunoassayoftotalprostate-specificantigenusingeuropium(III)nanoparticlelabelsandstreptavidin-biotintechnology.JImmunolMethods2004;294(1-2):111-122.
[10]vanGenderenFT,GorusFK,PipeleersDG,vanSchravendijkCF.Sensitiveandspecifictime-resolvedfluorescenceimmunoassayofratC-peptideformeasuringhormonesecretoryandstoragecapacityofbeta-cellsinvivoandinvitro.Endocrinology2013;154(5):1934-1939.
[11]FaridS,AziziG,MirshafieyA.Anti-citrullinatedproteinantibodiesandtheirclinicalutilityinrheumatoidarthritis.IntJRheumDis2013;16(4):379-386.
Determination of Anticyclic Citrullinated Peptide Based on Biotin-Streptavidin-Amplified Time-Resolved Fluoroimmunoassay
LI Mei,YE Yan*,HU Zhi-gang,et al.
(Department of Clinical laboratory,Affiliated Wuxi People’s Hospital to Nanjing Medical University,Wuxi 214023,China)
ObjectiveArapidandsensitivetimeresolvedfluoroimmunoassay(TRFIA)basedonthebiotin-streptavidinamplificationsystemwasdevelopedforthedeterminationofanticycliccitrullinatedpeptide(anti-CCP).MethodsEuropium-labeledstreptavidinderivativescombinedwitheuropiumandanhydrideofdiethylenetriaminepentaaceticacidwereusedtolabelstreptavidin,biotinwascoupledwithrabbitantihumanIgGtoformabiotin-anti-humanIgGbridgebetweenstreptavidin-europiumandtheanti-CCPantibodyintheimmunoassay.Theanti-CCPassaywascarriedoutbymeasuringthefluorescenceofEu3+-streptavidinat615nm.ResultsThepresentedmethodproducedawidelinearrangefrom0.58to9,463U/ml,whileitwasonly591.4-18.48U/mlwhenusinganELISAkit,andfeaturedadetectionlimitupto0.5U/mlforanti-CCP.Thevaluesdeterminedbythebiotin-streptavidin-TRFIAandELISAcorrelatedwell(R2=0.8927).Themethodwasappliedtodetermineanti-CCPinserumsampleswithsatisfiedrecoveriesof96.45-104.63%.ConclusionTheassayresultsobtainedbythepresentmethodshowedthatbiotin-streptavidin-amplifiedTRFIAimprovethetraditionalELISAkitforanti-CCPdetection.Therefore,itoffersabetteralternativeimmunoassayinrheumatoidarthritismanagement.
cycliccitrullinatedpeptide;rheumatoidarthritis;time-resolvedfluoroimmunoassay
本项目受南京医科大学重点项目(JMUZD057)、无锡市医管中心面上项目(YGZXM14013)资助
1007-4287(2016)08-1250-05
R446.6
A
2016-02-15)

