糖尿病小鼠合并结核菌感染后TNF-α表达及肠黏膜病理形态学观察
吴 华
(唐山市第四医院(结核病医院) 内四病区,河北 唐山063000)
糖尿病小鼠合并结核菌感染后TNF-α表达及肠黏膜病理形态学观察
吴华
(唐山市第四医院(结核病医院) 内四病区,河北 唐山063000)
糖尿病患者是结核病的高度易感人群[1,2],与糖尿病免疫功能紊乱等病理机制密切相关[3]。糖尿病患者合并结核病后将导致糖尿病病情迅速加重。到目前为止对糖尿病病因机制的研究较深入,其中小肠黏膜屏障受损是导致糖尿病发生、发展的重要因素之一[4],进一步研究发现:小肠黏膜屏障受损与多种细胞因子作用相关,TNF-α在该过程中起核心作用[5]。对结核杆菌感染后机体免疫调节功能相关研究证实,单一结核杆菌感染后机体TNF可出现表达异常[6,7]。鉴于以上结果,本研究将通过动物实验证实糖尿病合并结核菌感染后是否出现TNF-α表达紊乱及是否存在与TNF-α相关的肠黏膜病理形态学改变,为糖尿病合并结核病时,结核病可能出现的通过TNF-α相关途径影响肠黏膜屏障改变病理过程及临床治疗研究提供依据。
1 材料与方法
1.1材料
1.1.1动物健康清洁级ICR小鼠60只(18-22g,雌雄各半),由华北煤炭医学院动物中心提供。
1.1.2药物及检测试剂链尿佐菌素(streptoxolocin,STZ),弗氏完全佐剂(CFA);Sigma公司;TNF-α,北京华英生物技术研究所提供;结核菌:我院检测科分离的INH耐药菌株。
1.2方法
1.2.1糖尿病模型制备A、B组小鼠第1天腹腔注射0.5mlCFA,次日按25mg·kg-1腹腔内注射STZ[8]溶液,每周1次,连续3周后A组进行相关指标检测及观察。此模型属迟发型糖尿病模型,有免疫学的改变,更接近人类IDDM的发生发展变化。
1.2.2糖尿病感染结核菌模型糖尿病模型建立2周后,将临床分离的INH耐药株经B组小鼠皮下注射感染0.01MG,(2.5×104CFU),合并结核感染模型建立后第8周进行相关指标检测及观察。
1.2.3TNF-α检测于清洁环境,手术房间经紫外线消毒,参加手术人员穿无菌手术衣,佩带一次性口罩、帽子及无菌一次性手套,所用手术器械均经高温、高压灭菌,接触血样物品均使用一次性用品。C组研究开始、A、B组模型制作完成并完全符合各组标准后第3和第8周,在水合氯醛麻醉下,取腹部纵切口打开腹腔,分离出下腔静脉,分别用无菌注射器抽取血液进行TNF-α检测。
1.2.4小肠病理标本的采集各组小鼠于抽血成功后继续切取回盲部小肠组织5cm,将采集小肠沿肠系膜缘剖开,以细圆玻璃棒轻柔展平,把小肠组织的长轴两端用细小订书钉固定于剪好的A4打印纸片上,用PBS缓冲液洗去肠壁上残存的粪便、污垢。将其置入4%中性甲醛溶液中固定48小时以上(中间在固定标本4小时后更换甲醛液一次),然后取出标本,严格垂直定向石蜡包埋,切片,每只动物标本均连续切片10张,切片厚度为4μm,留作病理实验标本。HE染色病理学观察。采用HPIAS-1000彩色病理图像分析系统观测HE染色切片,随机全盲观测。在光镜下(100倍)每个时相随机计数为20个视野。肠损伤指数的计测根据Chiu等报告的肠黏膜损害指数(IntestinalmucosalesionIndex,IMLI)计分的标准判定[9]。
1.3统计方法
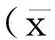
2 实验结果
2.1小肠黏膜
2.1.1小肠黏膜HE染色病理形态学观察
A组小鼠小肠黏膜的绒毛呈指状突起,绒毛较长,其高度是隐窝的数倍,其间有散在少量淋巴细胞浸润,表面覆盖以单层柱状上皮细胞,其肠腔面可见浓集的刷状缘。绒毛中轴的固有层结缔组织内可见1-2条纵形的毛细淋巴管。(图1)
B组小肠黏膜绒毛稀疏水肿,变粗,变厚,形态规则整齐,绒毛顶端上皮下可见囊状间隙,伴有毛细血管充血,杯状细胞部分呈圆形,上皮细胞排列整齐,形态规则。(图2)
C组正常小鼠小肠黏膜。(图3)

图1A组小肠黏膜(×40)图2B组小肠黏膜(×40)图3C组小肠黏膜(×40)
2.1.2小肠黏膜IMLI比较
显示A、B两组差异显著(t=4.87;P<0.01)。(表1)
2.2血清TNF-α检测结果比较
TNF-α指标A、B两组比较(t=2.88;P<0.01);B、C两组比较(t=5.98;P<0.01);A、C两组比较(t=2.99;P<0.01)。(表1)
3 讨论
糖尿病肠黏膜屏障损伤最重要原因之一表现为肠黏膜支持系统异常,包括肠道微生态平衡失调、肠道血液供应不足、肠动力障碍和肠免疫系统受损等多种因素[10]。在上述单一或多因素作用下,小肠黏膜通透性增加,吸收形态学改变[11],表现为小肠绒毛裂隙增多加深,上皮细胞微皱折,绒毛中轴筛状孔等改变,使葡萄糖摄入增加,导致糖耐量降低,体重、脂肪增加等一系列改变。在这种黏膜变化过程中TNF-α发挥重要作用:研究证实糖尿病是一种持续低水平的慢性炎症反应[12-14],炎性过程中细胞因子TNF-α升高[15],作为一种慢性代谢性疾病,持续升高的TNF作为炎症指标直接参与肠黏膜损伤的病理过程[16],包括激活中性粒细胞,释放大量活性氧与弹性蛋白酶,刺激交感-肾上腺髓质系统使机体内儿茶酚胺分泌增加,促进白三烯(LT)、血栓素A2(TXA2)、血小板激活因子(PAF)等多种血管活性物质释放;诱导大量NO生成,此外,TNF-α可以增加线粒体膜的通透性,减弱线粒体的呼吸作用,减少线粒体细胞色素,导致细胞程序性死亡;TNF-α引起的过多NO通过蛋白的氧化、硝化、S-亚硝化、c-GMP激活和细胞能量耗竭等机制造成肠黏膜屏障功能失调。最终造成肠黏膜血管、细胞受损、微循环障碍、肠黏膜缺血缺氧低灌流等情况,导致小肠黏膜病理形态学改变,屏障功能受损。本研究中糖尿病组TNF-α与与对照组比较有显著意义的升高,同时出现小肠黏膜病理形态学改变(图1),与上述病理过程研究相符。而在共病组中TNF-α较糖尿病组出现更显著升高,小肠黏膜病理形态学则表现更严重的改变(图2),这一结果与结核感染后机体发生TNF-α变化相关:结核感染后机体通过免疫相关基因等多种机制使TNF-α表达增加[17-18],在糖尿病时糖、脂、蛋白及免疫功能紊乱,营养不良、酸性环境、免疫调节紊乱等背景下,结核菌生长繁殖加快,病情进展迅速,进而导致TNF-α呈持续过多性病理性升高[19],在糖尿病本身TNF-α升高致肠黏膜损伤基础上进一步了强化该病理机制过程,从而表现出本研究中进一步加重的病理形态学损伤。

表1 ABC组肠损伤指数及TNF-α结果分析
注:IMLI指标AB两组比较*P<0.01。TNF-α指标AB两组比较*P<0.01;BC两组比较▲P<0.01;AC两组比较▼P<0.01。
研究结果显示,在整个研究过程中糖尿病组与合并组TNF-α、小肠黏膜损伤均呈显著正相关。糖尿病小鼠感染结核后显著升高的TNF-α加重本已存在的小肠黏膜屏障损伤,加剧糖尿病病理过程。除此之外,感染结核后进一步升高的TNF-α还通过多途径抑制胰岛素作用及产生胰岛素抵抗加剧糖尿病症状[20],有关这一机制将在今后研究中继续探讨。这一结论完善了结核通过TNF-α损伤肠黏膜屏障机制加重糖尿病的病理过程,由于小鼠与人体存在肠黏膜结构、免疫功能等方面的差异,今后在本研究基础上将进行进一步糖尿病合并结核感染的人体活组织检查,为临床治疗提供更可靠的依据。
[1]StevensonCR.Diabetesandtheriskoftuberculosis:aneglectedthreatopublichealth[J].Chronicillness,2007,3(2):228.
[2]AlisjahbanaB.DiabetesmellitusisstronglyassociatedwithtuberculosisinIndonesia[J].InternationalJournalofTuberculosisandLungDisease,2006,10(4):696.
[3]中华医学会,编著.临床诊疗指南结核病分册[M].北京:人民卫生出版社,2005:47.
[4]ArrietaMC,BistritzL,MeddingsJB.Alterationsinintestinalpermeability[J].Gut,2006,55(10):1512.
[5]何剑琴,李俊达.肠粘膜屏障损伤与治疗[J].临床消化病杂志,2008(2):113.
[6]孟昭彦,刘海林.肺结核患者血清肿瘤坏死因子-a、内皮素-1的含量及临床分析[J].现代中西医结合杂志,2001,10(24):2337.
[7]项杰,章晓联,席淑红,等.结核病人血清IL-17、TNF-A、IFN-Y的检测及其免疫学意义[J].数理医药学杂志,2009,22(2):149.
[8]郭啸华,刘志红,李恒,等.高糖高脂饮食诱导的2型糖尿病大鼠模型及其肾病特点[J].中国糖尿病杂志,2002,10(5):290.
[9]ChiuCJ,McArdleAH,BrownR,etal.Intestinalmucosallesioninlow-flowstates[J].ArchSurg,1970,101(4):478.
[10]王娜.肠道菌群与糖尿病发生关系的研究[D].大连医科大学.2011.4
[11]张献彩,张雷.糖尿病小鼠小肠粘膜电镜观察[J].重庆医学.2011,40(28):2815.
[12]MokdadAH.Prevalenceofobesity,diabetes,andobesity-relatedhealthriskfactors.2001[J].Jama,2003,289(1):76.
[13]GunnarEngstrm,LarsStavnow,BoHedblad,etal.Inflammationsensitiveplasmaproteins,diabetesandmoaalityandincidenceofmyocardialinfarctionandstrokeApopulation-Basedstudy[J].Siabetes,2003,52(2):442.
[14]EngstronG,LindP,HedbladB,etal.Effectsofcholesterolandinflammation-sensitiveplasmaproteinsonincidenceofmyocardialinfarctionandstrokeinmen[J].Circulation,2002,105(22):2632.
[15]高玲.IL-6和TNF-α与2型糖尿病关系的探讨[J].现代中西医结台杂志,2009,18(3):63.
[16]王想.2型糖尿病患者血清IL-10及TNF-α表达对血管病变的影响[J].中国实用神经疾病杂志,2002,15(1):63.
[17]赵雁林,端木宏谨.结核病患者免疫相关基因表达变化的基因芯片研究[J].中华结核和呼吸杂志,2005,28(5):301.
[18]杨颖乔,彭圣威.肺结核患者血清中TNF-A、VEGF水平的变化及其意义[J].咸宁学院学报(医学版).2010,24(4):312.
[19]梁健通,蔡炜标.肺结核合并糖尿病的临床分析[J].齐齐哈尔医学院学报,2011,32(22):3637.
[20]NicholasAngelopoulos,AnastasiaGouls,etal.Currentknowledgeintheneurophysiologicmodulationofobesity[J].Metabolism,2005,54:1202.
1007-4287(2016)08-1254-03
吴华,女,41岁,主治医师,研究方向:结核内科。
2015-09-12)

