促红细胞生成素在成骨细胞分化中的实验研究
张嘉熙 何美丽 赵冰松 李临梅
1.中国人民解放军第263医院口腔治疗中心 北京 101149;2.北京佳美口腔医院正畸科 北京 100020
促红细胞生成素在成骨细胞分化中的实验研究
张嘉熙1何美丽1赵冰松1李临梅2
1.中国人民解放军第263医院口腔治疗中心 北京 101149;2.北京佳美口腔医院正畸科 北京 100020
目的 研究促红细胞生成素(EPO)对成骨细胞分化和功能的影响以及EPO-EPO受体(EPOR)信号在成骨细胞中的作用,探讨EPO在骨稳态中的作用及其机制。方法 体外培养小鼠骨髓基质细胞系(ST2),加入EPO蛋白,采用实时荧光定量聚合酶链式反应方法检测成骨分化相关基因的变化,采用碱性磷酸酶(ALP)和茜素红染色方法观察成骨细胞骨形成功能。采用RNA干扰技术沉默EPOR基因,检测阻断EPO-EPOR信号通路后成骨细胞分化和功能的变化。结果 骨髓基质细胞表达EPOR,EPO与受体EPOR结合后,可诱导其向成骨细胞分化,增加Runx2、Alp和Col1等成骨细胞相关基因的表达,同时增加ALP蛋白的表达和钙结节的沉积。EPOR基因沉默后,成骨相关基因的表达受到抑制。结论 EPO通过EPOR信号促进成骨细胞的分化和功能。
骨髓基质细胞; 成骨细胞; 促红细胞生成素; 促红细胞生成素受体
促红细胞生成素(erythropoietin,EPO)是由肾皮质肾小管周围间质细胞和肝脏分泌的一种激素样物质,是参与红细胞前体细胞分化和成熟的一个至关重要的细胞因子,EPO肾功能衰竭的患者必须注射促红细胞生成素以避免严重贫血[1]。EPO与促红细胞生成素受体(erythropoietin receptor,EPOR)结合发挥作用,引发信号传导调节红细胞的增殖和分化[2]。因此EPO-EPOR信号是调节红细胞增殖、分化和存活所必需的关键信号转导通路。 然而,EPO/EPOR信号在非造血细胞中的作用还知之甚少。最近,有学者已经证明了EPO能激活造血干细胞(hematopoietic stem cell,HSC)的JAK/STAT信号,导致骨形态发生蛋白2(bone morphogenetic protein 2,BMP2)的产生和骨形成,而且EPO在体外还直接激活间充质细胞分化为成骨细胞[3]。因此,本研究设想EPO-EPOR信号参与了骨髓间充质干细胞向成骨细胞分化的过程,应用骨髓基质细胞系ST2,研究EPO通过与EPOR结合诱导成骨细胞的骨形成的作用。
1 材料和方法
1.1材料
α-最低必需培养基(minimum essential medium,MEM)、胎牛血清(fetal bovine serum,FBS)(GIBCO公司,美国);RNA提取试剂盒(北京博迈德公司);荧光定量聚合酶链式反应(polymerase chain reaction,PCR)试剂盒、PCR试剂盒(大连宝生物工程有限公司),小鼠骨髓基质细胞系ST2(ATCC号:TIB-71,ATCC细胞库,美国)。青霉素-链霉素(PAA公司,美国)。维生素C、β-甘油磷酸钠、地塞米松、碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(Sigma公司,美国)。
1.2仪器设备
CO2恒温细胞培养箱(三洋公司,日本),ABI7300荧光定量PCR仪(非凡公司,美国)。
1.3细胞培养
ST2细胞用α-MEM培养基(含10%胎牛血清和1%青霉素-链霉素)培养于37℃、95%湿度、5%CO2环境中。细胞达70%~80%融合时,用0.25%胰蛋白酶进行消化传代。ST2细胞的诱导培养:取细胞生长状况比较良好的ST2细胞进行传代后,加入成骨诱导培养液进行培养,培养条件与ST2细胞培养相同。每日观察细胞贴壁增殖情况及细胞形态的变化。成骨诱导培养液的配制:在正常的有血清培养基中加入终浓度为50 mg·L-1维生素C,β-甘油磷酸钠10 mmol·L-1,1×10-8mol·L-1地塞米松,避光,4 ℃冰箱保存备用。
ST2细胞以每孔1.5×105个细胞的密度接种于6孔板,实验分为4组:实验组(简称EPO组),对照组,转染组(EPO+转染质粒GI583527),转染对照组(EPO+空白质粒TR30013)。实验组和对照组分别用含或不含EPO蛋白(20 U·mL-1)的条件培养基培养(含10%FBS、成骨细胞诱导液和1%青霉素-链霉素)。转染组采用RNA干扰(RNA interference,RNAi)技术使EPOR基因沉默,分别按实验分组转染空质粒shRNA TR30013作为阴性对照和实验组质粒EPOR shRNA-GI583527,每2天换液。
1.4基因沉默
ST2细胞转染EPOR短发夹RNA(short hairpin RNA,shRNA),使EPO的配体EPOR基因沉默,从而达到EPO不发挥作用的效果。使用脂质体2000携带EPOR shRNA,按照试剂盒的说明操作。ST2细胞接种到6孔板,培养直到细胞达到80%汇合。应用脂质体转染,使EPOR基因沉默,在无血清培养基中转染质粒EPOR(shRNAGI583527),6孔板每孔脂质体2000为6 µL,相对应EPOR shRNA为2.5 µg。稀释培养基为250 µL的无血清、无双抗α-MEM培养基,混匀之后,静止20 min,转染5 h后换10%胎牛血清的α-MEM培养基。对照组,转染空白质粒shRNA-TR30013,方法同上。
1.5荧光定量PCR
细胞分别培养2、4、6 d时提取总RNA,总RNA进行定量(260 nm的吸光度),逆转录成cDNA后进行荧光定量PCR反应,使用SYBR®Premix Ex Taq™ PCR试剂盒,内参为β-肌动蛋白,荧光定量PCR所用引物如下:Epor(基因片段标号为:NM_ 010149.3),Runx2(NM_001145920.1),Col1(NM_007742.3),Alp(NM_007431.2)。结果表示成2(-ΔΔCt)形式,以对照组为1。
1.6ALP活性检测
ALP检测试剂盒内A、B溶液比例为1∶1,避光,吸取培养基,盐水冲洗1遍,每孔加入200 μL的AB混合液,静置40 min后加入50 μL终止液。检测细胞ALP活性,酶联仪520 nm测定各孔吸光度。
1.7钙结节测定
取ST2细胞接种于6孔板内,各个实验组分别处理,放入培养箱中培养。各组按要求相应的换条件培养液,而对照组仍为等体积的常规培养液。各组每3 d换液1次,连续培养3周左右,显微镜观察钙化结节形成过程。
茜素红染色:镜下可以查见黑色不透明区域时行茜素红染色,磷酸盐缓冲液(phosphate buffered saline,PBS)洗后,95%乙醇固定10 min,10 ℃、0.2%茜素红染色30 min,蒸馏水冲洗,倒置显微镜下拍照保存。
茜素红定量:染色完成后,配洗脱液:10%氯化十六烷吡啶单水合物(用PBS缓冲液稀释),37 ℃以6孔板每孔1 mL洗脱20 min,将洗脱液吸取到96孔板内,设5个复孔,在波长562 nm处振荡10 s测光密度(optical density,OD)值。
1.8统计分析
采用SPSS 17.0统计学软件,配对t检验分析实验结果,以P<0.05为差异有统计学意义。
2 结果
2.1EPO对成骨细胞的作用
ST2细胞在成骨诱导培养基中培养,实验组加入终浓度为20 U·mL-1的EPO,对照组加入相同体积的PBS液,培养2、4和6 d分别提取总RNA。采用荧光定量PCR检测EPO对成骨细胞的影响。结果显示(图1),实验组EPOR的表达在培养2 d(P<0.05)和4 d(P<0.01)时呈递增趋势,而成骨分化标志性基因Runx2、Col1和Alp的表达都有所增加。其中Runx2和Alp细胞培养第4天时表达增加(P<0.05),Col1在培养2、4和6 d时表达明显增加(P<0.01)。
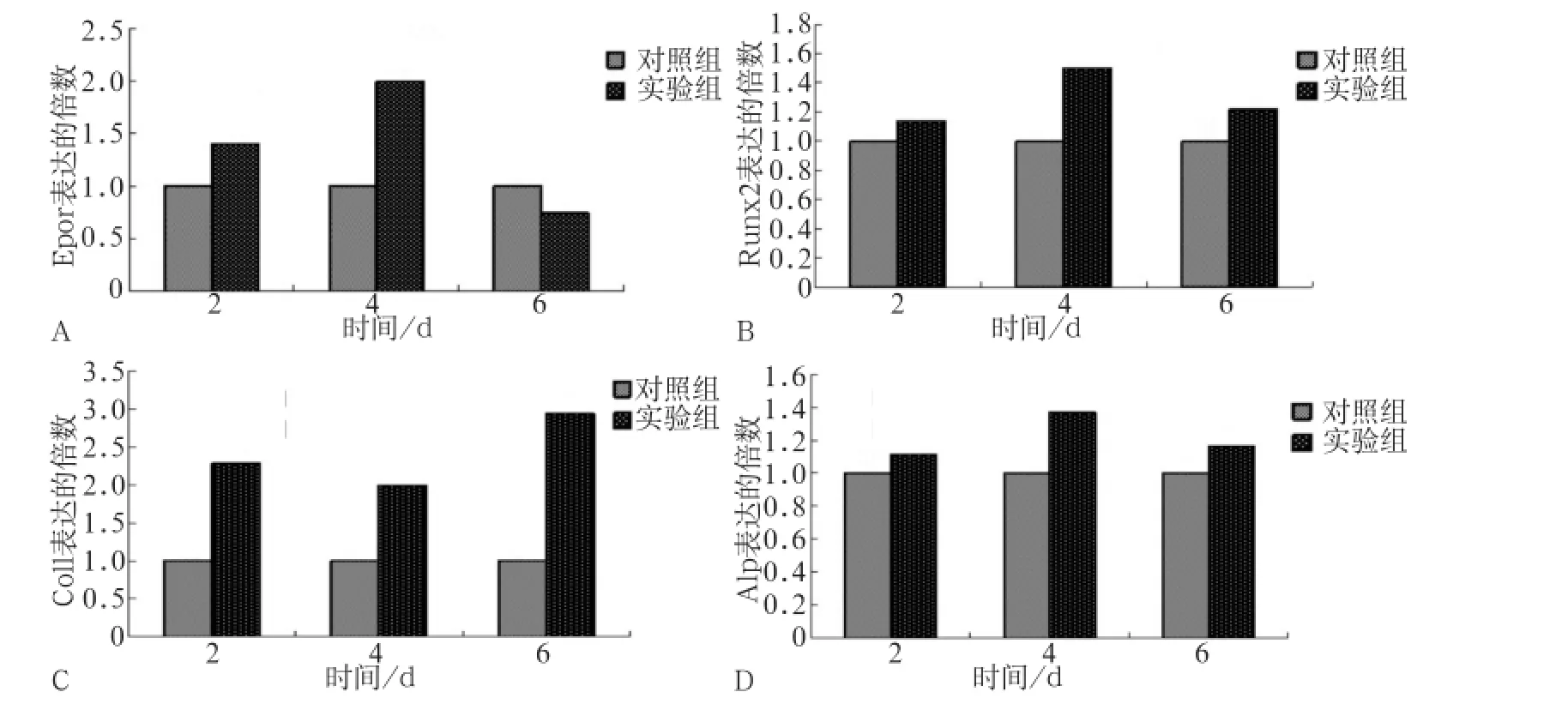
图1 定量荧光PCR检测EPO对成骨分化相关基因表达的影响Fig 1 The expression of gene osteoblast differentiation of EPO by real-time PCR
2.2EPOR基因沉默对成骨细胞的作用
采用荧光定量PCR检测EPOR基因沉默后,EPO对成骨向诱导的ST2细胞的影响。图2A结果显示,EPOR基因沉默后,其表达受到抑制。其中第四天表达明显降低(P<0.01),沉默效率最高能达到约80%。图2B~D为成骨分化标志性基因的表达,Runx2、Col1和Alp表达都有所降低。其中Runx2的表达在第2天和第4天明显降低(P<0.01),Col1和Alp在细胞培养第6天时表达明显降低(P<0.01)。
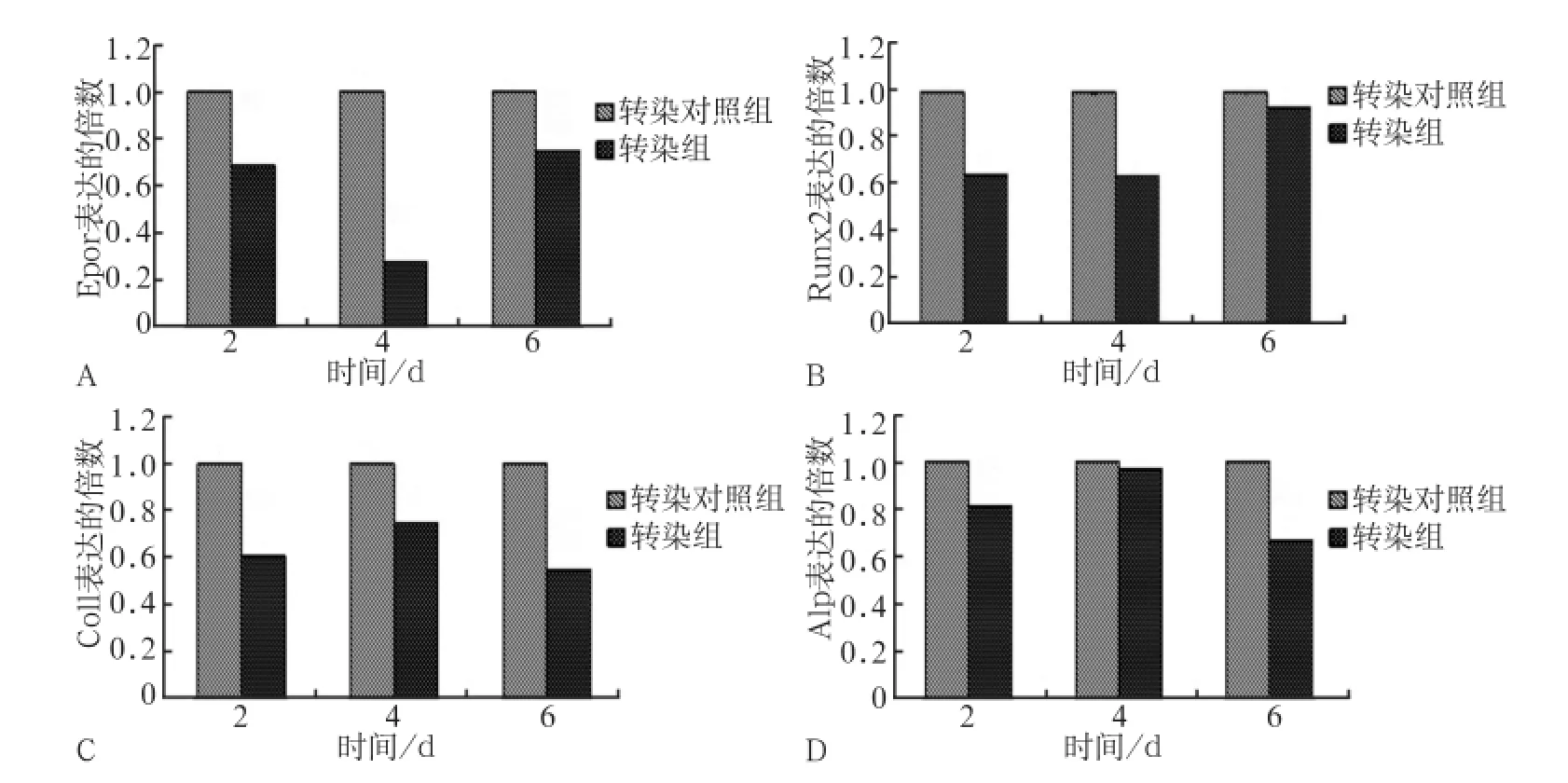
图2 EPOR基因沉默后定量荧光PCR检测成骨相关基因的表达Fig 2 The expression of gene osteoblast differentiation of EPO by real-time PCR after EPOR gene silence
2.3EPO对成骨细胞的功能作用
ST2细胞培养3、7和14 d的ALP检测结果见图3,图中2组3、7和14 d的ALP活性均呈递增趋势,7和14 d实验组明显比对照组表达升高(P<0.01)。图4为茜素红染色,检测2组钙结节量的变化,图4A为对照组,4B为实验组,实验组的钙结节量明显比对照组高。对照组茜素红定量在波长562 nm处测得OD值为0.134 3,而实验组OD值为0.189,差异有统计学意义(P<0.01)。
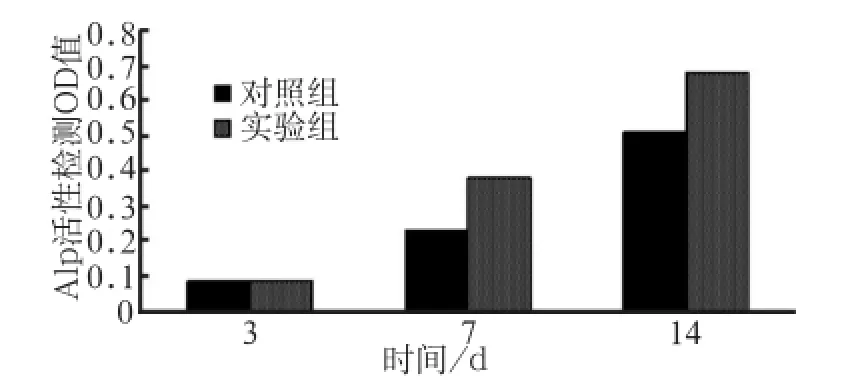
图3 ALP检测Fig 3 ALP activity assay
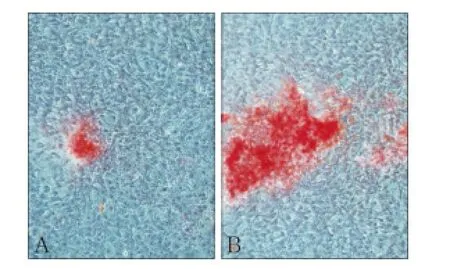
图4 钙结节检测EPO对成骨细胞的影响 体式显微镜 × 100Fig 4 Alizarin red stain for erythropoietin calcium in osteoblasts stereomicroscope × 100
3 讨论
EPO是一种造血肽激素,调节细胞增殖、存活和红系祖细胞前体细胞的终末分化[4]。人EPO基因位于7号染色体长臂22区,有多肽和糖基构成,相对分子质量约3.4×104,含有2个二硫键、一个碳末端的精氨酸(Arg)残基[5]。未成熟的EPO前体仅由193个氨基酸组成,发育过程中,一个包含27个氨基酸的信号肽和一个碳末端C-精氨酸解离,碳水化合物加入,形成由165个氨基酸和4条糖链组成的成熟EPO。
EPOR是人类Epor基因编码的蛋白质,由细胞外结构域、跨膜域、胞内域组成。EPOR是分子量为5.9×104,其本身没有内源性酪氨酸激酶活化剂来激活受体信号。EPOR作为一个二聚体预先存在,它与3.4×104的EPO配体结合,改变其二聚化的状态。在EPO的刺激下,EPOR胞浆近膜部分到羧基末端的8个酪氨酸残基全部发生磷酸化,结合胞质内包含SH2功能区的信号传递因子,从而发挥EPO促进细胞增殖和分化等的功能。
EPO可以活化造血干细胞中的JAK/STAT信号,诱导BMP2的产生,进而促进骨形成,同时发现EPO可以直接作用于骨髓间充质干细胞诱导成骨细胞表型,增加Runx2、Col1和Alp等成骨细胞相关基因的表达。
经荧光定量PCR实验结果显示,EPO组的Runx2、Col1和Alp等成骨细胞相关基因的表达明显增加,得出EPO可以促进骨髓基质细胞向成骨细胞的分化。同时,EPOR基因沉默组成骨相关基因的表达受到抑制。由此得出,EPO促进成骨细胞的分化是通过与EPOR结合而发挥作用的。本研究又对EPO功能进行检测,通过ALP与钙结节的结果得出,加入EPO的实验组明显比对照组高表达,说明EPO能够促进成骨细胞的功能。
[1] Elliott S, Lorenzini T, Asher S, et al. Enhancement of therapeutic protein in vivo activities through glycoengineering[J]. Nat Biotechnol, 2003, 21(4):414-421.
[2] Lombardero M, Kovacs K, Scheithauer BW. Erythropoietin: a hormone with multiple functions[J]. Pathobiology, 2011, 78(1):41-53.
[3] Kim J, Jung Y, Sun H, et al. Erythropoietin mediated bone formation is regulated by mTOR signaling[J]. J Cell Biochem, 2012, 113(1):220-228.
[4] Klingmüller U. The role of tyrosine phosphorylation in proliferation and maturation of erythroid progenitor cells—signals emanating from the erythropoietin receptor[J]. Eur J Biochem, 1997, 249(3):637-647.
[5] Buemi M, Cavallaro E, Floccari F, et al. Erythropoietin and the brain: from neurodevelopment to neuroprotection[J]. Clin Sci(Lond), 2002, 103(3): 275-282.
(本文编辑 张玉楠)
Roles of erythropoietin on the differentiation of osteoblasts
Zhang Jiaxi1, He Meili1, Zhao Bingsong1, Li Linmei2.
(1.Center of Stomatology, 263 Hospital of People Liberation Army, Beijing 101149, China; 2. Dept. of Orthodontics, Jiamei Dental Hospital, Beijing 100020, China)
Objective This study aimed to investigate the effects of erythropoietin(EPO) on the differentiation and function of osteoblasts, to identify the roles of EPO-erythropoietin receptor(EPOR) in osteoblasts, and to explore the effects and mechanism of EPO in bone homeostasis. Methods Mouse bone marrow stromal cell line ST2 was cultured in vitro and treated with EPO. Changes in osteoblastic gene levels were quantified by real-time polymerase chain reaction. The function of osteoblasts in bone formation was observed by alkaline phosphatase(ALP) and alizarin red staining. EPOR expression was knocked down by RNA interfere. The differentiation and function of osteoblasts were then tested by the above methods. Results ST2 cells expressed EPOR. After binding with EPOR, EPO induced osteoblast differentiation from bone marrow stromal cells. Expression levels of osteoblast-related genes Runx2, Alp, and Col1 increased. ALP and calcium deposition increased. Expression levels of osteoblast-related genes were repressed after EPOR knockdown. Conclusion EPO promotes the differentiation and function of osteoblasts through EPO-EPOR signaling.
bone marrow stromal cell; osteoblasts; erythropoietin; erythropoietin receptor
Q 51
A [doi] 10.7518/gjkq.2016.06.004
2016-03-22;
2016-09-01
张嘉熙,硕士,Email:491994879@qq.com
李临梅,学士,Email:jeson_yue5@sina.com

