大孔树脂纯化辣根中烯丙基硫代葡萄糖苷的研究
谢 赛,丁 轲,陈湘宁,*
(1.北京农学院食品科学与工程学院,北京 102206;2.食品质量与安全北京实验室,北京 102206;3.农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206)
大孔树脂纯化辣根中烯丙基硫代葡萄糖苷的研究
谢 赛1,2,3,丁 轲1,2,3,陈湘宁1,2,3,*
(1.北京农学院食品科学与工程学院,北京 102206;2.食品质量与安全北京实验室,北京 102206;3.农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206)
本文针对大孔树脂纯化烯丙基硫代葡萄糖苷的方法进行了研究,首先在静态条件下筛选出了最佳树脂ZGD630,并应用其研究了提取液pH和洗脱剂对纯化效果的影响,确定了最佳吸附pH是6,最佳洗脱剂为0.5 mol/L NaCl溶液;在动态条件下,考察了柱平衡试剂和柱尺寸对动态吸附量与动态解吸得率的影响,确定了纯水为平衡液,动态吸附量为2.057 mg·g-1,同时树脂柱尺寸变大时,动态吸附量会减小。建立了一种操作简便、有效纯化辣根中烯丙基硫代葡萄糖苷的方法,为其日后工业生产及降解产物异硫氰酸烯丙酯的研究奠定了基础。
烯丙基硫代葡萄糖苷,大孔树脂,纯化,辣根
辣根(horseradish,Armoraciarusticana)是十字花科辣根属多年生作物,源自欧洲,我国各地多有种植,用作饲料,根部可作调味料,有药用价值[1-2]。硫代葡萄糖苷(glucosinolate,GS,简称硫苷)多存在于辣根、芥末、西兰花等十字花科类植物中[3]。植物利用硫苷衍生物作为天然杀虫剂,并抵御食草动物的猎食[4]。硫苷是阴离子含硫亲水性次生代谢产物,属葡萄糖衍生物,目前已知植物中天然存在的硫苷大约120种[4-5]。硫苷没有生物活性,植物中黑芥子酶(β-thioglucoside glucohydrolase;EC 3.2.3.147)会将其水解成不同产物,包括异硫氰酸酯,硫氰酸酯,硫酸盐和腈类等[6-7]。烯丙基硫代葡萄糖苷(allyl glucosinolate)(化学结构见图1)在黑芥子酶水解下生成的异硫氰酸烯丙酯(allyl isothiocyanate,AITC)有抗炎[8],抗癌[9],抑菌[10-13],保鲜[14]等作用。但因硫苷的高极性和易酶解性,提取、纯化难度较大[15]。目前国内关于硫苷的纯化研究多针对萝卜硫苷[16-19],对辣根中烯丙基硫苷的研究较少。所以烯丙基硫苷的纯化方法研究有待进一步深入。

图1 烯丙基硫代葡萄糖苷的化学结构Fig.1 Structure of allyl glucosinolate
大孔树脂吸附作为常用的纯化技术,在提取纯化植物活性成分中应用广泛,不仅具有稳定性好,选择吸附性强,不受共存物干扰,可再生等优点,而且技术设备简单,操作方便,生产连续化程度高,得到的产品往往纯度高,成本低[20]。
本实验采用大孔树脂纯化辣根中的烯丙基硫代葡萄糖苷,探究静态条件下树脂类型、吸附酸碱度,洗脱剂种类及浓度因素对纯化的影响,并进行动态吸附实验。旨在获取最佳的纯化工艺条件,以期日后用于工业生产,为研究异硫氰酸烯丙酯相关性质进行原料积累。
1 材料与方法
1.1 材料与仪器
辣根粉 由射阳县天德食品有限公司提供。ZGA398大孔强碱性阴离子交换树脂,ZGA430大孔弱碱性阴离子交换树脂,ZGA412大孔弱碱性阴离子交换树脂和ZGD630大孔弱碱性阴离子交换树脂 浙江争光实业有限公司,树脂的理化性质见(表1)。
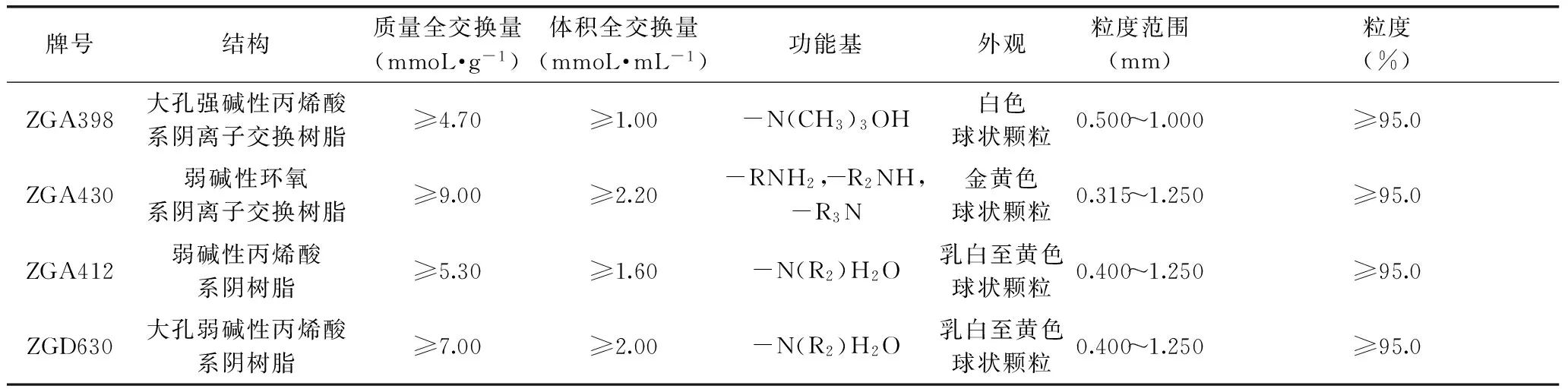
表1 大孔碱性阴离子交换树脂的物理性质Table 1 Physical characters of macroporous anion-exchange resins
无水乙醇,乙酸钡,氢氧化钠,氯化钠磷酸氢二钠,磷酸二氢钠(均为分析纯),盐酸(35%~37%),甲醇(色谱纯) 美国Fisher公司;四甲基溴化铵(色谱纯) 德国Sigma公司;黑芥子硫氰酸钾(sinigrin,纯度≥99.0%) 德国Sigma公司。
LC-20AD型高效液相色谱仪 日本SHIMADZU公司;DSHZ-300A回旋式水浴恒温振荡器 太仓市实验设备厂;RE-5203型旋转蒸发器 SHZ-Ⅲ型循环水真空泵 上海亚荣生化仪器厂;DF-101S型集热式恒温加热磁力搅拌器 郑州长城科工贸有限公司;PHG-9246A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;pH计;BSZ-100型自动部分收集器 上海泸西分析仪器厂有限公司;DG15系列蠕动泵 保定兰格恒流泵有限公司;L530型台式低速离心机 湖南赫西仪器装备有限公司;Alpha 1-2LD plus型真空冷冻干燥机 德国Christ公司;AWL-1002-U型超纯水系统 美国艾科浦国际公司。
1.2 实验方法
1.2.1 烯丙基硫代葡萄糖苷的检测方法
1.2.1.1 HPLC检测条件 参照文献[21],检测器为PDA检测器,检测波长为226 nm,色谱柱:COSMOSIL Packed Column 5C18-MS-Ⅱ(4.6 mm×250 mm),流动相为5 mmol·L-1四甲基溴化铵水溶液∶甲醇=19∶1(v/v),梯度洗脱条件见表2,流速:0.8 mL·min-1,柱温:40 ℃,进样量:5 μL。

表2 梯度洗脱条件表Table 2 The conditions of gradient elution
1.2.1.2 标准曲线的绘制 准确称取4 mg烯丙基硫苷标准品,配制成2 mg·mL-1的标准储备液,依次稀释为2、1、0.5、0.25、0.125、0.05 mg·mL-1的烯丙基硫代葡萄糖苷标准溶液,进入HPLC进行检测,以烯丙基硫苷浓度(mg·mL-1)作为横坐标(x),以峰面积作为纵坐标(y),绘制标准曲线。
1.2.2 烯丙基硫代葡萄糖苷的提取 应用刘佳[20]优化的溶剂回流法,称取100 g辣根粉,以料液比1∶20(g∶mL),加入80%乙醇水溶液2000 mL,在65 ℃的条件下提取3 h,过滤,弃沉淀,上清液中加入4 mmol/L乙酸钡溶液200 mL,静置30 min,过滤去除沉淀。然后在50 ℃下进行旋蒸浓缩,至约200 mL。
1.2.3 树脂的预处理与筛选
1.2.3.1 树脂的预处理 对于弱碱性阴离子交换树脂,首先将树脂用5%盐酸浸泡4 h后,用蒸馏水多次清洗至pH不变,再用5%氢氧化钠溶液浸泡4 h,用蒸馏水多次清洗至pH不变,再用5%盐酸浸泡4 h,用蒸馏水洗至pH不变,备用。对于强碱性阴离子交换树脂,首先将树脂用5%盐酸浸泡4 h后,用蒸馏水多次清洗至pH不变,再用5%氢氧化钠溶液浸泡4 h,用蒸馏水洗至pH不变,备用。
1.2.3.2 树脂的筛选 分别准确量取四份60 mL烯丙基硫代葡萄糖苷提取液于干净的锥形瓶中,接着分别加入0.4 g ZGA430、ZGA412、ZGD630、ZGA398型湿树脂,在37 ℃下恒温水浴振荡4 h进行吸附。取适量吸附上清液,用0.45 μm有机系膜过滤,续滤液进入HPLC检测。根据下面公式计算树脂的吸附量。然后用纯水冲洗树脂1至2遍,加入0.5 mol/L NaOH溶液25 mL进行洗脱。在37 ℃下振荡洗脱4 h,取适量洗脱上清液,过滤,进入HPLC检测,根据下面公式计算解吸得率。
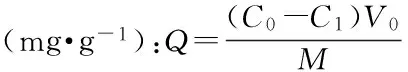
式(1)
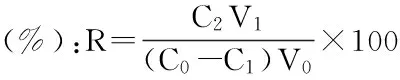
式(2)
式中:C0-烯丙基硫苷的初始质量浓度mg·mL-1;C1-吸附收集液中烯丙基硫苷的质量浓度mg·mL-1;C2-洗脱液中烯丙基硫苷的质量浓度mg·mL-1;V0-吸附液的体积mL;V1-洗脱液的体积mL;M-树脂质量g。
1.2.4 静态吸附与解吸条件的优化
1.2.4.1pH对吸附的影响 分别准确量取60mL烯丙基硫代葡萄糖苷提取液于6个锥形瓶中,并分别调节溶液pH为2、4、6、8、10、12,各加入0.4gZGD630型湿树脂,在37 ℃下恒温水浴振荡4h进行吸附。取适量吸附上清液,调节其pH至液相色谱柱的耐受范围,用0.45μm有机系膜过滤,续滤液进入HPLC检测。根据式(1)计算树脂的吸附量。然后用纯水冲洗树脂1至2遍,加入0.5mol/LNaCl溶液25mL,在37 ℃下振荡洗脱4h,取适量洗脱上清液,过滤,进入HPLC检测,根据式(2)计算解吸得率。
1.2.4.2 洗脱剂种类与浓度对解吸的影响 分别准确量取60mL烯丙基硫代葡萄糖苷提取液于8个锥形瓶中,调节溶液pH为6,各加入0.4gZGD630型湿树脂,在37 ℃下恒温水浴振荡4h进行吸附。取适量吸附上清液,过滤,进入HPLC检测,计算树脂吸附量。用纯水冲洗树脂1至2遍,分别加入25mL浓度为1、0.5、0.1、0.05mol/L的NaCl溶液与HCl溶液,在37 ℃下振荡洗脱4h,取适量洗脱上清液,调节其pH至色谱柱耐受范围,过滤,进入HPLC检测,计算解吸得率。
1.2.5 动态吸附与解吸 将ZGD630型树脂以湿法装柱(Φ1.0cm×20cm),平衡后上样,进行吸附,上样流速为0.5mL·min-1,使用自动收集器定时每4min收集一管,用上述HPLC法测定浓度,绘制动态穿透曲线,上样结束后以纯水连续冲洗树脂柱,至流出液接近无色。用洗脱剂进行解吸,洗脱流速为0.5mL·min-1,每4min收集一管,用上述HPLC法测定浓度,绘制动态洗脱曲线,最后用纯水冲洗树脂柱备用。动态吸附量和动态解吸得率的计算公式如下所示:
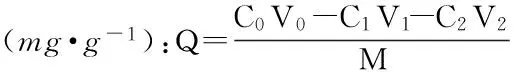
式(3)
式(4)
式中:C0-烯丙基硫苷的初始质量浓度mg·mL-1;C1-吸附收集液中烯丙基硫苷的质量浓度mg·mL-1;C2-纯水冲洗液中烯丙基硫苷的质量浓度mg·mL-1;C3-洗脱液中烯丙基硫苷的质量浓度mg·mL-1;V0-烯丙基硫苷样品的上样体积mL;V1-吸附收集液的体积mL;V2-纯水冲洗液的体积mL;V3-洗脱液的体积mL;M-树脂质量g。
2 结果与讨论
2.1 烯丙基硫代葡萄糖苷的标准曲线
烯丙基硫苷的标准曲线如图2所示,得到的线性回归方程为y=209.29x+4.0519,相关系数R2=0.9994,显示了良好的线性关系。

图2 烯丙基硫代葡萄糖糖苷标准曲线Fig.2 The standard curve of allyl glucosinolates
2.2 树脂筛选
通过比较四种大孔树脂在静态吸附和解吸条件下对烯丙基硫苷的吸附量与解吸得率,确定最佳的树脂类型。在控制实验条件相同的情况下,仅改变树脂类型这一变量,经过吸附、解吸,得到目标物烯丙基硫苷的吸附量与解吸得率,如图3所示。相比ZGA430、ZGA412、ZGD630这三种弱碱性阴树脂,大孔强碱性阴树脂ZGA398的吸附量与解吸得率均最小,对于纯化的烯丙基硫苷获取量最少,不适宜使用。而在三种弱碱性阴树脂中,ZGA430型树脂的吸附量最大,其次是ZGD630型树脂,最后是ZGA412型树脂;ZGD630型树脂的解吸得率最大,其次是ZGA412,然后是ZGA430。从目标物的获得与树脂的重复利用率来看,保证吸附量时,解吸得率越大越好。对于ZGA430,虽然它的吸附量最大,但是解吸得率较低,说明该树脂上残留了较多的烯丙基硫苷未解吸下来,不利于树脂的重复利用,会减短树脂的使用寿命。而ZGD630型树脂的烯丙基硫苷吸附量较高,解吸得率最大。所以确定纯化烯丙基硫代葡萄糖苷的最佳树脂材料为ZGD630型弱碱性丙烯酸系阴树脂。
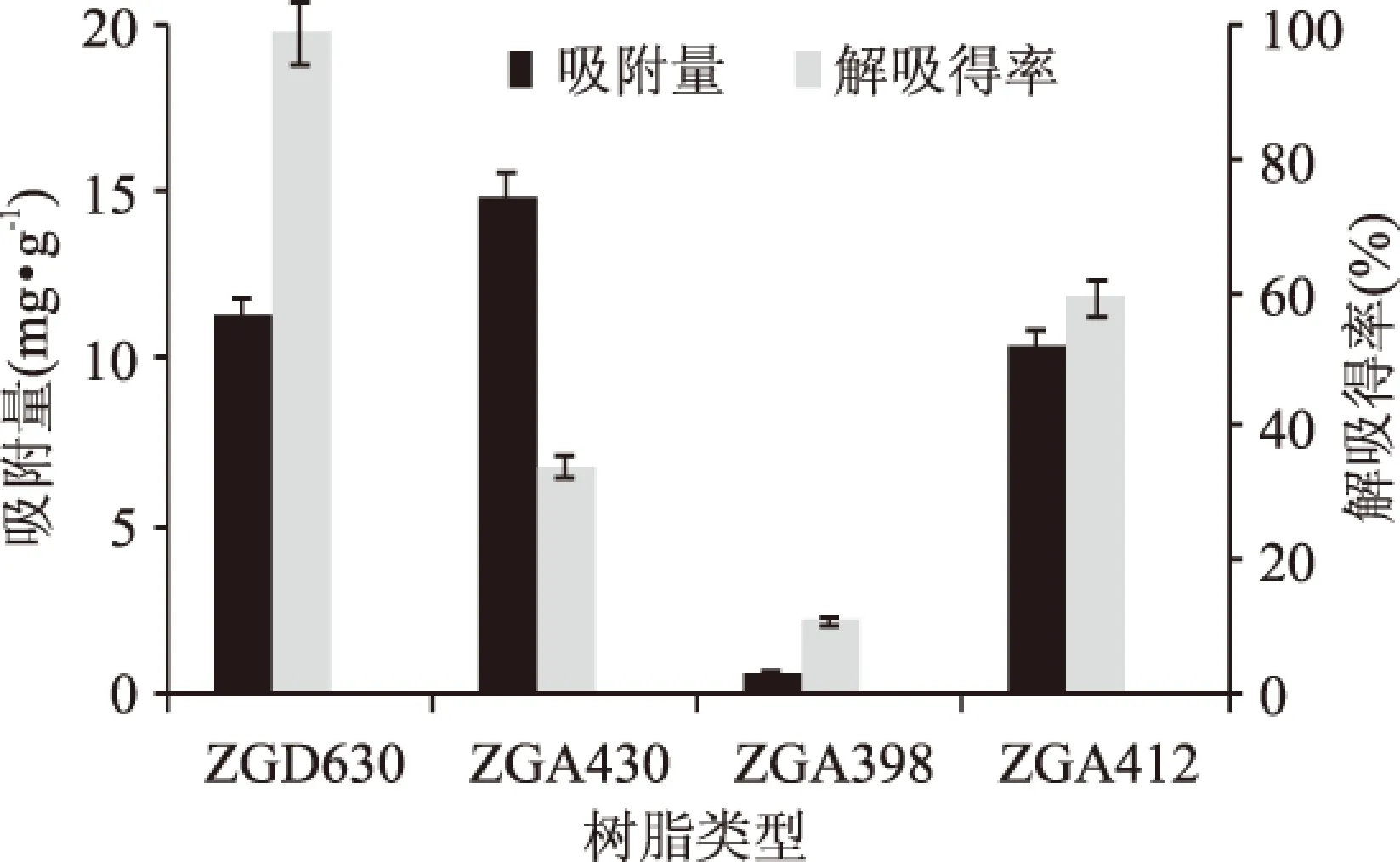
图3 树脂对吸附量和解吸得率的影响Fig.3 Effect of resins on the adsorption and desorption rate
图4中初步直观展现了树脂纯化的效果,烯丙基硫苷提取液经高效液相检测得到的色谱图中杂质峰较多,表明粗提液中组分复杂,杂质较多。而通过树脂纯化后,可以明显看到解吸液色谱图中的杂质峰大多消失,目标峰清晰,说明去掉了大多数的杂质,纯化效果明显。但样品具体纯度还需后续实验进一步验证得到。

图4 烯丙基硫代葡萄糖苷色谱图Fig.4 The chromatogram of allyl glucosinolates注:1:烯丙基硫代葡萄糖苷解吸液;2:提取液;3:标准品。
2.3 吸附pH的影响
应用已确定的最佳树脂材料ZGD630型树脂,研究树脂吸附时pH对纯化效果的影响。以3 mol/L NaOH溶液与3 mol/L HCl溶液调节样液pH分别为2、4、6、8、10、12,再加入ZGD630弱碱性阴树脂进行吸附,然后进行洗脱。得到的结果如图5所示,可以看到,当pH为2时,烯丙基硫苷的吸附量最大,在pH为2~8时,吸附量呈下降趋势,随后在pH10时略有升高,在pH12处无吸附量。在pH为2~12时,烯丙基硫苷的解吸得率先增加,并且在pH6时达到最大,随后下降,在pH12处无解吸。虽然pH2处的吸附量最大,但是解吸得率很小,会影响树脂的回收利用率,减少树脂的使用寿命。而在pH6时烯丙基硫苷的吸附量虽然不是最高的,但是此时的解吸得率最大,表明树脂上的烯丙基硫苷解吸的最多,树脂上残留少,利于树脂重复使用,因而确定树脂吸附时的最佳pH为6。

图5 pH对吸附量和解吸得率的影响Fig.5 Effect of pH value on the adsorption and desorption rate
2.4 洗脱剂种类与浓度的影响
洗脱剂的选择是影响树脂纯化效果的重要因素之一,常用洗脱剂NaCl溶液与HCl溶液在浓度为0.05、0.1、0.5和1 mol·L-1时对烯丙基硫苷的解吸得率见图6。控制吸附条件一致,保证了树脂对烯丙基硫代葡萄糖苷吸附量相同,继而以不同洗脱剂的不同浓度进行洗脱,考察洗脱剂种类及浓度对硫苷的洗脱效果。如图6所示,对比了两种洗脱剂在相同浓度时的解吸得率。可以看到,浓度为0.5 mol·L-1时两种洗脱剂的解吸得率均高于其他浓度,其中NaCl溶液的解吸得率较大,即表明其解吸效果较好;浓度为0.05 mol·L-1时两种洗脱剂的解吸得率均最小,解吸效果都最差。所以洗脱剂的种类与浓度均会影响解吸效果,相比HCl,NaCl不仅价廉、安全,而且对于烯丙基硫苷的解吸得率还高。因而确定最佳洗脱剂为0.5 mol·L-1NaCl溶液。
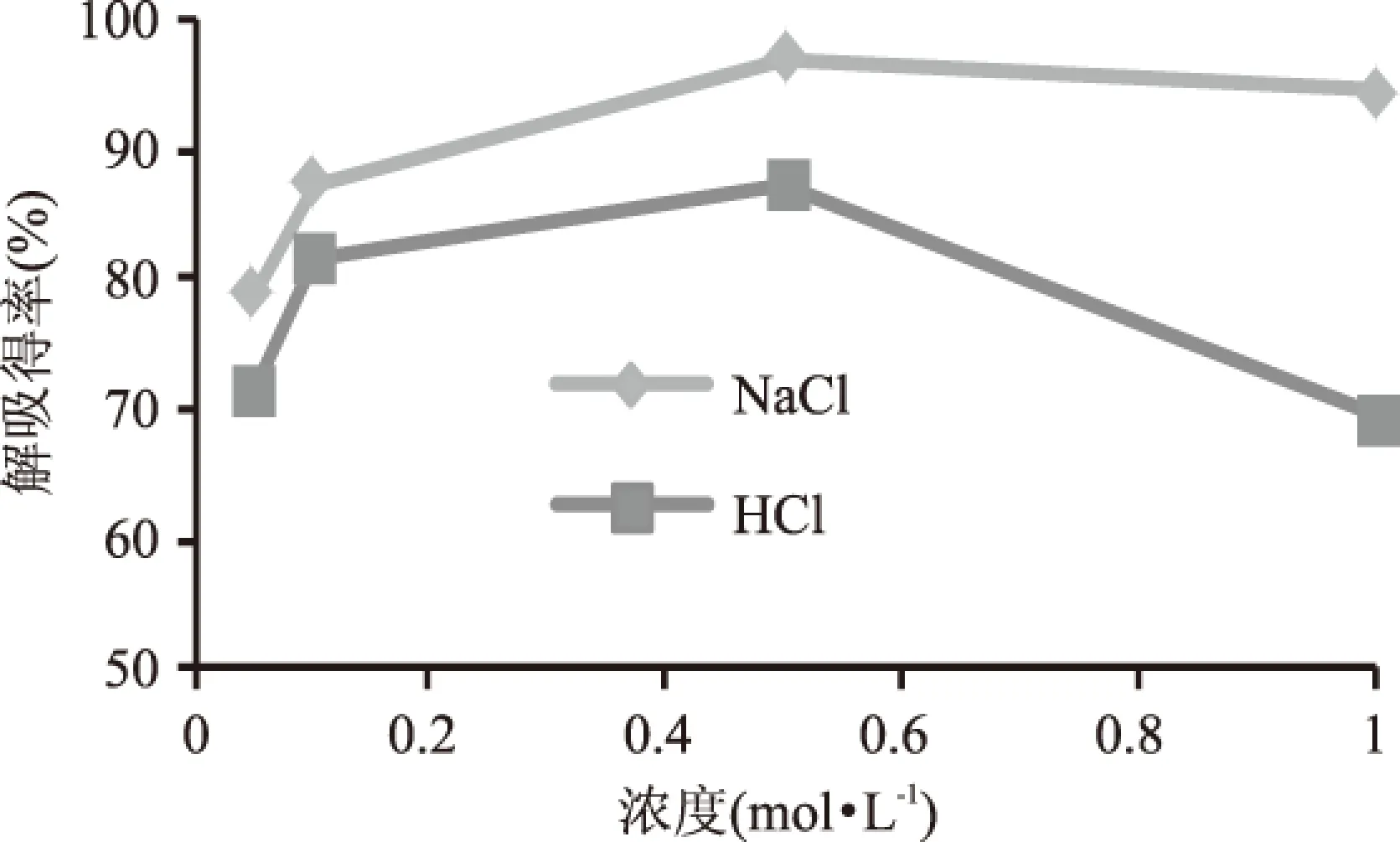
图6 洗脱剂对解吸得率的影响Fig.6 Effect of eluent for desorption rate
2.5 动态吸附与解吸实验
根据静态实验确定的树脂ZGD630,采用湿法装柱,将其装填于小树脂柱(Φ1.0 cm×20 cm)中,图7展示了用纯水平衡直接上样(测得样品pH为5.8)与用pH6磷酸盐缓冲液平衡上样(使用微量氢氧化钠溶液调节样品pH至6)后,经树脂吸附得到的收集液中烯丙基硫苷的浓度随时间的变化图,即穿透曲线。用纯水平衡直接上样的方法,穿透曲线在16 min处穿透,呈逐渐上升态势,并趋于平缓,于160 min后浓度不变,达到样品原始浓度,即表明树脂吸附量已饱和。用pH6磷酸盐缓冲液平衡上样的方法,曲线在20 min处穿透,与纯水平衡中上升态势相比略缓慢,随后趋于平缓,于180 min时达到样品原始浓度,树脂饱和。纯水平衡直接上样使树脂在160 min达到吸附饱和,而采用pH6的磷酸盐缓冲液平衡,再上pH6的样品则使树脂在180 min才达到吸附饱和。从穿透时间与树脂吸附饱和时间来看,纯水平衡直接上样的时间均要少,即省时,而且还省去了试剂调节pH的操作,省钱省力,节约成本。
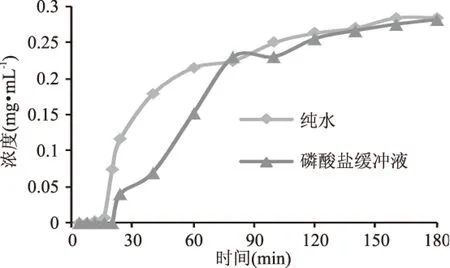
图7 不同的平衡液对烯丙基硫代葡萄糖苷穿透曲线的影响Fig.7 Effect of different equilibration buffers on the breakthrough curve of allyl glucosinolates
图8显示了用纯水平衡直接上样(测得样品pH为5.8)与用pH6磷酸盐缓冲液平衡上样(使用微量氢氧化钠溶液调节样品pH至6)后,经氯化钠溶液解吸得到的收集液稀释30倍后测得的烯丙基硫苷浓度随时间的变化图,即洗脱曲线。当纯水平衡直接上样时,洗脱曲线在56 min处解吸得到的烯丙基浓度最大,为0.7414 mg·mL-1;当用pH6磷酸盐缓冲液平衡上样时,洗脱曲线在44 min处解吸得到的烯丙基浓度最大,为0.5146 mg·mL-1。虽然后者用时较短,但前者解吸得到的目标物显然多于后者,从解吸量来看,还是应该用前者。所以应选用纯水平衡直接上样,得到的动态吸附量为2.057 mg·g-1。
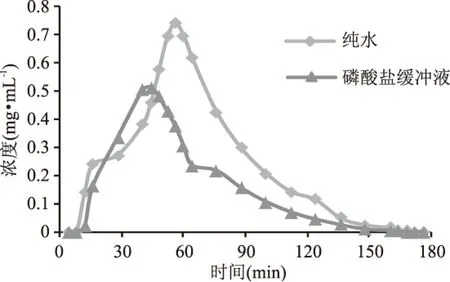
图8 不同平衡液对烯丙基硫代葡萄糖苷洗脱曲线的影响Fig.8 Effect of different equilibration buffers on the elution curve of allyl glucosinolates
当树脂填装于大树脂柱(Φ5.0 cm×30 cm)时,纯水平衡直接上样吸附,上样流速与洗脱流速设置为9 mL·min-1。图9是烯丙基硫苷的穿透曲线,在30 min处穿透,这是由于大柱子的体积比小柱子的体积大,在平衡后存留的纯水相应更多,样液流入时会被稀释,所以穿透时间要长。图10是解吸液稀释100倍后测得的烯丙基硫苷浓度随时间变化的洗脱曲线,在70 min时解吸液浓度达到最大,270 min后浓度降至接近0,得到动态吸附量为0.6611 mg·g-1,小于小树脂柱的动态吸附量。

图9 烯丙基硫代葡萄糖苷的穿透曲线Fig.9 The breakthrough curve of allyl glucosinolates
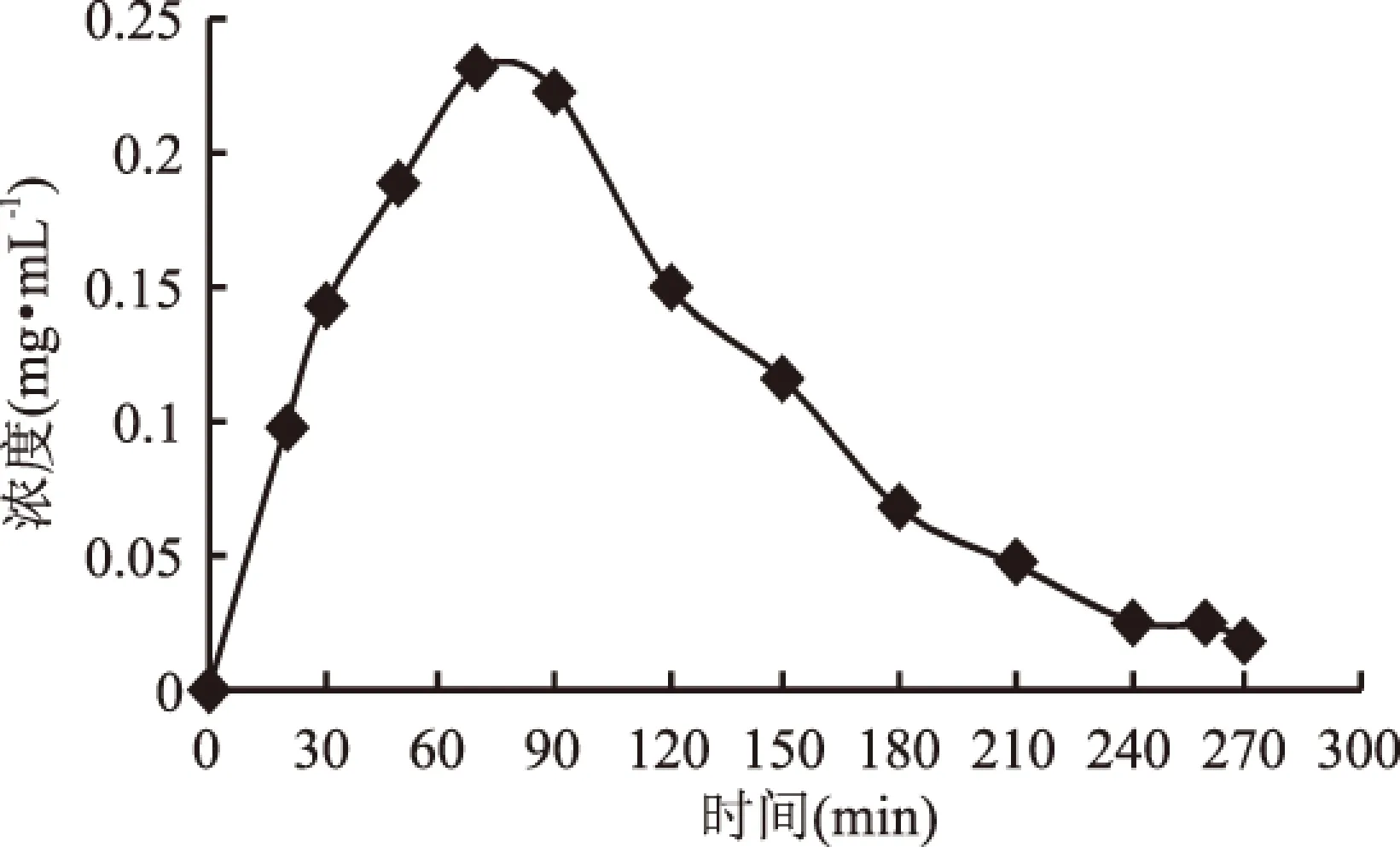
图10 烯丙基硫代葡萄糖苷的洗脱曲线Fig.10 The elution curve of allyl glucosinolates
3 结论
本研究应用大孔树脂技术纯化烯丙基硫代葡萄糖苷,通过静态实验筛选出了最适的树脂类型为ZGD630型弱碱性阴离子交换树脂;提取液pH对吸附的影响较大,确定了ZGD630型树脂吸附的最适pH为6;解吸时所用的最佳洗脱剂为浓度为0.5 mol/L的NaCl溶液;根据动态实验过树脂柱时,由于用pH6的磷酸盐缓冲液平衡柱子反而使树脂解吸量下降,所以直接采用纯水平衡更好,不必用磷酸盐平衡,节省了成本;树脂柱增大时,穿透时间变长,洗脱浓度达到最大的时间变晚,吸附量变小。
应用树脂吸附法优化了烯丙基硫苷纯化的吸附与解脱条件,去掉了大多数杂质,研究了动态柱纯化,为工业连续化批量生产做铺垫;操作过程简单,所需试剂廉价安全,具有广泛的推广、应用、生产潜质。但是对于该法纯化得到的烯丙基硫苷的纯度还需进一步检测,并致力探索获得高纯烯丙基硫代葡萄糖苷的技术手段,为日后其在生产异硫氰酸烯丙酯等应用上提供原料基础。
[1]宋亦斋. 辣根[J]. 开卷有益(求医问药),2015,310(4):73.
[2]Kang M K,Elizabeth H J,John A J,et al. Correlation of quinone reductase activity and allyl isothiocyanate formation among different genotypes and grades of horseradish roots[J]. Journal of Agricultural and Food Chemistry,2015,63(11):2947-2955.
[3]Fenwick G R,Heaney R K,Mullin W J. Glucosinolates and their breakdown products in food and food plants[J]. Critical Reviews in Food Science and Nutrition,1983,18(2):123-201.
[4]Fahey J W,Wade K L,Stephenson K K,et al. Separation and purification of glucosinolates from crude plant homogenates by high-speed counter-current chromatography[J]. Journal of Chromatography. A,2003,996(1):85-94.
[5]Clarke D B. Glucosinolates,structures and analysis in food[J]. Analytical Methods,2010,2(4):310-325.
[6]Bjorkman R,Janson J C. Studies on myrosinases. Purification and characterization of a myrosinase from white mustard seed(Sinapisalba.L.)[J]. Biochimica et Biophysica Acta,1972,276(2):508-518.
[7]Rodman JE. A taxonomic analysis of glucosinolate-producing plants[J]. Systematic Botany,1991,16(4):598-618.
[8]Kanyasiri R,Hang X. Anti-inflammatory effect of allyl isothiocyanate and curcumin in combination[J]. The FASEB Journal,2015,29(1):390.7.
[9]Andre L,Glenda N,Daisy M. Inhibition of bladder cancer cell proliferation by allyl isothiocyanate(mustard essential oil)[J]. Mutation Research,2015,771:29-35.
[10]Jideani V A,Vogt K. Antimicrobial packaging for extending the shelf life of bread-a review[J]. Critical Reviews in Food Science and Nutrition,2015.
[11]Shofran B,Purrington S,Breidt F,et al. Antimicrobial properties of sinigrin and its hydrolysis products[J]. Journal of Food Science,1998,63(4):621-624.
[12]Amin N O,Richard A H. Control of salmonella on fresh chicken breasts by k-carrageenan/chitosan-based coatings containing allyl isothiocyanate or deodorized oriental mustard extract plus EDTA[J]. Food Microbiology,2015,48:83-88.
[13]Anezka J,Andrea B,Jakub S,et al. Long-term antifungal activity of volatile essential oil components released from mesoporous silica materials[J]. Industrial Crops and Products,2015,67:216-220.
[14]Aparajita B,Suprasanna P,Prasad S. Allyl isothiocyanate enhances shelf life of minimally processed shredded cabbage[J]. Food Chemistry,2015,183:265-272.
[15]Xie Z Y,Wang R,Wu Y C,et al. An efficient method for separation and purification of glucosinolate stereoisomers from radix isatidis[J]. Journal of Liquid Chromatography and Related Technologies,2012,35(1):153-161.
[16]江敏,石林娟,杨毅. 西兰花籽中萝卜硫苷的提取、分离及结构鉴定[J]. 食品科学,2013,34(5):124-126.
[17]李宁. 西兰花干硫苷的提取工艺优化及富集纯化研究[D]. 杭州:浙江工商大学,2015.
[18]江敏. 萝卜硫苷的分离纯化工艺研究[D]. 合肥:合肥工业大学,2012.
[19]石林娟,潘见,谢慧明,等. 高效液相色谱法测定西兰花籽提取物中萝卜硫苷含量[J]. 食品科技,2013,38(6):231-236.
[20]孙京沙,张朝辉. 大叶藻总黄酮的大孔树脂纯化工艺[J]. 食品科学,2014,14:5-10.
[21]刘佳,丁轲,陈湘宁,等. 辣根中烯丙基硫代葡萄糖苷提取工艺的优化[J]. 食品与机械,2014,30(6):204-208.
Studies on purification of Allyl glucosinolates from horseradish by macroporous resin
XIE Sai1,2,3,DING Ke1,2,3,CHEN Xiang-ning1,2,3,*
(1.College of Food Science and Engineering,Beijing University of Agriculture,Beijing 102206,China;2.Beijing Laboratory of Food Quality and Safety,Beijing 102206,China;3.Beijing Key Laboratory Agriculture Product Detection and Control for Spoilage Organisms and Pesticide,Beijing 102206,China)
Inthispaper,purificationofallylglucosinolatesfromHorseradishbymacroporousresinwasstudied.First,ZGD630wasscreenedoutasthebestresinunderthestaticconditions.EffectsofpHandeluentontheextractionwereinvestigated.TheresultsshowedthatoptimalpHofextractwaspH6,andtheoptimaleluentwas0.5mol/LNaClsolution.Subsequently,thedynamicadsorptioncapacityanddynamicdesorptionyieldwiththeresincolumnweremeasured,andthereagentonequilibrationandsizeofcolumnunderthedynamicconditionwerediscussed.Itwasdiscoveredthatpurewaterwasbetteronequilibrationofcolumn.Meanwhile,sizeofcolumngotlarger,thedynamicadsorptioncapacitydecreased.Asimpleandeffectivepurifyingmethodofallylglucosinolateswasestablishedanditlaidthefoundationforitsindustrialproductionandtheresearchaboutallylisothiocyanateofitsdegradationproduct.
allylglucosinolates;macroporousresin;purification;horseradishroots
2016-04-25
谢赛(1992-),女,硕士研究生,研究方向:食品加工与安全,E-mail:13552761962@163.com。
*通讯作者:陈湘宁(1972-),女,博士,教授,研究方向:农产品贮藏加工,E-mail:cxn@bua.edu.com。
北京市属高等学校高层次人才引进与培养计划项目(CIT&TCD20154045);北京市自然科学基金(14L00184);北京市属高等学校高层次人才引进与培养计划项目(CIT&TCD20150315);现代农业产业技术体系北京市叶类蔬菜创新团队项目(BAIC 07-2016)。
TS201.2
A
1002-0306(2016)21-0070-06
10.13386/j.issn1002-0306.2016.21.005

