拟南芥P5CS1基因转化羽衣甘蓝增强耐盐性分析
李大红 刘宏伟 秦兰娟 崔文艺 李伟 李春枝 宋丽 李鸿雁
摘要:【目的】分析轉拟南芥△1-吡咯啉-5-羧酸合成酶(P5CS1)基因羽衣甘蓝的耐盐性,为获得较强的耐盐性羽衣甘蓝品种及其抗逆育种提供理论依据。【方法】将拟南芥P5CS1基因(AtP5CS1)经农杆菌介导转入羽衣甘蓝植物中,在盐胁迫下,分别检测转基因植株与野生型植株的AtP5CS1 mRNA表达量、幼苗脯氨酸含量、株系根系性状、整株干质量和鲜质量、叶片相对水含量、叶片电导率和整株存活率。【结果】在150 mmol/L NaCl胁迫下,转基因植株的P5CS1基因mRNA可正常表达,与对照相比,转基因株系Y1、Y2的主根和最长侧根长度较长,侧根数目较多,整株干质量和鲜质量较重;而且相对水含量显著高于对照植株(P<0.05,下同),脯氨酸含量及存活率均极显著高于对照植株(P<0.01),叶片相对电导率显著低于对照植株。【结论】转AtP5CS1基因植株的耐盐表型优于对照,即AtP5CS1基因在羽衣甘蓝中的表达明显改善了转基因植株的耐盐性。
关键词: 羽衣甘蓝;拟南芥;△1-吡咯啉-5-羧酸合成酶(P5CS);脯氨酸;耐盐性
中图分类号: S635.9 文献标志码:A 文章编号:2095-1191(2017)05-0768-06
Salt tolerance strengthening of Brassica oleracea var. acephala f. tricolor genetically modified by P5CS1 gene from
Arabidopsis thaliana
LI Da-hong 1, LIU Hong-wei2, QIN Lan-juan3, CUI Wen-yi1, LI Wei1,
LI Chun-zhi4, SONG Li1, LI Hong-yan1 *
(1 School of Biotechnology and Food Engineering Huanghuai University, Zhumadian, Henan 463000, China; 2 Green Department of Zhumadian, Zhumadian, Henan 463000, China; 3 Nanhai Park of Zhumadian, Zhumadian, Henan 463000, China; 4 Zhumadian Landscaping Architecture & Research Institute, Zhumadian,Henan 463000, China)
Abstract:【Objective】Salt tolerance of Brassica oleracea var. acephala f. tricolor after being transferred with △1-pyrroline-5-carboxylate synthetase(P5CS1) gene from Arabidopsis thaliana was analyzed, in order to obtain slat-tolerant B. oleracea var. acephala f. tricolor varieties and provide reference for breeding for stress tolerance. 【Method】P5CS1 gene from A. thaliana was transferred into B. oleracea var. acephala f. tricolor via Agrobacterium. Under salt stress,expression of P5CS1 mRNA, proline content in seedlings, root traits, dry weight of whole plant,fresh weight of whole plant,relative water content in leaf, relative electric conductivity of leaf and whole plant survival rate in transgenic plants and wild plants were measured. 【Result】Under 150 mmol/L NaCl stress, P5CS1 mRNA of transgenetic plants was in normal expression. Compared with control, main roots and the longest lateral roots of transgenic plants Y1 and Y2 were long, lateral roots were abundant, dry weights and fresh weights of whole plant were heavy. Their relative water contents were significantly higher than that of control(P<0.05, the same below), proline contents and survival rates were extremely significantly higher than that of control(P<0.01), but relative electric conductivity of leaf was significantly lower than that of control. 【Conclusion】Salt tolerance of plants genetically modified by AtP5CS1 was better than control. AtP5CS1 gene expression significantly improves salt tolerance of transgenic plants in B. oleracea var. acephala f. tricolor.
Key words: Brassica oleracea var. acephala f. tricolor; Arabidopsis thaliana; △1-pyrroline-5-carboxylate synthetase(P5CS); proline; salt tolerance
0 引言
【研究意義】渗透胁迫(如盐或干旱)严重影响植物生长及其产量。植物的抗逆机制之一是其可产生一些如脯氨酸和甘氨酸等低分子量渗透压调节物质(Greenway and Munns,1980)。脯氨酸可作为渗透保护剂对细胞的渗透平衡起重要调节作用,能增加细胞膨压,对细胞进行必要的保护。脯氨酸是唯一已被证明可清除单线态氧和自由基(包括OH-)的渗透调节物质,也可调节氧化还原电位、保护大分子(如蛋白质、DNA)和降低由干旱、盐或其他胁迫引起的酶变性(Kumar et al.,2010)。△1-吡咯啉-5-羧酸合成酶(P5CS)是脯氨酸合成限速酶。脯氨酸在高等植物中的积累表现为合成增加或分解减少,其中,脯氨酸生物合成增加必需要增强P5CS活性(Yamchi et al.,2007)。因此,植物体内转入P5CS基因,可能会增加P5CS含量并提高植物的抗逆性。【前人研究进展】已有研究显示,将外源P5CS基因转入其他植物体内,可一定程度上提高转基因植株的耐旱、耐盐和耐寒等抗逆性。Igarashi等(1997)研究表明,盐胁迫下水稻抗盐品种的OsP5CS mRNA表达量和脯氨酸积累量均增加,而盐敏感品种中两者变化不明显。Sawahel和Hassan(2002)研究表明,转VaP5CS基因的小麦株系耐盐性远高于对照。Han和Hwang(2003)研究表明,转PvP5CS1基因拟南芥植株可忍耐150 mmol/L NaCl盐胁迫,死亡率明显低于对照。李志亮等(2005)、Xu等(2006)研究表明,以豇豆的P5CS-F129A基因转化高羊茅或麦草,转基因植株耐旱性明显提高。Yamchi等(2007)将拟南芥P5CS1基因(AtP5CS1)转入烟草,发现转基因烟草耐渗透胁迫能力明显增强。Karthikeyan等(2011)研究表明,水稻转入乌头叶豇豆P5CS1基因,转基因水稻耐盐性明显提高。徐博等(2015)将朝鲜碱茅(Puccinellia chinam poensis)的PuP5CS基因转入紫花苜蓿,提高了转基因植株的抗逆性。【本研究切入点】羽衣甘蓝(Brassica oleracea var. acephala f. tricolor)属十字花科芸苔属的变种植物,草本,1~2年生,常作为城市观赏植物。但由于环境污染,土壤盐碱化,培育耐盐性强的羽衣甘蓝已成为当前育种的一项重要工作,而目前有关通过转入AtP5CS1基因增强羽衣甘蓝耐盐性的研究鲜见报道。【拟解决的关键问题】通过转基因技术将AtP5CS1基因导入羽衣甘蓝基因组中,测定转基因植株的干质量、鲜质量、叶片含水量及根系生长状况并测定脯氨酸的含量及存活率,研究转基因羽衣甘蓝的耐盐性,为获得较强的耐盐性羽衣甘蓝品种及其抗逆育种提供理论依据。
1 材料与方法
1. 1 试验材料
以羽衣甘蓝名古屋为受体材料,大肠杆菌DH5α为受体细菌(通过农杆菌介导),菌种为LBA4404,表达载体pCAMBIA1301。质粒pMDT-P5CS带有AtP5CS1基因(NCBI登录号NM_129539)由黄淮学院生物与食品工程学院实验中心保存提供;DNA聚合酶和限制性内切酶分别购自TaKaRa公司;DNA凝胶提取试剂盒、质粒提取试剂盒购自上海捷瑞生物工程有限公司。
1. 2 表达载体构建
通过引物P1(5'-cggatccAAACTATGACGGAGAT
CG-3'),P2(5'-cgagctcTGGTACAAACCTCAAGGA-3')从pMD-T-P5CS克隆基因P5CS,并与pMD18-T载体连接,转化大肠杆菌DH5α后,挑取单菌落送至生工生物工程(上海)股份有限公司进行测序;比对正确后分别用BamH I和Sac I酶切消化表达载体和克隆载体,然后将目的基因与表达载体进行回收且按3∶1的比例连接,选单克隆菌落PCR鉴定,提取质粒后用冻融法转化感受态农杆菌中。经PCR鉴定,阳性菌于4 ℃保存备用。
1. 3 遗传转化
参照高航等(2015)的方法进行羽衣甘蓝遗传转化。以无菌羽衣甘蓝苗的下胚轴为转化材料,接种到再生培养基中,经过2 d预培养(16 h光/8 h暗),经预培养的下胚轴用农杆菌浸染5 min,深度为0.5 OD;无菌吸水纸吸干后置于再生培养基中共培养2 d,后转入选择培养基培养,每2周继代1次,1个月后将幼苗转入生根培养基中进行生根培养;根长至3 cm左右炼苗移植。
1. 4 抗性植株的Southern blotting检测
参照Murray和Thompson(1980)用CTAB法提取转基因羽衣甘蓝和对照基因组DNA。以P1和P2为引物,转基因和对照羽衣甘蓝基因组DNA为模板,对其进行PCR扩增。羽衣甘蓝基因组DNA用EcoR I内切酶37 ℃酶解后,采取以地高辛随机标记AtP5CS1基因全长作为探针,化学发光信号的Southern blotting检测参考相关手册(DIG DNA Labeling and Detection Kit,Roche,德国)进行操作。
1. 5 抗性植株的qRT-PCR检测
以4个T1代转基因株系(Y1、Y2、Y3和Y4)及对照苗叶片为检测材料,每个株系检测3株苗。选择羽衣甘蓝的叶样品用Trizol试剂(Invitrogen公司)提取RNA。用紫外分光光度计在260/280 nm处测定RNA浓度。参照SMART cDNA synthesis Kit说明书合成cDNA第一链。qPCR在ABI 7300实时检测系统进行检测。使用试剂为Power Sybr Green PCR试剂(ABI)。actin基因(NCBI登录号AF044573)为内参基因。用AtP5CS1基因P3(AtP5CS1基因F:5'-GATACGGATATGGCAAAGC
G-3'),P4(AtP5CS1基因R:5'-CCAAGTCCAAATCGG
AAACC-3')和P5(actin基因F:5'-GGAAGGACTTG
TACGGTAACATTG-3'),P6(actin基因R:5'-TGGACC
TGCCTCATCATACTCA-3')荧光定量PCR引物。反应体系参考Li等(2009)的研究结果。所有PCR进行3次重复,在同一条件下进行测试。基因拷贝数采用双标准曲线法(Li et al.,2009)进行定量分析。
1. 6 转基因植物耐盐胁迫分析
用潮霉素浸泡T1代羽衣甘蓝种子,对其进行筛选,选定30粒正常发芽、胚根统一且根长在2~3 mm的种子,当根长至5 mm左右,转移到固体基质培养盘中,MS培养液培养7 d 后,用150 mmol/L NaCl处理,对照用同体积的营养液;培养箱光照培养(温度24 ℃,湿度80%,光照8000 lx,16 h光/8 h暗)。材料处理5 d后,刻度尺测量主根长、最长侧根长;计数侧根数;天平测定根干质量/鲜质量(DW/FW)、整株干质量和鲜质量。按照陈建勋和王晓峰(2006)的方法测定相对水含量、叶片脯氨酸含量和电导率。试验结束后计算对照组与处理组存活率,存活率(%)=存活数量/总数量×100 。所有试验均重复3次。
2 结果与分析
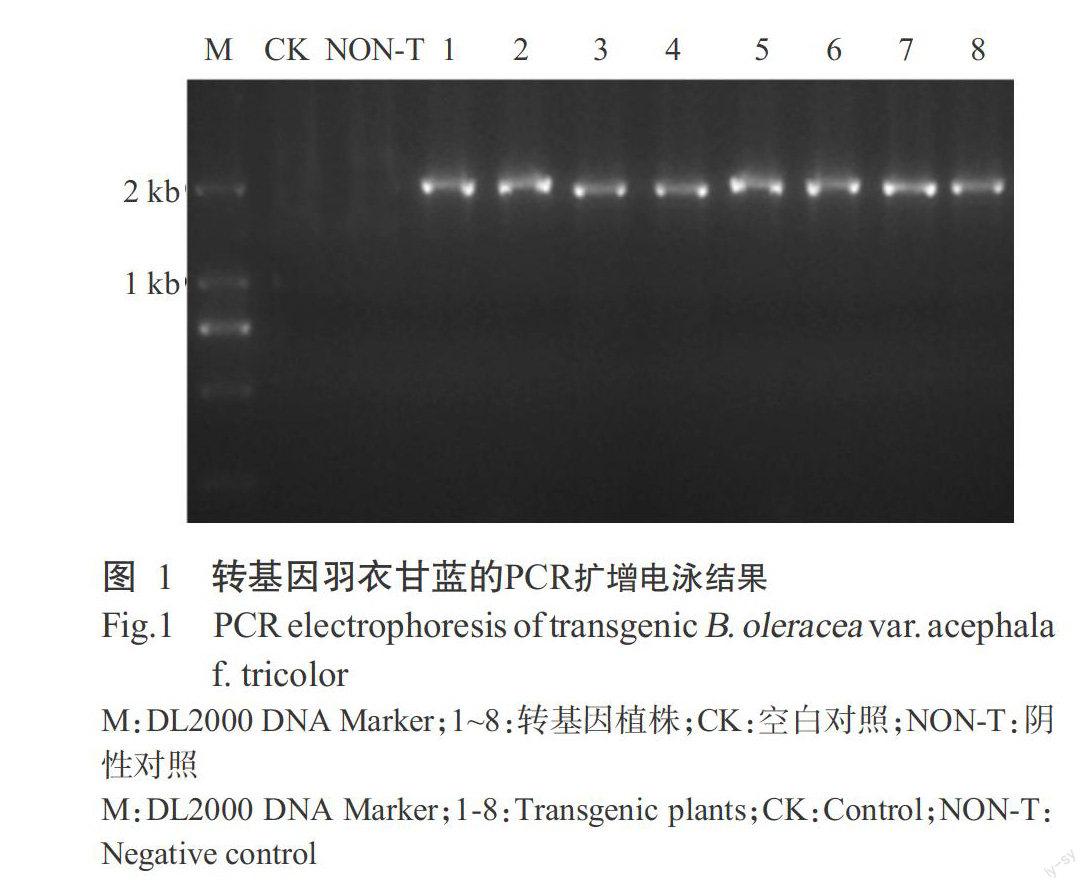
2. 1 转基因羽衣甘蓝的PCR扩增结果
选取8株经潮霉素浸种获得的转基因植株幼苗进行PCR扩增,结果(图1)显示均呈阳性。
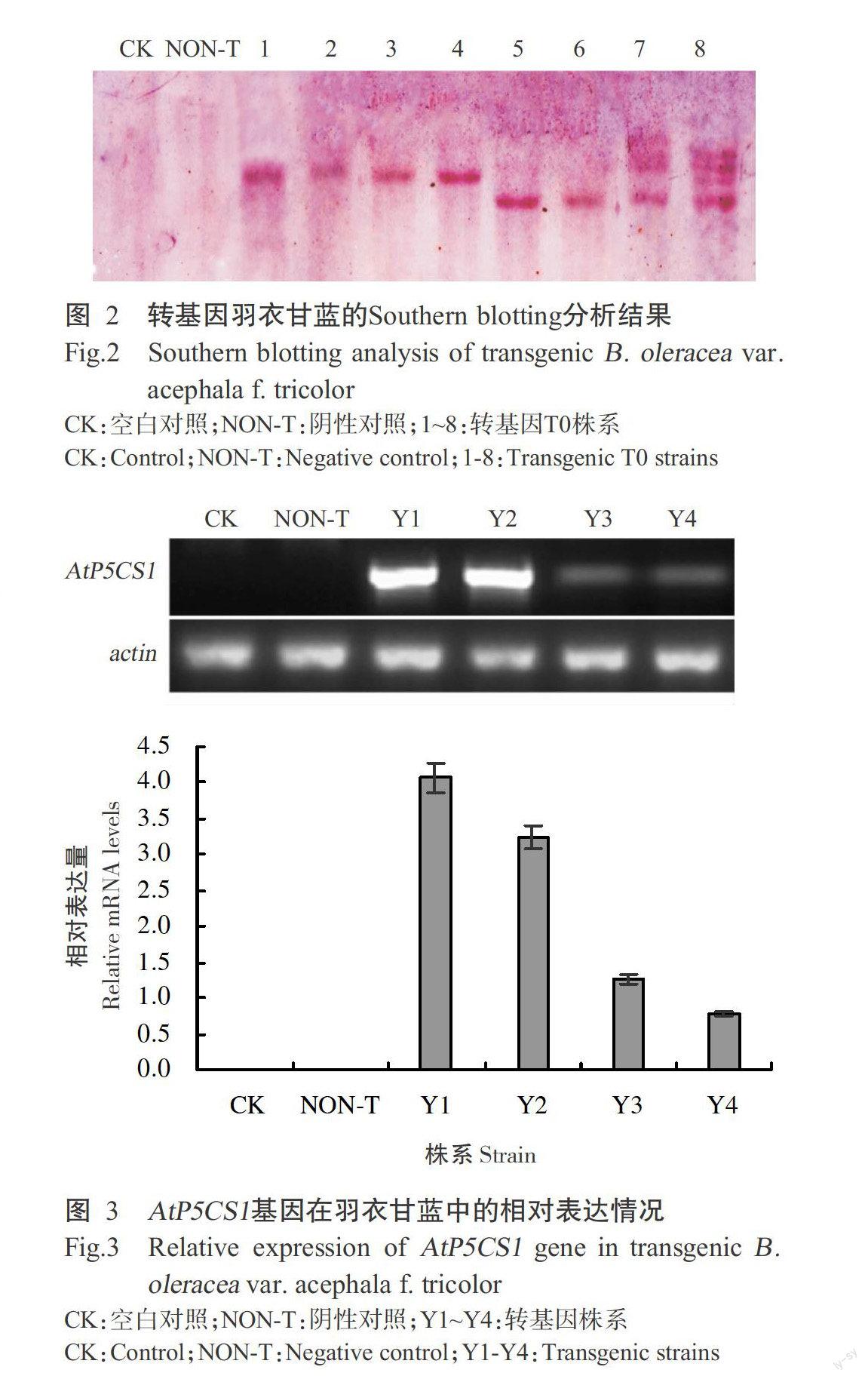
2. 2 转基因羽衣甘蓝Southern blotting分析结果
从PCR检测阳性的叶子中提取总DNA,使用潮霉素基因为杂交探针,总DNA用EcoR I进行酶解,结果如图2所示。从图2可看出,对照植物无杂交条带,而转基因羽衣甘蓝出现杂交条带,且大多数为单拷贝,少量呈多个拷贝。说明AtP5CS1基因已成功整合到羽衣甘蓝的基因组中,有的插入1个序列,有的插入多个序列。
2. 3 转基因羽衣甘蓝定量表达分析结果
实时荧光定量PCR(qRT-PCR)以actin为内参基因,结果如图3所示,AtP5CS1基因mRNA在Y1、Y2株系中的表达水平较高,在Y3、Y4株系中表达水平相对较低,对照中AtP5CS1基因的mRNA没有表达。
2. 4 转基因羽衣甘蓝耐盐性分析结果
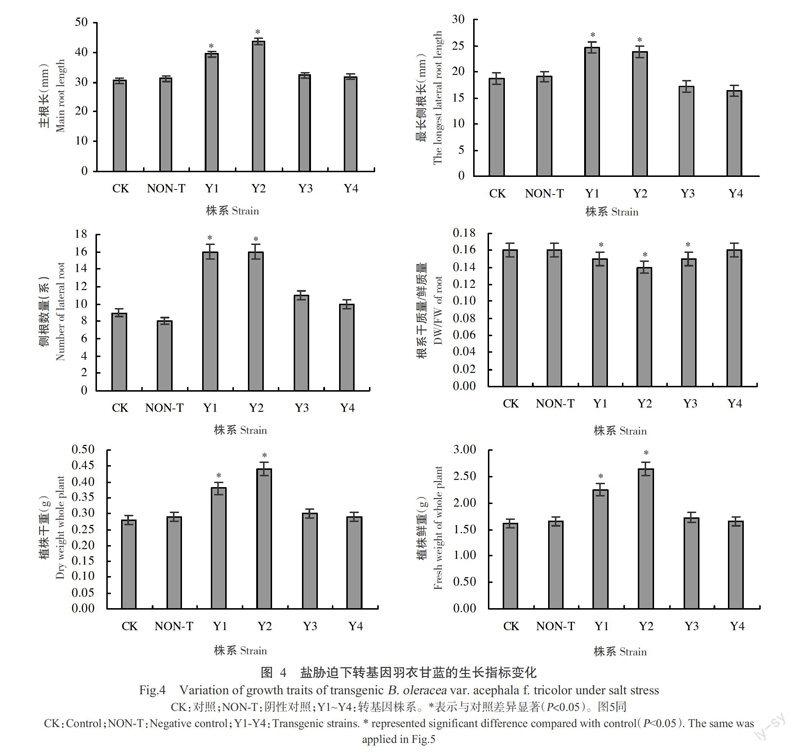
2. 4. 1 转基因羽衣甘蓝在盐胁迫下的生长性状 由图4可看出,用150 mmol/L NaCl胁迫处理后,对照植株的生长受到不同程度抑制,生长趋势下降。AtP5CS1基因的mRNA表达量较高株系Y1、Y2的主根和最长侧根长度较长,侧根数目较多,整株干质量和鲜质量较重,与对照的差异均达显著水平(P<0.05,下同)。说明AtP5CS1基因表达量与植株根的生长状态呈正相关。
2. 4. 2 盐胁迫下转基因羽衣甘蓝生理特性及存活率 由图5可看出,在盐胁迫下,转基因羽衣甘蓝Y1、Y2株系的叶片相对水含量显著高于对照,而叶片相对电导率显著低于对照;脯氨酸含量及存活率均极显著高于对照(P<0.01)。表型观察(图6)与数据分析一致,说明转基因植株具有明显的耐盐性。
3 讨论
本研究成功获得羽衣甘蓝转AtP5CS1基因的高效转化株系,利用PCR分析转化植株,并进一步通过Southern blotting进行杂交证实。前人类似的报道是将VaP5CS1基因转入小麦植株等(Sawahel and Hassan,2002);Kavi Kishor(1995)也在烟草中过表达P5CS1基因, 发现转基因植物产生的P5CS酶活性明显提高。本研究中发现AtP5CS1基因mRNA表达量也达到较高水平。Armengaud等(2004)在研究蒺藜苜蓿时发现植物响应高渗应激性,通常与游离脯氨酸的积累呈正相关。Yamada等(2005)把AtP5CS1转入到矮牵牛属植物中,发现脯氨酸含量明显增加,是总氨基酸含量的1.5~2.6倍;而对照野生型矮牵牛属植物在正常条件下的脯氨酸含量仅为总氨基酸含量的0.50%~
1.01%。Yamchi等(2007)观察发现,在盐胁迫下,烟草中转入AtP5CS1基因,转基因烟草较非转基因烟草植株的脯氨酸含量增加26倍。Kiran Kumar Ghanti等(2011)、Karthikeyan等(2011)观察发现,在盐胁迫下,水稻转基因植株和转基因鹰嘴豆脯氨酸含量是对照的5倍。本研究结果表明,经150 mmol/L NaCl处理5 d,转基因株系的脯氨酸含量均高于野生型对照,表明AtP5CS1基因的转入能有效提高转基因羽衣甘蓝脯氨酸的积累,与上述前人研究结果基本一致。
陈吉宝等(2010)将菜豆脯氨酸合成酶基因P5CS1转入拟南芥,在渗透胁迫下,转基因植株平均相对发芽率分别是野生型的1.60和1.62倍。本研究结果表明,在盐胁迫下,转基因拟南芥植株的脯氨酸含量分别是野生型的2.68倍,平均相对根长分别是野生型植株的1.20倍,顯著高于对照;而相对电导率是野生型植株的85%;显著低于野生型。但本研究用于胁迫处理的NaCl浓度为150 mmol/L,未涉及更高的盐浓度,且选用的株系为T1代转基因植株,下一步应对更高的盐胁迫浓度及T2代纯合体植株的耐盐稳定性进行深入研究。
4 结论
转AtP5CS1基因植株的耐盐表型优于对照植株,即AtP5CS1基因在羽衣甘蓝中的表达明显改善了转基因植株的耐盐性。
参考文献:
陈吉宝,赵丽英,毛新国,王述民,景蕊莲. 2010. 转PvP5CS1基因拟南芥植株对干盐和盐胁迫的反应[J]. 作物学报,36(1):147-153. [Chen J B,Zhao L Y,Mao X G,Wang S M,Jing R L. 2010. Response of PvP5CS1 transgenic Arabidopsis plants to drought- and salt- stress[J]. Aata Agronomica Sinica,36(1):147-153.]
陈建勋,王晓峰. 2006. 植物生理学实验指导[M]. 广州:华南理工大学出版社:76-94. [Chen J X,Wang X F. 2006. Experimental Instruction on Plant Physiology[M]. Guangzhou:South China University of Technology press:76-94.]
高航,高玉亮,李葵花. 2015. 羽衣甘蓝下胚轴农杆菌介导遗传转化体系的优化[J]. 生物技术通报,31(6):111-115. [Gao H,Gao Y L,Li K H. 2015. Optimization of Agrobacterium-mediated transformation system for Brassica olera-
cea var. acephala with hypocotyls as explants[J]. Biotechnology Bullentin,31(6):111-115.]
李志亮,黃丛林,张秀海,曹鸣庆,李征,王刚,吴忠义. 2005. 利用基因枪法向高羊茅导入P5CS基因的研究[J]. 园艺学报, 32(4):653-657. [Li Z L,Huang C L,Zhang X H,Cao M Q,Li Z,Wang G,Wu Z Y. 2005. Studies on transferring P5CS gene into tall fescue(Festuca arundinacea Schreb.)via microprojectile bombardment[J]. Acta Horticulturae Sinica,32(4):653-657.]
徐博,任伟,王英哲,孙启忠,郭玮,娄玉杰. 2015. 农杆菌介导的朝鲜碱茅PuP5CS基因转化紫花苜蓿的研究[J]. 草业科学, 32(6):895-901. [Xu B,Ren W,Wang Y Z,Sun Q Z,Guo W Z,Lou Y J. 2015. Transformation of Puccinellia chinampoensis PuP5CS gene into alfalfa with Agrobacterium-mediated method[J]. Pratacultural Science,32(6):895-901.]
Armengaud P,Thiery L,Buhot N,March GD,Savouré A. 2004. Transcriptional regulation of proline biosynthesis in Medicago truncatula reveals developmental and environmental specific features[J]. Physiologia Plantarum,120(3):442-450.
Greenway H,Munns R. 1980. Mechanisms of salt tolerance in nonhalophytes[J]. Annual Review of Plant Physiology,31:149-190.
Han K H,Hwang C H. 2003. Salt tolerance enhanced by transformation of a P5CS gene in carrot[J]. Journal of Plant Biotechnology,5:149-153.
Igarashi Y,Yoshiba Y,Sanada Y,Yamaguchi-Shinozaki K,Wada K,Shinozaki K. 1997. Characterization of the gene for Δ1-pyrroline-5-carboxylate synthetase and correlation between the expression of the gene and salt tolerance in Oryza sativa[J]. Plant Molecular Biology,33(5):857-865.
Karthikeyan A,Shumugiah Karutha P,Ramesh M. 2011. Transgenic indica rice cv. ADT 43 expressing a Δ1-pyrroline-5-carboxylate synthetase(P5CS) gene from Vigna aconitifolia demonstrates salt tolerance[J]. Plant Cell Tissue and Organ Culture,107(3):383-395.
Kavi Kishor P B,Hong Z L,Miao G H, Hu C-A A,Verma D P S. 1995. Overexpression of Δ1-pyrroline-5-carboxylate synthetase increases proline overproduction and confers osmtolerance in transgenic plants[J]. Plant Physiology,108(4):1387-1394.
Kiran Kumar Ghanti S,Sujata KG,Vijay Kumar B M,Nataraja Karba N,Reddy K J,Srinath Rao M. 2011. Heterologous expression of P5CS gene in chickpea enhances salt tole-
rance without affecting yield[J]. Biologia Plantarum,55(4):634-640.
Kumar V,Shriram V,Kavi Kishor P B,Jawali N,Shitole M G. 2010. Enhanced proline accumulation and salt stress tole-
rance of transgenic indica rice by over-expressing P5CSF129A gene[J]. Plant Biotechnology Reports,4(1):37-48.
Li D H,Liu H,Yang Y L,Zhen P P,Liang J S. 2009. Down-regulated expression of RACK1 gene by RNA interference enhances drought tolerance in rice[J]. Rice Science,16(1):14-20.
Murray M G,Thompson W F. 1980. Rapid isolation of high mole-
cular weight plant DNA[J]. Nucleic Acids Research,8(19):4321-4325.
Sawahel W A,Hassan A H. 2002. Generation of transgenic wheat plants producing high levels of the osmoprotectant proline[J]. Biotechnology Letters,24(9):721-725.
Xu C B,Mi F G,Wang Y. 2006. Research on salt-tolerance of wheatgrass transformed by P5CS gene[J]. Acta Agrestia Sinica,(1):34-39.
Yamada M,Morishita H,Urano K,Shiozaki N,Yamaguchi-Shinozaki K,Shinozaki K,Yoshiba Y. 2005. Effects of free proline accumulation in petunias under drought stress[J]. Journal of Experimental Botany,56(417):1975-1981.
Yamchi A,Jazii F R,Mousav A,Karkhane A A,Renu. 2007. Proline accumulation in transgenic tobacco as a result of expression of Arabidopsis △1-pyrroline-5-carboxylate synthetase(P5CS) during osmotic stress[J]. Journal of Plant Biochemistry Biotechnology,16(1):9-15.
(責任编辑 王 晖)

