独龙牛瘤胃细菌纤维素酶基因克隆
杨天龙 王淑玲 顾招兵 朱仁俊 刘旭川 张春勇 杨舒黎 毛华明 冷静

摘要:【目的】從分子生物学水平对独龙牛的瘤胃纤维素酶基因资源进行筛选及酶学特性研究,为后续开发利用新的纤维素酶提供参考依据,也为揭示瘤胃微生物降解纤维素的作用机理打下基础。【方法】提取独龙牛瘤胃微生物中的大片段基因组DNA,构建瘤胃微生物基因组文库,并进行纤维素酶活性筛选,筛选获得的高活性基因经测序后进行生物信息学分析与酶学性质研究。【结果】从独龙牛瘤胃中共获得20352个阳性克隆,白斑率达92%,构建的瘤胃微生物基因组文库容量899.6 Mb,空载率1.82%。从瘤胃微生物基因组文库筛选获得2个具有纤维素酶活性的阳性克隆(B1和B2),其中,B1基因序列长1230 bp,编码409个氨基酸,基因编码产物与来自Ruminococcus albus纤维素酶基因编码产物(β-1,4-内切葡聚糖酶,GenBank登录号P23661.1)的覆盖率高达99%,其同源性高达97%;B2基因序列长1002 bp,编码333个氨基酸,基因编码产物与Uncultured microorganism纤维素酶基因编码产物(纤维糊精酶,GenBank登录号ADB80112.1)的覆盖率高达99%,其同源性为83%。B1和B2基因可在Rosetta原核表达宿主菌中成功诱导表达,B1纤维素酶的最适pH为6.0,最适温度40 ℃;B2纤维素酶的最适pH为6.0,最适温度40~50 ℃。【结论】从构建的独龙牛瘤胃微生物基因文库中筛选获得2株具有较高活力的纤维素酶(B1和B2),其中,B1为β-1,4-内切葡聚糖酶,而B2为新的纤维糊精酶,可为纤维素的体外降解提供新型材料。
关键词: 独龙牛瘤胃;基因文库;纤维素酶;克隆
中图分类号: S823.89 文献标志码:A 文章编号:2095-1191(2017)05-0901-06
Gene clone of Gayal rumen bacteria cellulase
YANG Tian-long 1, WANG Shu-ling 1, GU Zhao-bing 2, ZHU Ren-jun2, LIU Xu-chuan 2, ZHANG Chun-yong 1,2, YANG Shu-li1,2, MAO Hua-ming 1,2, LENG Jing 1,2 *
(1 Yunnan Provincial Key Laboratory of Animal Nutrition and Feed Science, Kunming 650201, China; 2 College of Animal Science and Technology, Yunnan Agricultural University, Kunming 650201, China)
Abstract:【Objective】Rumen bacteria cellulase gene resources of Gayal were selected and enzymatic characteristics were studied from molecular biology level, so as to provide reference for development and utilization of new cellulases, and lay foundation for revealing the machenism of cellulose degradation. 【Method】Large fragment genome DNA was extracted from Gayal rumen microorganisms to establish rumen microorganism gene library and select cellulase activity. The selected genes with high activity were sequenced, and studied in bioinformatics and enzymatic characteristics. 【Result】20352 positive clones were obtained, the white spot rate reached 92%, the library capacity was 899.6 Mb, no load rate was 1.82%. Two positive clones with cellulase activity were obtained(B1 and B2). B1 gene sequence length was 1230 bp, encoding 409 amino acids, the coverage rate of its encoding product and encoding product from Ruminococcus albus cellulase gene(β-1,4-endoglucanase, GenBank accession number P23661.1) reached 99%, and their homology was up to 97%. B2 gene sequence length was 1002 bp, encoding 333 amino acids, coverage rate of its encoding product and encoding product from Uncultured microorganism cellulase gene(cellodextrinase, GenBank accession number ADB80112.1) reached 99% and homology was 83%. B1 and B2 genes could be induced in Rosetta prokaryotic expression host bacteria. The optimum conditions for B1 cellulase were pH 6.0 and temperature 40 ℃, and for B2 cellulase were pH 6.0 and temperature 40-50 ℃. 【Conclusion】Two strains with high-activity cellulase(B1 and B2) are selected from rumen microorganism gene library established. B1 is β-1,4-endoglucanase and B2 is cellodextrinase. They can serve as new materials for degradation of crude fiber in vitro.
Key words: Gayal rumen; genomic library; cellulase; clone
0 引言
【研究意义】纤维素和半纤维素在自然界中储备量极大,是含量最多的可再生资源,其开发利用被认为是缓解能源问题的最有效途径之一(陈富荣等,2010)。纤维素酶是指能有效降解纤维素的一系列酶总称(范东等,2016),根据其组成与功能一般分为内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶。这3种酶通过协同作用可将纤维素进行有效降解(Jeffries et al.,2007)。纤维素酶除了在降解纤维素类生物质方面发挥重要作用外,在其他工业领域也具有很高的应用价值,如在饲料、食品、纺织、造纸、环保、医药等领域均有广泛应用(Cha et al.,2007;Li et al.,2009)。纤维素酶的来源非常广泛,原生动物、微生物(细菌、真菌、古菌、放线菌等)均具有合成与分泌纤维素酶的能力(Bhat and Bhat,1997),但因其稳定性、活性、灵敏度等的局限,目前尚无法满足工业生产需求(Ko et al.,2011)。因此,需要发掘新型高效纤维素酶以解决粗纤维和生物燃料转化的瓶颈问题。【前人研究进展】至今,有关反刍兽瘤胃微生物的分离鉴定研究已有较多报道。Krause和Russell(1996)通过多样性分析,发现从瘤胃中分离获得的主要微生物有20多种;Stevenson和Weimer(2007)通过16S rRNA检测,发现黄色瘤胃球菌、白色瘤胃球菌和产琥珀酸丝状杆菌等优势菌仅占瘤胃微生物的很小一部分。采用传统分离培养方法,自然界99%的微生物无法在实验室中分离培养(Kellenberger,2001),进而限制了人们对瘤胃微生物种类及作用的认识。宏基因组学、宏转录组学等新型组学技术不依赖分离培养,可直接用于研究瘤胃微生物的DNA和RNA。朱雅新等(2007)成功构建了荷斯坦奶牛瘤胃微生物元基因组BAC文库,并从BAC文库中筛选出16个具有淀粉酶活性的阳性克隆和26个具有纤维素酶活性的阳性克隆。姜海琴等(2015)从已构建的安徽白山羊基因文库中筛选出1个新型纤维素酶基因,以pET28a(+)为载体、大肠杆菌BL21(DE3)为表达宿主菌,经1 mmol/L IPTG诱导7 h后融合蛋白大量表达。此外,还可通过组学手段研究微生物的结构与功能。Güllert等(2016)采用宏基因组与宏转录组学相结合的方法分析工业沼气罐、奶牛瘤胃和大象粪便,结果显示,沼气罐中厚壁菌门(Firmicutes)∶拟杆菌门(Bacteroidetes)为2.8∶1.0,在大象粪便中为1.0∶1.0,在牛瘤胃中为1.4∶1.0,因此认为厚壁菌门与拟杆菌门比例越接近1.0∶1.0,越能提高纤维素的水解能力。【本研究切入点】独龙牛主产于我国云南贡山县独龙江一带,以竹子、芦苇、杂草等粗纤维含量高的植物为食。由于长期生活在恶劣的环境下,独龙牛形成了耐粗饲、抗高寒等极强的抗逆特性(Deng et al.,2007;Xi et al.,2007),但这种特性是否与其瘤胃微生物密切相关(Krause et al.,2003)仍有待进一步探究。【拟解决的关键问题】通过构建独龙牛瘤胃微生物的宏基因文库,从分子生物学水平对独龙牛的瘤胃纤维素酶基因资源进行筛选及酶学特性研究,以期为后续开发利用新的纤维素酶提供参考依据,也为揭示瘤胃微生物降解纤维素的作用机理打下基础。
1 材料与方法
1. 1 独龙牛瘤胃微生物基因文库构建
从云南贡山县(东经98°39′99″,北纬27°46′15″,海拔2260 m)采集5头独龙牛的瘤胃内容物,采集样品-80 ℃保存。取50 g瘤胃样品与135 mL DNA提取溶液[100 mmol/L Tris/NaCl,pH 8.0,100 mmol/L EDTA-Na,100 mmol/L NaH2PO4,1.5 mol/L NaCl,1%十六烷基三甲基溴化铵(CTAB)]混合,参照Rondon等(2015)的方法提取瘤胃微生物大片段基因组DNA。以琼脂糖凝胶回收试剂盒纯化和回收10~100 kb的DNA,与pCC1BAC载体连接,經脱盐与电转后涂布于LB培养基(氯霉素12.5 μg/mL,X-Gal 40 μg/mL,APTG 0.4 mmol/L)上,构建独龙牛瘤胃微生物基因文库。
1. 2 文库纤维素酶基因筛选
对构建的独龙牛瘤胃微生物基因文库进行库容量和稳定性分析,并采用刚果红染色法对该文库进行酶活性筛选(Teather and Wood,1982;钟国祥等,2015),根据菌落周围的水解圈直径分析其产酶性能。将阳性克隆抽提质粒,用Not I于37 ℃下酶切,酶切产物以琼脂糖凝胶电泳进行检测;同时用Hind III和BamH I对阳性克隆质粒插入片段的多样性进行检测。
1. 3 纤维素酶基因表达分析
1. 3. 1 纤维素酶序列分析与鉴定 将筛选出具有纤维素酶活性的阳性克隆送至华大基因公司进行测序,测序结果通过ExPASy(http://www.expasy.org/tools/pi_
tool.html)预测其编码蛋白的等电点和分子量,采用SMART(http://smart.embl-heidelberg.de/)对编码的蛋白序列进行结构域分析,最后用GenBank数据库中的BLAST进行同源性比对分析。
1. 3. 2 纤维素酶基因克隆与表达 针对从瘤胃微生物基因文库中筛选获得的纤维素酶基因设计特异引物序列进行PCR扩增。PCR扩增产物经1%琼脂糖凝胶电泳检测后,进行双酶切鉴定和回收,与pET28-a载体连接后转化至DH5α感受态细胞,筛选阳性重组质粒进行测序,以验证序列的正确性。
1. 4 酶学性质研究
酶活性测定:采用羧甲基纤维素钠(CMC-Na)法测定酶活性,即向25.0 mL具塞试管中加入1.5 mL的1% CMC-Na溶液(以0.2 mol/L HAc-NaAc缓冲液配制,pH 4.6),置于40 ℃水浴中预热5 min,加0.5 mL适当稀释的酶液,40 ℃反应30 min,加入DNS试剂,沸水浴显色后定容至25.0 mL,摇匀。以相同条件下沸水浴灭活5 min的酶液为空白对照,在540 nm波长处测定吸光值,然后在葡萄糖标准曲线上求得生成的葡萄糖量。在上述反应条件下,1 min水解CMC-Na产生1 μg葡萄糖的酶用量定义为1个酶活性单位,以U表示。
酶最适pH测定:分别配制pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0、7.0和8.0的磷酸氢二钠—柠檬酸缓冲液,按照上述方法测定在40 ℃下不同pH缓冲液中的酶活性。酶最适温度测定:在酶最适pH条件下测定25、30、35、40、45、50、55和60 ℃等温度下的酶活性。
2 结果与分析
2. 1 独龙牛瘤胃微生物基因文库构建及纤维素酶基因克隆筛选结果
以琼脂糖凝胶回收试剂盒收集10~100 kb的酶切DNA片段,得到0.1~0.4 μg/mL独龙牛瘤胃液DNA。然后与酶切处理好的pCC1BAC载体进行连接,经脱盐与电转后最终获得含20352个阳性克隆的瘤胃微生物基因组文库,白斑率达92%。
从独龙牛瘤胃微生物基因组文库20352个克隆中随机挑取55个克隆的质粒进行Hind Ⅲ酶切,结果统计得到空载1个(空载率1.82%),构建的文库容量899.6 Mb。随机挑取插入片段较合适的3个克隆进行4次连续转接培养,并对Hind Ⅲ酶切指纹图谱进行对比分析,未发现有任何2个克隆的Hind Ⅲ酶切指纹图谱存在明显变化,充分证明克隆能稳定繁殖。从构建的独龙牛瘤胃微生物基因文库挑选出5200个克隆,结果获得2个具有纤维素酶活性的阳性克隆,分别命名为B1和B2。
2. 2 纤维素酶基因的序列测定分析结果
将具有纤维素酶活性的2个阳性克隆送至华大基因公司测序,得到的测序峰峰值较单一(图1)。B1和B2基因经验证测序后,通过NCBI上的ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/)细菌蛋白翻译寻找开放阅读框,得知B1纤维素酶编码基因长1230 bp,编码409个氨基酸;B2纤维素酶编码基因长1002 bp,编码333个氨基酸。ExPASy预测结果显示,B1理论等电点为4.41,分子量45517.64 Da;B2理论等电点为5.11,分子量38934.68 Da。SMART分析结果表明,B1蛋白的氨基酸序列显示第1~23个氨基酸是信号肽,第86~373个氨基酸是糖苷水解酶家族5功能域;B2蛋白的氨基酸序列显示第1~23个氨基酸是信号肽,第30~331个氨基酸是糖苷水解酶家族5功能域。BLAST分析得知,B1基因编码产物与来自Ruminococcus albus纤维素酶基因编码产物(β-1,4-内切葡聚糖酶,GenBank登录号P23661.1)的覆盖率高达99%,其同源性最高达97%,而与其他来自不同细菌纤维素酶基因编码产物的同源性均低于90%(图2);B2基因编码产物与Uncultured microorganism纤维素酶基因编码产物(纤维糊精酶,GenBank登录号ADB80112.1)的覆盖率达99%,同源性最高达83%,而与其他来自不同细菌纤维素酶基因编码产物的同源性均低于70%(图3)。
2. 3 纤维素酶基因的克隆与原核表达
经重组质粒pET28a-B1/B2转化的Rosetta原核表达宿主菌,以1.0 mmol/L IPTG诱导表达5 h后收集菌体,经超声波破碎,离心收集沉淀和上清液。分别取80 μL上清液和溶解沉淀,经SDS-PAGE电泳检测,发现重组菌经IPTG诱导表达,B1和B2融合蛋白分别在分子量约45.5和38.9 kD处有一条明显条带(图4),而空载体宿主菌在诱导前和诱导后几乎没有区别,与预期结果一致。
2. 4 B1和B2融合蛋白的酶学特性
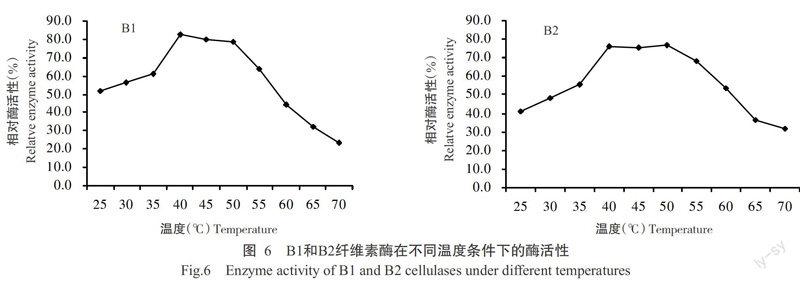
超声波破碎后离心收集的上清液用孔径0.22 μm的滤器过滤,所得液体即为粗酶液,4 ℃保存或直接用于酶活性测定。在40 ℃水浴条件下,分别测定B1和B2纤维素酶在pH为3.0、3.5、4.0、4.5、5.0、5.5、6.0、7.0和8.0时的酶活性,结果(图5)表明,B1和B2纤维素酶的最适pH在6.0左右。在pH 6.0的条件下,分别测定B1和B2纤维素酶在温度为25、30、35、40、45、50、55、60、65和70 ℃时与底物反应30 min的酶活性,结果(图6)表明,B1纤维素酶的最适反应温度在40 ℃左右,B2纤维素酶的最适反应温度在40~50 ℃。
3 讨论
纤维素是地球上分布最广、含量最高的生物质和糖类资源。但由于技术上的局限,人们对纤维素的利用仍然十分有限。反刍动物能高效利用纤维素,这种特有的消化功能是由其瘤胃内大量的微生物所赋予。目前,已从牛的瘤胃中提取获得一些纤维素酶(Liu et al.,2009;Shedova et al.,2009;Bao et al.,2011)。本研究通过提取独龙牛瘤胃未培养微生物的基因组DNA,成功构建了一个宏基因组文库,随后进行活性筛选得到2个纤维素酶阳性克隆(B1和B2),经原核表达能获得与预期结果一致的目的融合蛋白,说明B1和B2基因能在原核生物中诱导表达。
至今,关于β-1,4-内切葡聚糖酶的研究较多,并证实内切葡聚糖酶是影响革兰氏阴性内生细菌定殖的主要因素之一(Reinhold-Hurek et al.,2006)。范晓静等(2014)研究表明,内生芽孢杆菌BS2菌株β-1,4-内切葡聚糖酶活力与其在小白菜体内的定殖数量呈正相关,随着β-1,4-内切葡聚糖酶表達量的增加,内生芽孢杆菌BS2菌株的定殖效果越优。本研究采用BLAST进行同源性比对分析,发现B1基因编码产物与来自Ruminococcus albus纤维素酶基因编码产物(β-1,4-内切葡聚糖酶)的覆盖率高达99%,其同源性高达97%。表明某些纤维素酶除了专一地对底物直接作用外,在增强定殖效果方面还具有很强的促进作用,可经改造后进一步开发利用。纤维素降解体系是一个多酶协同作用体系,每种酶都在发挥各自的作用(Mach-Aigner et al.,2008;Harris et al.,2010;Hori et al.,2011;Langston et al.,2011)。在纤维糊精酶基因研究方面,庄永红等(2008)将编码纤维糊精酶DM1(GenBank索引号ACA61162)的催化功能域DNA序列与其他3种菌合成的纤维素结合功能域和连接桥的DNA序列进行融合,构建了3个融合酶基因,并分别在大肠杆菌BL21菌株中得到过量表达,但对纤维素的水解效果不理想。本研究结果表明,B2基因编码产物与Uncultured microorganism纤维素酶基因编码产物(纤维糊精酶)的覆盖率达99%,同源性达83%;其最适pH在6.0左右,最适温度在40~50 ℃,其他酶学特性有待进一步探究。
虽然目前已有纤维素酶在瘤胃中被发现与利用(朱雅新等,2007;陈富荣等,2010;姜海琴等,2015),且一些纤维素酶经改造后可投入生产,但高效纤维素酶缺乏仍是粗纤维利用的瓶颈。本研究筛选获得的B2基因经鉴定为一个新型纤维素酶基因,其编码产物的酶活力强,具有较高的研究价值,可为纤维素的体外降解提供新型材料。
4 结论
从构建的独龙牛瘤胃微生物基因文库中筛选获得2株具有较高活力的纤维素酶(B1和B2),其中,B1为β-1,4-內切葡聚糖酶,而B2为新的纤维糊精酶,可为纤维素的体外降解提供新型材料。
参考文献:
陈富荣,朱雅新,东秀珠,刘丽华,黄力,戴欣. 2010. 瘤胃木质纤维素降解菌及降解酶基因的研究进展[J]. 微生物学报,50(8):981-987. [Chen F R,Zhu Y X,Dong X Z,Liu L H,Huang L,Dai X. 2010. Lignocellulose degrading bacteria and their genes encoding cellulase/hemicellulase in rumen—A review[J]. Acta Microbiologica Sinica,50(8):981-987.]
范东,刘世操,祝爱侠,陈帆. 2016. 香菇菌糠纤维素酶的提取工艺优化[J]. 江西农业学报,28(5):83-87. [Fan D,Liu S C,Zhu A X,Chen F. 2016. Optimization of cellulase extraction process of waste material from mushroom(Lentinus edodes)[J]. Acta Agriculturae Jiangxi,28(5):83-87.]
范晓静,杨瑞先,邱思鑫,胡方平. 2014. 内生芽孢杆菌BS2的β-1,4-内切葡聚糖酶基因与定殖相关性[J]. 中国农业科学,47(2):262-272. [Fan X J,Yang R X,Qiu S X,Hu F P. 2014. Relationship between β-1,4-endoglucanase gene in endophytic Bacillus strain BS2 and its colonization in plant[J]. Scientia Agricultura Sinica,47(2):262-272.]
姜海琴,程建波,王力生,李吕木,范彩云. 2015. 山羊瘤胃微生物宏基因组文库中一个新型纤维素酶基因的克隆与表达[J]. 安徽农业大学学报,42(2):209-212. [Jiang H Q, Cheng J B, Wang L S, Li L M, Fan C Y. 2015. Cloning and expression of a new cellulase gene from the metagenomic library of the goat rumen[J]. Journal of Anhui Agricultural University,42(2):209-212.]
钟国祥,姚健,张诚,王洪秀,马吉平,陈柳萌,陈庆隆. 2015. 纤维素降解菌的筛选及其酶学性质研究[J]. 江西农业学报,27(6):85-89. [Zhong G X,Yao J,Zhang C,Wang H X,Ma J P,Chen L M,Chen Q L. 2015. Screening and enzymatic properties of cellulose-degrading bacterium[J]. Acta Agriculturae Jiangxi,27(6):85-89.]
朱雅新,王加启,马润林,黄力,董志扬. 2007. 荷斯坦奶牛瘤胃微生物元基因组BAC文库的构建与分析[J]. 微生物学报,47(2):213-216. [Zhu Y X,Wang J Q,Ma R L,Huang L,Dong Z Y. 2007. Construction and analysis of rumen bacterial artificial chromosome library from a dairy cow rumen microflora[J]. Acta Microbiologica Sinica,47(2):213-216.]
庄永红,刘利,段承杰,唐纪良,冯家勋. 2008. 纤维糊精酶DM1与CBD的融合及融合酶性质分析[J]. 广西农业生物科学,27(4):365-371. [Zhuang Y H,Liu L,Duan C J,Tang J L,Feng J X. 2008. Fused cellodextrinase DM1 with CBDs and characterization of fused enzymes[J]. Journal of Guangxi Agricultural and Biological Science,27(4):365-371.]
Bao L,Huang Q,Chang L,Zhou J,Lu H. 2011. Screening and characterization of a cellulase with endocellulase and exocellulase activity from yak rumen metagenome[J]. Journal of Molecular Catalysis B:Enzymatic,73(1-4):104-110.
Bhat M K,Bhat S. 1997. Clulose degrading enzymes and their potential industrial applications[J]. Biotechnology Advances,15(3-4):583-620.
Cha J,Matsuoka S,Chan H,Yukawa H,Inui M,Doi R H. 2007. Effect of multiple copies of cohesins on cellulase and hemicellulase activities of Clostridium cellulovorans mini-cellulosomes[J]. Journal of Microbiology & Biotechnology,17(11):1782-1788.
Deng W,Wang L,Ma S,Jin B,He T,Yang Z,Mao H,Wanapat M. 2007. Comparison of Gayal(Bos frontalis) and Yunnan yellow cattle(Bos taurus):Rumen function,digestibilities and nitrogen balance during feeding of pelleted lucerne(Medi-
cago sativum)[J]. Asian-Australasian Journal of Animal Sciences,20(20):900-907.
Güllert S,Fischer M A,Turaev D,Noebauer B,Ilmberger N,Wemheuer B,Alawi M,Rattei T,Daniel R,Schmitz R A,Grundhoff A,Streit W R. 2016. Deep metagenome and metatranscriptome analyses of microbial communities affilia-
ted with an industrial biogas fermenter,a cow rumen,and elephant feces reveal major differencess in carbohydrate hydrolysis strategies[J]. Biotechnology for Biofuels,9:121.
Harris P V,Welner D,McFarland K C,Re E,Navarro Poulsen J C,Brown K,Salbo R,Ding H,Vlasenko E,Merino S,Xu F,Cherry J,Larsen S,Lo Leggio L. 2010. Stimulation of lignocellulosic biomass hydrolysis by proteins of glycoside hydrolase family 61:Structure and function of a large,enigmatic family[J]. Biochemistry,49(15):3305-3316.
Hori C,Igarashi K,Katayama A,Samejima M. 2011. Effects of xylan and starch on secretome of the basidiomycete Phanerochaete chrysosporium grown on cellulose[J]. FEMS Microbiology Letters,321(1):14-23.
Jeffries T W,Grigoriev I V,Grimwood J,Laplaza J M,Aerts A,Salamov A,Schmutz J,Lindquist E,Dehal P,Shapiro H,Jin Y S,Passoth V,Richardson P M. 2007. Genome sequence of the lignocellulose-bioconverting and xylose-fermenting yeast Pichia stipitis[J]. Nature Biotechnology,25(3):319-326.
Kellenberger E. 2001. Exploring the unknown. The silent revolution of microbiology[J]. EMBO Reports,2(1):5-7.
Ko K C,Han Y,Choi J H,Kim G J,Lee S G,Song J J. 2011. A novel bifunctional endo-/exo-type cellulase from an anaerobic ruminal bacterium[J]. Applied Microbiology and Bio-
technology,89(5):1453-1462.
Krause D O,Denman S E,Mackie R I,Morrison M,Rae A L,Attwood G T,McSweeney C S. 2003. Opportunities to improve fiber degradation in the rumen:Microbiology,ecology,and genomics[J]. FEMS Microbiology Reviews,27(5):663-693.
Krause D O,Russell J B. 1996. How many ruminal bacteria are there?[J]. Journal of Dairy Science,79(8):1467-1475.
Langston J A,Shaghasi T,Abbate E,Xu F,Vlasenko E,Sweeney M D. 2011. Oxidoreductive cellulose depolymerization by the enzymes cellobiose dehydrogenase and glycoside hydrolase 61[J]. Applied and Environmental Microbiology,77(19):7007-7015.
Li X H,Yang H J,Roy B,Wang D,Yue W F,Jiang L J,Park E Y,Miao Y G. 2009. The most stirring technology in future:Cellulase enzyme and biomass utilization[J]. African Journal of Biotechnology,8(11):2418-2422.
Liu L,Feng Y,Duan C J,Pang H,Tang J L,Feng J X. 2009. Isolation of a gene encoding endoglucanase activity from uncultured microorganisms in buffalo rumen[J]. World Journal of Microbiology and Biotechnology,25(6):1035-1042.
Mach-Aigner A R,Pucher M E,Steiger M G,Steiger M G,Bauer G E,Preis S J,Mach R L. 2008. Transcriptional regulation of xyr1,encoding the main regulator of the xylanolytic and cellulolytic enzyme system in Hypocrea jecorina[J]. Applied and Environmental Microbiology,74(21):6554-6562.
Reinhold-Hurek B,Maes T,Gemmer S,Van Montagu M,Hurek T. 2006. An endoglucanase is involved in infection of rice roots by the not-cellulose-metabolizing endophyte Azoarcus sp. strain BH72[J]. Molecular Plant-Microbe Interactions,19(2):181-188.
Rondon M R,Raffel S J,Goodman R M,Handelsman J. 2015. Toward functional genomics in bacteria:Analysis of gene expression in Escherichia coli from a bacterial artificial chromosome library of Bacillus cereus[J]. Proceedings of the National Academy of Sciences of the United States of America,96(11):6451-6455.
Shedova E N,Lunina N A,Berezina O V,Zverlov V V,Schwarz V,Velikodvorskaia G A. 2009. Expression of the genes CelA and XylA isolated from a fragment of metagenomic DNA in Escherichia coli[J]. Molekuliarnaia Genetika,Mikrobiologiia I Virusologiia,(2):28-32.
Stevenson D M,Weimer P J. 2007. Dominance of Prevotella and low abundance of classical ruminal bacterial species in the bovine rumen revealed by relative quantification real-time PCR[J]. Applied Microbiology and Biotechnology,75(1):165-174.
Teather R M,Wood P J. 1982. Use of Congo red-polysaccharide interactions in enumeration and characterization of cellulolytic bacteria from bovine rumen[J]. Applied and Environmental Microbiology,43(4):777-780.
Xi D,Wanapat M,Deng W,He T,Yang Z,Mao H. 2007. Comparison of Gayal(Bos frontalis) and Yunnan yellow cattl (Bos taurus):In vitro dry matter digestibility and gas production for a range of forages[J]. Asian-Australasian Journal of Animal Sciences,20(8):1208-1214.
(責任编辑 兰宗宝)

