不同养殖方式对鳙肠道细菌群落结构的影响
夏耘 余德光 谢骏 王广军 郁二蒙 谢瑞涛


摘要:【目的】評价不同养殖方式对鳙肠道微生物菌群种类及其多样性的影响,为发展鳙的健康养殖提供参考依据。【方法】设生物絮团组、施肥组和网箱吊养组3种养殖方式,经过8周的饲养周期后,运用PCR-DGGE对不同养殖方式下鳙肠道定植菌进行比较分析。【结果】鳙肠道细菌多样性排序为生物絮团组>施肥组>网箱吊养组,其中,生物絮团组与施肥组、生物絮团组与网箱吊养组、施肥组与网箱吊养组的DGGE图谱相似性依次为53.8%、39.4%和42.8%。生物絮团组鳙肠道的特异条带代表α-亚群的葡糖醋杆菌属(Gluconacetobacter)、葡萄球菌属(Staphylococcus)、绿弯菌(Chloroflexi)和几类不可培养细菌(EU585886.1、FN824844.1、GU498473.1、GU486235.1和JN399992.1);施肥组和网箱吊养组鳙肠道的特异条带代表梭菌属(Clostridium)、气单胞菌属(Aeromonas)及不可培养细菌(EU376178.1)。【结论】生物絮团的应用能有效增强养殖鳙肠道微生物菌群组成多样性,降低气单胞菌在鳙肠道的分布,可作为高蛋白饵料类型被鳙摄食。
关键词: 鳙;肠道;细菌群落;生物絮团;养殖方式;PCR-DGGE
中图分类号: S965.114 文献标志码:A 文章编号:2095-1191(2017)05-0907-06
Effects of different aquaculture models on intestinal bacterial
community of bighead carp(Aristichthys nobilis)
XIA Yun1,2, YU De-guang 1, XIE Jun1*, WANG Guang-jun1, YU Er-meng 1, XIE Rui-tao 2
(1 Pearl River Fisheries Research Institute, Chinese Academy of Fishery Sciences / Key Laboratory of Tropical & Subtropical Fishery Resource Application & Cultivation, Ministry of Agriculture, Guangzhou 510380, China; 2 Fisheries College, Guangdong Ocean University, Zhanjiang, Guangdong 524025, China)
Abstract:【Objective】The present study was carried out to evaluate the effects of different aquaculture models on intestinal bacteria composition and diversity of Aristichthys nobilis, to provide reference for healthy culture of it. 【Method】A feeding trial was carried out for eight weeks, and was divided into three groups: biofloc group, fertilization group and cage hanging group. The intestinal colonization bacteria of A. nobilis which were cultivated in three different models was compared by PCR-DGGE technology. 【Result】Results showed that the order of intestinal bacteria diversity followed as biofloc group>fertilization group>cage hanging group, and the DGGE map similarities between biofloc group and fertilization group, biofloc group and cage hanging group, fertilization group and cage hanging group were 53.8%, 39.4% and 42.8% respectively. Specific bands in biofloc group represented Gluconacetobacter, Staphylococcus, Chloroflexi and some uncultured bacteria(EU585886.1, FN824844.1, GU498473.1, GU486235.1 and JN399992.1) of α-subset. Specific bands in fertilization group and cage hanging group were Clostridium, Aeromonas and uncultured bacteria(EU376178.1). 【Conclusion】The application of biofloc enhances the diversity of intestinal microflora composition in A. nobilis, and reduces the distribution of Aeromonas in A. nobilis intestine. Biofloc can also be used as one kind of high protein bait for A. nobilis.
Key words: Aristichthys nobilis; intestine; bacterial community; biofloc; culture model; PCR-DGGE
0 引言
【研究意义】鳙(Aristichthys nobilis)又名胖头鱼、大头鱼、花鲢,主要以浮游动植物为食,是四大家鱼之一,也是池塘水质调节的重要品种(严骏骢等,2011)。近年来,随着对鳙养殖高效益的追求,在高密度的养殖条件下其病害发生率居高不下,尤其以暴发性细菌性败血症最严重。因此,如何提高鳙自身免疫力及抗病能力成为养殖过程中倍受关注的热点。【前人研究进展】鱼类肠道细菌群落组成在食物消化及抑制肠道病原菌定植方面发挥着重要作用(Manzano et al.,2012)。肠道菌群生態平衡决定了宿主的健康状态,通过刺激免疫系统,协助机体产生免疫反应,对病原菌的侵袭起到屏障作用,并产生有益的代谢产物,如维生素和短链脂肪酸等(Gaggìa et al.,2010)。鱼类肠道细菌群落的组成受多种因素影响,包括养殖环境和摄食类型(Batista et al.,2016)。摄食类型对塑造肠道菌群和改变关键共生菌的代谢与规模起主导作用,进而引起宿主生物学的改变(Brown et al.,2012)。长期以来,人们主要通过饵料种类选择及饵料添加剂应用来改善水产动物肠道菌群的分布状况,促进养殖对象的健康生长(Merrifield et al.,2010)。Bakke- McKellep等(2007)研究发现,在大西洋鳕鱼饵料中添加豆粕可提高其肠道微生物组成多样性,但同时伴有肠炎发生;Arkadios等(2010)研究证实,饵料中添加豆粕能有效改变金头鲷肠道细菌群落构成,但在生长发育方面无明显差异;Yang等(2012)研究表明,饵料中添加芽孢杆菌可调节石斑鱼肠道微生物菌群,能选择性刺激各种潜在益生菌(肠球菌属和短小芽孢杆菌)的生长,进而抑制一些有害菌(葡萄球菌和弧菌)的生长;He等(2013)研究表明,饵料中添加低剂量芽孢杆菌能改变罗非鱼肠道菌群组成,有利于罗非鱼机体的健康发育;Batista等(2016)研究发现,在以植物蛋白替换掉部分动物蛋白的条件下,添加益生菌能改变塞内加尔鳎的肠道菌群组成,进而改善机体免疫能力。【本研究切入点】近年来,生物絮团作为一种特殊的养殖技术在水产养殖领域得到广泛应用,尤其在养殖水质改善及养殖对象饵料替代方面发挥重要作用(Hari et al.,2004;Avnimelech,2007)。生物絮团是以异养微生物为主,经生物絮凝作用结合水体中的有机质、原生动物、藻类等而形成的絮状物,可作为滤食性鱼类的一种新型饵料(李朝兵等,2012),但有关摄食生物絮团对鳙肠道细菌群落组成的影响尚未明确。【拟解决的关键问题】将生物絮团、施肥、网箱吊养等3种养殖方式应用于鳙的养殖,从其肠道微生物菌群种类及其多样性出发,评价不同养殖方式对鳙肠道微生物菌群种类及多样性的影响,为发展鳙的健康养殖提供参考依据。
1 材料与方法
1. 1 样品准备
试验于2015年9~10月在广东省中山食品水产进出口集团有限公司养殖基地进行,共8周。供试鳙规格为15.00±0.59 g,放养密度30尾/池,共270尾。养殖水源为同一养殖基地主养草鱼的池塘表层水,使用前以40目筛绢过滤,水体总固体悬浮物(TSS)维持在18.30 mg/L。水源水质参数为氨氮(NH4+-N)0.58±0.02 mg/L,亚硝酸盐氮(NO2--N)0.03±0.01 mg/L,硝酸盐氮(NO3--N)0.71±0.03 mg/L。养殖水体浮游动物种类主要有轮虫、枝角类和桡足类等,含量为3~5 ind/L。
1. 2 试验设计
共设3种养殖方式。(1)生物絮团组:在水泥池(10 m3)中注入8 m3的养殖水源水,用100 μm筛绢收集生物絮团,调节TSS浓度至100.00 mg/L,整个养殖过程不换水,每隔7 d对水体TSS浓度进行调整。(2)施肥组:在水泥池(10 m3)中注入8 m3的养殖水源水,泼洒尿素7 g(N 46%)和过磷酸钙3 g(P2O5 16%)培养水体浮游动物量至8~10 ind/L,每隔7 d镜检一次,并调整水体浮游动物量;每隔15 d更换10%养殖用水。(3)池塘网箱吊养组:在草鱼养殖池塘上层(1 m)悬挂网目为2.5~3.0 cm的网箱(3 m×3 m),每隔7 d镜检一次水体浮游动物量,维持在3~5 ind/L。试验结束后停食24 h,每组3个重复,每个重复取3尾鳙(郁二蒙等,2012)。
1. 3 样品基因组总DNA提取与测定
鳙肠道样品采集不分段,解剖后以0.65%无菌生理盐水冲洗一次肠内壁,去除内容物,肠壁置于2 mL灭菌EP管中,-40 ℃保存备用(张振男等,2015)。将每个养殖单元内的3份鳙肠道制成混合样品。肠道细菌基因组DNA提取参照Bacterial DNA Kit说明进行操作,并在初始样品处理时加入15% SDS裂解细胞。检测DNA浓度后-20 ℃保存备用。
1. 4 16S rRNA基因PCR扩增及DGGE分析
参照张振男等(2015)的方法对样品基因组DNA进行PCR扩增及DGGE分析;并参照王峰等(2004)的方法,采用BIO-RAD Quantity One进行图像分析。
1. 5 条带切胶回收、克隆测序及系统发育进化树构建
DGGE条带的切割回收、克隆及序列分析参照张振男等(2015)的研究方法进行操作。经NCBI数据库比对后,得到的相关序列信息通过ClustalX进行多序列对位排列(Thompson et al.,1997),经校对和剪切后采用MEGA 4.0构建系统发育进化树(Kumar et al.,2004)。
2 结果与分析
2. 1 基因组DNA的提取及PCR扩增结果
由图1可看出,9个鳙肠道样品的基因组DNA均已提取获得,其分子量约为23 kb,与细菌基因组DNA的大小相同,即提取获得的DNA属于较完整的细菌基因组DNA,亮度和纯度均较好,无拖尾现象,可用于后续的PCR扩增和DGGE分析。以提取的鳙肠道菌群总DNA为模板,能扩增获得200 bp的16S rDNA-V3区片段(图2),与预期结果一致。
2. 2 DGGE指纹图谱及分析结果
鳙肠道菌群16S rDNA-V3区片段的DGGE指纹图谱如图3所示。3个处理组的样品分别在DGGE指纹图谱上产生31、28和25条可鉴别条带,条带数量能反映鳙肠道细菌的多样性程度,说明生物絮团的应用有利于提高鳙肠道菌群种类多样性。鳙肠道细菌多样性排序为生物絮团组>施肥组>网箱吊养组,但各处理组鳙腸道细菌群落的优势种十分明显,均有10条左右的条带(对应于DGGE泳道中的亮条带)。
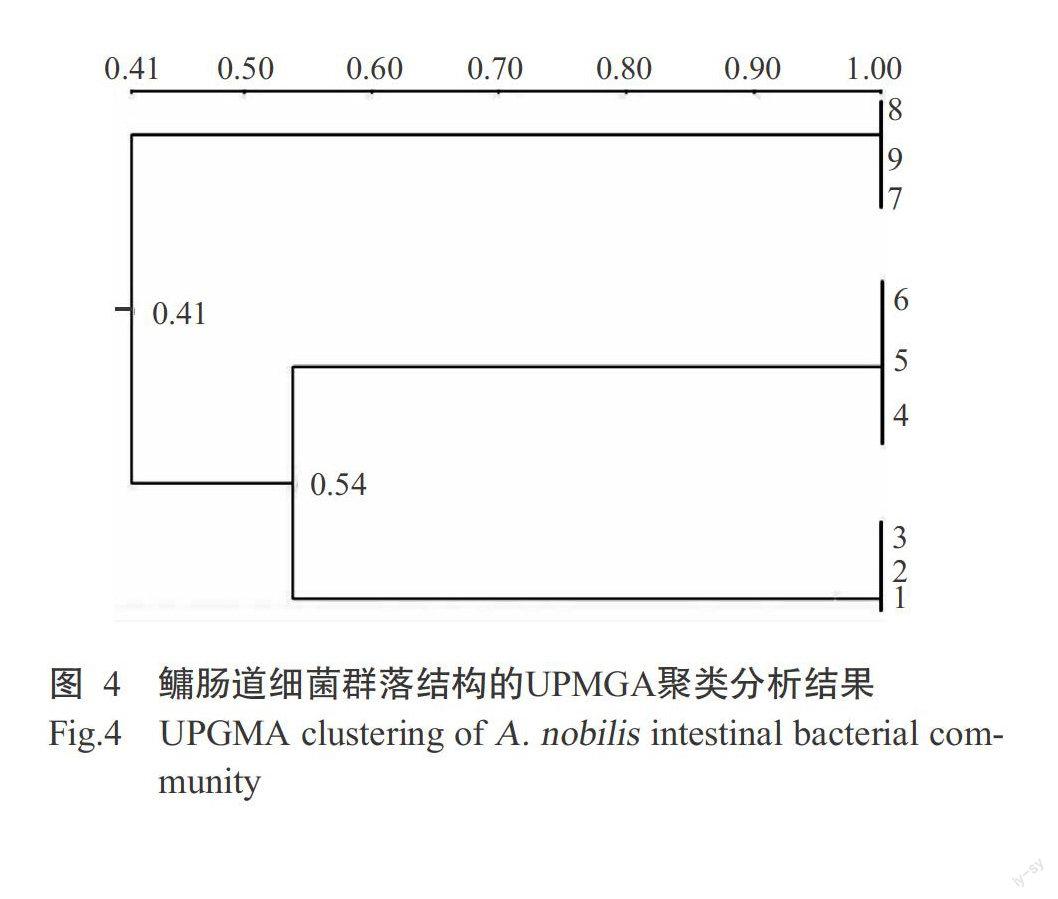
PCR-DGGE指纹图谱经BIO-RAD Quantity One分析后得到UPMGA聚类图(图4)。9个鳙肠道样品按其相似性程度聚为三簇,即每个处理组聚为一簇,相似性均为100.0%;生物絮团组和施肥组先聚为一大簇,再与网箱吊养组汇聚。进一步分析各处理组鳙肠道微生物多样性,结果(表1)显示,生物絮团组与施肥组、生物絮团组与网箱吊养组、施肥组与网箱吊养组的DGGE图谱相似性依次为53.8%、39.4%和42.8%。
2. 3 DGGE目的条带基因片段克隆测序及比对分析结果
共对10条DGGE特异性条带进行切割,切割的条带如图3所示(三角形标注)。其中,条带B1、B2、B3、B4、B7、B8和B10为生物絮团组鳙肠道特异性条带,条带B5、B6和B9为施肥组和网箱吊养组鳙肠道特异性条带。获得的10个阳性克隆测序结果在GenBank数据库中用BLAST进行检索和同源性比对分析,结果表明,测得的条带序列与GenBank数据库中已知序列的同源性均在97%以上(表2)。一般认为16S rDNA序列同源性大于98%时即为同种细菌。但由于本研究的克隆片段较短(200 bp),无法精确到种,只能认为是同属范畴。
由基于16S rDNA-V3区片段构建的系统发育进化树(图5)可看出,10个阳性克隆序列所代表的物种来源十分广泛,包括变形菌门(Proteobacteria)的α-亚群和γ-亚群、绿弯菌纲(Chloroflexi)、梭菌纲(Clostridia)和芽孢杆菌纲(Bacilli)的细菌,以及一些未知的不可培养细菌。与这10个阳性克隆序列最相似的序列来源于以下几个属:气单胞菌属(Aeromonas sp.)、葡糖醋杆菌属(Gluconacetobacter sp.)、梭菌属(Clostridium sp.)和葡萄球菌属(Staphylococcus sp.)。其中,葡萄球菌属、葡糖醋杆菌属、绿弯菌和几类未知细菌为生物絮团组鳙肠道特异性条带所代表的菌株,梭菌属、气单胞菌属及某些未知菌属为施肥组和网箱吊养组鳙肠道特异性条带所代表的菌株。
3 讨论
DGGE是从环境中直接提取细菌DNA进行检测,因此可绕过培养环节,而且采用16S测序和基因库比对的方式可快速确定细菌种属,节省检测时间(王琳等,2015)。近年来,PCR-DGGE已广泛应用于鱼类及其他水生生物的肠道菌群组成和某一类细菌数量研究(李可俊等,2007;罗鹏等,2009)。从本研究的DGGE指纹图谱可看出,不同养殖方式下鳙肠道存在大量的共性条带,且这些条带所占比例较高,由于样品前期处理时采用生理盐水冲洗肠道外壁和内容物,最终获得的鳙肠道内壁黏膜细菌群落被认为是鳙肠道的定植菌。其中,生物絮团组与施肥组的相似性系数为53.8%,生物絮团组与网箱吊养组的相似性系数为39.4%,施肥组与网箱吊养组的相似性系数为42.8%。养殖水体环境和饵料组成等因素对养殖对象肠道的细菌群落组成有明显影响(周文豪等,1998;李可俊等,2007;罗鹏等,2009)。本研究采用的养殖水源相同,外界环境对鳙肠道菌群的影响具有类似效果,因此菌群结构表现出一定程度的相似性。同组不同重复间的养殖管理与流程完全一致,且每个重复取3尾鳙的肠道制成混合样品,一定程度上削弱了个体间的差异,保证每处理组3个重复样品的DGGE指纹图谱均比较一致的产生相应普带,其中生物絮团组鳙肠道的DGGE条带数目最多,为31条;网箱吊养组相对较少,为25条。可见,生物絮团的应用有利于提高鳙肠道菌群种类多样性。
本研究未对3个处理组存在的大量共性条带进行克隆测序分析,这些共性条带可能代表鱼类肠道中一些常见的细菌种类,如变形菌、大肠杆菌和芽孢杆菌等;而将研究焦点集中在不同养殖方式下的鳙肠道特异优势细菌群落构成分析,结果显示,生物絮团组鳙肠道特异性条带所代表的菌群主要有α-亚群的葡糖醋杆菌属、葡萄球菌属及绿弯菌纲。其中,葡糖醋杆菌属菌株通常具有固氮作用,并能产生细菌纤维素(冯静等,2009)。此外,生物絮团组鳙肠道的特异性条带B1克隆测序结果显示为葡萄球菌属,与赵庆新和谭远德(2001)通过传统计数法在鳙肠道中未检测到葡萄球菌属的结论存在差异,同时说明生物絮团的应用对葡萄球菌属菌株有明显影响。葡萄球菌属菌株一般来源于养殖对象居住环境或摄食饵料(Apun et al.,1999;Zmyslowska et al.,2001),故推测本研究中葡萄球菌属的存在来源于生物絮团,因此有必要从应用层面对生物絮团进行深入调控与研究。
本研究中,特异性条带B5和B6为施肥组和网箱吊养组鳙肠道的特异性条带,序列比对分析结果显示,条带B5与GenBank数据库中不可培养梭菌属(JF733419.1)的同源性达99%,条带B6与气单胞菌属(JN032352.1)的同源性为99%。气单胞菌属为鲤科鱼类肠道中的广谱性共生菌(赵庆新和谭远德,2001),是淡水鱼类胃肠中的主要兼性厌氧菌之一。祭仲石等(2014)在南太湖湖州水域鳙肠道中也检测到气单胞菌属菌株的存在。虽然在正常的水产动物肠道壁均能检测到气单胞菌属菌株的存在(Ring■ et al.,2006;Roeselers et al.,2011),但气单胞菌属中的一些种类仍是潜在的致病菌(Wu et al.,2012)。从本研究结果可知,气单胞菌属是施肥组和网箱吊养组鳙肠道特异性条带所代表的细菌,且为这两组鳙肠道的优势和次优势种类,进一步佐证生物絮团的应用能有效降低鳙肠道中的气单胞菌属菌株分布量,进而减少发病概率。
4 结论
生物絮团的应用能有效增强养殖鳙肠道微生物菌群组成多样性,降低气单胞菌在鳙肠道的分布,可作为高蛋白饵料类型被鳙摄食。
参考文献:
冯静,施庆珊,欧阳友生,陈仪本. 2009. 醋酸菌多相分类研究进展[J]. 微生物学通报,36(9):1390-1396. [Feng J,Shi Q S,Ouyang Y S,Chen Y B. 2009. Research progress on the polyphasic taxonomy of acetic acid bacteria[J]. Microbiology,36(9):1390-1396.]
祭仲石,管卫兵,苏孙国,张明月. 2014. 鲢、鳙肠道微生物的研究[J]. 大连海洋大学学报,29(1):22-26. [Ji Z S,Guan W B,Su S G,Zhang M Y. 2014. The intestinal microflora in silver carp Hypophthalmichthys molitrix and bighead carp Aristichthys nobilis[J]. Journal of Dalian Ocean University,29(1):22-26.]
李朝兵,王广军,余德光,谢骏,郁二蒙,李志斐,龚望宝,刘邦辉. 2012. 生物絮团对鳙生长、肌肉氨基酸成分及营养评价的影响[J]. 江苏农业科学,40(11):242-245. [Li C B,Wang G J,Yu D G,Xie J,Yu E M,Li Z F,Gong W B,Liu B H. 2012. Effects of bio-floc on growth,muscle amino acid composition and nutrition value evaluation of bighead carp(Aristichthys nobilis)[J]. Jiangsu Agricultural Sciences,40(11):242-245.]
李可俊,管卫兵,徐晋麟,张延,赵立平. 2007. PCR-DGGE对长江河口八种野生鱼类肠道菌群多样性的比较研究[J]. 中国微生态学杂志,19(3):268-272. [Li K J,Guan W B,Xu J L,Zhang Y,Zhao L P. 2007. PCR-DGGE analysis of bacterial diversity of the intestinal system in eight kinds of wild fishes from the Changjiang river estuary[J]. Chinese Journal of Microecology,19(3):268-272.]
罗鹏,胡超群,张吕平,任春华. 2009. 凡纳滨对虾海水养殖系统内细菌群落的PCR-DGGE分析[J]. 中国水产科学,16(1):31-38. [Luo P,Hu C Q,Zhang L P,Ren C H. 2009. PCR-DGGE analysis of bacterial communities in marine Litopenaeus vannamei culture system[J]. Journal of Fishery Sciences of China,16(1):31-38.]
王峰,傅以钢,夏四清,杨殿海. 2004. PCR-DGGE技术在城市污水化学生物絮凝处理中的特点[J]. 环境科学,25(6):74-79. [Wang F,Fu Y G,Xia S Q,Yang D H. 2004. Cha-
racteristics of municipal sewage chem-bioflocculation treatment process by using PCR-DGGE technology[J]. Environmental Science,25(6):74-79.]
王琳,李敏,魏启舜,张洪海,周影,赵荷娟. 2015. 双孢蘑菇培养料发酵过程中细菌群落结构分析[J]. 江苏农业学报,31(3):653-658. [Wang L,Li M,Wei Q S,Zhang H H,Zhou Y,Zhao H J. 2015. Bacterial communities in Agaricus bisporus compost analysed by denaturing gradient gel electrophoresis[J]. Jiangsu Journal of Agricultural Sciences,31(3):653-658.]
严骏骢,赵金良,李思发,郑德锋,曹阳. 2011. 鳙中国土著群体与移居群体遗传变异的AFLP分析[J]. 中国水产科学,18(2):283-289. [Yan J C,Zhao J L,Li S F,Zheng D F,Cao Y. 2011. Genetic variation of bighead carp Aristichthys nobilis from Chinese native populations and introduced popu-
lations by AFLP[J]. Journal of Fishery Sciences of China,18(2):283-289.]
郁二蒙,余德光,畢香梅,谢骏,王广军,龚望宝,王海英,李志斐. 2012. 脆化草鱼与氹仔草鱼的肠道细菌群落PCR-DGGE指纹图谱及多样性分析[J]. 农业生物技术学报,20(10):1184-1191. [Yu E M,Yu D G,Bi X M,Xie J,Wang G J,Gong W B,Wang H Y,Li Z F. 2012. Fingertprinting and diversity of the intestinal bacterial community of crisp grass carp and Dang-zai grass carp(Ctenopharyngodon idellus) with PCR-DGGE[J]. Journal of Agricultural Biotechnology,20(10):1184-1191.]
張振男,郁二蒙,谢骏,王广军,余德光,李志斐,龚望宝,王海英,魏南,夏耘. 2015. 不同脆化阶段草鱼肠道菌群动态变化、血清酶指标及生长性能[J]. 农业生物技术学报,23(2):151-160. [Zhang Z N,Yu E M,Xie J,Wang G J,Yu D G,Li Z F,Gong W B,Wang H Y,Wei N,Xia Y. 2015. Intestinal microflora dynamic change,serum enzyme and growth performance of the grass carp(Ctenopharyngodon idellus) at different stages of feeding broad bean(Vicia faba)[J]. Journal of Agricultural Biotechnology,23(2):151-160.]
赵庆新,谭远德. 2001. 鲤科鱼肠道菌分布及共生关系研究[J]. 中国预防兽医学报,23(2):130-133. [Zhao Q X,Tan Y D. 2001. Distribution of intestinal bacteria in cyprinidate and relationship of symbiosis between fishes and intestinal microorganisms[J]. Chinese Journal of Preventive Veterinary Medicine,23(2):130-133.]
周文豪,陈孝煊,张冬晓,陈昌福. 1998. 摄食不同饵料对草鱼肠道菌群影响的研究[J]. 华中农业大学学报,17(3):252-256. [Zhou W H,Chen X X,Zhang X D,Chen C F. 1998. A perlimilary study on the influence of different fee-
ding stuff on intestinal microflora of grass carp(Ctenopha ryngodon idellus)[J]. Journal of Huazhong Agricultural University,17(3):252-256.]
Apun K,Yusof A M,Jugang K. 1999. Distribution of bacteria in tropical freshwater fish and ponds[J]. International Journal of Environmental Health Research,9(4):285-292.
Arkadios D,Daniellee M,Peter S,John S,Roy M,John D S. 2010. Effects of mannan oligosaccharide(MOS) supplementation on growth performance,feed utilisation,intestinal histology and gut microbiota of gilthead sea bream(Sparus aurata)[J]. Aquaculture,300(1-4):182-188.
Avnimelech Y. 2007. Feeding with microbial flocs by tilapia in minimal discharge bio-flocs technology ponds[J]. Aquaculture,264(1-4):140-147.
Bakke-McKellep A M,Penn M H,Salas P M,Refstie S,Sperstad S,Landsverk T,Ring■ E,Krogdahl A. 2007. Effects of dietary soyabean meal,inulin and oxytetracycline on intestinal microbiota and epithelial cell stress, apoptosis and proliferation in the teleost Atlantic salmon(Salmo salar L.)[J]. British Journal of Nutrition, 97(4):699-713.
Batista S,Medina A,Pires M A,Mori■igo M A,Sansuwan K,Fernandes J M,Valente L M,Ozório R O. 2016. Innate immune response,intestinal morphology and microbiota changes in Senegalese sole fed plant protein diets with probiotics or autolysed yeast[J]. Applied Microbiology and Biotechnology,100(16):7223-7238.
Brown K,DeCoffe D,Molcan E,Gibson D L. 2012. Diet-induced dysbiosis of the intestinal microbiota and the effects on immunity and disease[J]. Nutrients,4(8):1095-1119.
Gaggìa F,Mattarelli P,Biavati B. 2010. Probiotics and prebiotics in animal feeding for safe food production[J]. International Journal of Food Microbiology,141(S1):S15-S28.
Hari B,Madhusoodana Kurup B,Varghese J T,Schrama J W,Verdegem M C J. 2004. Effects of carbohydrate addition on production in extensive shrimp culture systems[J]. Aquaculture,241(1-4):179-194.
He S X,Zhang Y,Xu L,Yang Y L,Marubashi T,Zhou Z G,Yao B. 2013. Effects of dietary Bacillus subtilis C-3102 on the production,intestinal cytokine expression and autochthonous bacteria of hybrid tilapia Oreochromis niloticus♀×Oreo-
chromis aureus♂[J]. Aquaculture,412:125-130.
Kumar S,Tamura K,Nei M. 2004. MEGA3:Integrated software for molecular evolutionary genetics analysis and sequence alignment[J]. Briefings in Bioinformatics,5(2):150-163.
Manzano M,Iacumin L,Giusto C,Cecchini F,Patthey C,Fontanillas R,Comi G. 2012. Utilization of denaturing gradient gel electrophoresis(DGGE) to evaluate the intestinal microbiota of brown trout Salmo trutta fario[J]. Journal of Veterinary Medical Science,1(2):1-6.
Merrifield D L,Dimitroglou A,Bradley G,Baker R T M,Davies S J. 2010. Probiotic applications for rainbow trout(Oncorhynchus mykiss Walbaum) I. Effects on growth performance,feed utilization,intestinal microbiota and related health criteria[J]. Aquaculture Nutrition,16(5):504-510.
Ring■ E,Sperstad S,Myklebust R,Refstie S,Krogdahl A. 2006. Characterisation of the microbiota associated with intestine of Atlantic cod(Gadus morhua L.):The effect of fish meal,standard soybean meal and a bioprocessed soybean meal[J]. Aquaculture,261(3):829-841.
Roeselers G,Mittge E K,Stephens W Z,Parichy D M,Cavanaugh C M,Guillemin K,Rawls J F. 2011. Evidence for a core gut microbiota in the zebrafish[J]. The ISME Journal,5:1595-1608.
Thompson J D,Gibson T J,Plewniak F,Jeanmougin F,Higgins D G. 1997. The CLUSTAL_X windows interface:Flexible strategies for multiple sequence alignment aided by quality ana-
lysis tools[J]. Nucleic Acids Research,25(24):4876-4882.
Wu S,Wang G,Angert E R,Wang W,Li W,Zou H. 2012. Composition,diversity,and origin of the bacterial community in grass carp intestine[J]. PLoS ONE,7(2):e30440.
Yang H L,Sun Y Z,Ma R L,Ye J D. 2012. PCR-DGGE analysis of the autochthonous gut microbiota of grouper Epinephelus coioides following probiotic Bacillus clausii administration[J]. Aquaculture Research,43(4):489-497.
Zmyslowska I,Lewandowska D,Nowa kowski T,Kozlowski J. 2001. Occurrence of bacteria in water and invendace(Coregonus albula) during rearing in tanks[J]. Polish Journal of Environmental Study,10(1):51-56.
(責任编辑 兰宗宝)

