载荷槲皮素的酪蛋白纳米粒子输送载体的构建*
游丽君 刘敏,2 林恋竹,2 赵谋明,2†
(1. 华南理工大学 食品科学与工程学院, 广东 广州 510640;2. 广东省食品绿色加工与营养调控工程技术研究中心, 广东 广州 511400)
载荷槲皮素的酪蛋白纳米粒子输送载体的构建*
游丽君1刘敏1,2林恋竹1,2赵谋明1,2†
(1. 华南理工大学 食品科学与工程学院, 广东 广州 510640;2. 广东省食品绿色加工与营养调控工程技术研究中心, 广东 广州 511400)
利用酸诱导法和热诱导法制备酪蛋白自组装纳米粒子,并构建了载荷槲皮素的酪蛋白纳米粒子输送载体,分别采用荧光光谱法、动态光散射法研究了酪蛋白纳米粒子与槲皮素的相互作用机制以及酪蛋白纳米粒子与槲皮素相互作用对酪蛋白结构、自组装特性的影响.实验结果表明:槲皮素可以猝灭酪蛋白内源荧光;pH5.5、热处理所制备的酪蛋白粒子与槲皮素的结合能力最强;酪蛋白纳米粒子-槲皮素复合物的形成过程是自发和放热的过程,主要作用力来自氢键;酪蛋白纳米粒子与槲皮素的相互作用对酪蛋白的自组装特性没有显著影响;载荷槲皮素的酪蛋白纳米粒子在储藏30天内保持良好的稳定性;30天时,pH 5.5、热处理所制备的酪蛋白纳米粒子对槲皮素的保留率达75.38%.
酪蛋白;槲皮素;荧光光谱;纳米粒子
槲皮素(Quercetin),化学命名为3,5,7,3’,4’-五羟基黄酮,属于黄酮醇类化合物,在大自然植物中的存在状态多为糖苷(如芦丁等),广泛存在于苹果、洋葱、葡萄、红酒等食物中,具有抗氧化、抗菌、抗癌、抗病毒等生理活性[1].但槲皮素在水和油中的低溶解度限制了槲皮素在食品工业中的应用.通过自组装的胶束或微粒运载、包埋槲皮素可以提高槲皮素在水中的溶解度,并提高乳液的抗氧化性[2].研究最多的是利用牛血清蛋白(BSA)及人血清蛋白(HSA)包埋槲皮素,例如: Fang等[3]利用BSA纳米粒子包埋槲皮素,并研究了该复合物在模拟肠液中的稳定性,结果表明BSA纳米粒子可以有效包埋槲皮素,形成粒径小于10 nm的球形颗粒,该粒子不仅能提高槲皮素的稳定性还能维持槲皮素的抗氧化能力.此外,还有学者利用其他天然蛋白质及合成高聚物包埋制备槲皮素输送体系.Oshima等[4]利用去溶剂法制备酪蛋白与槲皮素的复合物,该复合物在水中分散后的粒径为90~120 nm,以无定型的亲水胶体的形式存在.
食物蛋白具有较高的营养价值和公认的安全性,可用于运载、包埋小分子活性物质.因此,用食物蛋白作为小分子活性物质的运送载体具有诱人的前景.酪蛋白是牛奶中含量最高的蛋白质,其来源广泛,价格便宜,安全无毒且稳定性好,用其作为载体运送小分子活性物质在食品工业受到高度关注.酪蛋白在牛奶中约占蛋白总量的80%.它包含4种蛋白组分:αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白,分子质量在19.00~25.15 ku之间[5].4种组分均为链状两亲性蛋白质,有明显的疏水区和亲水区.酪蛋白结构上的两亲性使其在亲水的同时能够结合疏水性分子[6].酪蛋白能够自组装形成胶束[6],使其成为运载、包埋小分子活性物质的良好材料;通过适当的酸处理和热处理方式可以控制酪蛋白胶束的粒度[7].
本研究旨在纳米尺度下操控酪蛋白,构建载荷槲皮素的酪蛋白纳米粒子输送载体,制备适合在食品工业中应用的新型营养配料.文中利用酸诱导法和热诱导法制备酪蛋白自组装纳米粒子,在此基础上,构建了载荷槲皮素的酪蛋白纳米粒子输送载体,研究了酪蛋白纳米粒子与槲皮素的相互作用.载荷槲皮素的酪蛋白纳米粒子输送载体有助于人体对槲皮素的吸收,同时保留了蛋白质本身的营养特性,可以作为多功能多营养食品配料应用在功能性食品以及普通食品中.
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
酪蛋白,购于美国Sigma公司(分析纯);槲皮素、水溶性维生素E(Trolox)、2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)均为标准品,购于美国Sigma公司;95%乙醇、浓硫酸、盐酸、氢氧化钠、均为分析纯.
1.1.2 仪器
UV-2100紫外可见分光光度计,广州广一科学仪器有限公司产品;高速冷冻离心机、酶标仪、荧光分光光度计,Thermo公司产品;纳米粒度仪Mastersizer 2000,英国Malvern公司产品.
1.2 方法
1.2.1 酪蛋白溶液的制备
将酪蛋白溶于10 mmol/L磷酸盐缓冲溶液(PBS)(pH=7.0)中,配成一定浓度的酪蛋白溶液,加入0.02%的叠氮化钠防止微生物的生长,室温下磁力搅拌4 h,之后转移到4 ℃放置8h使酪蛋白颗粒充分溶胀.将酪蛋白溶液于4 ℃、8 000 r/min离心15 min,之后将蛋白质量浓度调整到5 mg/mL.
1.2.2 酪蛋白自组装纳米粒子的制备
分别取25mL酪蛋白溶液加入烧杯中,分别用1 mol/L盐酸和1 mol/L氢氧化钠溶液将酪蛋白溶液的pH值调至7.0、6.3、5.8、5.5,并于室温下平衡1 h,制得酸诱导的酪蛋白纳米粒子.取各pH值条件下的酪蛋白溶液10 mL,于100 ℃恒温箱中反应30 min,冰水浴中迅速冷却,制得酸诱导、热诱导的酪蛋白纳米粒子.
1.2.3 酪蛋白纳米粒子与槲皮素相互作用研究
于烧杯中依次加入一定体积的酪蛋白纳米粒子溶液(5 mg/mL)和槲皮素乙醇溶液,使得槲皮素的终浓度分别为0、25、50、75、100、150、200、250、300 μmol/L(乙醇的加入量不超过3%).采用荧光分光光度计测定不同条件下制备的酪蛋白纳米粒子-槲皮素复合物的荧光光谱.酪蛋白检测质量浓度为1 mg/mL,荧光发散光谱分析以蛋白质内部荧光基团为探针,荧光光谱在 290 nm 激发,扫描波长为310~400 nm,激发和发射狭缝宽均为 5 nm,电压为 500 mV.
1.2.4 动态光散射分析
用纳米粒度仪检测不同条件下制备的酪蛋白纳米粒子、酪蛋白纳米粒子-槲皮素复合物的粒径大小及分布,测定条件为:比色池为1 cm的聚苯乙烯池,测定温度为25 ℃,温度平衡2 min.
1.2.5 载荷槲皮素的酪蛋白纳米粒子储藏稳定性测定
分别在不同条件下制备的酪蛋白纳米粒子溶液(5 mg/mL)中加入一定量的槲皮素,构建载荷槲皮素的酪蛋白纳米粒子.设置空白组(不添加槲皮素)、低浓度组(槲皮素浓度为50 μmol/L)、高浓度组(槲皮素浓度为250 μmol/L).所有样品均在 4 ℃避光条件下保存,分别测定30天内样品在374 nm处的紫外吸收.用槲皮素标准品做标准曲线,根据标准曲线计算溶液中槲皮素的保留率.
1.2.6 ORAC值测定
ORAC的评价方法参考文献[8]的方法进行,ORAC值表示每克蛋白相当于Trolox的量,单位为μmol/g.
1.2.7 数据分析
每个实验重复3次,所有数据均使用均数±标准偏差来表示.使用SPSS 19.0软件对数据进行分析处理,使用Origin 8.5作图,使用方差分析进行显著性分析,P<0.05认为具有显著性差异.
2 结果与讨论
2.1 酪蛋白纳米粒子的粒度表征
酪蛋白在pH值为2.0~3.0和5.0~12.0的条件下,皆可以形成胶束,疏水作用、氢键作用和盐键作用在酪蛋白胶束的形成过程中起到了重要作用[7].pH值为7.0和5.5时经热处理的酪蛋白的粒度分布如图1所示,在pH值为7.0时,酪蛋白溶液为多分散体系,此时的平均粒径为(126.60±0.87)nm(P<0.05),多分散系数为(0.517±0.008 2)(P<0.05);当pH值为5.5时,酪蛋白经过热处理后的酪蛋白溶液为单分散体系,此时的平均粒径为(87.79±0.97)nm(P<0.05),多分散系数为(0.148±0.024 5)(P<0.05).酪蛋白等电点为4.6,靠近等电点,胶束中静电斥力减小,胶束收缩,平均粒径减小,胶束结构在pH值为5.5时最为紧密[9].有研究表明,热处理促进蛋白形成均匀稳定的纳米粒子,为包埋小分子活性物质,形成稳定的结合物提供可能[10].因此,文中利用适宜的pH诱导和热处理制备酪蛋白纳米粒子.
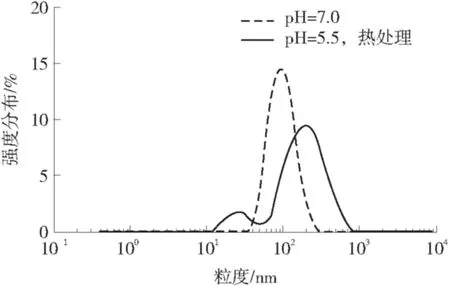
图1 酪蛋白粒度分布图
2.2 酪蛋白纳米粒子与槲皮素的相互作用
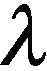
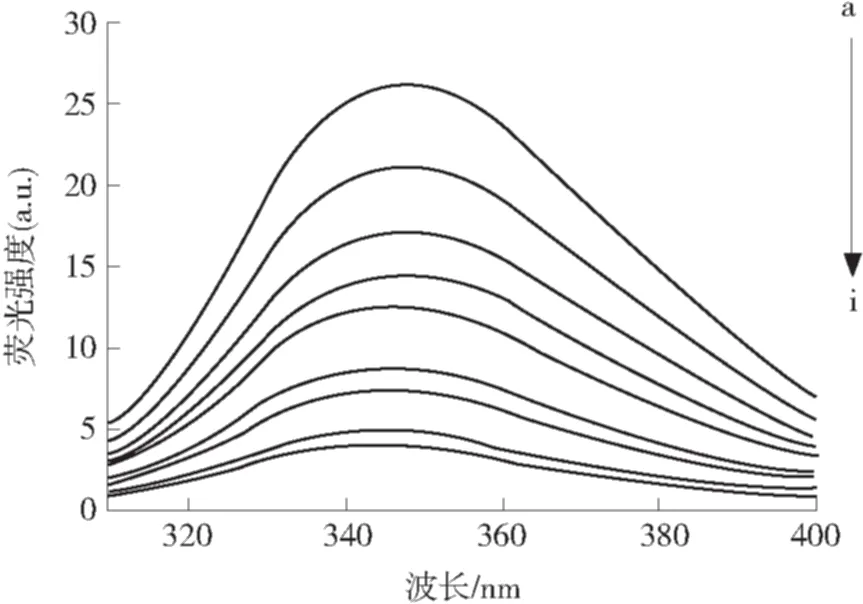
图2 槲皮素与酪蛋白相互作用的荧光光谱
Fig.2 Fluorescence spectra of the interaction between quercetin and caseins
荧光猝灭可由多种分子间的相互作用产生,通常可分为动态猝灭和静态猝灭.动态猝灭是指猝灭由荧光基团与猝灭剂之间的碰撞产生,静态猝灭是指由于荧光基团与猝灭剂之间生产的稳定的复合物导致的荧光猝灭[12].可以根据体系对温度的变化趋势来判断动态猝灭和静态猝灭,动态猝灭常数随着温度的增大而增大,而静态猝灭常数随着温度的增大而减小.假设猝灭过程为动态猝灭,则蛋白质等荧光体与荧光猝灭剂分子间的相互作用可以用动态猝灭常数Ksv(Stern-Volmer猝灭常数)来描述.
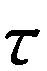
(1)
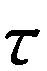
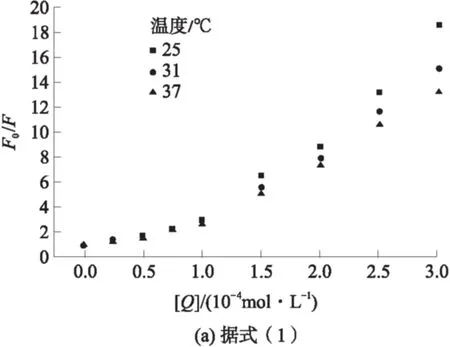
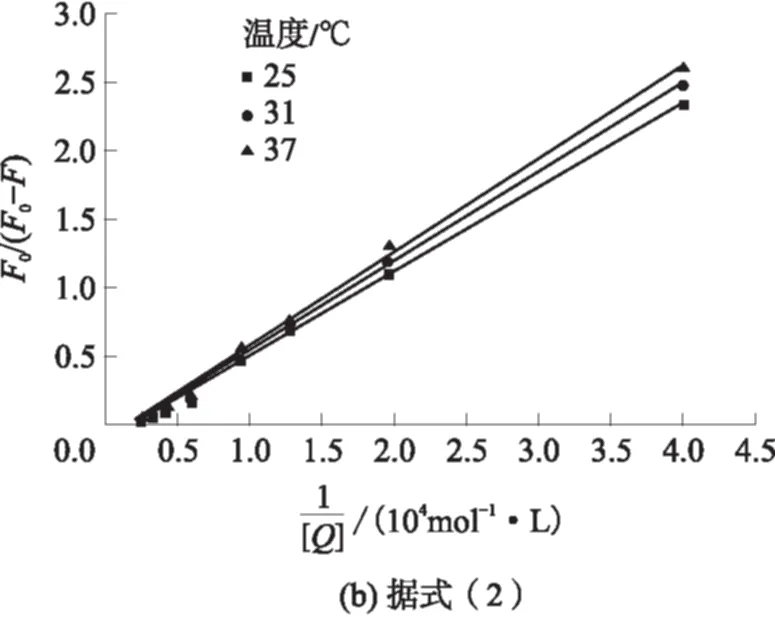

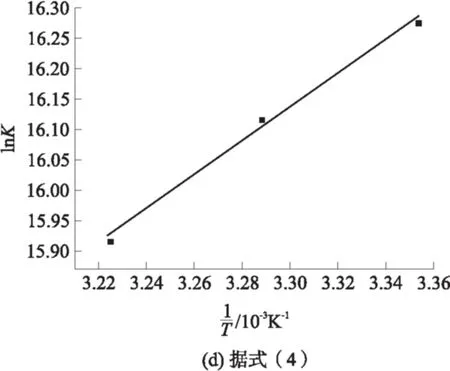
图3 pH=5.5、热处理的酪蛋白荧光发射强度
Fig.3 The fluorescence emission intensity of casein at pH 5.5 after heating
对于存在多个荧光基团的体系,通常使用改进后的Stern-Volmer方程来描述;
(2)
式中, f为结合位点数.
结合常数K根据下式计算:
(3)
式中,n为结合位点数.
小分子活性物质与蛋白之间的结合力主要有氧键、范德华力、疏水作用及静电作用,可根据热力学参数来判断药物与蛋白之间的作用力类型.当温度变化不大时,蛋白与小分子活性物质结合过程中的焓变(ΔH)、熵变(ΔS)可由Van’tHoff方程确定.
(4)
式中:K为温度T下的结合常数;R为气体常数,取8.314J/(mol·K).
蛋白与小分子活性物质结合反应的自由能变(ΔG)可由以下公式计算:
ΔG=ΔH-TΔS
(5)
在25、31、37 ℃时,考察酪蛋白纳米粒子与槲皮素的相互作用,根据式(1)-(5),通过绘制图3(b)-(d)可分别得到不同条件下酪蛋白与槲皮相互作用的结合常数、结合位点数和热力学参数.
酪蛋白纳米粒子与槲皮素的动态猝灭常数和结合位点数见表1,其中7.0-H,6.3-H,5.8-H,5.5-H分别表示在pH=7.0,6.3,5.8,5.5的条件下经过热处理的酪蛋白样品.从表1可以看出,酪蛋白纳米粒子的结构显著影响酪蛋白与槲皮素的相互作用.对于酸诱导制备的酪蛋白纳米粒子,随着纳米粒子制备pH值从 7.0减小到5.5,酪蛋白纳米粒子与槲皮素相互作用的动态猝灭常数值逐渐增大,pH值为5.5时制备的纳米粒子与槲皮素相互作用的动态猝灭常数值最大.deFretias等[13]在研究原花青素与唾液蛋白的结合作用时发现,在唾液蛋白的等电点附近结合程度最大,这是因为在等电点附近,静电斥力较小,导致蛋白分子间的斥力小于蛋白质与多酚间的交联亲和力,使蛋白与多酚之间的结合强度最大.
表1 酪蛋白纳米粒子与槲皮素相互作用的动态猝灭常数Ksv和荧光分数f
Table 1 Dynamic quenching constantKsvand available binding sitefof casein nanoparticles interacting with quercetin
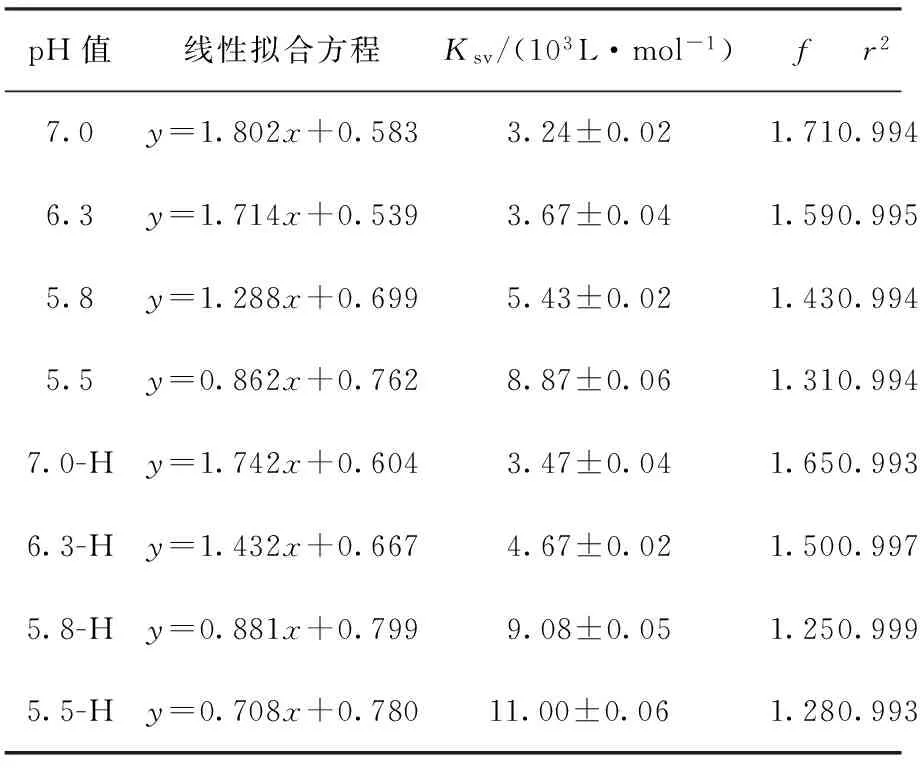
pH值线性拟合方程Ksv/(103L·mol-1)fr27.0y=1.802x+0.5833.24±0.021.710.9946.3y=1.714x+0.5393.67±0.041.590.9955.8y=1.288x+0.6995.43±0.021.430.9945.5y=0.862x+0.7628.87±0.061.310.9947.0-Hy=1.742x+0.6043.47±0.041.650.9936.3-Hy=1.432x+0.6674.67±0.021.500.9975.8-Hy=0.881x+0.7999.08±0.051.250.9995.5-Hy=0.708x+0.780 11.00±0.061.280.993
pH值为5.5时热处理制备的酪蛋白纳米粒子在不同温度下与槲皮素相互作用的结合常数、结合位点数和热力学参数见表2.从表2可知,酪蛋白纳米粒子与槲皮素结合常数较大说明酪蛋白纳米粒子与槲皮素的结合较易发生.当温度升高时,结合常数减小,这一结果与酪蛋白和白藜芦醇相互作用的研究结果相符[14],说明酪蛋白纳米粒子-槲皮素复合物的稳定性随温度升高而降低.
表2 pH值为5.5时不同温度下热处理后的酪蛋白纳米粒子与槲皮素相互作用的结合常数、结合位点数和热力学参数
Table 2 Binding constant,the number of binding site and thermodynamic parameters of casein nanoparticles interacting with quercetin at pH 5.5 and different temperatures after heating

T/KKnr2ΔH/(kJ·mol-1)ΔS/(J·mol-1·K-1)ΔG/(kJ·mol-1)2981.17×1071.6600.997-6.8558.26-24.213049.95×1061.6690.996-24.563108.17×1061.6460.997-24.91
根据酪蛋白纳米粒子-槲皮素相互作用前后的热力学焓变(ΔH)和熵变(ΔS),可对酪蛋白纳米粒子和槲皮素之间的作用力类型进行判断.从表2可知,酪蛋白纳米粒子与槲皮素作用过程中ΔG<0、ΔH<0,表明酪蛋白纳米粒子与槲皮素的结合是自发的,属于放热反应.ΔH<0、ΔS>0,说明结合过程存在氢键作用和疏水作用力[15-16].从表2中可以看出,随着温度上升,结合常数减小,说明体系以氢键作用为主.
2.3 不同条件下酪蛋白的荧光最大发射波长变化
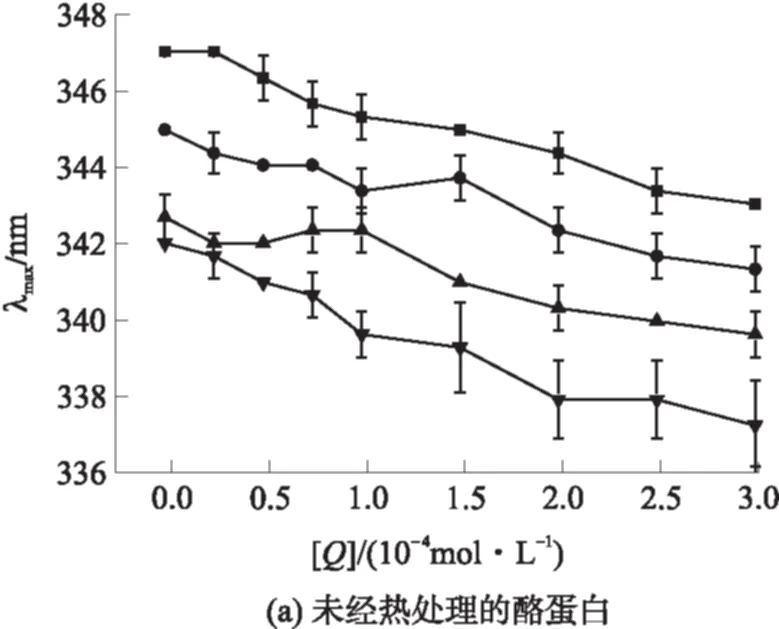
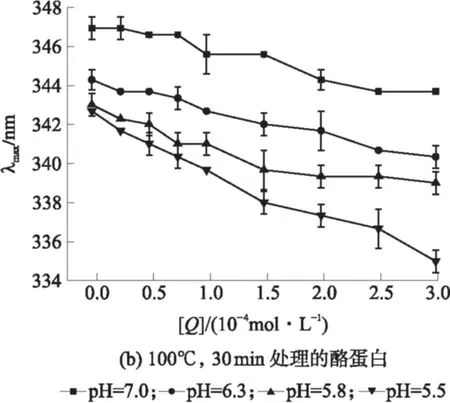
图4 激发波长为290 nm时酪蛋白的最大发射波长
2.4 槲皮素与酪蛋白纳米粒子的相互作用对酪蛋白粒度的影响
由图5可知,当溶液中不存在槲皮素时,当pH值由7.0减小到5.5时,粒度(用平均水动力直径Dh表示)显著减小(P<0.05),表明酪蛋白纳米粒子的结构在接近等电点时更加紧凑;多分散指数(PDI)减小,表明溶液中粒子分布更加均匀.热处理后,pH值为7.0~5.8时,粒度减小;pH值为5.5时,粒度增大.这是因为在不同的pH条件下,热处理影响酪蛋白胶束的解离和聚集.Anema等[7,16]研究表明,pH值为6.3~7.0时,80~100 ℃的热处理可促进酪蛋白胶束的解离,粒度减小;在更高的温度或更低的pH下进行热处理,会导致酪蛋白胶束的聚集,粒度增大.由图5可知,热处理后PDI减小,说明热处理使得溶液中粒子分布更加均匀,酪蛋白与槲皮素的结合对酪蛋白的粒度和PDI的影响较小.随着槲皮素浓度增加,即酪蛋白粒子中包埋的槲皮素增多,粒度略有增加,PDI变化不显著,表明酪蛋白纳米粒子包埋槲皮素后粒子的结构没有显著的改变.

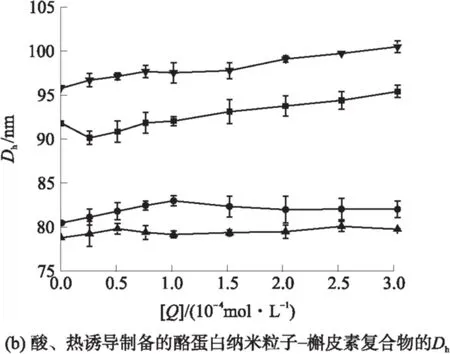
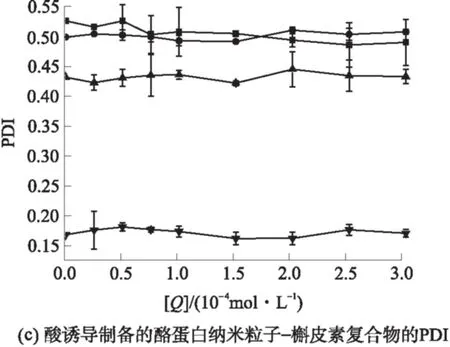
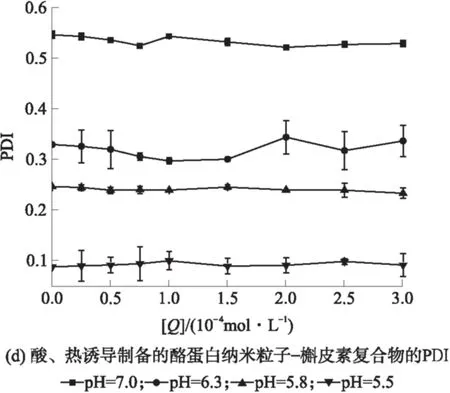
图5 槲皮素与酪蛋白纳米粒子的相互作用对酪蛋白粒度和PDI的影响
Fig.5 Influences of quercetin on particle size and PDI of casein nanoparticles interacting with quercetin
2.5 载荷槲皮素的酪蛋白纳米粒子储藏稳定性
载荷槲皮素的酪蛋白纳米粒子在储藏30天内(4 ℃)槲皮素的浓度变化如图6所示.图6(a)和(b)分别代表低浓度组(50 μmol/L)和高浓度组(250 μmol/L).槲皮素在中性环境中极不稳定,从图6中可以看出,槲皮素在PBS溶液(pH=7.0)中迅速降解,1天后保留量接近于0.利用酪蛋白载荷槲皮素能显著延缓槲皮素在溶液中的降解.用酪蛋白纳米粒子(pH=7.0)载荷槲皮素,槲皮素的保留率显著高于空白组,但30天后只有少量的槲皮素保留,保留率分别为6.93%(低浓度组)和0.90%(高浓度组).此外,酪蛋白纳米粒子(pH=7.0)经热处理后,对槲皮素的保护作用并未增强,这是因为此时的蛋白结构更加松散,不利于与槲皮素的结合.
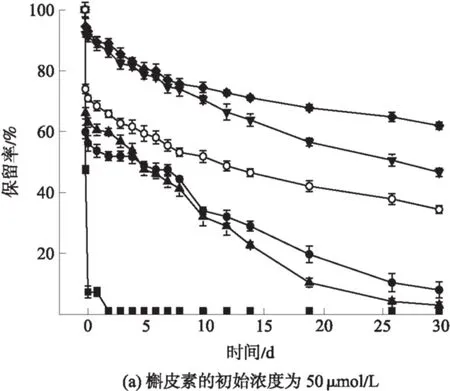
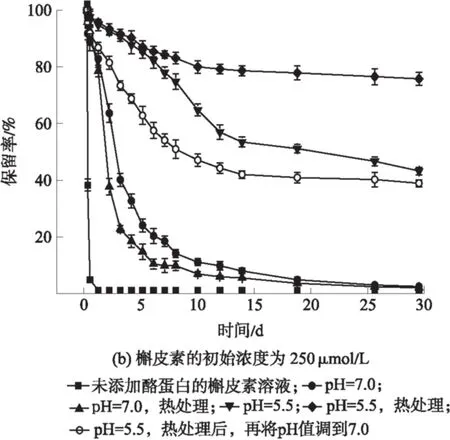
图6 载荷槲皮素的酪蛋白纳米粒子在30天储存期间槲皮素保留率
Fig.6 Retention rate of quercetin combined with casein nano-particles within 30 days
酸诱导制备的酪蛋白粒子对槲皮素的保护效果明显优于酪蛋白纳米粒子(pH=7.0).用酪蛋白纳米粒子(pH=5.5)载荷槲皮素在30天后槲皮素的保留率分别为46.00%(低浓度组)和42.55%(高浓度组),比载荷槲皮素的酪蛋白纳米粒子(pH=7.0)时分别提高了6.63倍和47.27倍.pH=5.5时,经热处理的酪蛋白结构最为紧凑,用酸(pH=5.5)、热诱导制备的酪蛋白纳米粒子载荷槲皮素在30天后其槲皮素的保留率分别为61.45%(低浓度组)和75.38%(高浓度组),比pH=7.0时分别提高了8.86倍和83.76倍,具有显著的保护作用.
为了探究酸(pH=5.5)、热诱导制备的酪蛋白纳米粒子在中性条件下载荷槲皮素的稳定性,研究了将酸(pH=5.5)、热诱导制备的酪蛋白纳米粒子溶液的pH值回调至7.0后对槲皮素的保护效果.结果表明,30天后槲皮素的保留率分别为33.67%(低浓度组)和38.15%(高浓度组),说明回调pH值后的酪蛋白纳米粒子对槲皮素仍具有较好的保护作用.
综上所述,酪蛋白纳米粒子对溶液中的槲皮素具有较好的保护作用,酪蛋白的结构影响蛋白与槲皮素的结合,同时影响载荷槲皮素时对它的保护作用.
2.6 ORAC值分析
槲皮素的抗氧化作用主要取决于其酚羟基,其中槲皮素A环上的5-OH和7-OH以及B环上的3′-OH和5′-OH是主要的抗氧化基团.早有研究表明,当多酚与生物大分子(如蛋白质)非共价结合会导致抗氧化活性的降低[18].槲皮素和酪蛋白的ORAC实验表明,槲皮素的ORAC值为(168.68±20)μmol/g,酪蛋白纳米粒子(pH=5.5、经热处理)的ORAC值为(3 763.84±176)μmol/g,两者结合后的ORAC值为(269.62±33)μmol/g.从实验结果可以看出,槲皮素具有较高的ORAC值,与文献报道相符[8],酪蛋白也具有一定的抗氧化活性,但效果远不如槲皮素.当槲皮素与酪蛋白纳米粒子结合后,复合物的ORAC值远远小于槲皮素的活性,稍大于酪蛋白的活性,说明结合作用对槲皮素的抗氧化活性具有很强的掩盖作用,与文献报道相符[13].有研究表明,这种掩盖作用与槲皮素与大分子之间形成的氢键有关[3],槲皮素分子上的酚羟基与酪蛋白纳米粒子形成分子间的氢键,不仅起到了提高稳定性的作用,同时也保护了槲皮素的抗氧化活性.
3 结论
利用酸诱导法和热诱导法制备酪蛋白自组装纳米粒子,并构建了载荷槲皮素的酪蛋白纳米粒子输送载体.槲皮素可以猝灭酪蛋白内源荧光,pH=5.5、热处理所制备的酪蛋白粒子与槲皮素结合能力最强;酪蛋白纳米粒子-槲皮素复合物的形成过程是自发和放热的过程,主要作用力是氢键作用.酪蛋白纳米粒子与槲皮素的相互作用对酪蛋白的自组装特性没有显著影响.载荷槲皮素的酪蛋白纳米粒子在储藏30天内保持良好的稳定性.30天时,pH=5.5、热处理所制备的酪蛋白纳米粒子对槲皮素保留率达75.38%.
[1] CHO S Y,KIMMiK Y,MOKH Y J,et al. Separation of quercetin’s biological activity from its oxidative property through bioisosteric replacement of the catecholic hydroxyl groups with fluorine atoms [J].Journal of Agricultural and Food Chemistry,2012,60(26):6499- 6506.
[2] WAN Z L,WANG J M,WANG L Y,et al. Enhanced physical and oxidative stabilities of soy protein-based emulsions by incorporation of a water-soluble stevioside-resveratrol complex [J]. Journal of Agricultural and Food Chemistry,2013,61(18):4433- 4440.
[3] FANG R,HAO R F,WU X,et al. Bovine serum albumin nanoparticle promotes the stability of quercetin in simulated intestinal fluid [J].Journal of Agricultural and Food Chemistry,2011,59(11):6292- 6298.
[4] OSHIMA T,MASUDA Y,HARANOMURA T,et al. Enhancement of water dispersibility of quercetin by complexation with casein [J]. Chemical Engineering,2014,40(40):125- 130.
[5] FARRELL H M,WICKHAM E D,UNRUH J J,et al. Secondary structural studies of bovine caseins:temperature dependence of b- casein structure as analyzed by circular dichroism and FTIR spectroscopy and correlation with micellization [J]. Food Hydrocolloids,2000,5(4/5/6):341- 354.
[6] 于钰.酪蛋白自组装纳米粒的超声制备及其应用 [D].青岛:中国海洋大学,2012.
[7] ANEMA S G,Lowe E K,LEE S K. Effect of pH at heating on the acid-induced aggregation of casein micelles in reconstituted skim milk [J]. LWT-Food Science and Technology,2004. 37(7):779- 787.
[8] 赵谋明,刘敏,林恋竹,等.山苦茶多糖结构表征及抗氧化活性研究 [J].现代食品科技,2015,31(7):61- 66. ZHAO Mou-ming,LIU Min,LIN Lian-zhu,et al. Structural characteristics and antioxidant activity of polysaccharides fromMallotusbolongifolius[J]. Modern Food Science and Technology,2015,31(7):61- 66.
[9] 刘燕. 酪蛋白胶束结构与功能特性的研究 [D]. 扬州:扬州大学,2007.
[10] SHPIGELMAN A,ISRAELI G,LIVNEY Y D. Thermally-induced protein-polyphenol co-assemblies:beta lactoglobulin-based nanocomplexes as protective nanovehicles for EGCG [J]. Food Hydrocolloids,2010,24(8):735- 743.
[11] ESMAILI M,GHAFFARI S M,MOOSAVI- MOVAHEDI Z,et al. Beta casein- micelle as a nano vehicle for solubility enhancement of curcumin; food industry application [J]. LWT- Food Science and Technology,2011,44(10):2166- 2172.
[12] SCHWILLE P,RIES J. Principles and applications of fluorescence correlation spectroscopy (FCS) [C]∥Proceedings of NATO Science for Peace and Security Series B- Physics and Biophysics.Erice:Springer,2011:63- 85.
[13] de Freitas V,MATEUS N. Structural features of procyanidin interactions with salivary proteins [J].Journal of Agricultural and Food Chemistry,2001,49(2):940- 945.
[14] ACHARYA D P,SANGUANSRI L,AUGUSTIN M A.Bin-ding of resveratrol with sodium caseinate in aqueous solutions [J].Food Chemistry,2013,141(2):1050- 1054.
[15] ROSS P D,SUBRAMANIAN S. Thermodynamics of protein association reactions:forces contributing to stability [J]. Biochemistry,1981,20(11):3096- 102.
[16] ANEMA S G,Klostermeyer H. Heat- Induced,pH- dependent dissociation of casein micelles on heating reconstituted skim milk at temperatures below 100 ℃ [J].Journal of Agricultural and Food Chemistry,1997,45(4):1108- 1115.
[17] 郑华. 蛋白质折叠的荧光测定和计算机模拟 [D]. 武汉:武汉大学,2005.
[18] STOJADINOVIC M,RADOSAVLJE-VIC J,OGNJENO-VIC J,et al. Binding affinity between dietary polyphenols andβ- lactoglobulin negatively correlates with the protein susceptibility to digestion and total antioxidant activity of complexes formed [J]. Food Chemistry,2013,136(3/4):1263- 1271.
Construction of Casein Nanoparticles for Quercetin Delivery System
YOULi-jun1LIUMin1,2LINLian-zhu1,2ZHAOMou-ming1,2
(1. School of Food Science and Engineering, South China University of Technology, Guangzhou 510640,Guangdong,China;2.Guangdong Food Green Processing and Nutrition Regulation Technologies Research Center,Guangzhou 511400, Guangdong,China)
Self- assembled casein nanoparticleswere prepares via acid induction and thermal induction, and aquercetin delivery system was constructed. Then, the interaction mechanism and the effect of quercetin on casein conformation were investigated by means of fluorescence spectroscopy and dynamic light scattering. The results indicate that (1) quercetin can quench the intrinsic fluorescence of casein; (2) casein nanoparticles at pH5.5 after heat treatment possesses the strongest binding with quercetin; (3) the interaction between quercetin and casein is a spontaneous and exothermal process, and the main force in this process is hydrogen bonding; (4) the interaction between quercetin and casein nanoparticles has no great effect on the self- assembly characteristics of casein; (5) quercetin after a 30- day storage keeps stable; and (6) casein nanoparticles after a heat treatment at pH5.5 is of the highest retention rate up to 75.38%.
casein; quercetin; fluorescence spectrum; nanoparticle
2016- 03- 28
国家自然科学基金资助项目(31501424) Foundation item: Supported by the National Natural Science Foundation of China(31501424)
游丽君(1982-),女,博士,副研究员,主要从事食品营养与健康研究. E-mail:feyoulijun@scut.edu.cn
†通信作者: 赵谋明(1964-),男,博士,教授,主要从事食品生物技术研究. E-mail:femmzhao@scut.edu.cn
1000- 565X(2017)03- 0138- 08
TS 235.1
10.3969/j.issn.1000-565X.2017.03.020

