高酸苹果多酚鉴定及抗氧化、抗溶血活性研究*
孙为正 杨坤 林恋竹 邹颖 赵谋明
(华南理工大学 食品科学与工程学院, 广东 广州 510640)
高酸苹果多酚鉴定及抗氧化、抗溶血活性研究*
孙为正 杨坤 林恋竹 邹颖 赵谋明†
(华南理工大学 食品科学与工程学院, 广东 广州 510640)
对新疆产高酸苹果—“洪勋1号(红肉)”进行系统研究,发现其可滴定酸度为1.31%,总酚和花青素含量依次为果皮>果渣>全果(总酚含量为(2 026.88±28.30)mg/kg;花青素含量为(244.92±13.88)mg/kg)>果肉.采用高效液相色谱法对高酸苹果多酚进行分离鉴定,共鉴定出10种多酚类化合物,包括绿原酸、根皮苷、表儿茶素、阿魏酸、杨梅酮、儿茶素、香草酸、p-香豆酸、芦丁和咖啡酸,全果中以绿原酸(391.19±18.37)mg/kg)、表儿茶素(698.82±17.21)mg/kg)和儿茶素(570.30±9.21)mg/kg)为主.采用DPPH自由基清除法、氧自由基吸收能力法、2,2-偶氮二异丁基脒二盐酸盐(AAPH)损伤人血红细胞氧化模型评价苹果各部位的抗氧化活性与抗溶血活性,结果表明:高酸苹果的皮、肉、渣、全果均具有较强的抗氧化活性,抗溶血能力依次为果皮>果渣>全果>果肉.研究表明,高酸苹果值得深度开发加工为高营养价值的产品.
高酸苹果;抗氧化活性;抗溶血活性;多酚
苹果含有丰富的营养成分,位列我国四大水果之首. 苹果多酚作为苹果中的重要的生物活性物质,引起了人们的关注.苹果多酚是苹果中所含多元酚类物质的通称,苹果中的多酚物质主要包括黄烷-3-醇类、黄酮醇类化合物、羟基苯甲酸类、二氢查耳酮、花色苷类等五大类[1].苹果多酚可分为酚酸类(主要是绿原酸和咖啡酸)和黄酮类化合物(如儿茶素、表儿茶素、原花青素等黄烷醇、黄酮醇)[2- 3].研究表明,苹果多酚具有多种生理功能[4],包括抗氧化[5]、抗菌消炎[6]、预防冠心病[7]以及抗肿瘤[8]等.
高酸苹果属于蔷薇科苹果属,有果味酸,具有生津、消食的功效.洪勋1号高酸苹果根据其果肉颜色可以分为黄色、浅红和红色,本次实验所用原料是产自新疆的高酸苹果“洪勋1号”,所用个体经人工挑选,果肉鲜红,质地紧密.
据报道,浓缩果汁的价值与其可滴定酸度有着直接的关系.在国际市场上,浓缩苹果汁酸度每提高 1度,每吨售价相应提高100~150美元[9].我国是世界上第一大苹果生产国,同时也是世界浓缩苹果汁第一出口大国,但我国浓缩苹果汁在出口价格上和出口量上都受到制约,其中一个很重要的原因就是我国浓缩苹果汁酸度较低,市场竞争力差.“洪勋1号(红肉)”高酸苹果在新疆地区已经有较广泛的种植,来源丰富,具有加工成浓缩果汁的生产潜质.然而,目前对于高酸苹果的研究很少.
研究表明,苹果中多酚的种类和含量会因品种的不同而不同,同一种苹果的不同部位也有差异. Podesedek等[10]对Alva、Elstar、Jonagold、Szampion、Warta等10个品种的成熟苹果中的多酚组成的研究表明,儿茶素在 Szampion和Elstar两个品种中含量较高,而绿原酸为其余品种苹果中主要的酚类物质.因此,笔者以“洪勋1号(红肉)”高酸苹果为研究对象,系统研究了其出汁率、pH值、可溶性固形物含量、水分含量、可滴定酸含量、总糖、总酚以及花青素含量,对比研究了其果皮、果肉、果渣、果汁的多酚组成与含量,及其抗氧化活性,构建了2,2-偶氮二异丁基脒二盐酸盐(AAPH)氧化损伤人血红细胞模型,评价了全果、果皮、果肉、果渣、果汁的抗溶血活性,以期为高酸苹果的综合开发利用提供理论和方法指导.
1 材料与方法
1.1 原料
“洪勋1号(红肉)”高酸苹果,2015年8月采摘自新疆伊犁,空运至广州,1 h内运送至实验室,4 ℃冷藏保存.
多酚提取液的制备:将高酸苹果分批,将一批高酸苹果削皮,分离得到果皮、果肉;另外,将一批苹果榨汁,得果汁和果渣.分别称取一定质量的果皮、果肉、果渣和全果,切丁后浸入无水乙醇(按料液比1 g∶10 mL),立即打浆, 60 ℃提取2 h,过滤,得滤液,45 ℃真空浓缩后,转入100 mL容量瓶中,50%乙醇定容后,分别得到果皮、果肉、果渣和全果的多酚提取液.
1.2 试剂
DPPH、AAPH、荧光素、Trolox、绿原酸、根皮苷、表儿茶素、阿魏酸、杨梅酮、儿茶素、香草酸、p-香豆酸、芦丁、咖啡酸,纯度为99%,为美国Sigma公司产品;甲醇、三氟乙酸,纯度为99%,为德国Merck公司产品.其他试剂均为分析纯,购置于富宇化学有限公司和广州化学试剂厂.
1.3 设备
E-line型阿贝折光仪,香港德祥科技有限公司;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;SHZ-D(Ⅲ)型循环水式真空泵,巩义市予华仪器有限公司;3-18K型离心机,美国Sigma公司;Varioskan Flash型酶标仪,美国Thermo公司;UV-721型紫外分光光度计,上海精密科学仪器仪表有限公司;Waters 2695型高效液相色谱仪,美国Waters公司.
1.4 实验方法
1.4.1 出汁率
将苹果切成小丁,放入压榨机中匀浆榨汁,后放入4层纱布中,挤出水分得到原果汁,95 ℃灭酶 20 s,称取质量,计算出汁率.
1.4.2 pH值、可溶性固形物和水分含量
取原果汁,使用pH计测定果汁pH值,使用阿贝折光仪测定果汁中固形物含量.采用GB 5009.3—2010方法进行水分含量测定.
1.4.3 可滴定酸含量测定
将苹果切成小丁,按1 g∶10 mL的料液比加水打浆,放入80 ℃水浴锅,每15 min摇晃一次,保温1 h后取出.过滤,得滤液.取容量瓶,定容后,取20 mL溶液,按1∶5稀释后,滴入数滴酚酞溶液,用标定后的NaOH溶液进行酸碱滴定.
1.4.4 总糖含量测定
将苹果切成小丁,按1 g∶10 mL的料液比加水打浆,放入70 ℃超声波清洗仪,800 W超声提取1 h后取出.过滤,得滤液.取容量瓶,定容后,取20 mL溶液,按1∶5稀释后取1 mL加入试管中,加入0.5 mL 6%苯酚,摇匀,继续加入2.5 mL浓硫酸,摇匀,放置20 min,于490 nm处测定吸光度值.以标准葡萄糖为标品做标准工作曲线,计算得总糖含量.
1.4.5 总酚含量测定
采用Lin等[11]的方法,取200 μL多酚提取液,加蒸馏水至6 mL后摇匀,再分别加入0.5 mL福林酚试剂,摇匀,在1~8 min内加入20%的碳酸钠溶液1.5 mL,加蒸馏水稀释到10 mL,摇匀,最后在40 ℃的水浴锅上保温反应2 h,迅速冷却后,立即在760 nm处测定其吸光度.以没食子酸溶液为标品做标准工作曲线,计算得总酚含量.
1.4.6 花青素含量测定
采用pH示差法[12],分别吸取200 μL多酚提取液于两支试管中,分别用pH=4.5的缓冲液和pH=1.0的缓冲液稀释至10 mL,暗处放置80 min,分别在515 nm和700 nm处测吸光值D.花青素含量w的计算方法如下:
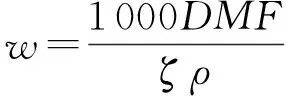
其中:花青素含量的单位为mg/g;D=(D515-D700)pH1.0-(D515-D700)pH4.5;M为矢车菊色素-3-葡萄糖苷的摩尔质量,449.2 g/mol;F为样品体积稀释倍数;ζ为矢车菊色素-3-葡萄糖苷的摩尔消光系数,26 900 L/(mol·cm);ρ为质量浓度,mg/mL.
1.4.7 高效液相色谱法分离鉴定苹果多酚
色谱柱为XBridge C18色谱柱,温度为30 ℃,流动相为0.1% 三氟乙酸水溶液(A)和甲醇(B). 梯度洗脱程序为: 0~5 min,95%A; 5~15 min,95%~80%A;15~35 min,80%~50%A; 35~45 min,50%~30%A; 45~50 min,30%~0% A; 50~60 min,0%~95% A; 60~65 min,95% A.
检测波长为254 nm;流速为1.0 mL/min;进样量为10 μL.
1.4.8 DPPH自由基清除率的测定
采用Hai等[13]的方法,取2 mL多酚提取液,加入2 mL 0.2 mmol/L DPPH自由基溶液,混匀,避光反应30 min后,在517 nm波长处测得吸光值(D样品).用蒸馏水替代样品,测得的吸光值为D0,用乙醇替代DPPH自由基溶液,测得的吸光度值为D对照.DPPH自由基清除率=100[1-(D样品-D对照)/D0] .以Trolox做标准曲线,样品的DPPH值,即每千克样品相当于Torlox的量(mmol/kg).
1.4.9 氧自由基吸收能力的评价
氧自由基吸收能力(ORAC)评价方法参考Lin等[14]的方法.配制pH=7.4 的75 mmol/L NaH2PO4-Na2HPO4缓冲液.用缓冲液配制浓度为39.9 μmol/L的荧光素钠储备液,避光,于4 ℃保藏.用缓冲液稀释荧光素钠储备液,即得使用液(0.159 μmol/L). 用缓冲液配制成38.25 mmol/L的AAPH溶液,每次使用的AAPH溶液均为现配现用,使用前,放置于冰水中.精确称量Trolox,溶于乙醇,配成2 mmol/L溶液,并用缓冲液稀释成不同浓度.样品用二甲基亚砜(DMSO)溶解,以缓冲液稀释样品溶液.预先将酶标仪调温至37 ℃,保持反应体系温度恒定为37 ℃.设定激发波长为485 nm,发射波长为530 nm.在96孔板中,每孔加入25 μL样品溶液或Trolox溶液,或缓冲液(空白对照),然后加入75 μL荧光素钠使用液,将孔板放入酶标仪中,37 ℃孵育10 min.加入100 μL AAPH溶液后,开始计时反应并读数(f0),每1 min读一次数 (f1,f2,…,f70),共读数71次(共计反应70 min),将每次读数连成曲线.每个样品设置3个复孔.Q表示曲线下的面积.
Q=0.5(f0+fn)+(f1+f2+…+fi+…+fn-1),
L=Qs-Qb.
Trolox浓度与L成正比,将样品L代入,换算得到ORAC值,即每千克样品相当于Torlox的量(mmol /kg).
1.4.10 AAPH氧化损伤人血红细胞实验
采用杨兆艳[15]的方法,并加以改进.
(1)氧化损伤模型建立
2%红细胞悬液(PBS):取健康成年人新鲜抗凝血,4 ℃ 2 500 r/min离心10 min,弃上清得红细胞,然后用PBS洗涤红细胞3次(前两次4 ℃ 2 500 r/min 10 min,第3次4 ℃,2 500 r/min,6 min),严格控制洗涤条件,以便得到相同紧密度的红细胞,最后用PBS配制2%红细胞悬液.
各取400 μL 2%红细胞悬液于2 mL离心管中,加入20 μL样品溶剂(PBS),37 ℃预保护30 min,分别加入400 μL浓度为0、50、100、150、200、250、300 和400 mmol/L的AAPH溶液(不加AAPH为空白对照),37 ℃孵育4 h.每30 min取同一管各60 μL,分别用生理盐水和蒸馏水稀释5倍,4 ℃ 2500 r/min离心10 min,取上清液200 μL,412 nm处测吸光值.
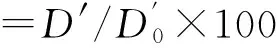
(2)样品对红细胞氧化损伤的预保护
实验分正常组、模型组、样品组和空白组.
样品组:140 μL 2%红细胞悬液中加入7 μL样品,37 ℃预保护30 min,然后加入140 μL终浓度为100 mmol/L(根据损伤模型确定)的AAPH溶液,使得终体积为287 μL,37 ℃反应1 h.
正常组:140 μL 2%红细胞悬液中加入7 μL样品溶剂,37 ℃预保护30 min,然后加入140 μL生理盐水,使得终体积为287 μL,37 ℃反应1 h.
模型组:140 μL 2%红细胞悬液中加入7 μL样品溶剂,37 ℃预保护30 min,然后加入140 μL终浓度为100 mmol/L(根据损伤模型确定)的AAPH溶液,使得终体积为287 μL,37 ℃反应1 h.
空白组:140 μL PBS中加入7 μL样品溶剂,37 ℃预保护30 min,然后加入140 μL生理盐水,使得终体积为287 μL,37 ℃反应1 h.
(3)红细胞溶血率的测定
取反应后的同一管中红细胞反应液各100 μL,分别用生理盐水和蒸馏水稀释5倍,4 ℃ ,2 500 r/min离心10 min,取上清412 nm处测定吸光度.
1.4.11 数据分析
采用SPSS 17.0 软件中的ANOVA方法对数据进行差异显著性检验分析,以P<0.05为差异显著,数据以平均值±标准差的形式来表示.
2 结果与讨论
2.1 高酸苹果基本成分分析
高酸苹果的出汁率、pH、可滴定酸度、总糖含量、总酚含量、花青素含量检测结果见表1.据报道,80%以上品种的苹果可滴定酸含量在0.2%~1.0%之间[16],高酸苹果可滴定酸为(1.31±0.01)%,是澳洲青苹[9](0.8%)的1.64倍,是红富士(0.25%)[9]的5.24倍.高酸苹果果汁的pH值为3.17±0.01,其出汁率较高, 且可滴定酸度高, 适合加工成高品质的浓缩苹果汁.高酸苹果多酚含量和花青素含量高,达到(2 026.88±28.3) mg/kg和(244.92±13.88) mg/kg,预示着其较强的生理活性,且一般认为:酸度高、其干物质含量也高,因而苹果的营养品质也高[17].故该品种的苹果有望开发为兼具营养价值与商业价值的苹果浓缩汁.
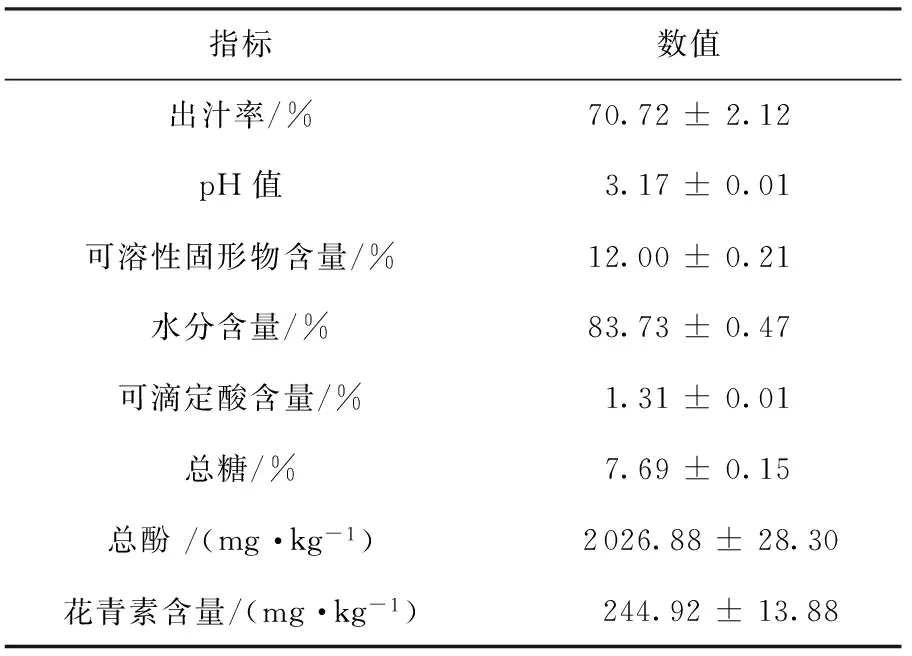
表1 高酸苹果全果基本成分分析
此外,笔者对比研究了其果皮、果肉、果渣、全果的总酚和花青素含量,结果见表2.果汁的总酚含量为(1380 ± 12.32) mg/L,花青素含量为(152.79 ± 1.18) mg/L.可见,果皮中多酚、花青素含量最丰富;多酚、花青素含量从高到低依次是:果皮>果渣>全果>果肉;高酸苹果果汁鲜红透亮,含有较丰富的总酚和花青素.榨汁后,果渣中总酚和花青素含量较高,说明苹果在榨汁的过程中,果汁主要来自于果肉,果皮中仅仅只有少量的多酚进入果汁中,大量的多酚类化合物还残留于果渣中.因此,榨汁后的果渣值得进一步深度开发.
表2 高酸苹果皮、肉、渣、全果总酚和花青素含量1)
Table 2 Total phenolics and anthocyanins contents of peel, flesh, pomace, and whole fruit of high acid apple
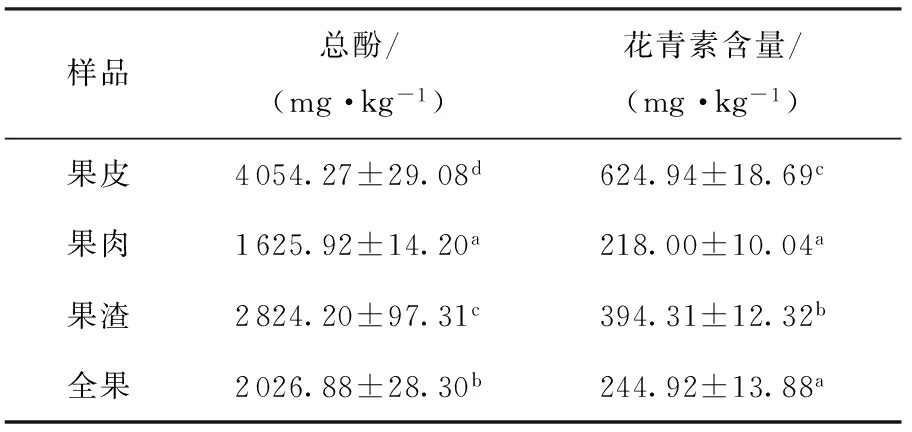
样品总酚/(mg·kg-1)花青素含量/(mg·kg-1)果皮4054.27±29.08d624.94±18.69c果肉1625.92±14.20a218.00±10.04a果渣2824.20±97.31c394.31±12.32b全果2026.88±28.30b244.92±13.88a
1)同列中标注不同角标者具有显著性差异(P<0.05).表5与此同.
2.2 高酸苹果多酚类化合物的分离鉴定
研究显示:苹果中的多酚类化合物主要包括了绿原酸、根皮苷、表儿茶素、阿魏酸、杨梅酮、儿茶素、香草酸、p-香豆酸、芦丁和咖啡酸[18],每种多酚类化合物因其结构不同,所呈现的生理活性不同.而植物多酚因其独特的酚羟基结构,普遍具有抗氧化活性,但因结构差异,抗氧化活性强弱不同.如绿原酸具有抗氧化、抗诱变、抗菌、抗病毒,保肝利胆的生理活性[19];根皮苷具有抗肿瘤活性,对皮肤癌有治疗效果,在治疗糖尿病及其并发症方面有很好的疗效[20].
苹果中多酚的种类和含量会因品种的不同而不同,同一种苹果的不同部位也有差异[10].目前对于高酸苹果多酚组成和含量研究较少.采用高效液相色谱法对高酸苹果(全果、皮、肉、渣、汁)中的多酚类化合物进行研究,实验结果见表3和4.共有10种多酚类化合物被鉴定出来,分别是绿原酸、根皮苷、表儿茶素、阿魏酸、杨梅酮、儿茶素、香草酸、p-香豆酸、芦丁和咖啡酸.高酸苹果富含绿原酸、根皮苷、表儿茶素、儿茶素、香草酸、p-香豆酸和咖啡酸,值得进一步开发利用.
将高效液相色谱法测定得到的多酚类物质含量进行加合得到总酚含量,与前面使用福林酚法测得的总酚含量进行对比,两种方法测定结果存在一定差异.原因可能是,福林酚与酚型氨基酸、抗坏血酸等还原性物质反应,进而使其测得的总酚结果偏高.
2.3 高酸苹果抗氧化、抗溶血活性评价
高酸苹果富含多酚类化合物,一般情况下,多酚含量越高,其抗氧化活性越强.笔者采用DPPH自由基清除法和氧自由基吸收能力法评价了高酸苹果(全果、皮、肉、渣、汁)的抗氧化活性,并构建AAPH损伤人血红细胞氧化模型,对比研究了高酸
表3 高酸苹果皮、肉、渣、全果多酚类化合物组成与含量1)
Table 3 Phenolics profiles of peel, flesh, pomace, and whole fruit of high acid apple

多酚化合物含量/(mg·kg-1)果皮果肉果渣全果绿原酸357.75±10.23a546.30±19.56b413.52±20.1a391.19±18.37a根皮苷348.39±7.98d23.58±1.65a148.86±5.72c57.10±1.85b表儿茶素1834.96±21.78d550.21±11.76a1210.88±18.32c698.82±17.21b阿魏酸6.89±0.21a3.68±0.03a10.39±0.12c3.88±0.11a杨梅酮41.91±1.01d1.42±0.01a14.42±0.05c4.25±0.01b儿茶素1001.90±9.21d399.01±8.24a647.08±7.21c570.30±9.21b香草酸132.81±2.22d7.82±0.18a98.79±0.76c55.68±0.64bp-香豆酸76.99±1.01b38.87±0.65a98.83±1.11c38.75±0.21a芦丁125.25±7.21d3.84±0.11a41.83±0.76c12.75±0.14b咖啡酸104.40±1.23d37.93±0.24a78.35±0.63c42.95±0.35b总酚(HPLC法)4031.261612.662762.931875.67总酚(福林酚法)4054.271625.922824.202026.88
1)同行中标注不同角标者具有显著性差异 (P<0.05).

表4 高酸苹果汁多酚类化合物组成与含量
苹果(全果、皮、肉、渣、汁)的抗溶血活性,结果如表5 所示.果汁的DPPH自由基清除率为(9.75 ± 0.20)μmol/mL,抗溶血活性为(15.58 ± 0.05)μmol/mL,氧自由基吸收能力为(25.34 ± 1.20)μmol/mL.
总的来说, 高酸苹果(全果、皮、肉、渣、汁)均具有一定的抗氧化活性,且具有保护氧化损伤的红细胞能力(抗溶血活性).抗氧化和抗溶血活性从高到低依次为:果皮>果渣>全果>果肉.
表5 高酸苹果皮、肉、渣、全果抗氧化和抗溶血活性
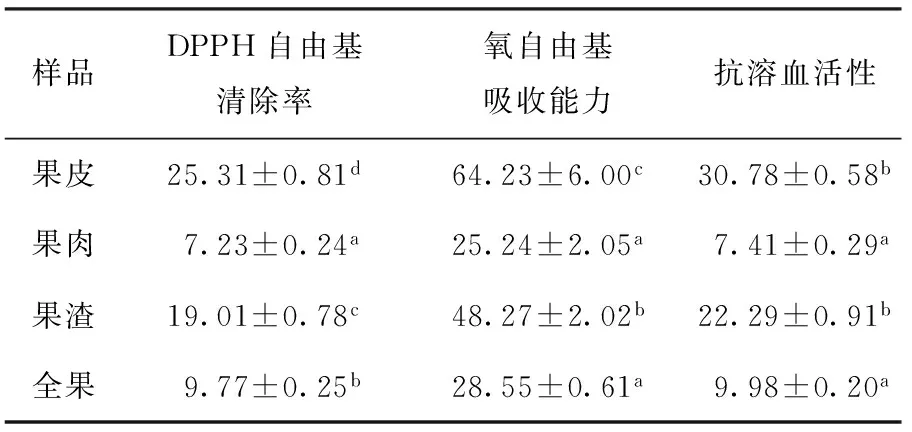
Table 5 Antioxidant and anti-hemolysis activities of peel, flesh,pomace, and whole fruit of high acid apple mmol/kg
具体说来,果皮抗氧化活性最好.果皮的DPPH自由清除能力是全果的2.6倍,是果肉的3.5倍;果皮的氧自由基吸收能力是全果的2.25倍,是果肉的2.54倍;果皮的抗溶血活性是全果的3.08倍,是果肉的4.15倍.此外,果汁也具有较强的抗氧化活性.
苹果的抗氧化活性与其中多酚含量呈正相关,即,多酚含量越高,其抗氧化活性越强.果皮中多酚类化合物最高,因此它呈现出最强的抗氧化活性.榨汁过程中,果肉中的多酚物质进入果汁,大量多酚还残留在果渣中,所以果渣的抗氧化活性也很强.
3 结论
(1)“洪勋1号(红肉)”高酸苹果出汁率高,pH值低,可滴定酸含量高,适合加工成高品质的浓缩果汁.
(2)高酸苹果的总酚和花青素含量较高,尤其以果皮含量为最高.总酚和花青素含量依次为:果皮>果渣>全果>果肉;果汁中总酚含量为(1 380±12.32)mg/L,花青素含量为(152.79± 1.18)mg/L.高酸苹果富含绿原酸((391.19 ±18.37 )mg/kg)、表儿茶素((698.82±17.21)mg/kg)和儿茶素((570.30±9.21)mg/kg) .
(3)高酸苹果(全果、皮、肉、渣、汁)均具有一定的抗氧化和抗溶血活性,且以果皮活性为最强, 抗氧化和抗溶血活性依次为:果皮>果渣>全果>果肉.
(4)“洪勋1号(红肉)”高酸苹果适合加工成为兼具营养价值和商业价值的优质浓缩果汁,且榨汁剩余的果渣中多酚含量较高,抗氧化活性较强,值得进一步开发利用.
[1] SHOJAOSADATI S A, BABAEIPOUR V. Citric acid production from apple pomace in multi- layer packed bed so-lid- state bioreactor [J]. Process Biochemistry, 2002, 37(8):909- 914.
[2] AUGUSTIN Scalbert,GARY Williamson. Dietary intake and bioavailability of polyphenols [M].Washington:Ameri-can Society for Nutritional Science,2000:2073- 2083.
[3] 唐传核,彭志英.苹果多酚的开发及应用 [J]. 中国食品添加剂,2001,12(2):41- 45. TANG Chuan- he,PENG Zhi- ying. Development and app-lication of apple polyphenols [J]. China Food Additives, 2001,12(2):41- 45.
[4] HYSON D A. A comprehensive review of apples and apple components and their relationship to human health [J]. Advanced Nutrition, 2011, 32(2):408- 420.
[5] BIEDRZYCKA E, AMAROWICZ R. Diet and health:apple polyphenols as antioxidants [J]. Food Reviews International, 2008,24(2):235- 251.
[6] CHANWITHEESUK A,TEERAWUTGULRAG A, KILBURN J D, et al. Antimicrobial gallic acid fromCaesalpiniamimosoidesLamk [J]. Food Chemistry, 2007,100(3):1044- 1048.
[7] SHAO J W,DAI Y C,XUE J P,et al. In vitro and in vivo anticancer activity evaluation of ursolic acid derivatives [J]. European journal of Medicinal Chemistry,2011,46(7):2652- 2661.
[8] WEICHSELBAUM E,WYNESS L,STANNER S. Apple polyphenols and cardiovascular disease—a review of the evidence [J].Nutrition Bulletin,2010,35(2):92- 101.
[9] 陈颖. 澳洲青苹加工品质测定及感官评价 [J]. 饮料工业,2010,13(7):21- 23. CHEN Ying. Measurement and sensory evaluation of Granny Smith apples processing quality [J]. Beverage Industry,2010,13(7):21- 23.
[10] PODESEDEK A,WILSKA- JESZKA J,ANDERS B,et al. Compositional characterization of some apple varieties [J].Eur Food Res Technol,2000,210(3):268- 272.
[11] LIN Lianzhu,ZHAO Haifeng,DONG Yi,et al. Macroporous resin purification behavior of phenolics and rosmarinic acid from Rabdosia serra (MAXIM.) HARA leaf [J].Food Chemistry,2012,130(2):417- 424.
[12] SHANTHY Sundaram,SHADMA Anjum,PRIYANKA Dwivedi,et al. Antioxidant activity and protective effect of banana peel against oxidative hemolysis of human erythrocyte at different stages of ripening [J].Applied Biochemistry and Biotechnology,2011,164(7):1192- 1206.
[13] 海金萍,赵谋明,林恋竹,等.三华李叶抗氧化活性物质的分离鉴定 [J].现代食品科技,2015,31(12):106- 110. HAI Jin- ping,ZHAO Mou- ming,LIN Lian- zhu,et al. Isolation and identification of plum leaf antioxidant active substances [J].Modern Food Science and Technology,2015,31(12):106- 110.
[14] 林恋竹,焦铭.光果甘草叶中性多糖结构表征及抗氧化活性研究 [J].现代食品科技,2016,32(1):106- 110. LIN Lian- zhu,JIAO Ming.Antioxidant activity study ofGlycyrrhizaglabraleaves and neutral polysaccharide structure characterization [J].Modern Food Science and Technology,2016,32(1):106- 110.
[15] 杨兆艳. pH示差法测定桑椹红色素中花青素含量的研究 [J].食品科技,2007,15(4):201- 203. YANG Zhao- yan. Research on determination of anthocyanin content of mulberry red pigmen with pH differential method [J].Food Science and Technology,2007,15(4):201- 203.
[16] 陆秋农,贾定贤. 中国果树志·苹果卷 [M].北京:中国农业科技出版社,中国林业出版社,1999:208- 510.
[17] 陆辉山,应义斌,傅霞萍,等.新鲜苹果汁可溶性固形物含量的傅里叶变换近红外光谱检测 [J].光谱学与光谱分析,2007,21(3):494- 498. LU Hui- shan,Ying Yi- bin,Fu Xia- ping,et al. Near infrared spectrum detection of fresh apple juice soluble solids content of Fourier transform [J].Spectroscopy and Spectral Analysis,2007,21(3):494- 498.
[18] 张泽生,史珅,张颖,等.苹果多酚的研究进展 [J].食品研究与开发,2011,32(5):174- 178. ZHANG Ze- sheng,Shi Kun,Zhang Ying,et al. Progress of apple polyphenols [J].Food Research and Development,2011,32(5):174- 178.
[19] 刘颖,郭明晔,白根本. 绿原酸的研究进展 [J].中药材,2012,35(7):1180- 1185. LIU Ying,GUO Ming- ye,BAI Gen- ben. Progress of chlorogenic acid [J].Chinese Herbal Medicine,2012,35(7):1180- 1185.
[20] 董华强,宁正祥.根皮苷与糖尿病防治 [J].食品科技,2006,39(12):192- 194. DONG Hua- qiang,Ning Zheng- xiang. Phlorizin and prevention and treatment of diabetes [J].Food Science and Technology,2006,39(12):192- 194.
Investigation into Identification, Antioxidant Activity and Anti-Hemolysis Activity of Phenolics Compounds in High Acid Apple
SUNWei-zhengYANGKunLINLian-zhuZOUYingZHAOMou-ming
(School of Food Science and Engineering, South China University of Technology, Guangzhou 510640, Guangdong, China)
The composition of a kind of high acid apple from Xinjiang, China, namely Hongxun Ⅰ (red flesh), was determined, finding that the high acid apple is of a titratable acidity of 1.31%, a total phenolics and anthocyanins content in an order of peel>pomace>whole fruit (with a total phenolics content of (2 026.88±28.30)mg/kg and a total anthocyanins content of (244.92±13.88)mg/kg)>flesh. Then, ten phenolic compounds including chlorogenic acid, phlorizin, epicatechin, ferulic acid, myricetin, catechins, vanillic acid,p-coumaric acid, rutin and caffeic acid were indentified by means of high-performance liquid chromatography, finding that the high acid apple is rich in chlorogenic acid ((391.19±18.37)mg/kg),epicatechin ((698.82±17.21)mg/kg) and catechins ((570.30±9.21)mg/kg). Moreover, the antioxidant and anti-hemolysis activities of the high acid apple were determined by means of DPPH radical scavenging activity assay, oxygen radical absorption capacity assay and AAPH-induced oxidative damage human erythrocytes model, finding that the peel, flesh, pomace and whole fruit of the high acid apple all exhibit excellent antioxidant activity and that the anti-hemolysis activities are indicative of the following order:peel>pomace>whole fruit>flesh. All these above-mentioned statements indicate that, as a valuable product, high acid apple is worth processing and developing.
high acid apple; antioxidant activity; anti-hemolysis activity; phenolics
2016- 05- 05
广东省自然科学基金博士启动基金资助项目(2015A030310494);广东“特支计划”科技创新青年拔尖人才项目(2014TQ01N538) Foundation items: Supported by the Dr. Start-up Fund Projects of the Natural Science Foundation of Guangdong Province (2015A030310494) and the Special Support Project of Guangdong Province for Science and Technology Innovative Young Talents (2014TQ01N538 )
孙为正(1983-),男,博士,教授,主要从事食品蛋白质与营养研究. E-mail:fewzhsun@scut.edu.cn
†通信作者: 赵谋明(1964-),男,博士,教授,主要从事食品生物技术研究. E-mail:femmzhao@scut.edu.cn
1000- 565X(2017)03- 0146- 07
TS 201
10.3969/j.issn.1000-565X.2017.03.021

