芍药汤对实验性结肠炎小鼠Notch信号通路的影响*
迟宏罡,于丰彦,张轶,邹颖**
(1.广东医科大学第二临床医学院中医学教研室东莞523808;2.广东医科大学第二临床医学院内科学教研室东莞523808)
芍药汤对实验性结肠炎小鼠Notch信号通路的影响*
迟宏罡1,于丰彦2,张轶1,邹颖1**
(1.广东医科大学第二临床医学院中医学教研室东莞523808;2.广东医科大学第二临床医学院内科学教研室东莞523808)
目的:研究芍药汤对葡聚糖硫酸钠(Dextran Sulfate Sodium,DSS)诱导的结肠炎小鼠Notch信号通路的影响,探讨其治疗结肠炎的疗效和机制。方法:实验设正常对照组、DSS组、DSS+芍药汤组(17.8 g·kg-1),n= 10;3.5%DSS自由饮用7天制成结肠炎小鼠模型后第2天进行治疗,连续7天。记录小鼠的疾病活动指数(Disease Activity Index,DAI)评分,HE染色观察病理改变并评分,检测结肠髓过氧化物酶(Myeloperoxidase,MPO)活性,ELISA法检测肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)和白介素-6(Interleukin-6,IL-6)浓度,Real-time PCR法和免疫组化法检测Notch-1、Hes-1、Math-1和黏蛋白2(Mucins-2,Muc-2)的表达。结果:与模型组比较,芍药汤能有效降低结肠炎小鼠DAI评分、结肠组织病理学评分和MPO活性,增加结肠长度,抑制IL-6和TNF-α的表达,抑制Notch-1和Hes-1 mRNA及蛋白表达,促进Math-1和Muc-2 mRNA及蛋白表达。结论:芍药汤能够对DSS诱导的结肠炎小鼠模型起到保护作用,其作用机制可能与调控Notch信号通路有关。
炎症性肠病芍药汤Notch信号通路肠道黏膜屏障葡聚糖硫酸钠
炎症性肠病(Inflammatory Bowel Disease,IBD)是一种较为常见的慢性反复发作的肠道炎症性疾病,包括溃疡性结肠炎(Ulcerative Colitis,UC)和克隆恩病(CrohnƳs Disease,CD)两种类型[1]。近年来,IBD的发病率和患病率在我国有逐年增高的趋势,由于该病的病因及发病机制复杂,具有病程缠绵、治愈难度大且容易复发的特点,已被WHO列为现代难治病之一。研究表明,肠道上皮细胞的增殖和分化在结肠上皮黏膜的维护和修复方面发挥非常重要的作用,Notch信号通路是肠道上皮细胞的自我更新和向不同谱系的细胞分化的重要调节通路,在维持肠道黏膜稳态中起关键的作用[2]。芍药汤出自《素问病机气宜保命集》,具有清热燥湿、调气和血的功效,临床和实验研究表明芍药汤治疗IBD具有较好的疗效[3,4],但其治疗IBD的机制尚未明确。本实验采用葡聚糖硫酸钠(Dextran Sulfate Sodi⁃um,DSS)诱导小鼠结肠炎模型,探讨芍药汤对结肠炎的治疗作用,并研究其对Notch信号通路的用,旨在深入研究芍药汤治疗IBD的疗效和分子机制,为该方的临床应用提供理论和实验依据。
1 仪器与试药
1.1 仪器与试剂
DSS(美国MP Biomedicals公司,批号:160110);髓过氧化物酶(Myeloperoxidase,MPO)活性检测试剂盒(南京建成生物工程研究所,批号:20150718);小鼠TNF-α和IL-6 ELISA检测试剂盒(欣博盛生物有限公司批号:M160913-102a,M160913-004a,);Trizol(美国Invitrogen公司,批号:108302)、RNase inhibitor、RT(逆转录)试剂盒(美国Thermo公司,批号:00145206);兔多克隆抗体Notch-1、Hes-1、Math-1和黏蛋白2(Muc-2)Muc-2(北京博奥森生物技术有限公司,批号:AD082520、AE011537、AD01206618、AA10236618);Biotek synergy 2多功能酶标仪(美国Bio-rad公司);ABI 7500实时荧光定量PCR(美国ABI公司)。
1.2 药物
芍药汤方:芍药30 g,黄芩、黄连、当归各15 g,大黄9 g,木香、槟榔、炙甘草各6 g,肉桂5 g,以上药物购自东莞市同仁堂药店(批号:20150166)。采用传统水煎方法,共煎煮两次,第一次煎煮加入药量10倍的水,侵泡30 min,煎煮1.5 h,纱布过滤,第二次煎煮将药物残渣加入6-8倍的水,煎煮1 h,将两次药液合并过滤后,水浴蒸发为浓度为1 g⋅mL-1的生药,高温灭菌后于4℃保存备用。
1.3 实验动物
30只C57BL/6小鼠,SPF级,(雌性,7-8周,体重18-20 g),购自广东省医学实验动物中心,合格证编号:SCXK(粤)2013-0002。动物饲养环境:室温为(18-25℃),湿度为(60%-70%),正常更替光照,24 h供应饲料及饮用水。
2 实验方法
2.1 造模
按照参考文献[5]的方法制备急性结肠炎小鼠模型,在饮用水中加入DSS粉末,制成3.5%DSS溶液给小鼠自由饮用,连续7天,制成结肠炎模型。
2.2 动物分组及给药
实验随机分为正常对照组、DSS组、DSS+芍药汤组。其中,芍药汤组给药量为17.8 g·kg-1(此为前期研究确定的最佳剂量),其余两组灌服相同剂量的纯净水,造模结束后第2天用芍药汤进行药物干预,每天1次,连续给药7天。
2.3 疾病活动指数(Disease Action Index,DAI)评分及结肠长度测量
实验期间观察并记录小鼠体重、大便性状和血便情况,DAI=体重下降百分比+大便性状分数+血便分数;参照文献[6]DAI评分标准,体重分数:(0=体重无下降;1=1%-5%;2=5%-10%;3=10%-15%;4=>15%);大便性状:(0=正常;2=粪便软条状;4=稀便);血便:(0=大便阴血阴性;2=大便潜血;4=肉眼血便)。同时,实验结束后,处死小鼠,分离阑尾至肛门之间的肠道,测量盲肠和近端直肠之间的距离。
2.4 结肠组织H&E染色及病理学评分
在10%福尔马林中固定24 h以上的结肠组织,经脱水、包埋后放在切片机上切片,厚度5 μm,苏木精-伊红(Hematoxylin Eosin,HE)染色,显微镜下观察组织病理切片形态学变化及评分,参照文献[7]的评分标准:(0分:未见明显病理改变;1分:10%高倍视野中,呈低水平淋巴细胞浸润,肠绒毛结构没有破坏;2分:10%-25%高倍视野中,呈中等水平淋巴细胞浸润,肠隐窝加深,肠壁增厚但未侵及肌层,未见溃疡;3分:25%-50%高倍视野中,呈高水平淋巴细胞浸润,血管增生,肠壁增厚并且侵及肌层,未见溃疡;4分:明显淋巴细胞浸润,血管增生伴肠隐窝加深变形,肠壁增厚且侵及肌层,见溃疡)。
2.5 MPO活性检测
MPO是一种主要表达于中性粒细胞内的过氧化物酶,在急性炎症时大量的聚集,因此,MPO活性是肠道急性炎症反应的一个重要指标。参照MPO活性检测试剂盒说明书进行操作。
2.6 ELISA实验
细胞因子在IBD的发病中起重要作用,其中最具有代表性的促炎因子是TNF-α,是目前治疗IBD的关键靶点之一。其次,促炎因子IL-6的含量也在很大程度上反映了炎症的轻重程度。因此,本实验应用ELI⁃SA方法检测小鼠结肠组织TNF-α和IL-6的浓度,方法按照ELISA试剂盒说明书进行操作。
2.7 Real-time PCR实验
Trizol试剂提取小鼠结肠总RNA,按照试剂盒的说明书进行逆转录为cDNA,各引物序列如下:Notch-1:Forward ACA TCC GTG GCT CCA TTG TCT A,Re⁃verse TCT TGT AAG GAA TAT TGA GGC TGC;Hes-1:Forward AAA ATT CCT CCT CCC CGG TG,Reverse TTT GGT TTG TCC GGT GTC G;Math-1:Forward AAA GGA GGC TGG CAG CAA,Reverse TGG TTC AGC CCG TGC AT;Muc-2:Forward GCT GAC GAG TGG TTG GTG AAT G,Reverse GAT GAG GTG GCA GAC AGG AGA C。在ABI 7 500荧光定量PCR仪上进行反应,以GAPDH基因为内参,实时荧光定量PCR数据结果采用2-ΔΔCt分析法。
2.8 免疫组化
取结肠组织先用10%福尔马林固定,然后经脱水、包埋、浸透和聚合后,将组织块放在切片机上连续切片,厚度为5 μm。采用SP法测定小鼠结肠组织Notch-1、Hes-1、Math-1和Muc-2表达情况,具体方法参照免疫组化检测试剂盒。

图1 芍药汤对结肠炎小鼠DAI评分的影响
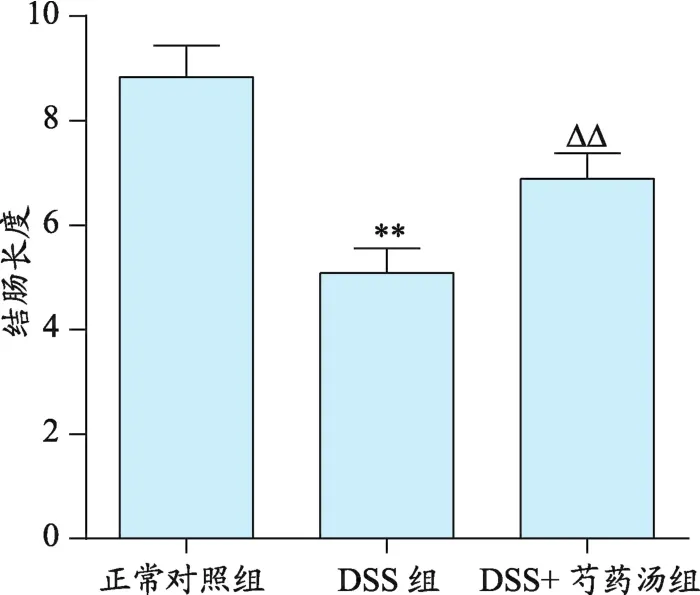
图2 芍药汤对结肠炎小鼠结肠长度的影响

图3 芍药汤对结肠炎小鼠结肠组织MPO活性的影响
2.9 统计学方法
用SPSS 16.0统计软件进行数据处理,计量资料用均数标准差()表示。多组间比较采用单向方差分析(One-way ANOVA),先对数据进行方差齐性检验,方差齐时多重比较采用LSD方法检验,如方差不齐时采用近似F检验Welch法进行方差分析,多重比较采用DunnettƳs T3方法检验,P<0.05为差异有统计学意义。
3 结果
3.1 芍药汤对结肠炎小鼠DAI评分的影响
由图1可见,正常对照组小鼠体重持续增长,大便正常;DSS组小鼠在造模第3天起体重明显减轻,肛周出现明显血便,DAI指数显著升高,伴活动减少,毛发色泽变差,与正常对照组比较差异有统计学意义(P< 0.001)。芍药汤治疗组小鼠治疗后第3天起体重开始逐渐回升,DAI指数显著低于DSS组,大便逐渐成型,与DSS组比较差异有统计学意义(P<0.05)。
3.2 芍药汤对结肠炎小鼠结肠长度的影响
由图2可见,结肠长度缩短可以作为反映肠道炎症严重程度的一项指标,DSS造模后小鼠结肠长度显著缩短,与正常对照组比较差异有统计学意义(P< 0.001);芍药汤治疗组小鼠与DSS组小鼠比较结肠长度增加,两组比较差异有统计学意义(P<0.001),结果表明芍药汤对DSS诱导的结肠炎小鼠结肠缩短有改善作用。
3.3 芍药汤对结肠炎小鼠结肠组织MPO活性的影响
由图3可见,DSS组小鼠肠道MPO活性显著升高,与正常对照组比较差异有统计学意义(P<0.001);而芍药汤治疗组小鼠结肠中MPO活性与DSS组比较则显著降低,差异有统计学意义(P<0.001),说明芍药汤可抑制肠道急性炎症。
3.4 芍药汤对结肠炎小鼠结肠组织H&E染色病理学评分的影响
由图4、图5可见,正常对照组小鼠结肠上皮完整,结构清晰,固有层有少量淋巴细胞,杯状细胞丰富,腺管结构正常。DSS结肠炎组小鼠结肠上皮大量破损,脱落,杯状细胞缺失,可见大量炎性细胞浸润;结肠可见溃疡,腺管破坏,隐窝脓肿,组织学评分与正常对照组比较,其差异有统计学意义(P<0.001);经芍药汤治疗后,小鼠肠道组织学损伤得到显著缓解,组织学评分与DSS组比较,其差异有统计学意义(P<0.001)。
3.5 芍药汤对结肠炎小鼠结肠组织TNF-α和IL-6的影响

图4 各组小鼠结肠组织H&E染色(×200)
由图6可见,与正常对照组比较,DSS组小鼠结肠组织TNF-α和IL-6的含量显著增高,两组比较差异有统计学意义(P<0.001)。芍药汤治疗后,TNF-α和IL-6的表达降低,与DSS组比较差异有统计学意义。说明芍药汤能够有效的抑制结肠炎发病过程中促炎因子TNF-α和IL-6的分泌,具有一定的抗炎作用。
3.6 芍药汤对结肠炎小鼠结肠组织Notch-1、Hes-1、Math-1和Muc-2 mRNA表达的影响
由图7可见,与正常对照组比较,DSS组Notch-1和Hes-1 mRNA表达显著增强,而Math-1和Muc-2 mRNA表达显著降低,两组比较差异均有统计学意义(P<0.001);经芍药汤治疗后,治疗组中Notch-1和Hes-1 mRNA表达显著降低,而Math-1和Muc-2 mRNA表达则明显增强,与DSS组比较差异均有统计学意义(P<0.05)。
3.7 芍药汤对结肠炎小鼠结肠组织Notch-1、Hes-1、Math-1和Muc-2蛋白表达的影响

图5 芍药汤对结肠炎小鼠结肠组织病理学评分的影响
由图8、图9可见,与正常对照组比较,DSS组Notch-1和Hes-1的蛋白表达显著增强,而Math-1和 Muc-2蛋白表达显著降低,两组比较差异均有统计学意义(P<0.001);经芍药汤治疗后,治疗组中Notch-1和Hes-1蛋白表达水平显著降低,而Math-1和Muc-2蛋白水平表达则明显增强,与DSS组比较差异均有统计学意义(P<0.05)。

图6 芍药汤对结肠炎小鼠结肠组织TNF-α和IL-6的影响

图7 芍药汤对结肠炎小鼠结肠组织Notch-1、Hes-1、Math-1和Muc-2 mRNA表达的影响

图8 各组小鼠结肠组织Notch-1、Hes-1、Math-1和Muc-2免疫组化结果(×200)
4 讨论

图9 芍药汤对结肠炎小鼠结肠组织Notch-1、Hes-1、Math-1和Muc-2蛋白表达影响
目前,临床常用于治疗IBD的药物主要有氨基水杨酸类药物、糖皮质激素、免疫抑制剂、炎性介质抑制剂和抗生素等[8],虽然这些药物可缓解IBD患者的临床症状,但仍存在很多局限性和副作用,不适于长期应用。中医药治疗IBD具有较好的优势,其特点是多途径、多层次、多靶点并且可以长期维持用药治疗,毒副作用较少。因此,进行结肠炎中药开发及研究有效验方的治疗机制具有非常重要的意义。IBD属于中医的“肠澼”、“久痢”和“休息痢”等疾病的范畴,病位在大肠,涉及了脾、肝、肾、肺等多个脏腑,其诱因主要是饮食失调,病机是脾失健运,湿热蕴结肠腑、气滞血瘀。因此,在治疗上应以清热燥湿,调和气血为主。芍药汤中黄芩、黄连性味苦寒,入大肠经,可清热燥湿,解毒泻火,祛除病因,二药共为君药;重用白芍养血和营、缓急止痛,当归养血活血,木香、槟榔行气导滞,四药相配,调气和血,共为臣药;大黄苦寒沉降,泻热通便,以少量肉桂防苦寒伤中,二药共为佐药;甘草调和诸药,与芍药相配可缓急止痛,为佐使。诸药合用,清热燥湿解毒,调气和血,下痢可愈,且可到促进肠道溃疡愈合的作用。临床和实验研究均证实芍药汤对活动期结肠炎具有较好的治疗作用,但是其机制尚未明确[9,10]。本研究观察了芍药汤对DSS诱导的结肠炎小鼠的保护作用,并从Notch信号通路探讨了芍药汤治疗结肠炎的作用机制。我们的研究结果证实芍药汤能够有效的抑制DSS诱导的结肠炎小鼠的肠道炎症反应,并能抑制Notch信号通路中Notch-1和Hes-1的表达,促进Math-1和Muc-2的表达,其治疗结肠炎的机制可能与对Notch信号通路的调控有关。
DSS诱导的实验性结肠炎是目前最常用的IBD的动物模型,其病理表现与人类的结肠炎非常相似,DSS对结肠黏膜上皮有直接毒性作用并能够激发炎症,临床症状表现主要有明显的体重减轻、腹痛腹泻、血便等,结肠组织病理学分析可见广泛的隐窝和上皮细胞损伤、中性粒细胞和巨噬细胞浸润、组织水肿等组织学改变[11]。本实验使用3.5%DSS造模,从造模第3天起,小鼠逐渐出现体重下降,稀水样便及肉眼血便,DAI评分、MPO指数、组织病理学观察和评分及炎症因子TNF-α和IL-6均较正常组小鼠显著升高,且可见结肠严重缩短。芍药汤治疗能够显著增加结肠炎小鼠的体重和结肠的长度,缓解腹泻和血便等临床症状,并且能够降低MPO的活性和组织病理学评分,对炎症因子TNF-α和IL-6均具有较好的抑制作用,表明芍药汤能缓解结肠炎的症状,抑制肠道过度的炎症反应,进一步证实了芍药汤对活动期结肠炎具有较好的疗效。
肠黏膜屏障功能障碍在IBD的发病机制中起非常关键的作用,结肠上皮黏膜的持续性损伤是其主要病理改变,而肠道上皮细胞的增殖和分化在结肠上皮黏膜的维护和修复方面发挥重要的作用。近年来研究发现Notch信号通路可调控黏膜上皮细胞的增殖分化程序,对维持肠道未分化隐窝祖细胞的增殖和决定隐窝祖细胞的命运起重要作用[12]。Notch信号通路由Notch受体、Notch配体和DNA结合蛋白组成,可通过促进肠上皮细胞向吸收细胞转换,减少分泌细胞特别是杯状细胞的数量[13],而在用γ-分泌酶抑制剂阻断Notch信号或敲除Notch信号的靶基因Hes-1后,可导致小鼠肠道肠内杯状细胞增加[14]。杯状细胞作为肠道上皮细胞中的分泌型细胞,其分泌的MUC、肠三叶因子(ITF)和抵抗素样分子β(RELMβ)等成分构成肠道表面覆盖的一层保护性黏液屏障,在肠道和上皮之间起着重要的防御作用,可使上皮细胞免受肠道内微生物的侵害[15]。杯状细胞的分化与Hes-1基因和Math1基因的表达关系非常密切,Hes-1是由Notch信号诱导的基本的碱性螺旋-环-螺旋(bHLH)转录抑制物,而鼠源Math-1蛋白是bHLH转录因子,可诱导MUC-2的表达,但受到Hes-1的抑制。本研究结果表明,芍药汤能够调控DSS诱导的结肠炎小鼠模型Notch信号通路,可以抑制Notch-1的过度活化,抑制Notch信号通路靶基因Hes-1的表达,同时促进Math-1蛋白的表达,从而调节Hes-1和Math-1之间的平衡,进一步增加MUC-2的表达,进而促进肠道黏膜屏障的再生,发挥对IBD的治疗作用。
综上所述,本研究结果证实芍药汤能有效缓解DSS诱导的结肠炎小鼠肠道的炎症反应,其作用机制可能与Notch信号通路有关。
1De Paula-Silva M,Barrios B E,Maccio-Maretto L,et al.Role of the pro⁃tein annexin A1 on the efficacy of anti-TNF treatment in a murine mod⁃el of acute colitis.Biochem Pharmacol,2016,115:104-113.
2Imaeda H,Andoh A,Aomatsu T,et al.Interleukin-33 suppresses Notch ligand expression and prevents goblet cell depletion in dextran sulfate sodium-induced colitis.Int J Mol Med,2011,28(4):573-578.
3陈利坚,叶斌.加味芍药汤联合美沙拉嗪治疗溃疡性结肠炎的疗效及对患者血清炎症因子的影响.中华中医药学刊,2014,32(5):1042-1043.
4罗敏,李帅军,胡响当,等.芍药汤对胃肠湿热型溃疡性结肠炎大鼠结肠黏膜核因子-κB DNA结合活性的影响.中国医药导报,2015,12 (3):4-6,169.
5Utrilla M P,Peinado M J,Ruiz R,et al.Pea(Pisum sativum L.)seed al⁃bumin extracts show anti-inflammatory effect in the DSS model of mouse colitis.Mol Nutr Food Res,2015,59(4):807-819.
6Wu X,Dou Y,Yang Y,et al.Arctigenin exerts anti-colitis efficacy through inhibiting the differentiation of Th1 and Th17 cells via an mTORC1-dependent pathway.Biochem Pharmacol,2015,96(4):323-336.
7Neurath M F,Fuss I,Kelsall B L,et al.Antibodies to interleukin 12 ab⁃rogate established experimental colitis in mice.J Exp Med,1995,182 (5):1281-1290.
8Roda G,Caponi A,Benevento M,et al.New proteomic approaches for biomarker discovery in inflammatory bowel disease.Inflamm Bowel Dis, 2010,16(7):1239-1246.
9周萍,曾志华,管江.芍药汤加减结合针刺治疗溃疡性结肠炎湿热蕴结证活动期临床研究.中成药,2016,38(7):1477-1480.
10罗敏,吴强,朱蓉,等.芍药汤对胃肠湿热型溃疡性结肠炎大鼠Th17相关细胞因子的影响.中国医药导报,2016,13(13):8-11.
11 Xue X,Ramakrishnan S,Anderson E,et al.Endothelial PAS domain protein 1 activates the inflammatory response in the intestinal epitheli⁃um to promote colitis in mice.Gastroenterology,2013,145(4):831-841.
12闫曙光,惠毅,李京涛,等.Notch信号通路与溃疡性结肠炎的相关研究进展.重庆医学,2015,44(35):5033-5035.
13 Zecchini V,Domaschenz R,Winton D,et al.Notch signaling regulates the differentiation of post-mitotic intestinal epithelial cells.Genes Dev, 2005,19(14):1686-1691.
14 Van Es J H,Van Gijn M E,Riccio O,et al.Notch/gamma-secretase in⁃hibition turns proliferative cells in intestinal crypts and adenomas into goblet cells.Nature,2005,435(7044):959-963.
15 Pelaseyed T,Bergstrom J H,Gustafsson J K,et al.The mucus and mu⁃cins of the goblet cells and enterocytes provide the first defense line of the gastrointestinal tract and interact with the immune system.Immunol Rev,2014,260(1):8-20.
Effects of Shaoyao Tang on Notch Signaling Pathway among Experimental Colitis in Mice
Chi Honggang1,Yu Fengyan2,Zhang Yi1,Zou Ying1
(1.Department of Traditional Chinese Medicine,The Second Clinical Medical College,Guangdong Medical University,Dongguan 523808,China;2.Department of Internal Medicine,The Second Clinical Medical College,Guangdong Medical University,Dongguan 523808,China)
This study was aimed to examine the effect of Shaoyao Tang(SYT)on the treatment of dextran sulfate sodium (DSS)-induced experimental colitis in mice via targeting the Notch signaling pathway.The mice were equally and randomly divided into the normal control group(control),model group(DSS),DSS+SYT group(17.8 g·kg-1),n=10.Mice were administered with 3.5%DSS for 7 days for the model establishment.And then,SYT was given to the model group on the second day after the induction of colitis with DSS for 7 days.The effects were studied by the disease activity index (DAI),histological analysis by HE staining,myeloperoxidase(MPO)activity.ELISA was used to measure secretion of tumor necrosis factor-α(TNF-α)and interleukin-6(IL-6)in the colon tissues.The expression of mRNA and protein of Notch-1,Hes-1,Math-1 and Mucin-2(Muc-2)were detected using real-time PCR and immunohistochemistry.The results showed that compared with the model group,SYT attenuated symptoms of colitis by decreasing DAI score, histopathologic score and MPO activity,as well as increasing the colon length.SYT treatment also inhibited the production of IL-6 and TNF-α in colon tissues of mice.Furthermore,SYT significantly blocked the expression of mRNA and protein of Notch-1 and Hes-1,but increased the expression of Math-1 and Muc-2.It was concluded that SYT exerted the anti-inflammatory activity in mice model of DSS-induced colitis by inhibiting the Notch signaling pathway.
Inflammatory bowel disease,Shaoyao Tang,Notch signaling pathway,intestinal mucosal barrier,dextran sul⁃fate sodium
10.11842/wst.2017.04.024
R285
A
(责任编辑:陈宁,责任译审:王晶)
2017-02-26
修回日期:2017-03-25
*国家自然科学基金委青年科学基金项目(81603592):黄芩汤调控NLRP6炎症小体对结肠炎肠道黏液屏障功能保护作用的机制研究,负责人:邹颖;广东省中医药局科研项目(20141150):黄芩汤通过Notch与Wnt/β-catenin通路croostalk多靶点调控结肠癌发生发展的机制,负责人:邹颖;东莞市社会科技发展项目(2014108101054):基于Notch/Wnt信号通路探讨黄芩汤干预结肠炎及其癌变的机制研究,负责人:邹颖。
**通讯作者:邹颖,副教授,硕士生导师,主要研究方向:中西医结合防治消化系统疾病研究。

