超表达苹果细胞分裂素响应基因MdCRF6影响花青苷积累和盐胁迫抗性
安建平,宋来庆,赵玲玲,由春香,王小非,郝玉金
超表达苹果细胞分裂素响应基因影响花青苷积累和盐胁迫抗性
安建平1,宋来庆2,赵玲玲2,由春香1,王小非1,郝玉金1
(1山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018;2烟台市农业科学研究院,山东烟台 265599)
【目的】克隆苹果细胞分裂素响应因子基因(cytokinin response factor 6),鉴定其在调节花青苷积累和盐胁迫抗性中的作用,揭示的功能,为研究细胞分裂素信号途径和果树生长发育调控提供理论依据。【方法】以‘嘎啦’苹果(‘Gala’)为研究材料,利用同源序列比对和PCR技术,分离细胞分裂素响应基因。使用MEGA 5.0软件构建苹果MdCRF6与拟南芥CRFs间系统进化树;通过SMART软件和DNAMAN软件分析MdCRF6蛋白的保守结构域。利用实时荧光定量PCR方法检测该基因对细胞分裂素和盐胁迫的响应。通过电泳迁移率试验(EMSA),验证MdCRF6原核表达蛋白对DRE作用元件的绑定。构建植物超表达载体,并通过农杆菌介导的遗传转化获得转苹果愈伤组织。比较野生型和转基因苹果愈伤组织在花青苷积累和盐抗性方面的差异,结合基因表达分析,初步鉴定在调节花青苷积累和盐胁迫方面的生物学功能。【结果】分离得到了苹果细胞分裂素响应因子基因(基因序列号:MDP0000783818),该基因开放阅读框(ORF)为1 047 bp,编码含有348个氨基酸的蛋白。进化树分析和氨基酸序列比对结果表明,苹果MdCRF6蛋白在N端包含保守的CRF结构域,在C端包含保守的AP2/ERF结构域,并且与拟南芥AtCRF6同源性最高。基因表达分析显示该基因具有细胞分裂素和盐胁迫响应,分别在10 μmol·L-1BA和100 mmol·L-1NaCl处理3 h和6 h时表达量最高。EMSA试验结果验证MdCRF6原核表达蛋白能够绑定DRE序列。在苹果愈伤组织中超表达,发现转基因苹果愈伤组织花青苷积累受到抑制,同时苹果愈伤组织的抗盐性降低。基因表达分析显示,显著抑制花青苷合成基因和盐响应相关基因的表达。【结论】苹果MdCRF6与拟南芥AtCRF6具有高度的同源性,其参与植物对细胞分裂素和盐胁迫的响应。在苹果愈伤组织中超量表达抑制其花青苷积累,降低植物抗盐性。推测苹果可能通过结合花青苷合成基因以及抗盐相关基因的启动子,抑制基因的表达,从而负调节花青苷积累和抗盐性。
苹果;;花青苷;盐胁迫
0 引言
【研究意义】苹果()作为一种世界性的水果,具有营养丰富,口感佳以及产量高等特点[1]。苹果的栽培和生长受到多种植物激素的调控。其中,细胞分裂素在调节植物生长发育过程中发挥重要作用[2-3]。CRFs(cytokinin response factors)属于细胞分裂素响应因子,它们在响应细胞分裂素信号,调节叶片发育以及抗逆过程中都发挥着关键作用[4-5]。因此,明确细胞分裂素响应因子的功能对于研究细胞分裂素信号途径和调节果树生长发育具有重要意义。【前人研究进展】细胞分裂素(cytokinin)是植物生长发育所必需的激素之一,在促进植物细胞分裂过程中发挥重要作用[6]。未完全纯化的细胞分裂物质最早由Miller在1961年从玉米中分离。随后,Letham在1963年从未成熟玉米种子中分离并纯化出天然的细胞分裂素-玉米素(ZR)。如今,30多种具有活性的天然细胞分裂素在不同植物中被陆续发现[7]。细胞分裂素在植物中存在着广泛的生物学效应,如诱导芽的分化[8],促进果实和种子发育[9],延缓植物衰老[10],调控非生物胁迫[11],影响花青苷积累[12-13]等。在苹果生产中应用外源植物细胞分裂素可以影响植株成花、坐果和果实发育[14]。此外,在果实膨大期对叶片喷施细胞分裂素可以提高叶片和果实的抗氧化活性,改善果品品质[15-16]。目前,对细胞分裂素的信号响应和转导机制已有了较清晰的认识。研究发现,组氨酸激酶AHKs作为膜受体,能够感受细胞分裂素信号;而组氨酸转移磷酸化蛋白AHPs,通过磷酸化反应,可以将信号传导至细胞核中,进而激活核内的信号响应因子[17-18]。CRFs被证实是一类重要的细胞分裂素响应因子[19-20]。通过对近百种植物的CRFs氨基酸序列进行比对分析,发现CRFs蛋白的N端都含有保守的CRF结构域,在C端都含有保守的AP2/ERF结构域[20]。作为典型的AP2/ERF转录因子,CRFs蛋白能够结合到下游靶基因的GCC(AGCCGCC)或者DRE(〔A/G〕CCGAC)序列,进而调节基因的表达[21]。研究发现拟南芥CRF家族基因参与多种胁迫过程。受冷胁迫诱导并且参与抵抗冷胁迫[22]。在拟南芥中超表达显著提高植株抗病性[23]。响应多种非生物胁迫,并且抑制叶片衰老[24]。受到低磷诱导[25]。此外,Shi等[26]对番茄CRF家族进行了分析,发现核定位的在番茄植物中组成型表达,并且受到多种激素和盐胁迫响应。杨昌[27]也对甘蓝型油菜CRF家族基因进行了初步分析,发现在调节甘蓝型油菜体内磷稳态方面发挥关键作用。【本研究切入点】虽然目前关于细胞分裂素响应基因已有较多研究,但是主要集中在拟南芥、番茄等模式植物。在苹果等多年生木本植物中未见报道。【拟解决的关键问题】在苹果中克隆细胞分裂素响应因子基因,对比分析其与拟南芥AtCRF6的同源性。检测其对细胞分裂素和盐的响应以及作为转录因子对启动子DRE序列的绑定,进而明确其与拟南芥AtCRF6的功能保守性。通过转基因分析初步揭示在调节花青苷积累和盐胁迫过程中的重要作用。
1 材料与方法
试验于2016—2017年在山东农业大学园艺科学与工程学院果树分子生物技术实验室进行。
1.1 试验材料
试验所用到的植物材料有‘嘎啦’(‘Gala’)苹果幼苗、‘王林’(‘Orin’)苹果愈伤组织。对‘嘎啦’苹果幼苗分别用10 μmol∙L-1细胞分裂素(N6-benzyladenine,BA)或100 mmol∙L-1NaCl溶液浇灌处理,间隔时间段取样,液氮速冻后保存备用。
‘王林’苹果愈伤组织用来进行遗传转化。苹果愈伤组织放置在继代培养基(MS培养基+1.5 mg·L-12,4-D+0.5 mg·L-16-BA)室温(24℃)、暗处培养。并且每隔15 d更新继代一次。
1.2 基因克隆与同源性分析
根据在苹果基因组数据库中检索到的序列设计引物(表1),以‘嘎啦’幼苗的cDNA为模板进行PCR扩增。PCR反应程序为:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,32个循环;72℃后延伸5 min。PCR产物用1%琼脂糖凝胶电泳并回收目的条带,连接到克隆载体pMD18-T进行测序。
从拟南芥数据库(http://www.arabidopsis.org/)中检索并下载拟南芥细胞分裂素响应基因(—)的核酸和蛋白序列。通过MEGA 5.0软件构建系统进化树。使用DNAMAN软件进行序列比对。使用SMART软件预测MdCRF6的蛋白结构。
1.3 RNA的提取与实时荧光定量PCR分析
使用天根生化科技有限公司的Plus植物总RNA提取试剂盒(DP437)提取苹果幼苗及愈伤组织的RNA。以提取的RNA为模板,按照Clontech SMARTTMLibrary试剂盒说明书进行反转录,合成cDNA第一链。
以(GenBank accession number:CN938024)为内参基因,使用Ultra SYBR Mixture试剂盒(康为世纪)进行实时荧光定量PCR分析。荧光定量PCR使用的仪器为BIO-RAD IQ5,所有PCR都设3个循环。PCR反应体系:2×UltraSYBR Mixture 10.0 μL,cDNA 1.0 μL,加去离子水至20 μl。PCR反应程序:94℃预变性10 min,94℃变性15 s,56℃退火15 s,65℃延伸15 s,40个循环,每次循环第2步进行荧光采集。最后采用2-△△CT法进行定量数据分析。所用的定量引物见表1。

表1 本研究中所用引物
1.4 原核表达及电泳迁移率试验(EMSA)
构建原核表达载体pGEX-MdCRF6,将连接产物转化大肠杆菌BL21中。加入0.5 mmol·L-1IPTG 6 h后收集菌体,超声波破碎后进行SDS-PAGE检测。诱导获得的活性蛋白GST和GST-MdCRF6用来进行后续试验。
生物素标记的结合探针-GCAAGATTTAACCGA CCCAAACCGAT-和突变探针-GCAAGATTTACCGG AGCCAAACCGAT-由生工生物工程有限公司(上海)合成。使用Lightshift Chemiliminescent EMSA 试剂盒(Thermo,USA)进行电泳迁移率试验。EMSA反应体系:1×binding buffer(2.5%甘油,50 mmol∙L-1KCl,5 mmol∙L-1MgCl3,10 mmol∙L-1EDTA)2 μL,GST蛋白或GST-MdCRF6融合蛋白10 μL,探针1 μL,室温孵育25 min。未标记的探针作为竞争探针。具体方法参照An等[28]。
1.5 超表达载体构建及苹果愈伤组织转化和鉴定
利用引物中引入的H I和I酶切位点,将从pMD18-T载体切除回收。并对pCAMBIA1300进行同样酶切,将两者在16℃连接,转化大肠杆菌,鉴定阳性单菌落。成功构建-pCAMBIA-1300超表达载体。
将-pCAMBIA-1300转化农杆菌LBA4404。取10 d左右生长状态良好的苹果愈伤组织与转化的农杆菌室温孵育20 min。将愈伤组织纱网过滤并吸干表面的菌液,置于继代培养基上培养1—2 d。随后,将苹果愈伤组织转移至筛选培养基(继代培养基+100 mg·L-1潮霉素+500 mg·L-1头孢霉素)。PCR检测得到的阳性转基因愈伤组织,在筛选培养基上继代三代以上,进行后续试验。
1.6 苹果愈伤组织着色试验
选择生长状态一致的野生型(WT)和转基因(-L1和-L2)苹果愈伤组织进行着色试验。将愈伤组织放置到强光(光子通量密度约为100 μmol·s-1·m-2)、低温(13℃)培养箱内进行培养,观察愈伤着色情况。
使用乙醇-HCl法提取苹果愈伤组织的花青苷。使用花青苷提取液(95%无水乙醇+1.5 mol∙L-1HCl)提取苹果愈伤组织内的花青苷。提取过程在暗处进行。使用分光光度计检测吸光度并计算花青苷含量。计算公式:OD=(A530-A620)-0.1×(A650-A620)。
1.7 苹果愈伤组织盐胁迫试验
选择生长状态一致的野生型(WT)和转基因(-L1和-L2)苹果愈伤组织进行盐胁迫试验。将大小一致的愈伤放置到含有不同NaCl浓度的继代培养基上。常温、暗处培养15 d,观察并称量愈伤组织的质量。
1.8 统计学分析
使用R(3.0.2)软件进行统计学分析。所有结果都是基于3个平行试验的平均值。
2 结果
2.1 苹果的克隆及同源性分析
以‘嘎啦’幼苗的cDNA为模板,MdCRF6-F/R为引物进行PCR扩增,获得一条大约1 000 bp的条带(图1)。对克隆得到的片段测序分析,结果表明,该基因片段的开放阅读框(ORF)长度为1 047 bp,编码含有348个氨基酸的蛋白质,命名为(MDP0000783818)。

图1 苹果MdCRF6的RT-PCR扩增产物电泳
将苹果MdCRF6氨基酸序列与拟南芥中12个细胞分裂素响应因子基因(—)的氨基酸序列进行比对并构建进化树(图2)。进化树分析结果表明,苹果MdCRF6与拟南芥AtCRF6亲缘关系最近,同源性最高。
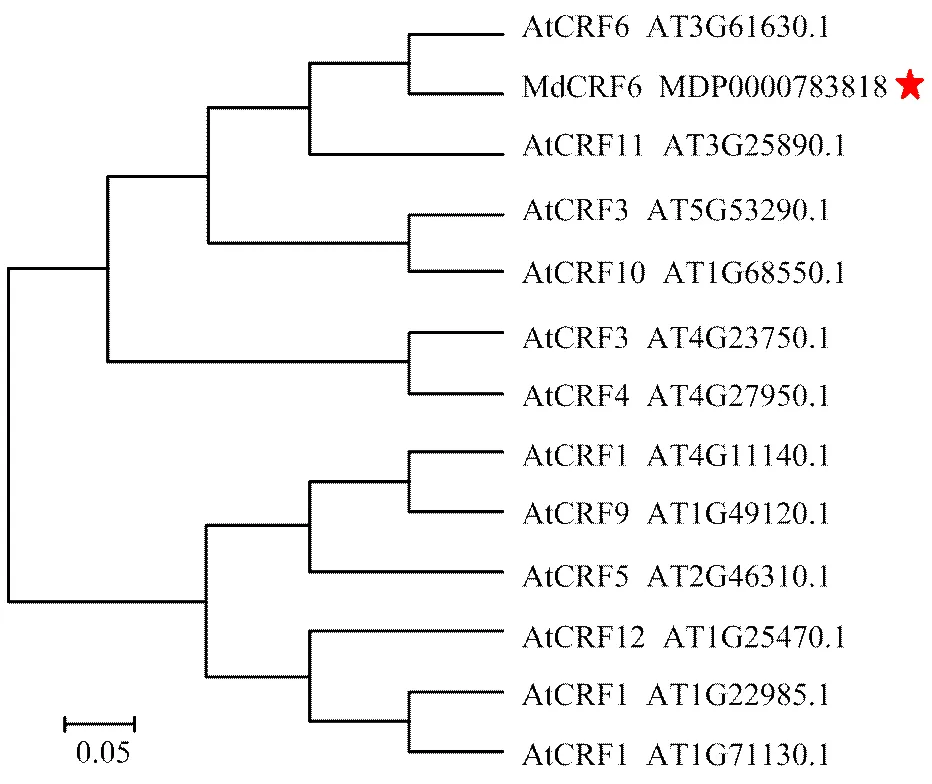
At:拟南芥Arabidopsis thaliana;Md:苹果Malus domestica
对苹果MdCRF6的氨基酸序列进行分析(图3)。结果显示,仅包含一个外显子,无内含子。MdCRF6蛋白在N端包含一个保守的CRF结构域,在C端包含一个保守的AP2/ERF结构域。
2.2 苹果的表达分析
对‘嘎啦’苹果幼苗分别用10 μmol∙L-1细胞分裂素(N6-benzyladenine,BA)或100 mmol∙L-1NaCl溶液浇灌处理,间隔时间段取样(整株)。实时荧光定量PCR分析对细胞分裂素和NaCl的响应。结果表明,在细胞分裂(10 μmol∙L-1BA)和NaCl(100 mmol∙L-1)处理下,表达量明显上调(图4)。

图3 苹果MdCRF6蛋白功能域分析
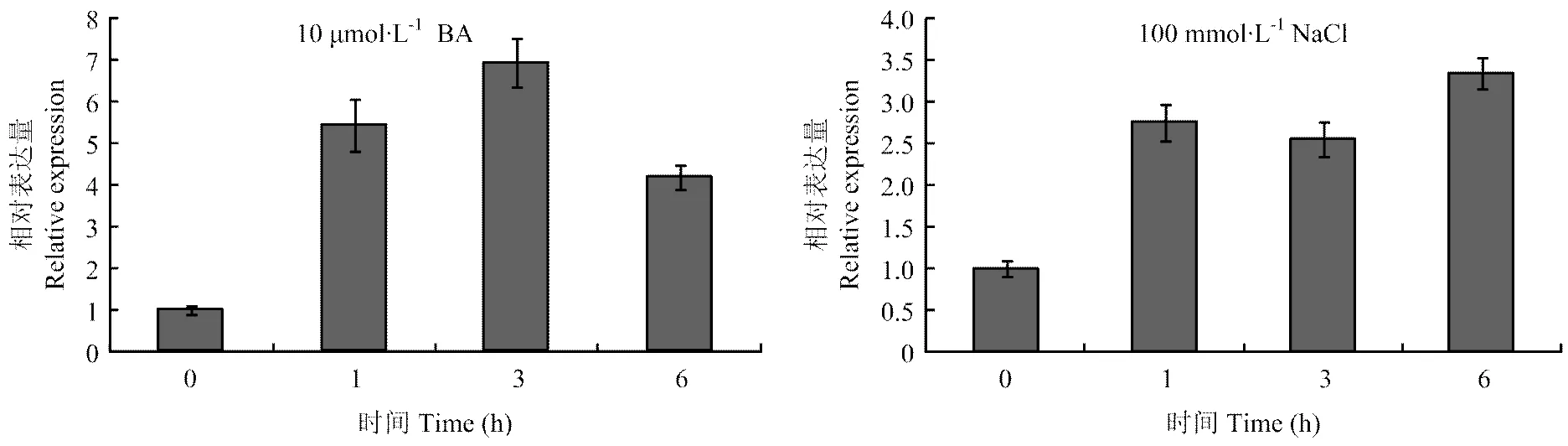
图4 MdCRF6在细胞分裂素和盐胁迫响应中的表达分析
2.3 MdCRF6蛋白绑定DRE序列
通过体外诱导的方式获得GST-MdCRF6的融合蛋白。生物素标记拟南芥ARR6启动子区域含有DRE(ACCGAC)序列的核苷酸序列。EMSA试验结果显示,GST-MdCRF6融合蛋白能够结合到DRE序列。增加未标记的竞争探针,结合条带变弱。将DRE(ACC GAC)序列突变为-CCGGAG-,结合条带消失(图5)。
2.4 载体构建与转基因苹果愈伤组织鉴定
构建超表达载体-pCAMBIA1300(图6),转化农杆菌LBA4404,通过农杆菌介导的遗传转化侵染苹果愈伤组织。实时荧光定量PCR检测转基因株系表达量(图7)。获得L1和L2两个转基因株系。
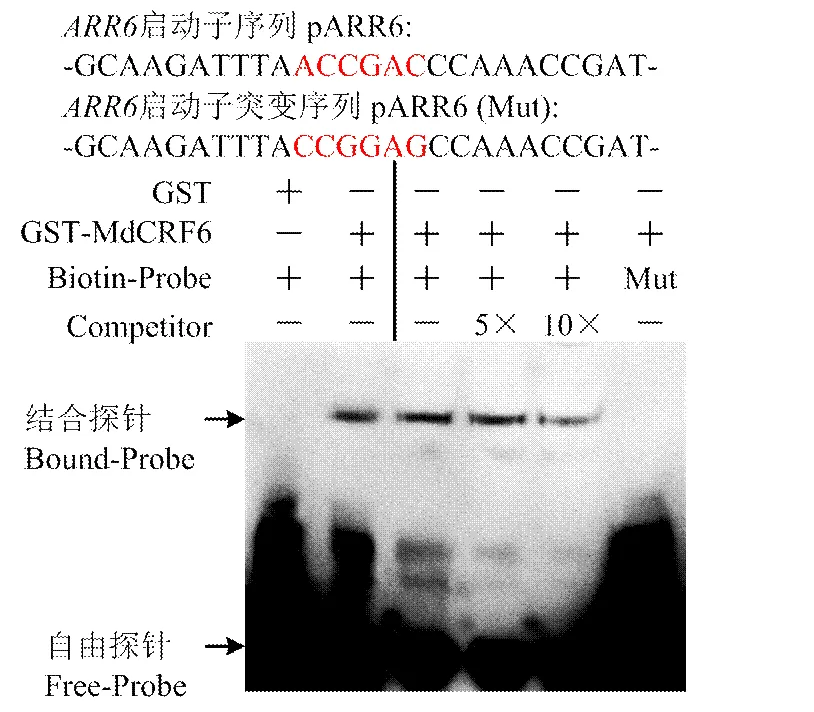
图5 MdCRF6绑定DRE序列
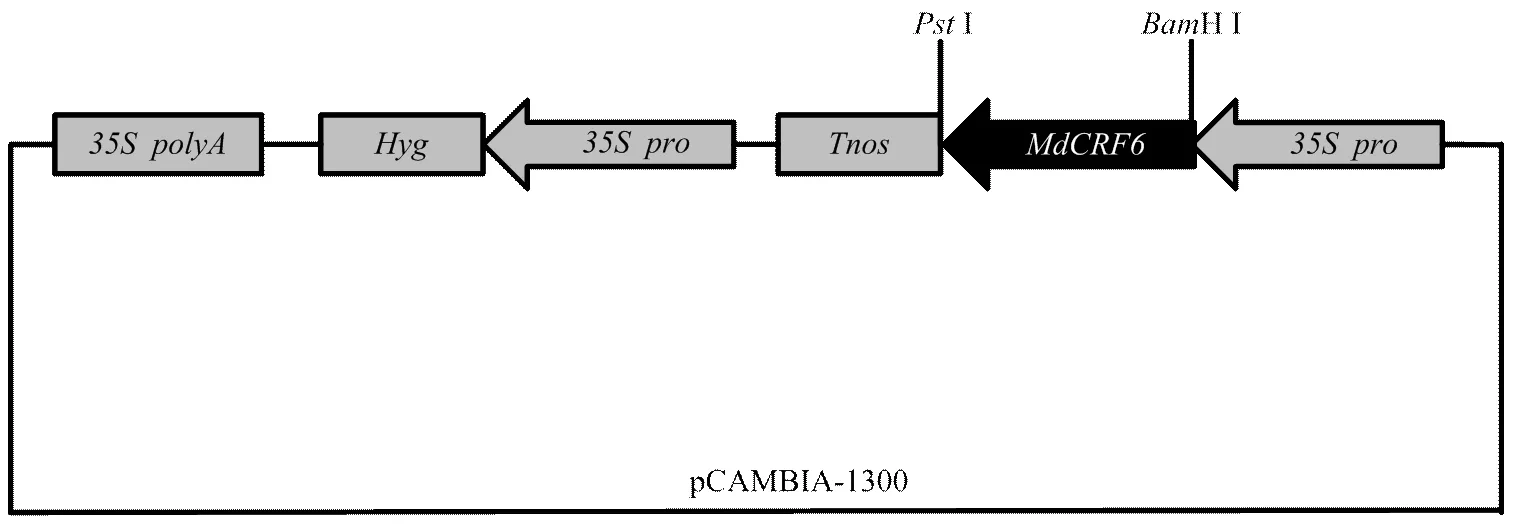
图6 MdCRF6-pCAMBIA-1300结构示意图
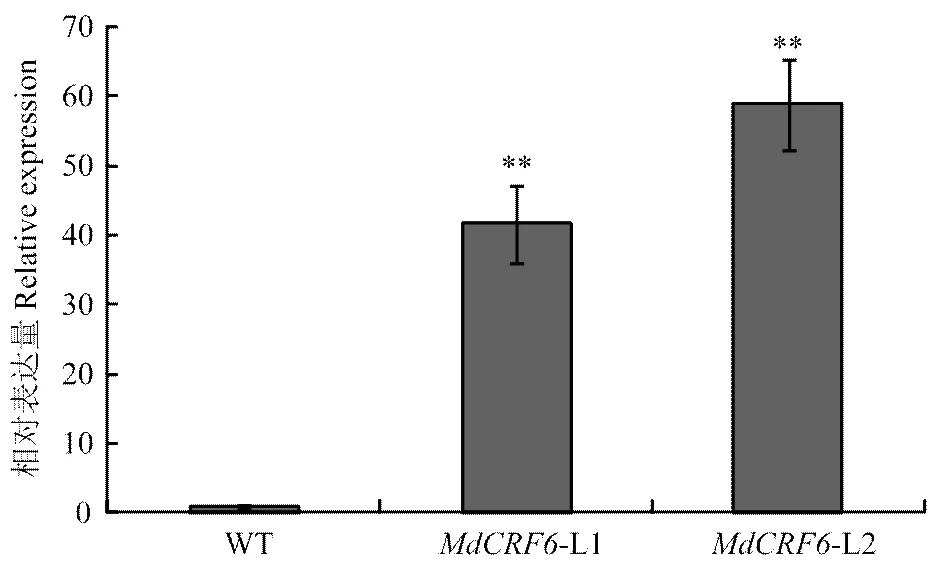
图7 定量PCR分析MdCRF6在转基因苹果愈伤组织L1和L2中的表达水平
2.5 超表达抑制花青苷积累
对获得的转基因苹果愈伤组织进行强光、低温处理,10 d后,野生型苹果愈伤组织(WT)积累较多花青苷,而转基因苹果愈伤组织(- L1和-L2)积累的花青苷含量很少(图8-a、b)。
实时荧光定量PCR检测花青苷合成基因的表达。结果显示,超表达明显抑制花青苷合成基因的表达(图8-c)。
2.6 超表达降低苹果愈伤的抗盐性
对获得的转基因苹果愈伤组织进行不同盐浓度盐处理,15 d 后,相比于野生型对照,转基因苹果愈伤组织表现出对盐胁迫更敏感的表型。盐处理后,转基因苹果愈伤组织的鲜重明显低于野生型(图9-a、b)。
实时荧光定量PCR检测盐胁迫响应相关基因的表达。结果显示,超表达明显抑制,和基因的表达(图9-c)。

a:野生型(WT)和转基因(MdCRF6-L1和MdCRF6-L2)苹果愈伤组织花青苷积累分析 Phenotypes of wild-type (WT) and transgenic (MdCRF6-L1 and MdCRF6-L2) apple calli on the anthocyanins accumulation;b:检测花青苷含量 Detection of the anthocyanins contents;c:定量PCR检测花青苷合成基因的表达 qRT-PCR analysis of the expression level of anthocyanins biosynthetic genes

a:野生型(WT)和转基因(MdCRF6-L1和MdCRF6-L2)苹果愈伤组织盐胁迫情况分析 Phenotypes of wild-type (WT) and transgenic (MdCRF6-L1 and MdCRF6-L2) apple calli on the salt stress tolerance;b:检测愈伤鲜重 Detection of the fresh weight;c:定量PCR检测盐胁迫响应相关基因的表达 qRT-PCR analysis of the expression level of salt stress related genes
3 讨论
细胞分裂素在植物生长发育过程中发挥重要作用。在果树生产中,研究细胞分裂素对花青苷积累和抗盐性调控的机理对于改善果实品质和提高苹果产量意义重大。前期研究表明,一定浓度的细胞分裂素可以促进花青苷的积累[12-13]。此外,在叶片喷施细胞分裂素可以显著提高植株的抗盐能力[7]。到目前为止,虽然对细胞分裂素调控的生长发育过程研究较多,但是其内在的调控机制仍然不清楚。
细胞分裂素响应因子CRFs作为细胞分裂素信号传导途径中的关键调控因子,在调节植物衰老、响应非生物胁迫以及抗病性等方面具有重要作用。其中,拟南芥作为转录抑制因子在响应细胞分裂素和外界胁迫,抑制叶片衰老过程中发挥关键作用[24]。最近研究表明,拟南芥在氧化胁迫条件下扮演负调控者的角色,它能够通过直接结合的启动子,抑制细胞分裂素相关基因的表达[22]。此外,番茄被初步鉴定在响应盐胁迫和多种植物激素过程中发挥重要作用[26]。据此,通过同源序列比对和RT-PCR技术得到苹果细胞分裂素响应因子基因,苹果MdCRF6与拟南芥AtCRF6同源性最高,并且包含保守的CRF结构域和AP2/ERF结构域,在拟南芥AtCRF6[20]和番茄SlCRF6[26]的研究过程中也发现了相类似的结构域。基因表达分析发现,响应细胞分裂素和盐胁迫,由此推测或许在盐胁迫响应过程中具有重要作用。作为典型的转录因子,本研究结果也验证MdCRF6能够结合到DRE序列。以上结果表明,苹果MdCRF6和拟南芥AtCRF6在结构和功能上都具有相似性。这是在苹果中首次克隆得到细胞分裂素响应因子。
为了进一步鉴定苹果MdCRF6的生物学功能,获得了转基因苹果愈伤组织。前人研究表明,细胞分裂素在调节花青苷积累方面发挥重要作用[29]。本研究结果表明在苹果愈伤组织中超表达显著抑制花青苷的积累。推测响应细胞分裂素信号,作为转录抑制因子负调控花青苷合成基因的表达,进而抑制花青苷积累。同时,发现能够负调节植物的抗盐性,但具体的作用机制还有待深入研究。后期将进一步通过基因编辑(CRISPR/ Cas9)等技术,进一步验证该基因的生物学功能,为深入研究细胞分裂素信号途径和调节果树生长发育提供理论基础。
4 结论
通过基因克隆获得苹果,该基因编码348个氨基酸。氨基酸序列分析表明苹果MdCRF6包含保守的CRF结构域和AP2/ERF结构域。定量表达分析结果显示受细胞分裂素和盐胁迫诱导。EMSA结果证实MdCRF6原核表达蛋白能够结合DRE作用元件。转基因苹果愈伤组织表现出抑制花青苷积累和对盐胁迫敏感的表型,表明在调节花青苷积累和响应植物盐胁迫过程中可能发挥着重要的调控作用。
References
[1] 翟衡, 赵政阳, 王志强, 束怀瑞. 世界苹果产业发展趋势分析. 果树学报, 2005, 22(1): 44-50.
Zhai H, Zhao Z Y, Wang Z Q, Shu H R. Analysis of the development trend of the world apple industry., 2005, 22(1): 44-50. (in Chinese)
[2] 闫国华, 甘立军, 孙瑞红, 张利华, 周燮. 赤霉素和细胞分裂素调控苹果果实早期生长发育机理的研究. 园艺学报, 2000, 27(1): 11-16.
Yan G H, Gan L J, Sun R H, Zhang L H, Zhou X. The study of mechanism about gibberellin and cytokinin regulation apple fruit early growth., 2000, 27(1): 11-16. (in Chinese)
[3] 邹养军, 王永熙. 内源激素对苹果果实生长发育的调控作用研究进展. 陕西农业科学, 2002(10): 13-15.
ZOU Y J, WANG Y X. The readjustment of endogenous hormones on apple fruit growth and development., 2002(10): 13-15. (in Chinese)
[4] MOK W, MOK M C. Cytokinin metabolism and action., 2001, 52(1): 89-118.
[5] WERNER T, SCHMULLING T. Cytokinin action in plant development., 2009, 12(5), 527-538.
[6] HEYL A, WULFETANGE K, PILS B, NIELSEN N, ROMANOV G A, SCHMULLING T. Evolutionary proteomics identifies amino acids essential for ligand-binding of the cytokinin receptor CHASE domain., 2007, 7(1): 62.
[7] 王三根. 细胞分裂素在植物抗逆和延衰中的作用. 植物学通报, 2000, 17(2): 121-126.
WANG S G. Roles of cytokinin on stress-resistance and delaying senescence in plants., 2000, 17(2): 121-126. (in Chinese)
[8] Werner T, Motyka V, Strnad M, Schmülling T. Regulation of plant growth by cytokinin., 2001, 98(18): 10487-10492.
[9] 周蕾, 魏琦超, 高峰. 细胞分裂素在果实及种子发育中的作用. 植物生理学通讯, 2006, 42(3): 549-553.
ZHOU L, WEI Q C, GAO F. The effect of cytokinins on fruit and seed development., 2006, 42(3): 549-553. (in Chinese)
[10] 杨晓红, 陈晓阳, 刘克锋. 细胞分裂素对植物衰老的延缓作用. 热带亚热带植物学报, 2006, 14(3): 256-262.
YANG X H, CHEN X Y, LIU K F. The role of cytokinins in retarding of senescence in plants., 2006, 14(3): 256-262. (in Chinese)
[11] ZWACK P J, RASHOTTE A M. Interactions between cytokinin signalling and abiotic stress responses., 2015, 66(16): 4863-4871.
[12] JI X H, WANG Y T, ZHANG R, WU S J, AN M M, LI M, CHEN X S. Effect of auxin, cytokinin and nitrogen on anthocyanin biosynthesis in callus cultures of red-fleshed apple ()., 2015, 120: 325-337.
[13] SHI M Z, XIE D Y. Engineering of red cells ofand comparative genome-wide gene expression analysis of red cells versus wild-type cells., 2011, 233: 787-805.
[14] 蔺经, 盛宝龙, 常有宏. 赤霉素和细胞分裂素类植物生长调节剂在苹果生产中的应用. 北方果树, 2000(1): 1-3.
LIN J, SHENG B L, CHANG Y H. The application of gibberellin and cell division plant growth regulator in apple production., 2000(1): 1-3. (in Chinese)
[15] 辛艳伟, 丁春刚. 不同浓度植物细胞分裂素对苹果叶片衰老的影响. 山西农业科学, 2016, 44(4): 467-469, 490.
XIN Y W, DING C G. Effects of different concentrations plant cytokinin on senescence of apple leaves., 2016, 44(4): 467-469, 490. (in Chinese)
[16] 辛艳伟, 牛颜冰, 李晓瑞. 不同植物细胞分裂素对‘红富士’苹果果实抗氧化活性及品质的影响. 中国农学通报, 2016, 32(4): 83-86.
XIN Y W, NIU Y B, LI X R. Effects of different plant cytokinin on antioxidant activity and quality of ‘Fuji’ apple fruit., 2016, 32(4): 83-86. (in Chinese)
[17] FERREIRA F J, KIEBER J J. Cytokinin signaling., 2005, 8(5): 518-525.
[18] KANG J, LEE Y, SAKAKIBARA H, MARTINOIA E. Cytokinin transporters: GO and STOP in signaling., 2017, 6(22): 455-461.
[19] RASHOTTE A M, MASON M G, HUTCHISON C E, FERREIRA F J, SCHALLER G E, KIEBER J J. A subset ofAP2 transcription factors mediates cytokinin responses in concert with a two-component pathway., 2006, 103(29): 11081-11085.
[20] RASHOTTE A M, GOERTZEN L R. The CRF domain defines cytokinin response factor proteins in plants., 2010, 10(1): 74.
[21] WEIRAUCH M T, YANG A, ALBU M, COTE A G, MONTENEGRO- MONTERO A, DREWE P, NAJAFABADI H S, LAMBERT S A, MANN I, COOK K. Determination and inference of eukaryotic transcription factor sequence specificity.,2014, 158: 1431-1443.
[22] ZWACK P J, DE CLERCQ I, HOWTON T C, HALLMARK H T, HURNY A, KESHISHIAN E A, RASHOTTE A M. Cytokinin response factor 6 represses cytokinin-associated genes during oxidative stress., 2016, 172(2): 1249-1258.
[23] LIANG Y S, ERMAWATI N, CHA J Y, JUNG M H, SUUDI M, KIM M G, SON D. Overexpression of an AP2/ERF-type transcription factor CRF5 confers pathogen resistance toplants., 2010, 53(2): 142-148.
[24] ZWACK P J, ROBINSON B R, RISLEY M G, RASHOTTE A M. Cytokinin response factor 6 negatively regulates leaf senescence and is induced in response to cytokinin and numerous abiotic stresses., 2013, 54(6): 971-981.
[25] RAMAIAH M, JAIN A, RAGHOTHAMA K G. Ethylene Response Factor070 regulates root development and phosphate starvation- mediated responses., 2014, 164(3): 1484-1498.
[26] SHI X, GUPTA S, RASHOTTE A M. Solanum lycopersicum cytokinin response factor (SlCRF) genes: Characterization of CRF domain-containing ERF genes in tomato., 2012, 63(2): 973-982.
[27] 杨昌. 甘蓝型油菜CRF家族的特征分析及BnaCRF8s的克隆和功能初步研究[D]. 武汉: 华中农业大学, 2016.
Yang C. Analysis of CRF family genes, cloning and preliminary function research of BnaCRF8s in[D]. Wuhan: Huazhong Agricultural University, 2016. (in Chinese)
[28] AN J P, Li H H, Song L Q, Su L, Liu X, You C X, Hao Y J. The molecular cloning and functional characterization of MdMYC2, a bHLH transcription factor in apple., 2016, 108: 24-31.
[29] DEIKMAN J, HAMMER P E. Induction of anthocyanin accumulation by cytokinins in., 1995, 108(1): 47-57.
(责任编辑 赵伶俐)
Effects of Overexpression of Apple Cytokinin Response Factor Geneon Anthocyanins Accumulation and Salt Stress Tolerance
AN JianPing1, SONG LaiQing2, ZHAO LingLing2, YOU ChunXiang1, WANG XiaoFei1, HAO YuJin1
(1College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 271018, Shandong;2)
【Objective】The objective of this study is to clone apple cytokinin response factor gene, to analyze its homology with, its expression of exposing to cytokinin and salt stress as well as its binding to DRE motif (ACCGAC), to identify its role in regulating anthocyanins accumulation and salt stress, and to provide a theoretical basis for studying cytokinin signaling pathway and regulating fruit tree growth and development. 【Method】gene was cloned by homology sequence alignment and PCR technique. The phylogenetic tree of MdCRF6 andCRFs was constructed using MEGA5.0. The conserved domains of MdCRF6 were analyzed using SMART software and DNAMAN software. Real-time fluorescent quantitative PCR (qRT-PCR) was performed to detect the gene expression ofexposing to cytokinin and salt stress. The electrophoretic mobility shift assay (EMSA) was conducted to verify whether MdCRF6 could bind to the DRE motif. A plant over-expression vector ofwas constructed and used to transform apple calli by-mediated method. The phenotypes of wild-type and transgenic apple calli on anthocyanins accumulation and salt stress tolerance were characterized to investigate the function of【Result】 A cytokinin response factor gene named(MDP0000783818) was cloned from‘Gala’Sequence analysis showed that its open reading frame (ORF) was 1 047 bp, which encoded 348 amino acids. The results of phylogenetic tree and amino acid sequence alignment indicated that MdCRF6 contained a CRF domain in its N-terminal side and an AP2/ERF domain in its C-terminal side. qRT-PCR analysis indicated thatwas responsive to cytokinin and salt stress, and the expression levels peaked at 3 h and 6 h exposing to 10 μmol∙L-1BA and 100 mmol∙L-1NaCl, respectively. EMSA assay showed that MdCRF6 could bind to the DRE motif. The-overexpressing apple calli exhibited reduced anthocyanins content and decreased salt stress tolerance. The gene expression analysis showed that overexpression ofsignificantly repressed the expression levels of anthocyanins biosynthetic genes and salt response related genes. 【Conclusion】The apple MdCRF6 exhibited high similarity to AtCRF6, and it was involved in the response to cytokinin and salt stress. Overexpression ofdown-regulated anthocyanins accumulation and salt stress tolerance by repressing the expression of anthocyanins biosynthetic genes and salt response related genes.
apple;; anthocyanins accumulation; salt stress
2017-04-10;接受日期:2017-06-15
国家自然科学基金(31601742)、教育部创新团队支持计划(IRT15R42)、山东省现代农业产业技术体系(SDAIT-06-03)
安建平,E-mail:1393427413@qq.com。通信作者王小非,E-mail:xfwang2004@163.com。通信作者郝玉金,E-mail:haoyujin@sdau.edu.cn

