新疆葡萄酒高产酸酿酒酵母菌的筛选和发酵条件优化
马文瑞,魏玉洁,邹弯,吴浩天,田歌,王德良,马静,高林龙,武运*,薛洁*
1(新疆农业大学,新疆 乌鲁木齐,830052)2(中国食品发酵工业研究院,北京,100015)
新疆葡萄酒高产酸酿酒酵母菌的筛选和发酵条件优化
马文瑞1,魏玉洁1,邹弯1,吴浩天1,田歌1,王德良2,马静1,高林龙1,武运1*,薛洁2*
1(新疆农业大学,新疆 乌鲁木齐,830052)2(中国食品发酵工业研究院,北京,100015)
以从新疆阜康、昌吉、焉耆3个产区的葡萄和土壤中所筛选出的39株酵母菌为出发菌株,以便确定高产酸酿酒酵母筛选培养基配方及其灵敏性。通过初筛和复筛,获得1株产酸含量高的酿酒酵母Y6,结果表明该菌株的挥发酸含量与商业酵母菌株71B基本一致,并对产酸酵母菌的发酵条件进行优化。单因素试验确定了初始酸度、发酵温度和酵母菌接种量对酵母菌产酸能力的影响较为显著,选取这3个因素进行响应面优化,得到优化条件是:葡萄汁初始酸度为6.70 g/L、发酵温度为20.35 ℃、接种量为109CFU/mL,响应预测值达1.7664 g/L。同时,最佳优化条件下获得的实际值与预测值吻合,说明所建立的回归模型是切实可行的。在小型葡萄酒发酵生产试验中,与71B相比,酿酒酵母Y6产酸量提高了1.84 g/L。
酿酒酵母;高产酸;培养基灵敏性;单因素试验;响应面优化
酿酒酵母菌(Saccharomycescerevisiae)是优质葡萄酒生产的关键之一[1-3],其性能的优劣不仅对葡萄酒的口感和风味影响很大,而且还直接影响到所酿葡萄酒的产量、质量[4-8]。新疆是我国优质酿酒葡萄产地之一[9],但是由于该地区日温差大、降雨量少等气候特点,造成了酿酒葡萄原料糖高酸低的特点。糖度过高,抑制酵母菌生长,酵母菌将葡萄糖转化为酒精的能力下降;酸度过低则会使葡萄酒颜色黯淡无光,口感单调、不清新;所以糖高酸低直接影响到新疆地区葡萄酒的品质[10-13]。因此筛选具有新疆产区的酿酒酵母菌,提高葡萄酒的质量,是未来新疆葡萄酒工业发展的重点。
有关产区特色酵母菌的筛选,国内外研究报道很多,PEREZ-COELLO等从德国La Mancha的葡萄园中筛选出了3株酵母菌可以增加葡萄酒的果香味,提高其中的草药香气[14];凌云等采用WL培养基对河北昌黎地区采集的赤霞珠进行初筛,获得性能优良的酵母菌株CLY03和CLY04,并通过一系列耐受性试验表明,这2菌株的香气和典型性得分都高于对照菌株,其发酵的葡萄酒体现了产区的品质和特色[15];商敬敏从山东蓬莱和云南德钦的葡萄园土壤中分离出的酵母菌,其中有5株菌发酵的酒样中乳酸乙酯含量明显高于其他酒样,果香味优雅浓郁[16]。但目前有关高产酸天然酵母菌的筛选、发酵条件的优化和改善葡萄酒风味的研究较少。
本研究以筛选出的新疆葡萄酒高产酸酵母菌为研究对象,通过单因素试验和响应面法优化发酵条件,确定该菌株最佳产酸的发酵条件,为该菌株在生产应用中提供一定的理论依据和实践基础。
1 材料与方法
1.1试验材料
1.1.1 原料与化学试剂
葡萄酵母筛选原料和酿酒葡萄原料:新疆阜康、昌吉和焉耆3个地区的赤霞珠葡萄及葡萄根部土壤;商业酵母71B:市场购买法国进口酵母。
麦芽汁培养基,PDA培养基,YPD培养基,去离子水,溴甲酚绿,菲林试剂A、B液,0.5%葡萄糖标液,4.0%HCl溶液,4.0 mol/L NaOH溶液,1.0%次甲基蓝,1.0%酚酞,0.05 mol/L NaOH溶液等。
1.1.2 仪器与设备
DHZ-B全温振荡器,太仓市豪威实验仪器制造有限公司;SW-CJ-2FD型双人单面超净工作台,苏州净化设备有限公司;离子色谱仪,美国赛默飞世尔科技,戴安ICS3000;电子天平,梅特勒-托利多实验室;LRH-250生化培养箱,上海恒科仪器有限公司;立式电热压力蒸汽灭菌锅,上海申安医疗器械厂;PHS-3C雷磁pH计等。
1.2实验方法
1.2.1 酵母菌的分离纯化与鉴定
1.2.1.1 酵母菌的分离纯化
具体方法参照魏玉洁等人的《新疆地产葡萄酒优良酿酒酵母菌的筛选》[17]。
1.2.2 高产酸酿酒酵母菌筛选培养基配方的确定及灵敏性验证
1.2.1.1 高产酸酿酒酵母菌筛选培养基的确定
以12 °P麦汁、PDA、YPD为基础培养基,添加0.01%、0.02%和0.10%的溴甲酚绿,调pH为最适pH=6.0,115 ℃灭菌20 min,接菌,最适培养基确定为易于观察菌落周围所出现的黄色圈并且加入溴甲酚绿后的培养基最为接近pH=6.0[18]。
1.2.1.2 培养基灵敏性验证
配制浓度分别为4.00、4.50、5.00、5.50、6.00、6.50、7.00、7.50、8.00、8.50 g/L的酒石酸溶液,滴加1滴到培养基中,观察0 h 和2 h后黄色圈的直径大小判定酒石酸溶液浓度差异在0.50 g/L范围内的灵敏性,使用游标卡尺测量黄色圈直径,减去牛津杯的内直径,即为黄色圈实际的直径。
1.2.3 高产酸酿酒酵母菌初筛
1.2.3.1 培养基初筛酿酒酵母菌
活化筛选所得酿酒酵母菌,挑取1环接种于培养基上,28 ℃静置培养24 h,观察黄色圈,选择菌落周围出现较大黄色圈的菌株进行发酵试验。
1.2.3.2 发酵初筛
调节葡萄汁总糖含量为210 g/L,用500 mL三角瓶分装葡萄汁,每瓶200 mL,115 ℃灭菌20 min,葡萄汁冷却后接入106CFU/mL菌悬液,25 ℃发酵,每天称重,观察发酵情况,直至发酵结束测定其总糖、总酸和挥发酸含量,具体方法参照GB15038—2006《葡萄酒、果酒通用分析方法》[19],每株菌测定指标各做3组平行试验,取平均值。
1.2.4 高产酸酿酒酵母菌复筛
1.2.4.1 培养基复筛酿酒酵母菌
称取0.06 g商业酵母71B加入10 mL 2%的葡萄糖水中,28 ℃振荡活化30 min。将初筛所得菌株和71B分别配置为106CFU/mL菌悬液,先在培养皿中倒入一层刚好可以覆盖培养皿底部的溴甲酚绿培养基,待其凝固后放入牛津杯,再倒入一层溴甲酚绿培养基,凝固后取出牛津杯,接种0.1 mL菌悬液于牛津杯孔洞内,28 ℃静置培养24 h,观察黄色圈,选择黄色圈大于71B的菌株进行发酵试验。
1.2.4.2 发酵复筛
方法同1.2.3.2,以71B为对照试验,发酵结束后,选择产酸量最大的菌株。
1.2.5 影响酿酒酵母菌产酸能力的单因素试验
葡萄汁初始酸度、初始糖浓度、发酵温度、接种量作为影响酿酒酵母菌产酸能力的主要因素,通过单因素试验选取响应面试验的因素和水平。单因素试验使用筛选所得高产酸酵母菌。
1.2.5.1 葡萄汁初始酸度对酵母菌产酸能力的影响
调节葡萄汁初始总糖含量为210 g/L,葡萄酒初始总酸为4.5 g/L,用酒石酸调节总酸含量分别为5.00、5.50、6.00、6.50、7.00、7.50、8.00 g/L,发酵工艺和总酸测定方法同1.2.3.2。
1.2.5.2 葡萄汁初始糖浓度对酵母菌产酸能力的影响
以初始酸含量为4.5 g/L的葡萄汁为原料,调节总糖含量分别为150、180、210、240、270 g/L,发酵工艺和总酸测定方法同1.2.3.2。
1.2.5.3 发酵温度对酵母菌产酸能力的影响
调节葡萄汁总糖为210 g/L,初始酸含量为4.5 g/L,分别放置在15、18、21、24、27 ℃培养箱中进行发酵,发酵工艺和总酸测定方法同1.2.3.2。
1.2.5.4 接种量对酵母菌产酸能力的影响
调节葡萄汁总糖为210 g/L,初始酸含量为4.5 g/L,灭菌冷却后分别接入104、105、106、107、108CFU/mL菌悬液,发酵工艺和总酸测定方法同1.2.3.2。
1.2.6 酿酒酵母菌产酸能力响应面优化试验
根据Box-Behnken设计原理设计3因素3水平响应面试验,见表1。

表1 响应面Box-Behnken试验因素编码及水平
1.2.7 小型生产中高产酸酵母菌的有机酸含量及成分的测定
总酸和挥发酸含量等理化指标的测定方法同1.2.3.2,有机酸含量及成分的测定参照杨东伟等人的《高效液相色谱法测定葡萄酒中11种有机酸含量》[20]。
2 结果与分析
2.1酵母菌分离结果与分析
通过分离纯化,确定了39株酵母菌,将其重新统一编号为Y1~Y39,菌落形态如图1所示。
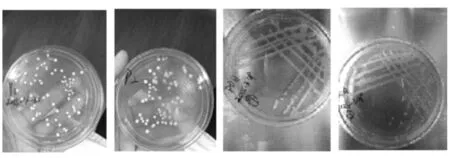
图1 部分酵母菌菌落形态Fig. 1 Colony form of some yeasts
2.2高产酸酿酒酵母菌筛选培养基配方的确定及灵敏性验证结果与分析
2.2.1 高产酸酿酒酵母菌筛选培养基的确定
通过试验证明,当12 °P麦汁基础培养基加入溴甲酚绿后,凝固性较差,接菌存在一定的困难;以YPD为基础培养基时,由于培养基本身颜色较深,加上溴甲酚绿的影响,不便于观察菌落周围所出现的黄色圈大小;相比之下,PDA本身颜色较浅,且凝固型良好,可作为该试验的基础培养基。当溴甲酚绿添加量为0.10%时,其本身的颜色会影响试验结果的观察,且培养基pH大大增加,需要添加NaOH中和;当添加量为0.02%时,pH还是略微偏高,而当添加量为0.01%时,不采用任何手段就可以达到培养基的最适pH,所以,将PDA基础培养基+0.01%溴甲酚绿作为筛选高产酸酿酒酵母菌的培养基。
2.2.2 产酸培养基灵敏性验证
将酒石酸浓度灵敏范围控制在0.50 g/L内,不同酒石酸浓度所产生的黄色圈大小如表2所示。
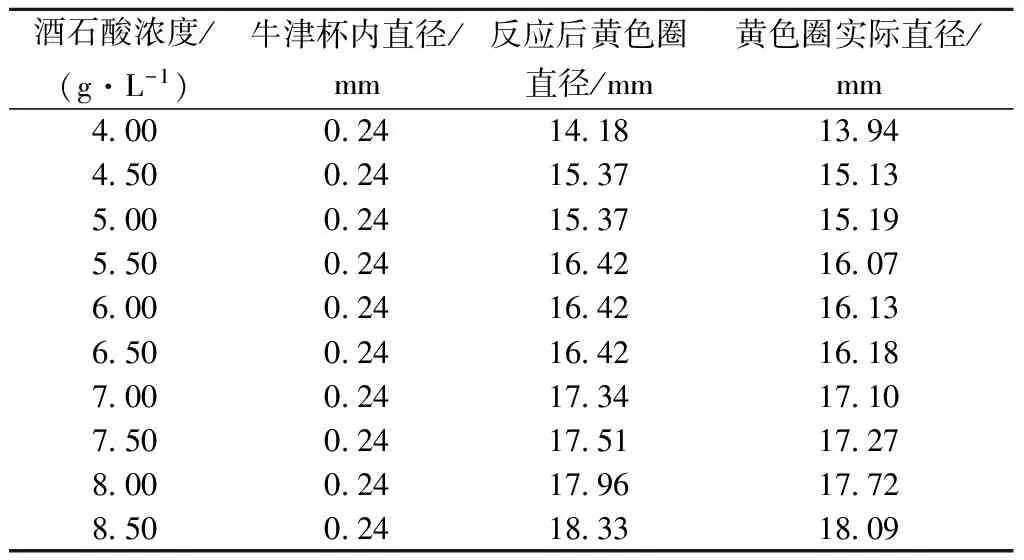
表2 不同酒石酸浓度所产生的黄色圈大小
由表2和图2看出,随着酒石酸浓度的增大,所产生的黄色圈直径整体呈增大趋势,而从4.50 g/L到6.5 g/L的酒石酸浓度范围内,黄色圈的直径变化十分微弱,都在0.10 mm以内,肉眼基本无法区分,灵敏性较差;从6.50~8.50 g/L的酒石酸浓度范围中,黄色圈直径变化都超过了0.10 mm,肉眼较易观察,灵敏性显著,证明该培养基适用于高产酸酵母菌的筛选。

图2 0 h和2 h后不同酒石酸浓度的黄色圈Fig.2 The yellow circle of tartaric acid concentration at zero hour and two hours
2.3高产酸酿酒酵母菌的初筛结果与分析
酵母菌的初筛包括培养基初筛和发酵试验初筛,在培养基初筛中, 39株酿酒酵母菌培养24 h后,最终选出菌落周围产生黄色圈较大的8株酵母菌,分别为:Y1、Y3、Y6、Y8、Y24、Y30、Y33和Y34。
对该8株酿酒酵母菌进行发酵初筛试验,发酵结束后检测其发酵液理化指标,表3数据显示各处理样品符合GB15037—2006《葡萄酒》[21];其中Y1、Y3、Y6和Y24具有良好的平行性,发酵稳定,其发酵液总酸含量为8.00 g/L左右,发酵后总酸含量增长了约2.00 g/L,比对照菌株产酸量高约1.50 g/L左右,其余菌株产酸量较其他四株相比较低或者发酵平行性较差。综上所述,用Y1、Y3、Y6和Y24进行复筛。
表3 8株酿酒酵母菌发酵液理化指标
注:葡萄原汁总糖含量为191.99 g/L;总酸含量为6.029 g/L。
2.4高产酸酿酒酵母菌的复筛结果与分析
初筛的4株酵母菌在培养基复筛中,牛津杯孔洞周围所产生的黄色圈大于71B的3株酵母菌,分别为:Y1、Y6和Y24,见图3。
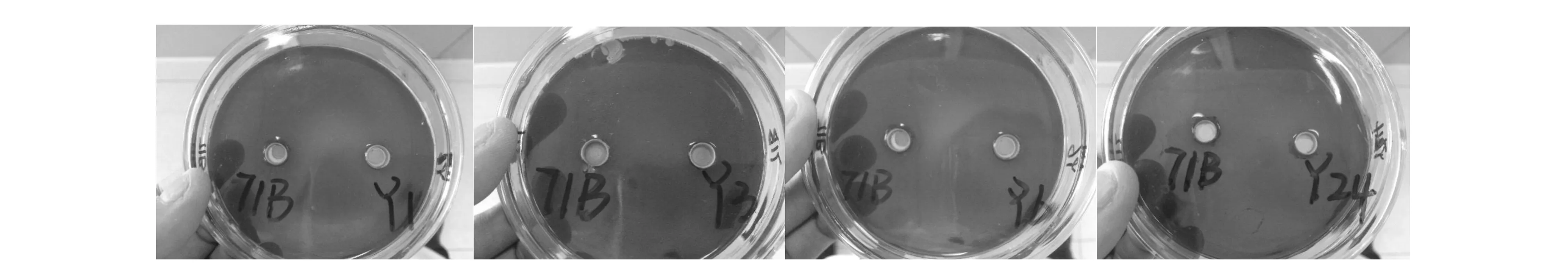
图3 复筛图片Fig.3 Secondary screening pictures
对Y1、Y6和Y24以71B为对照进行发酵复筛试验,发酵结束后检测其发酵液理化指标,表4数据显示各处理样品符合GB15037—2006《葡萄酒》[21];Y1、Y6、Y24和71B都具有良好的平行性;发酵后71B发酵液总酸含量为6.81 g/L,Y1和Y24约为7.00 g/L,Y6为8.65 g/L,Y6产酸量高于Y1和Y24且明显高于71B,同时,Y6的挥发酸含量与71B基本一致,综上所述,得到了1株高产酸优良酿酒酵母菌Y6。
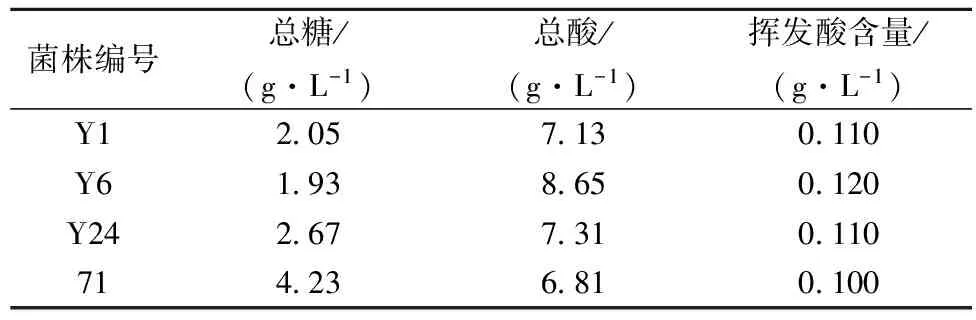
表4 四株酿酒酵母菌发酵液理化指标
注:葡萄原汁总糖含量为210g/L,总酸含量为6.25g/L。
2.5影响酿酒酵母菌产酸能力因素的结果与分析
2.5.1 葡萄汁初始酸度的影响
由图4可知,葡萄汁初始酸度对酵母菌产酸量的影响较为显著(P<0.05),随着葡萄汁初始酸度的增大,酵母菌产酸量呈先增高后降低趋势,当初始酸度为6.50 g/L时,酵母菌产酸量达到最大值为 1.79 g/L。因此,酵母菌产酸能力的最佳初始酸度为6.50 g/L。
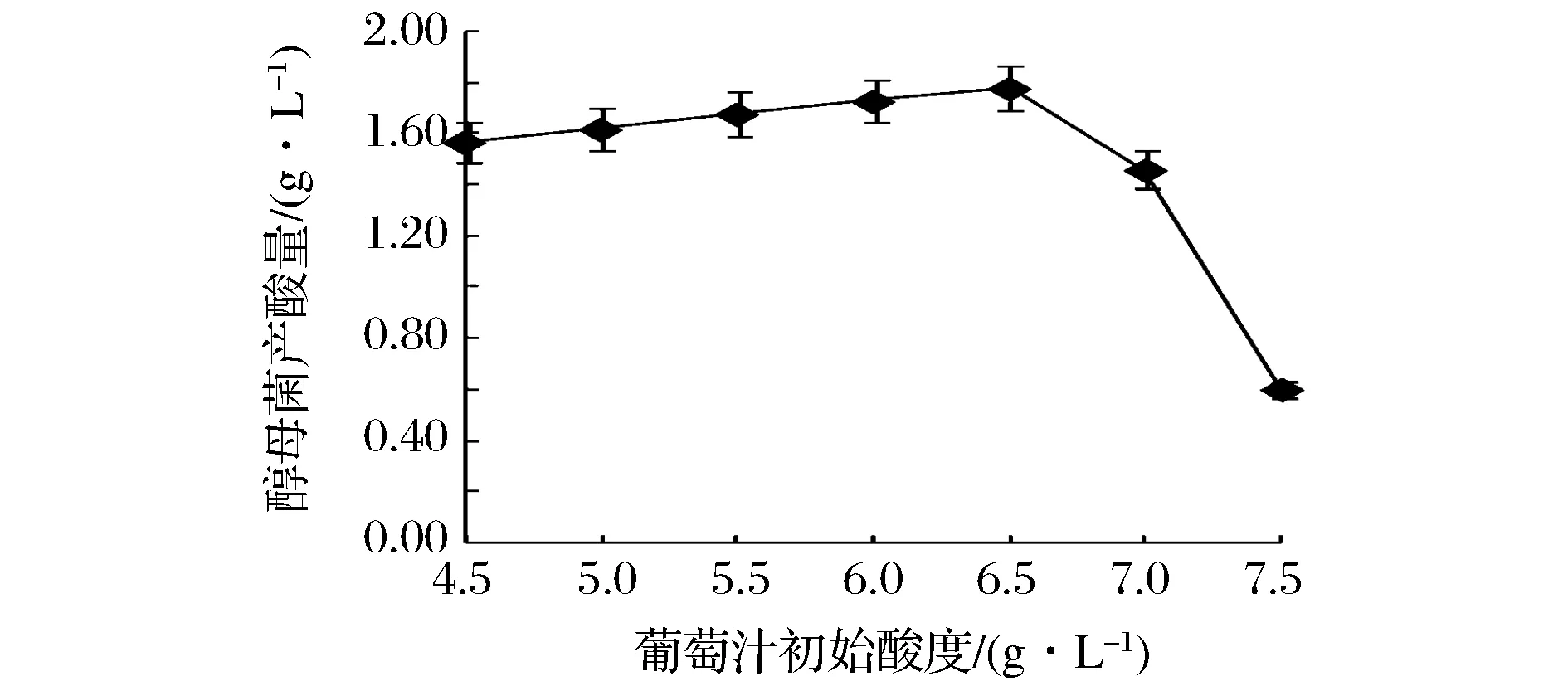
图4 不同初始酸度对酵母菌产酸量的影响Fig.4 Effect of initial acidity on the acid production capacity of yeast
2.5.2 葡萄汁初始糖度的影响
由图5显示,当葡萄汁初始糖浓度为210 g/L,酵母菌产酸量达到最大值为2.02 g/L,但是方差分析得初始糖浓度对酵母菌产酸量的影响不显著(P>0.05),当糖浓度从150 g/L增加到180 g/L时,其产酸量明显增大,而从180 g/L增加到210 g/L时,产酸量的上升率变化不大,前者产酸量明显增大是因为150 g/L的糖浓度达不到酵母菌发酵所消耗糖含量,所以其活性降低导致产酸量低,而糖浓度为180 g/L时,基本满足酵母菌的发酵,所以活性较好,产酸量上升;当糖浓度高于240 g/L时,酵母菌的活性反而受到了抑制,导致产酸量下降。
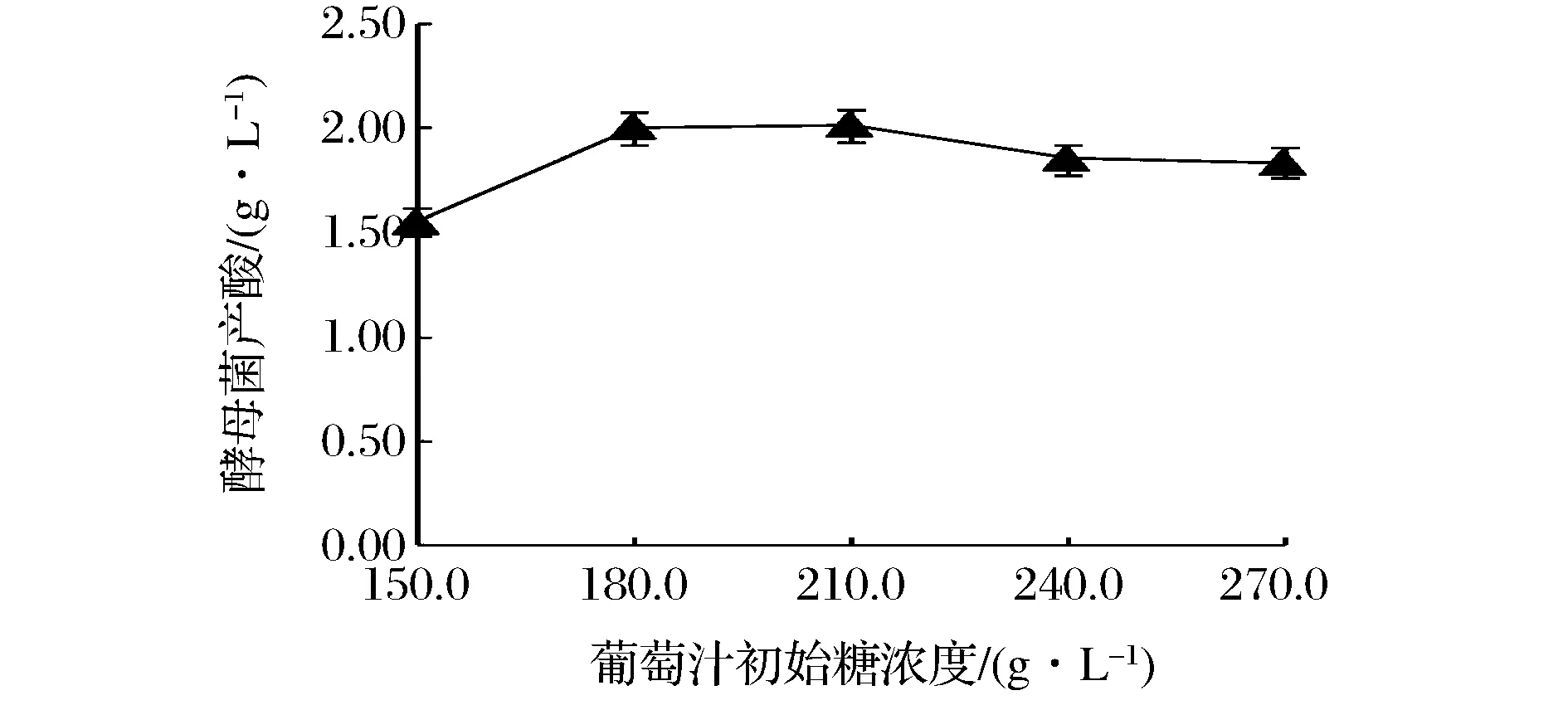
图5 不同初始糖浓度对酵母菌产酸量的影响Fig.5 Effect of sugar concentration on the acid production capacity of yeast
2.5.3 葡萄酒酒精发酵温度的影响
由图6可知,发酵温度对酵母菌产酸量的影响较为显著(P<0.05)。随着发酵温度的增大,酵母菌产酸量呈现先增高后降低的趋势,当发酵温度为21 ℃时,产酸量最高,因此,酵母菌产酸能力最好的发酵温度为21 ℃。
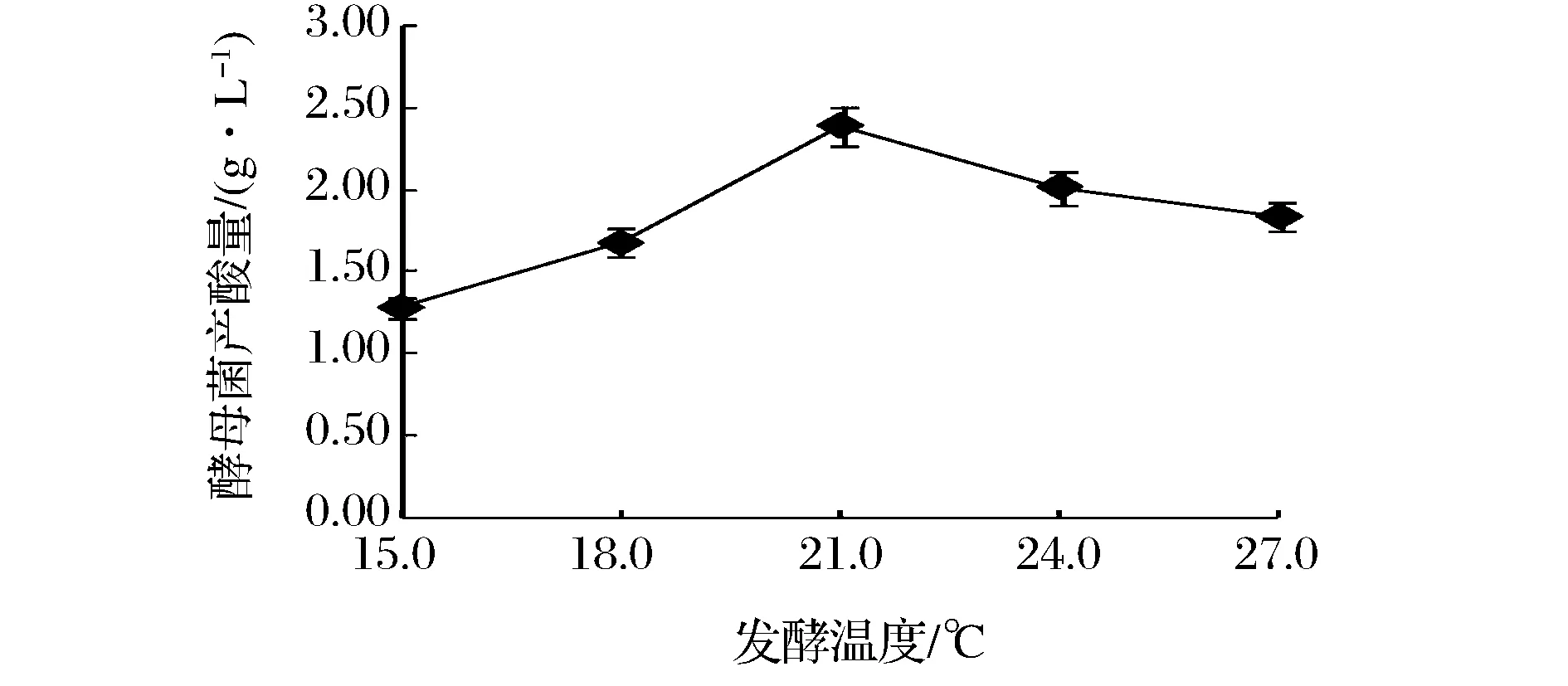
图6 不同发酵温度对酵母菌产酸量的影响Fig.6 Effect of fermentation temperature on the acid production capacity of yeast
2.5.4 酵母菌接种量的影响
由图7看到,发酵温度对酵母菌产酸量的影响有显著差异(P<0.05)。随酵母菌接种量的增大,酵母菌产酸量呈直线上升趋势,当酵母菌接种量为108CFU/mL时,产酸量最高,因此,酵母菌产酸能力最好的接种量为108CFU/mL。
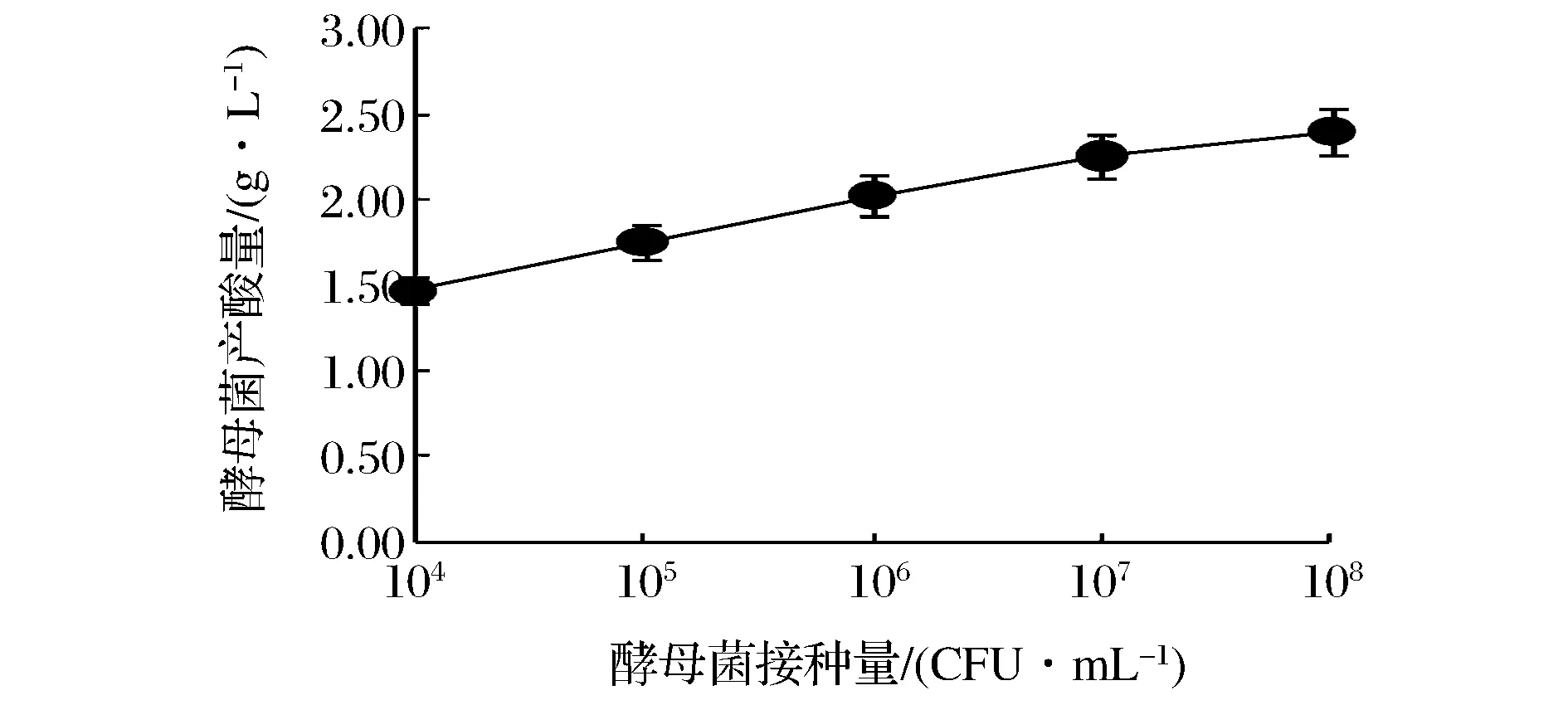
图7 不同酵母菌接种量对酵母菌产酸量的影响Fig.7 Effect of inoculum amount on the acid production capacity of yeast
2.6酿酒酵母菌产酸能力响应面优化试验结果与分析
根据单因素试验结果,采用响应面法对影响酿酒酵母菌产酸能力的初始酸浓度(A)、发酵温度(B)和接种量(C)3个因素和水平进行数据编码处理,采用3因素3水平响应面优化试验,结果如表5所示。
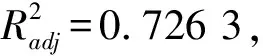
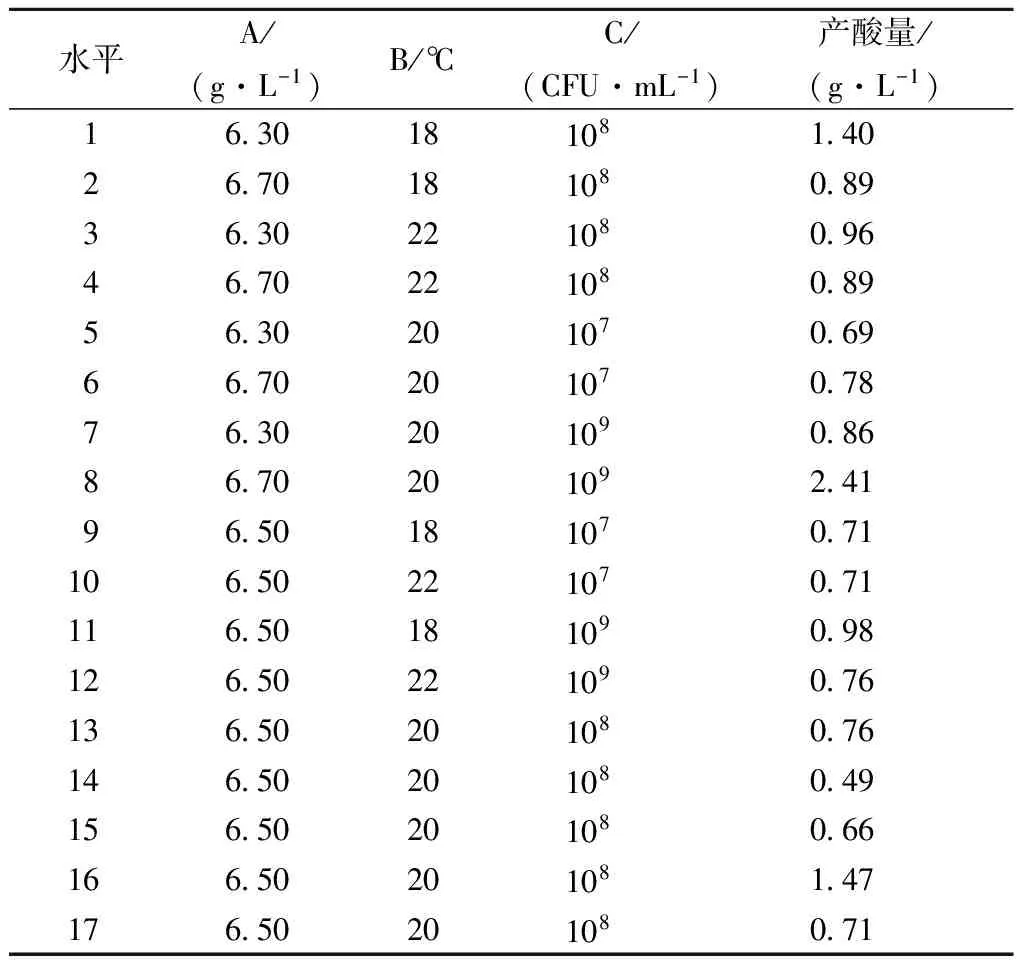
表5 Box-Behnken试验设计与结果
注:自变量C中1.5表示接种量为107CFU/mL;2.0表示接种量为108CFU/mL;2.5表示接种量为109CFU/mL。
通过分析因素间交互作用的影响,结果下图所示。从图中结果可以看出初始酸度和接种量交互作用对酵母菌产酸能力影响最为显著,初始酸度和发酵温度交互作用对酵母菌产酸能力影响较显著。如图8所示,当发酵温度恒定时,初始酸度在6.70 g/L时产酸量最大,图9得,当接种量一定时,酵母菌产酸量随初始酸度的增长而较小,6.55 g/L时又逐渐增多,因此初始酸度选择6.70 g/L左右最好;由图9可以看出,随着接种量和初始酸度的增长,酵母菌产酸能力逐渐增大,当接种量达108CFU/mL、初始酸度达6.60 g/L时产酸量明显增大。
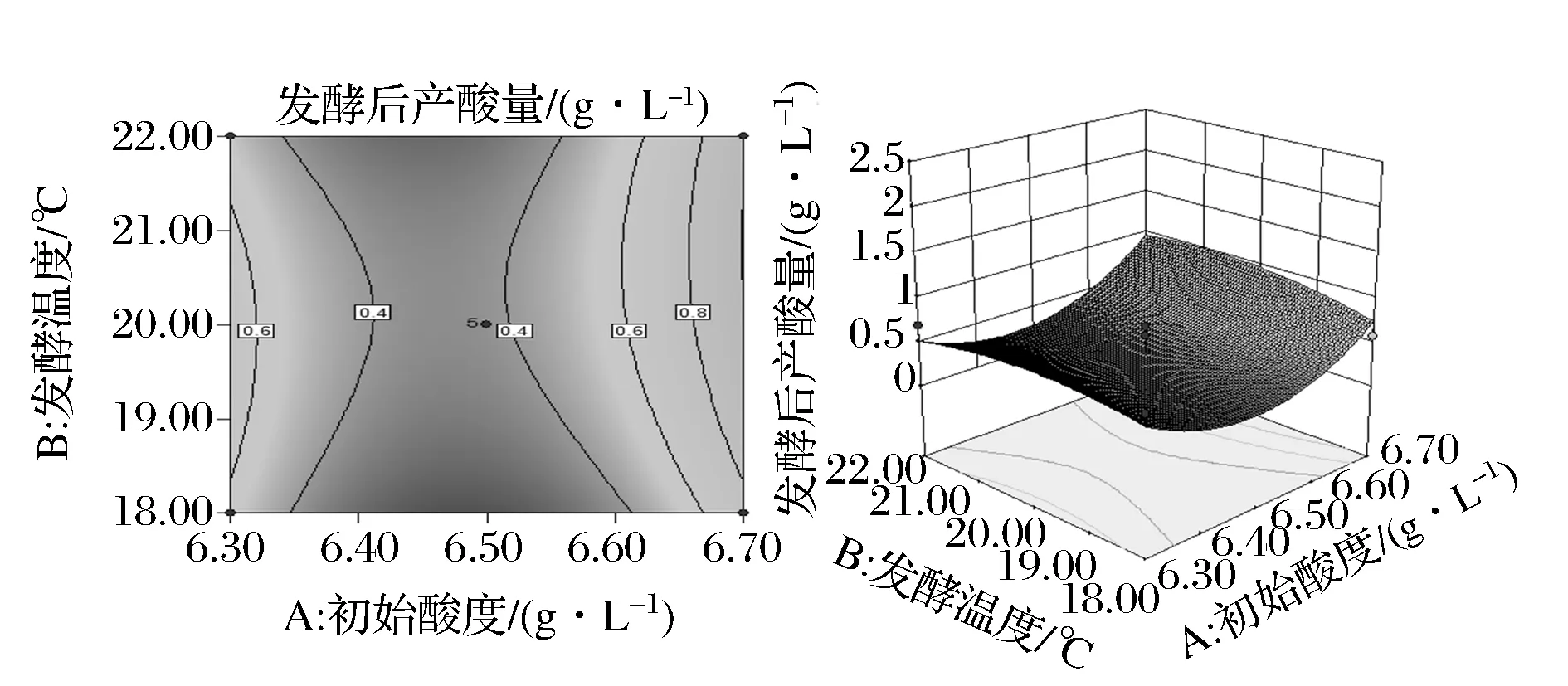
图8 初始酸度和发酵温度的交互作用对酵母菌产酸能力的影响Fig.8 Effect of initial acidity and fermentation temperature (AB) on the acid production capacity of yeast
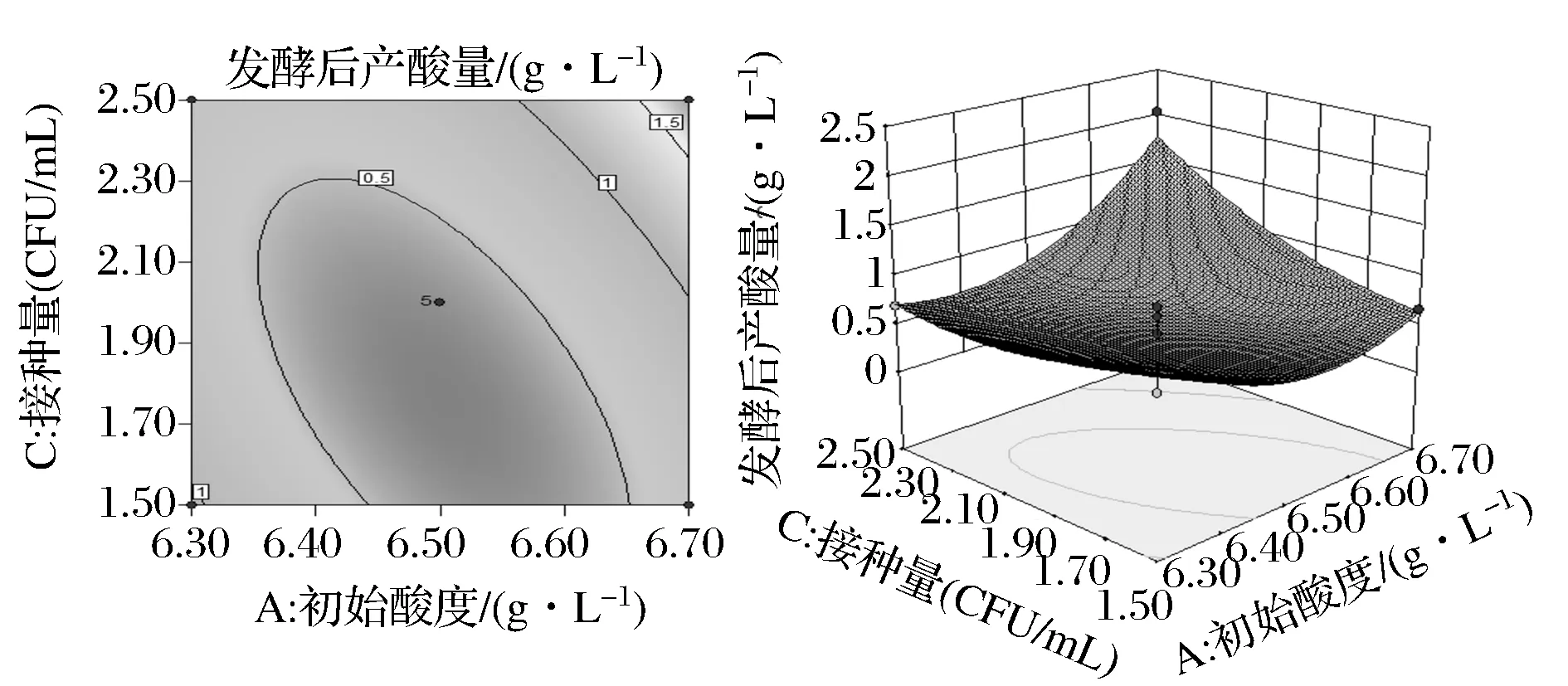
图9 初始酸度和接种量的交互作用对酵母菌产酸能力的影响Fig.9 Effects of initial acidity and inoculum amount (AC) on the acid production capacity of yeast
通过响应面优化,预测到最佳产酸发酵条件为:初始酸度6.70 g/L,发酵温度20.35 ℃,接种量109CFU/mL,响应预测值为1.766 4 g/L。按照响应面优化推荐的最优条件进行试验论证,酵母菌实际平均产酸能力为1.69 g/L,与预测值拟合率达95.67%,表明预测值和实际值有良好的拟合性,优化模型可靠。
2.7小型生产中高产酸酵母菌的有机酸含量及成分的结果与分析
在2个2.5 L广口瓶里分别装2 L赤霞珠葡萄汁(理化指标为:还原糖263.1 g/L;总酸5.25 g/L; pH 为4.80;添加总SO2约60 mg/L),分别加入高产酸酵母和商业酿酒酵母,使终浓度达到1×109CFU/mL,按照GB15037—2006《葡萄酒》进行生产[21],发酵温度25 ℃。发酵结束后取澄清的干红葡萄酒,取样测定有机酸含量,结果如表6、表7所示。

表6 两株酵母菌生产葡萄酒的理化指标

表7 两株酵母菌株生产葡萄酒主要有机酸的组成
所筛菌株与商业酿酒酵母相比,发酵结束后残糖均小于4 g/L,酒精度无显著差异,因此筛选的菌株符合工业发酵的要求;同时筛选菌株的有机酸含量明显高于商业酿酒酵母,该菌株所产生的有机酸,主要是酒石酸和苹果酸,而对挥发酸的影响较小,可以满足葡萄酒生产的要求。
3 结论
(1)确定了高产酸酿酒酵母菌的筛选培养基配方为:PDA培养基+0.01%溴甲酚绿,调pH为6.0,115 ℃灭菌20 min,且培养基灵敏性良好。
(2)通过对新疆3个酿酒葡萄产区的葡萄和土壤已筛选出的39株酵母菌进行2次培养基和发酵试验筛选得出一株高产酸酿酒酵母菌Y6,该菌株的产酸量比71B高出27%。
(3)酵母菌产酸能力的最佳单因素水平为:初始酸度为6.50 g/L,发酵温度为21 ℃,接种量为 108CFU/mL;通过响应面优化试验预测的最佳产酸发酵条件试验论证得出,初始酸度6.70 g/L,发酵温度20.35 ℃,接种量109CFU/mL,响应预测产酸量为1.7664 g/L,实际平均产酸能力为1.69 g/L,与预测值拟合率达95.67%。
[1] SUN Yue,GUO Jing-jing,LIU Fu-bing,et al.Identification of indigenous yeast flora isolated from the five winegrape varieties harvested in Xiangning, China[J].Antonie Van Leeuwenhoek, 2014, 105(3):533-540.
[2] BONCIANI T,SOLIERI L,VERO L D,et al.Improved wine yeasts by direct mating and selection under stressful fermentative conditions[J].European Food Research & Technology, 2016, 242(6):899-910.
[3] 周丽艳,刘绍军,刘畅.特色葡萄酒酵母菌种选育研究进展[J].中国酿造,2008,191(14):6-8.
[4] 李艳,康俊杰,成晓玲,等.3种酿酒酵母酿造赤霞珠干红葡萄酒的香气成分分析[J].食品科学,2010, 31(22):378-382.
[5] 侯晓瑞,王婧,杨学山,等.甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选[J].食品科学,2014,35(23):139-143.
[6] FLEET G H. Wine yeast for the future[J].FEMS Yeast Re-search, 2008, 8(7):979-995.
[7] CLEMENTE-JIMENEZ J M,MINGORANCE-CAZORLA L,MARTINEZ-RODRIGUEZ S,et al.Influence of sequential yeast mixtures on wine fermentation[J]. International Journal of Food Microbiology, 2005, 98(3):301-308.
[8] ZARA G,MANNAZZU I,CARO A D,et al.Wine quality improvement through the combined utilisation of yeast hulls and C andida zemplinina/Saccharomyces cerevisiae, mixed starter cultures[J].Australian Journal of Grape & Wine Research, 2014, 20(2):199-207.
[9] 付方圆.葡萄酒中低产氨基甲酸乙酯和生物胺酿酒微生物特性的研究[D].乌鲁木齐:新疆农业大学, 2015.
[10] 李慧,王惠玲,吴雅琨,等.天然葡萄酒酵母菌种的分离、鉴定和酿造性能评价[J].食品与发酵工业,2010,36(11):14-20.
[11] 王染霖.天山北麓酿酒葡萄产区葡萄与葡萄酒品质研究[D].石河子:石河子大学, 2015.
[12] 马莉涛.玛纳斯河流域酿酒葡萄赤霞珠和梅鹿辄的适应性研究[D].咸阳:西北农林科技大学, 2008.
[13] 刘雪梅.新疆玛纳斯河流域酿酒葡萄成熟度指标与葡萄酒质量关系的研究[D].咸阳:西北农林科技大学, 2008.
[14] PEREZ-COELLO M S,PEREZ A I,IRANZO J F U,et al.Characteristics of wine fermented with differentSaccharomycescerevisiaestains isolated from the La Mancha region[J].Food Microbiology, 1999,16(6):563-573.
[15] 凌云,杨雪峰,郭艾英,等.昌黎产区酿酒葡萄果表的酵母分离及发酵性能[J].食品科技, 2014, 39(12):7-12.
[16] 商敬敏.蓬莱、德钦产地葡萄酒相关酵母的分离鉴定及其耐受性研究[D].济南:山东轻工业学院,2012.
[17] 魏玉洁,邹弯,王威,等.新疆地产葡萄酒优良酿酒酵母菌的筛选[J].酿酒科技, 2016,263(5):42-47.
[18] 郭维烈,郭庆华.一种筛选产生有机酸新菌种方法的研究[J].食品与发酵工业,1984,(03):64-68.
[19] 全国食品工业标准化技术委员会酿酒分技术委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[20] 杨东伟,李晓静,王芬,等.高效液相色谱法测定葡萄酒中11种有机酸含量[J].安徽农业科学,2013,41(03):1286-1287;1290.
[21] 全国食品工业标准化技术委员会酿酒分技术委员会.GB/T 15037—2006 葡萄酒[S].北京:中国标准出版社,2006.
Screeningofhigh-yieldingacidyeaststrainsinXinjiangwineproducingregionsandoptimizationoffermentationconditions
MA Wen-rui1,WEI Yu-jie1,ZOU Wan1,WU Hao-tian1,TIAN Ge1, WANG De-liang2,MA Jing1, GAO Lin-long1, WU Yun1*,XUE Jie2*
1(Department of Food science and Pharmacy, Xinjiang Agriculture University, Urumqi 830052, China) 2(China National Research Institute of Food and Fermentation Industries, Beijing 10015, China)
39 yeast strains from three major wine-producing regions in Xinjiang including Changji, Manasi and Fukang were screened out to determine culture medium formulation and sensitivity of organic acids high-yieldingSaccharomycescerevisiae. Through initial and repeated screening, 1 strain ofSaccharomycescerevisiaewith high-yielding acids named as Y6 was screend out. The results showed that the volatile acid content ofSaccharomycescerevisiaeY6 was the same as that of commercial yeast strain 71B. Based on these single factor tests, response surface methodology with three variables was employed to optimize the fermentation conditions such as initial acidity, fermentation temperature and inoculum amount. Results showed the optimal fermentation conditions were grape juice initial acidity of 6.70 g/L, fermentation temperature of 20.35 ℃ and inoculum amount of 109CFU/mL. Under these optimal conditions, the acid production capacity reached 1.766 4 g/L. Finally, the consistent results between the predicted value and actual value indicated that the established model in this study was feasible. In a small scale of wine fermentation experiment, compared with the commercial strain 71B, the acid production of Y6 was increased by 1.84 g/L.
Saccharomycescerevisiae; high-yielding acid; culture medium sensitivity; single factor test; response surface
10.13995/j.cnki.11-1802/ts.014187
硕士研究生(武运教授、薛洁教授级高级工程师为通讯作者,E-mail:764630324@qq.com;825728388@qq.com)。
新疆维吾尔自治区重大科技专项(项目编号:2017A01001-2);国家自然科学基金项目—地区科学基金项目(项目编号:31360406)
2017-03-01,改回日期:2017-04-25

