线果芥CpNSP5基因的克隆及表达分析
朱燕飞,陈全家,姚正培,张 杰,曲延英
(新疆农业大学 农学院,农业生物技术重点实验室,乌鲁木齐830052)
干旱不仅影响植物的生长发育,同时影响作物的产量及品质,干旱胁迫已成为作物减产、粮食危机最重要的非生物胁迫因素[1]。中国也是受干旱影响严重的国家之一。尤其是西北内陆,年降水量少,农业水资源紧张。因此,培育抗旱性强的作物品种可以缓解水资源紧张对作物减产的影响。
短命植物是指生长发育周期快,能在短时间内完成生活史的一类植物[2],一般为草本植物,而且多集中在十字花科[3],大多生长在干旱、砾石、荒漠等地。由于特殊的环境气候条件,短命植物的生长发育快、生活周期短、繁殖能力强、光合效率高等特点引起国内外学者的广泛关注。近几年,开始研究短命植物中的抗逆基因。
线果芥(ConringiaplanisiliquaL.)为十字花科线果芥属短命植物,1年生、少数2年生草本。全世界有8种,产中欧、地中海及中亚地区,中国有1种,产新疆、西藏。线果芥染色体基数为7。生活周期为2~3个月。许春华[4]对线果芥进行干旱生理指标研究发现其具有一定的抗旱性。陈琴等[5-6]对线果芥的HRD基因同源克隆,并转化烟草发现CpHRD提高了转基因烟草的抗旱性。本实验从前期干旱胁迫线果芥中通过mRNA差异显示技术得到的414 bp核心片段,克隆得到一个与拟南芥NSP5(nitrile-specifier protein 5)相似性较高的基因。
芥子油苷(glucosinolate)是一类含氮、含硫的植物次生代谢产物,主要分布于十字花科植物。芥子油苷及其降解产物具有多种生化活性,使植物个体对食草动物和微生物病原体表现出抗性[7]。当植物组织遭到破坏时,芥子油苷与黑芥子酶接触后发生不可逆的水解反应,通常先降解为葡萄糖和不稳定的糖苷配基,后者在不同的条件下通过非酶化重组反应,进一步生成异硫代氰酸盐(isothiocyanate,ITC)、硫代氰酸盐(thiocyanate)、腈类(nitrile)、环硫腈(epithionitrile)或唑烷-2-硫酮(oxazolidine-2-thione)等活性物质[8-11]。腈特异蛋白(nitrile-specifier proteins,NSPs)属于芥子油苷-黑芥子酶体系中的一类蛋白质因子。它们间接地影响黑芥子酶对芥子油苷的分解作用,使水解产物从异硫氰酸盐变为腈类物质[12-13]。目前,对NSPs的其他生物学功能还不清楚,对于NSP的研究主要集中于模式植物拟南芥,其余植物中尚未有研究。NSP家族在拟南芥中有5个成员。
短命植物线果芥具有较强的抗逆性,因此,对其抗逆基因的发掘和克隆具有重要意义。本实验室利用mRNA差异显示技术,筛选得到NSP5核心片段,进行基因克隆及生物信息学分析,为线果芥的抗逆机制提供理论依据,为后续NSPs的生物学功能研究奠定基础,为植物的抗逆分子育种提供候选基因。
1 材料和方法
1.1 植物材料及处理方法
线果芥种子由本实验室种植保存。挑选饱满的线果芥种子播种在蛭石和营养土为1∶2的花盆中进行培养。培养条件为25 ℃/23 ℃(昼/夜),16 h 光照/8 h 黑暗,光强为8 000 Lx。选取3~4周龄植株用20% PEG-6000模拟干旱胁迫处理,200 mmol·L-1的NaCl模拟盐胁迫处理,采集胁迫0、3、6、9、12和24 h的叶片样品,每处理3个重复。-70 ℃保存,用于后续的RNA提取。
1.2 线果芥总RNA提取及反转录
线果芥总RNA提取用TIANGEN的TRNzol Total RNA Reagent进行提取,方法参照说明书。用紫外分光光度计检测RNA的质量和浓度,同时用琼脂糖凝胶电泳检测RNA质量。OD260/280在1.9~2.0范围内,电泳条带清晰,用于下一步的反转录反应。反转录用赛默飞的M-MLV First strand cDNA合成试剂盒参照说明书进行。
1.3 CpNSP5基因全长cDNA的克隆
对本实验室用mRNA差显法获得的414 bp核心片段,用Primer 5.0软件设计5′-RACE引物。具体操作参照TaKaRa的5′ Full RACE 试剂盒进行。将扩增产物连入pMD19-T Vector (TaKaRa 公司),转化大肠杆菌α感受态细胞进行菌落PCR,确认重组成功后,菌液送上海生工测序。用DNAMAN软件进行序列拼接,得到cDNA全长序列。
得到拼接的cDNA全长序列后设计扩增该基因全长的引物,进行全长序列的克隆。以线果芥cDNA为模板,CpNSP5-F和CpNSP5-R为引物(表1),利用高保真酶进行PCR扩增。扩增条件为:94 ℃预变性5 min,94 ℃变性30 s,57.5 ℃退火30 s,72 ℃延伸1.5 min,72 ℃延伸10 min;30个循环。琼脂糖凝胶电泳检测扩增产物切胶后用天根公司的胶回收试剂盒进行回收。将胶回收产物连入pMD19-T Vector (TaKaRa 公司),转化大肠杆菌DH5α感受态细胞进行菌落PCR,确认重组成功后,菌液送上海生工测序。
本实验所用引物(表1)由华大基因合成。菌液测序均由上海生工生物工程技术服务有限公司完成。
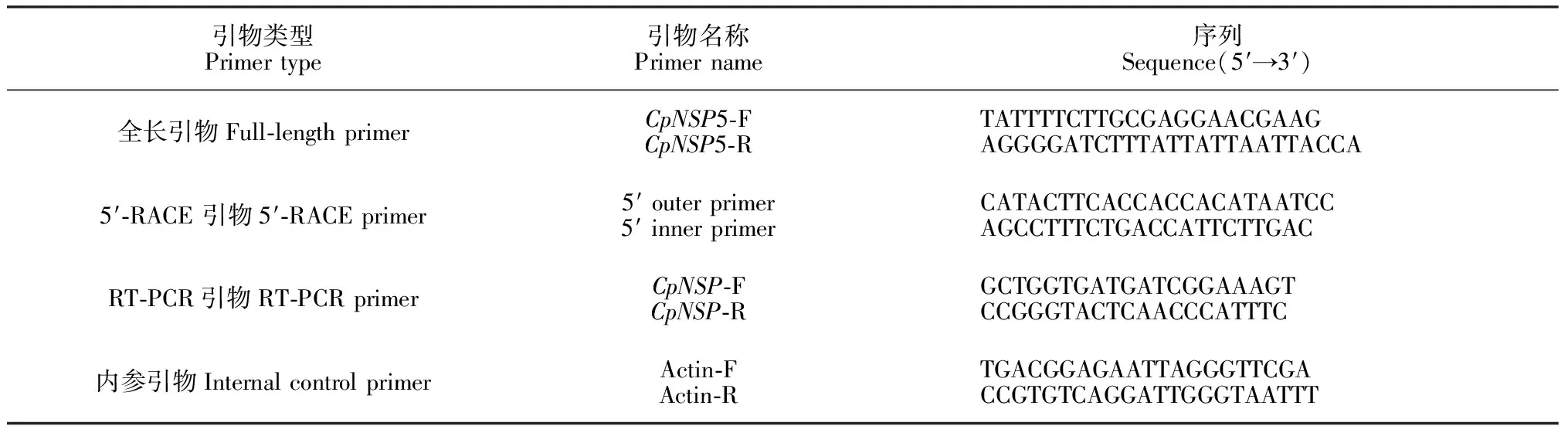
表1 实验中的引物及序列
1.4 CpNSP5基因生物信息学分析
对CpNSP5基因进行序列分析,采用DNAMAN软件分析核苷酸序列。利用ExPASy (http://www.expasy.orgproteomics)数据库中的ProtParam软件推导氨基酸序列的分子量和理论等电点。用SOPMA软件预测CpNSP5基因所编码蛋白的二级结构。利用NCBI网站GenBank 数据库的Blast程序,分析与其他植物的NSP蛋白家族成员的一致性并用Mega5进行系统进化分析。
1.5 干旱和盐胁迫下CpNSP5 基因表达分析
使用7500 Fast Real-Time PCR System,用SYBR Green Ⅰ荧光染料法检测线果芥幼苗在20% PEG-6000和200 mmol·L-1NaCl胁迫不同时间段的基因转录表达水平,反应体系参照Fast SYBR Green Master Mix ABI Applied Biosystems试剂盒说明书进行配制,每个反应3次重复。反应体系中含有10 μL Fast SYBR Green Master Mix(2×),引物各0.4 μL,稀释的cDNA模板2 μL,灭菌水7.2 μL,总体系20 μL。反应程序为95 ℃酶的激活20 s,95 ℃变性3 s,60 ℃退火延伸30 s,40个循环。反应结束后做溶解曲线以及利用2-ΔΔCt法[14]分析数据。
2 结果与分析
2.1 CpNSP5基因克隆
通过Blast比对发现,该基因序列的3′端完整,设计5′-RACE引物,参照TaKaRa公司的5′-RACE试剂盒说明书进行克隆。扩增产物用1% 琼脂糖凝胶电泳检测,结果在2 000 bp和1 000 bp之间有单一条带(图1,A)。经菌液PCR送测后,用Blast比对5′端序列,又用DNAMEN进行序列拼接,得到一个全长为1 313 bp cDNA全长序列,其中开放阅读框(ORF)长966 bp。
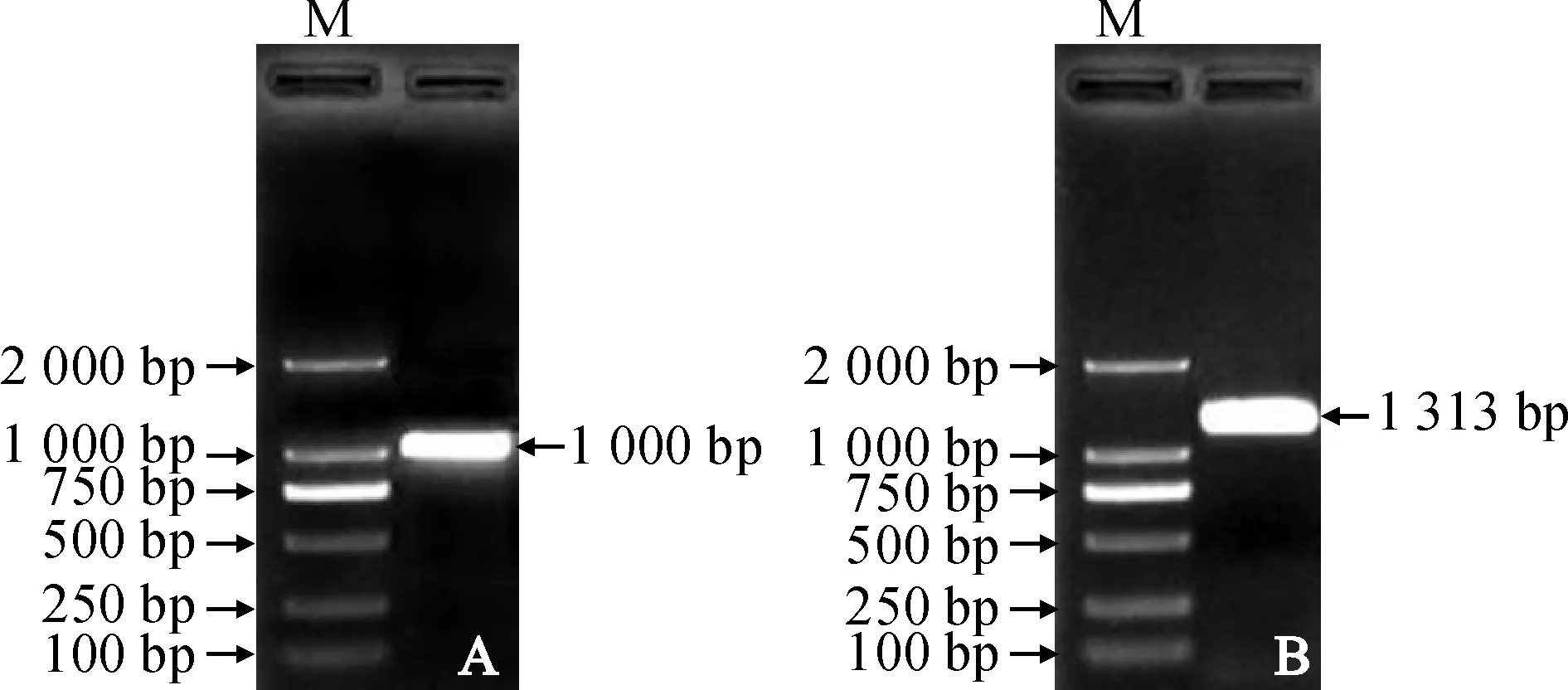
A. 5′-RACE; B. 全长扩增图1 CpNSP5 5′-RACE和cDNA全长扩增结果A. 5′-RACE; B. The amplified full-length cDNA; M. 2 kb DNA ladderFig.1 PCR products of 5′-RACE and the full-length cDNA of CpNSP5
以线果芥cDNA为模板,依据拼接得到的全长cDNA序列,设计基因特异引物CpNSP5-F和CpNSP5-R,用高保真酶进行PCR扩增得到了CpNSP5基因的全长cDNA(图1,B)。回收目的片段并进行连接转化后将阳性克隆测序,表明该序列与拼接序列相同并包含完整的ORF。
2.2 CpNSP5基因序列分析
序列比对发现其和拟南芥的AtNSP5相似性较高,命名为CpNSP5,该基因cDNA全长为1 228 bp,其中开放阅读框长966 bp,5′-UTR长32 bp,3′-UTR长227 bp,起始密码子为ATG,终止密码子为TAG,共编码321个氨基酸,具有一段AATAAA 的3′端转录终止信号(图2)。
2.3 CpNSP5 蛋白的生物信息学分析
氨基酸序列比对结果显示,该蛋白的结构域与山嵛菜(Eutremasalsugineum)的假想蛋白相似性高达92%,与琴叶拟南芥(Arabidopsislyratasubsp.lyrata)的含 Kelch 重复元件的蛋白质(kelch repeat-containing protein)相似性为89%,与拟南芥(Arabidopsisthaliana)的NSP5(nitrile specifier protein 5)蛋白相似性为86%。该蛋白的结构域与Kelch1、Kelch3、Kelch6有相同的结构域(图4),都属于Kelch_3超家族。

下划线部分表示非编码区域;大写字母表示所编码的氨基酸序列图2 CpNSP5基因的cDNA序列及推导的氨基酸序列The under lined letters indicated the non-coding regions;The capital letters showed the deduced amino acids sequenceFig.2 The cDNA sequence of CpNSP5 and its deduced amino acid sequence
ProtParam 预测结果显示,CpNSP5 编码蛋白的分子量为35.034 5 kD,等电点为5.41,蛋白质富含甘氨酸(Gly 13%)和缬氨酸(Val 10.2%),含有少量的半胱氨酸(Cys 1.2%)和谷氨酰胺(Gln 1.2%),不含有吡咯赖氨酸(Pyl)和硒半胱氨酸(Sec)。CpNSP5蛋白的二级结构预测结果显示,该蛋白二级结构包含26个β-折叠,没有α-螺旋,具有典型的Kelch repeat 结构。
2.4 CpNSP5蛋白的系统进化树分析
为了解CpNSP5蛋白与其他物种中NSP蛋白的亲缘关系,对CpNSP5与其他物种已知的NSP5蛋白家族成员进行了系统进化分析。用Blast 分析并用MEGA5软件构建系统进化树发现,CpNSP5与白菜的亲缘关系最近(图3)。
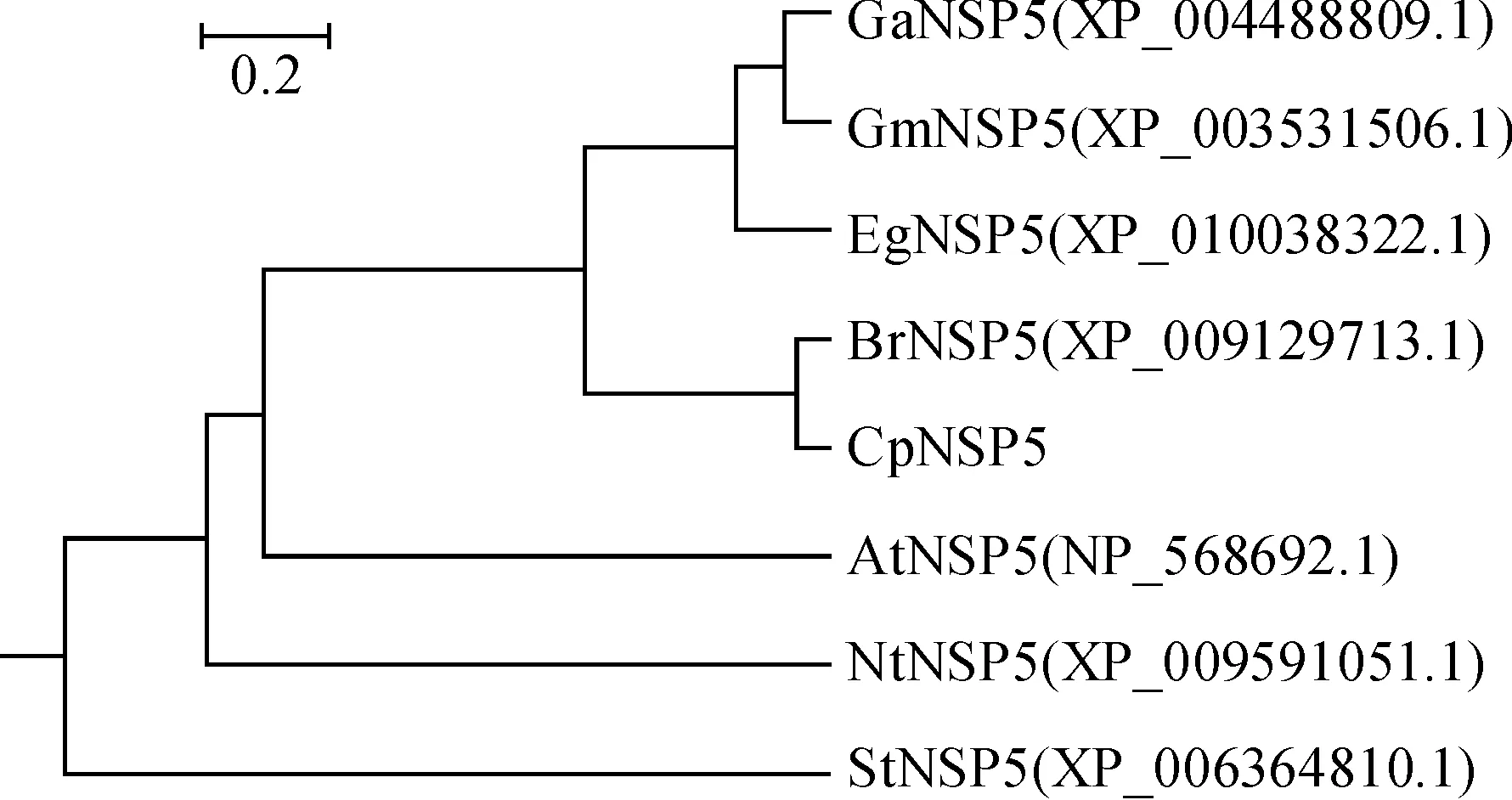
CaNSP5.鹰嘴豆;GmNSP5.大豆; EgNSP5.巨桉;BrNSP5.白菜;CpNSP5.线果芥;AtNSP5.拟南芥;NtNSP5.茸毛烟草; StNSP5.马铃薯图3 CpNSP5与其他植物NSP5蛋白的系统进化分析CaNSP5.Cicer arietinum; GmNSP5.Glycine max; EgNSP5.Eucalyptus grandis; BrNSP5.Brassica rapa;CpNSP5.Conringia planisiliqua L.;AtNSP5.Arabidopsis thaliana; NtNSP5.Nicotiana tomentosiformis; StNSP5.Solanum tuberosumFig.3 Phylogenetic analysis of CpNSP5 and members of NSP5 proteins from other plants

CpNSP5. 线果芥 ; AtNSP5.拟南芥(NP_568692.1);BrNSP5-like.白菜(NP_568692.1); CaNSP5- like.鹰嘴豆(XP_004488809.1);EgNSP5. 巨桉(XP_010038322.1); GmNSP5. 大豆(XP_003531506.1);NtNSP5. 茸毛烟草(XP_009591051.1); StNSP5-like .马铃薯 (XP_006364810.1)图4 线果芥CpNSP5氨基酸序列与其他植物NSP5同源比对CpNSP5. Conringia planisiliqua L.; AtNSP5.Arabidopsis thaliana (NP_568692.1);BrNSP5-like.Brassica rapa (NP_568692.1); CaNSP5-like.Cicer arietinum(XP_004488809.1); EgNSP5.Eucalyptus grandis (XP_010038322.1); GmNSP5.Glycine max (XP_003531506.1); NtNSP5.Nicotiana tomentosiformis(XP_009591051.1); StNSP5-like .Solanum tuberosum (XP_006364810.1)Fig.4 Comparison of amino acids sequence of CpNSP5 and homologous proteins of other plants
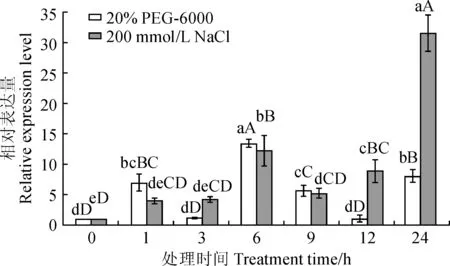
大写和小写字母分别表示0.01和0.05水平差异性显著图5 线果芥CpNSP5基因在干旱和盐胁迫下不同时间的表达Capital letters and normal letters indicate significant difference at 0.01 and 0.05, respectivelyFig.5 The expression of CpNSP5 at different time points under drought and salt stresses
2.5 CpNSP5基因的表达分析
本研究利用qRT-PCR技术检测了CpNSP5基因在20% PEG-6000和200 mmol· L-1NaCl处理条件下的表达情况,结果(图5)显示,CpNSP5 基因表达在不同处理时间均有不同程度的升高,在干旱胁迫下,除12 h有下降外,其余时间段都是升高趋势,并在胁迫6 h达到最高值;在盐胁迫24 h达到最高值。说明CpNSP5基因对干旱和盐都有不同程度的响应。
3 讨 论
线果芥属于野生植物资源,利用本实验室通过干旱胁迫下mRNA差异显示技术筛选克隆得到的414 bp的核心片段,通过RACE技术克隆得到和拟南芥AtNSP5相似性较高的CpNSP5基因。结果表明NSPs参与植物的抗旱调节,不仅可以为植物的抗逆育种提供候选基因,同时也可以为NSPs的生物学功能研究奠定基础。
CpNSP5属于芥子油苷—黑芥子酶系统中的其中1类蛋白质因子,其余2类是硫氰酸盐形成蛋白(thiocyanate-forming protein,TFP)和环硫指定蛋白(epithiospecifier protein,ESP),这3类特异蛋白都可以通过和黑芥子酶结合改变芥子油苷降解产物可塑性,从而激活植物的防御系统[11]。也有研究发现,外源施加芥子油苷降解产物可减轻非生物胁迫伤害,但其如何发挥功能尚不清楚[15-16]。
Blast比对结果显示,CpNSP5基因与十字花科其他植物的NSP基因有较高的一致性。系统进化树分析发现,线果芥NSP5和白菜的NSP5同源性最高。目前已从拟南芥、大蒜芥、甘蓝等植物中分离克隆到编码3类特异蛋白的基因。3类蛋白与植物中其他功能蛋白相似性很低,而3类蛋白之间序列相似性在50%~80%。Kucherning等[11]研究发现ESP、TFP均由NSP分化而来,其分化始于3 600万年前,早于十字花科各物种分化时间,这也说明3类蛋白为何具有较高的相似性。对CpNSP5的蛋白三级结构预测发现,该蛋白属于硫氰酸盐形成蛋白(thiocyanate forming protein ),推测线果芥中的NSPs家族分化相对拟南芥中的较快。
CpNSP5包含26个β-折叠,5个Kelch结构域。Kelch 重复元件首次在果蝇的kelch ORF1 蛋白序列中被发现[17],随后在病毒、植物和哺乳动物等生物体中相继被发现[18],其在生物体内具有多方面的重要功能。Kelch 重复结构元件是由 44~56 个氨基酸长度的重复序列组成,其中有 8 个高度保守的氨基酸:1 个芳香族氨基酸残基 + 4 个疏水性氨基酸残基 + 2 个甘氨酸 + 另外 1 个芳香族氨基酸残基。Kelch 结构域是由3 到 7 个 Kelch 重复结构元件组成,这种结构能形成高度保守的蛋白质三级空间结构——β-propeller(螺旋桨)结构[19]。
而包含有Kelch repeat结构域的蛋白在一些生物进化过程中涉及[20],同时Kelch结构域在蛋白与蛋白的互作中发挥作用,3类蛋白中均含有3~4个重复的Kelch结构域,这与3类特异蛋白能与黑芥子酶结合从而改变芥子油苷降解反应途径功能相一致。结构域分析同时也发现,3类蛋白中只有NSP在N端含有1~2个JRL(jacalin-related lectin,木菠萝素相关凝集素)结构域,该结构域在NSP蛋白功能方面的影响及作用目前尚不清楚[19]。
利用qRT-PCR技术检测CpNSP5基因在盐和干旱胁迫下的表达情况,结果表明该基因在胁迫条件下有不同程度的升高,说明该基因在植物的抗逆过程中发挥作用,这也为NSPs在生物中的其他生物学功能研究提供理论依据。其中,对于NSP的研究主要集中于模式植物拟南芥,上述特异蛋白中部分已成功在体外表达纯化,进行了相关活性的研究[21-23]。
CpNSP5只是NSP基因家族的一个基因,其具体在线果芥中的生物学功能及抗逆机制都需要进一步的研究。
参考文献:
[1]KASIM W A, OSMAN M E,OMAR M N,etal. Control of drought stress in wheat using plant growth promoting bacteria[J].PlantGrowthRegulation,2013,32(1):122-130.
[2]兰海燕,张富春. 新疆早春短命植物适应荒漠环境的机理研究进展[J]. 西北植物学报,2008,28(7):1 478-1 485.
LAN H Y,ZHANG F C. Reviews on special mechanisms of adaptability of early spring ephemeral plants to desert habitats in Xinjiang[J].ActaBotanicaBoreali-OccidentaliaSinica,2008,28(7):1 478-1 485.
[3]毛祖美,张佃民. 新疆北部早春短命植物区系纲要[J]. 干旱区研究,1994,11(3):1-26.
MAO Z M,ZHANG D M. The conspectus of ephemeral flora in northern Xinjiang[J].AridZoneResearch,1994,11(3):1-26.
[4]许春华. 两种短命植物抗旱性评价及其机理研究[D]. 乌鲁木齐:新疆农业大学, 2012.
[5]陈琴,曲延英, 刘静静,等. 两种短命植物HRD转录因子基因的克隆及序列分析[J]. 植物研究,2015,35(2):250-258.
CHEN Q,QU Y Y,LIU J J,etal. Cloning and sequence analysis of HRD transcription factors gene from two kinds of ephemeral plants[J].BulletinofBotanicalResearch,2015,35(2):250-258.
[6]陈琴,李星星,童婷,等. 干旱胁迫对转CpHRD基因烟草的影响[J]. 植物生理学报,2015,(5):715-720.
CHEN Q, LI X X,TONG T,etal. Influence of drought stress on transgenicCpHRDgene in tobacco[J].PlantPhysiologyJournal,2015,51(5):715-720.
[7]BUXDORF K,YAFFE H,BARDA O,etal. The effects of glucosinolates and their breakdown products on necrotrophic fungi[J].PLoSOne,2013,8(8): e70771.
[8]BUROW M,BERGNER A,GERSHENZON J,etal. Glucosinolate hydrolysis inLepidiumsativum——identification of the thiocyanate-forming protein[J].PlantMolecularBiology,2007,63(1):49-61.
[9]LAMBRIX V,REICHELT M,MITCHELL-OLDS T,etal. TheArabidopsisepithiospecifier protein promotes the hydrolysis of glucosinolates to nitriles and influences Trichoplusia ni herbivory[J].ThePlantCell,2001,13:2 793-2 807.
[10]ZHANG Z,OBER J A,KLIEBENSTEIN D J. The gene controlling the quantitative trait locus EPITHIOSPECIFIER MODIFIER1 alters glucosinolate hydrolysis and insect resistance inArabidopsis[J].ThePlantCell,2006,18:1 524-1 536.
[11]KUCHERNIG J C,BUROW M,WITTSTOCK U. Evolution of specifier proteins in glucosinolate-containing plants[J].BMCEvolutionaryBiology,2012,12(1):127.
[12]KISSEN R,BONES A M. Nitrile-specifier proteins involved in glucosinolate hydrolysis inArabidopsisthaliana[J].JournalofBiologicalChemistry,2009,284(18):12 057-12 070.
[13]BRANDT W,BACKENKOHLER A,SCHULZE E,etal. Molecular models and mutational analyses of plant specifier proteins suggest active site residues and reaction mechanism[J].PlantMolecularBiology,2014,84(1-2): 173-188.
[14]LIVAK K J,SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J].Methods,2001,25:402-408.
[15]MARTINEN-BALLESTA M D C,MORENO D A,CARVAJAL M. The physiological importance of glucosinolates on plant response to abiotic stress inBrassica[J].InternationalJournalofMolecularSciences,2013,14(6):11 607-11 625.
[16]MOSTAFA I,ZHU N,YOO M J,etal. New nodes and edges in the glucosinolate molecular network revealed by proteomics and metabolomics ofArabidopsismyb28/29 and cyp79B2/B3 glucosinolate mutants[J].JournalofProteomics,2016,138(1):1-19.
[17]XUE F,COOLEY L. Kelch encodes a component of intercellular bridges inDrosophilaegg chambers[J].Cell,1993,72(5):681-693.
[18]PRAG S,ADAMS J C. Molecular phylogeny of the kelch-repeat superfamily reveals an expansion of BTB/kelch proteins in animals[J].BMCBioinformatics,2003,(4): 42.
[19]ADAMS J,KELSO R,COOLEY L. The kelch repeat superfamily of proteins: propellers of cell function[J].TrendsCellinBiology,2000,10(1):17-24.
[20]ZABALA M T,GRANT M,BONES A M,etal. Characterisation of recombinant epithiospecifier protein and its over-expression inArabidopsisthaliana[J].Phytochemistry,2005,66(8):859-867.
[21]KONG X Y,KISSEN R,BONES A M. Characterization of recombinant nitrile-specifier proteins (NSPs) ofArabidopsisthaliana: dependency on Fe(II) ions and the effect of glucosinolate substrate and reaction conditions[J].Phytochemistry,2012,84(6):7-17.
[22]MATUSHESKI N V,SWARUP R,JUVIK J A,etal. Epithiospecifier protein from broccoli (BrassicaoleraceaL. ssp. italica) inhibits formation of the anticancer agent sulforaphane.[J].JournalofAgricultural&FoodChemistry,2006,54(6):2 069-2 076.
[23]BUROW M,LOSANSKY A,MULLER R,etal. The genetic basis of constitutive and herbivore-induced ESP-independent nitrile formation inArabidopsis[J].PlantPhysiology,2009,149(1):561-574.

