白藜芦醇对脑梗死小鼠线粒体生物合成及脑水肿的影响
裴美娟,王 恺,2,张 婷 ,3,涂 悦,耿 俐
(1.武警后勤学院附属医院 脑科中心,天津 300162;2.中国人民解放军91428部队 卫生队,浙江 宁波 315456;3.中国人民解放军第三医院 医务处,陕西 宝鸡 721000;4.中国人民解放军第三医院 妇产科,陕西 宝鸡 721000)
脑梗死作为常见的一种脑血管疾病,近年来发病率逐渐升高,其较高的致残率和致死率给患者及社会带来了沉重负担,早期干预对于患者的病情控制及预后有着重要意义[1-2]。多项研究证实,应用白藜芦醇可有效改善患者脑水肿和神经功能损伤症状,但具体机制尚未形成定论[3-4]。线粒体是细胞能量代谢的重要场所,线粒体的功能障碍与细胞毒性脑水肿和神经功能损伤程度密切相关,这提示线粒体可能是白藜芦醇发挥神经保护作用的重要靶点之一[5-6]。本研究拟通过构建小鼠大脑中动脉栓塞(MCAO)模型,探讨白藜芦醇对脑水肿的影响,并检测线粒体DNA(mitochondrial DNA,mtDNA)拷贝数以及线粒体生物合成相关基因表达的变化,从而为探索白藜芦醇治疗脑梗死的机制提供更多基础支持。
1 材料与方法
1.1 实验动物 雄性C57BL/6小鼠36只,25~30 g,购于军事医学科学院动物实验中心(动物合格证号:0033432)。
1.2 试剂与仪器 组织DNA/总RNA共提取试剂盒、cDNA合成试剂盒(北京天根生化科技有限公司),real-time PCR试剂盒(康为世纪公司),白藜芦醇(501-36-0(纯度≥98%),武汉远成共创科技有限公司),real-time PCR仪(美国ABI公司),小动物麻醉机、台式动物手术显微镜(深圳瑞沃德公司)
1.3 实验方法
1.3.1 白藜芦醇的配制 将2 g白藜芦醇溶于100 mL生理盐水中,4 ℃保存。
1.3.2 实验分组及术前准备 将36只C57BL/6雄性小鼠随机分为3组,即对照组(C组)、大脑中动脉栓塞组(MCAO组)和白藜芦醇组(R组),每组12只。MCAO组和R组采用线栓法构建大脑中动脉栓塞模型:以400 mL/min的3%浓度异氟烷进行诱导麻醉,随后改为2%浓度持续麻醉。
1.3.3 MCAO模型制备 取颈正中切口,手术显微镜10倍视野下分离并暴露右侧颈内、外动脉分叉处。首先,结扎颈外动脉以防止插线时将线栓插入颈外动脉而未进入大脑中动脉。其次,在颈内动脉上打1个活结但不结扎,为稍后固定线栓做准备。然后,在颈内、外动脉分叉处远端的颈总动脉上结扎以阻断血流,另在距离分叉处近端夹1个动脉夹,为随后插入线栓做准备。最后,在颈总动脉结扎线和动脉夹之间剪一斜形切口,将鱼线从切口插入颈总动脉直至动脉夹处,此时将颈总动脉连同鱼线一起结扎,松紧以不影响线栓移动为宜,撤去动脉夹,将鱼线继续向颈内动脉插入1 cm左右,遇阻力时停止,此时结扎颈内动脉上的套线以固定线栓,缝合皮肤,并在体外留有线栓的另一头。1 h后缓慢拔出部分线栓(约1 cm),并剪断体外部分线栓。
1.3.4 给药剂量及途径 C组小鼠正常饲养,不进行任何特殊操作。MCAO组按1 mL/100 g剂量给予生理盐水灌胃,3次/日;R组按1 mL/100 g剂量给予2%白藜芦醇生理盐水溶液灌胃,3次/日。
1.3.5 MCAO模型评价 麻醉清醒后,小鼠出现如下三种状态之一,则认为MCAO造模成功:①不能完全伸展单侧前肢;②向单侧转圈;③向单侧倾斜[7]。如出现可正常行走或生命体征衰弱则予以剔除并进行增补。
1.3.6 神经功能损伤评分及标本采集 3组小鼠于术后第72小时行mNSS评分,分数越高表明神经功能损伤症状越严重,即0分为正常,最严重为18分。评价完成后通过颈椎离断法处死小鼠,MCAO组及R组留取缺血半暗带同一部位脑组织约10 mg,C组留取相应部位脑组织10 mg。剩余脑组织进行干湿比重测量。
1.3.7 线粒体DNA拷贝数及线粒体合成相关基因表达的测定 依据试剂盒的说明书,提取标本脑组织的基因组DNA和总RNA,并将RNA反转录成cDNA。设计过氧化物酶体增殖物激活受体γ共激活因子-1α(Peroxisome proliferator-activated receptor-gamma coactivator-1alpha,PGC-1α)、过氧化物酶体增生物激活受体δ(peroxisome Proliferator-activated receptorδ,PPARδ)、核呼吸因子-1(nuclear respiratory factor1,NRF1)、线粒体转录因子-A(mitochondrial transcription factor A,TFAM)和线粒体单拷贝基因Cytb的引物。通过实时荧光定量PCR的方法进行基因表达检测,具体操作如下:配制25 μL的PCR反应体系,包括2×SYBR Mixture(12.5 μL),cDNA 50ng或基因组DNA100 ng(2 μL),上下游引物(共2 μL)和双蒸水(8.5 μL),每个基因均设置3个重复孔。反应条件采用两步法:95 ℃预变性10 min,随后95 ℃ 15 s、60 ℃ 1 min共40个循环,随后以0.3 ℃梯度逐渐升温以进行溶解曲线分析。应用2-ΔΔCt法计算各目的基因的相对表达量。引物序列见表1。
表1引物序列
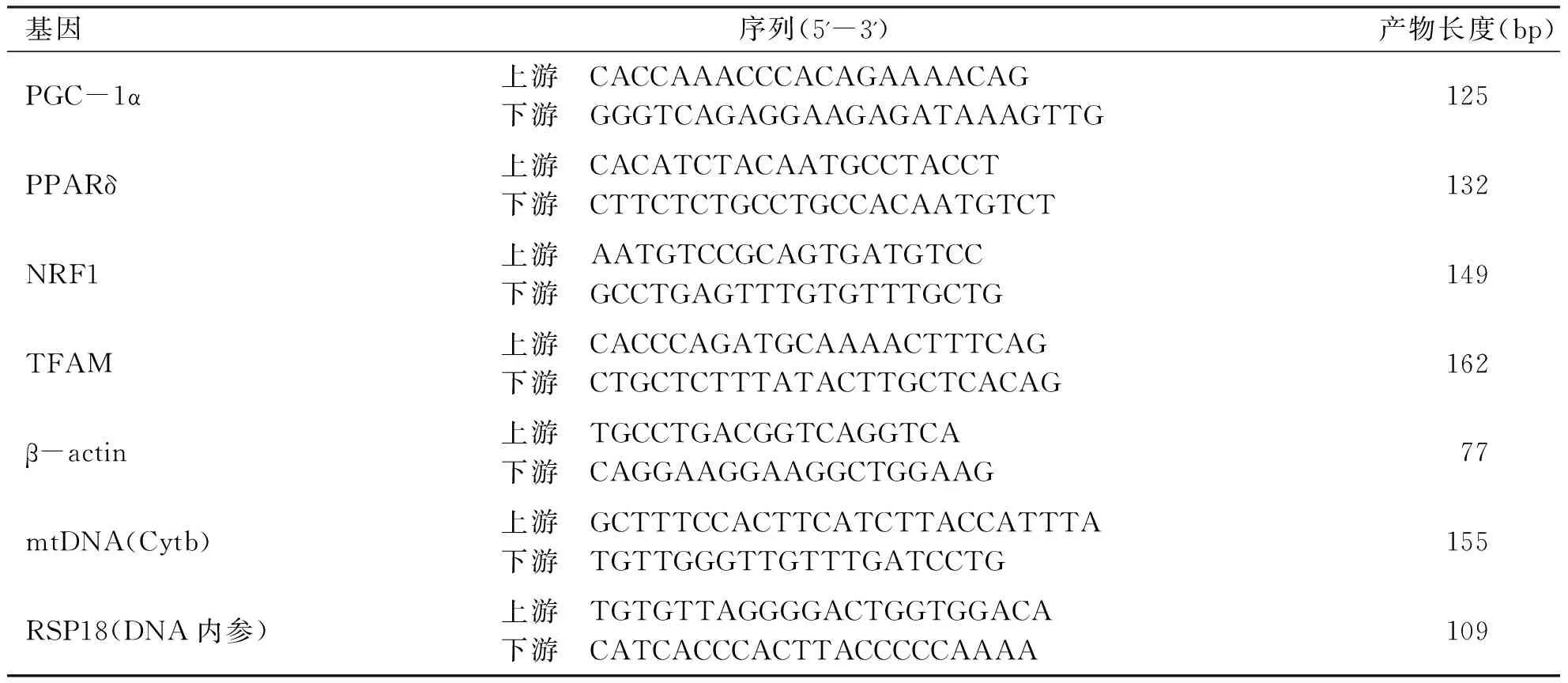
基因 序列(5'-3')产物长度(bp)PGC-1α上游 CACCAAACCCACAGAAAACAG下游 GGGTCAGAGGAAGAGATAAAGTTG125PPARδ上游 CACATCTACAATGCCTACCT下游 CTTCTCTGCCTGCCACAATGTCT132NRF1上游 AATGTCCGCAGTGATGTCC下游 GCCTGAGTTTGTGTTTGCTG149TFAM上游 CACCCAGATGCAAAACTTTCAG下游 CTGCTCTTTATACTTGCTCACAG162β-actin上游 TGCCTGACGGTCAGGTCA下游 CAGGAAGGAAGGCTGGAAG77mtDNA(Cytb)上游 GCTTTCCACTTCATCTTACCATTTA下游 TGTTGGGTTGTTTGATCCTG155RSP18(DNA内参)上游 TGTGTTAGGGGACTGGTGGACA下游 CATCACCCACTTACCCCCAAAA109
1.3.8 脑组织含水量测定 分离左右大脑半球,去除嗅球、小脑和脑干,立即称重,此时为湿重。随后将大脑放入烘干箱中,75 ℃烘烤48 h后称重,此时为干重。含水量=(湿重-干重)/湿重。
2 结果
2.1 造模一般情况 24只手术小鼠,3只于术后72 h内死亡,1只可正常行走,故予以剔除,并增补4只入组。
2.2 神经功能损伤评分 R组和MCAO组mNSS评分显著高于C组,且应用白藜芦醇后R组评分低于MCAO组,差异有统计学意义(P<0.05,见表2)。
2.3 各基因表达及mtDNA拷贝数变化 R组和MCAO组大鼠脑组织中PGC-1α、PPARδ、NRF1和TFAM 基因表达以及mtDNA拷贝数均显著高于C组,且R组高于MCAO组,差异有统计学意义(P<0.05,见表3)。
2.4 脑组织含水量 MCAO组和R组大鼠脑组织含水量显著高于C组,且MCAO组高于R组,差异有统计学意义(P<0.05,见表2)。
表2 mNSS及脑含水量变化

组别mNSS含水量R5.75±1.13*0.774±0.060*MCAO8.63±2.05*0.789±0.004*C 0.000.762±0.007 F104.654.46
*:与其他两组比较,均P<0.05。
表3各基因表达及mtDNA拷贝数变化
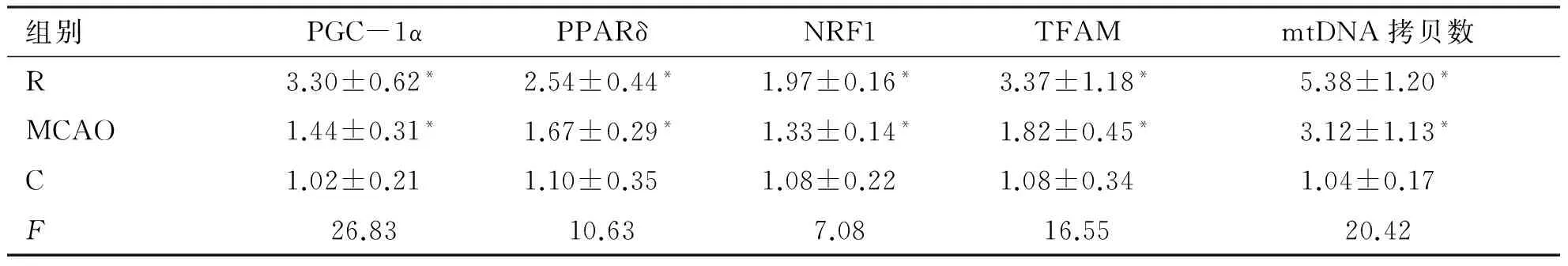
组别PGC-1αPPARδNRF1TFAMmtDNA拷贝数R3.30±0.62*2.54±0.44*1.97±0.16*3.37±1.18*5.38±1.20*MCAO1.44±0.31*1.67±0.29*1.33±0.14*1.82±0.45*3.12±1.13*C1.02±0.211.10±0.351.08±0.221.08±0.341.04±0.17 F26.8310.637.0816.5520.42
*:与其他两组比较,均P<0.05。
3 讨论
脑水肿是发生脑梗死后常见的并发症之一,通常于发病后的第3~5天达到高峰。前期主要是由于脑缺血后,细胞无氧酵解增加导致乳酸堆积,Na+/K+交换通道抑制,细胞内H+浓度升高,促使大量水进入,形成细胞毒性脑水肿[8]。当脑细胞发生水肿后,颅内压可急剧增高,正常脑组织受到压迫,从而加重循环障碍及缺血性损伤,使病情恶化,甚至导致脑疝形成,威胁生命[9]。白藜芦醇主要存在于葡萄、花生根茎、虎杖等植物中,具有抗炎症、抗氧化等效果,对血管内膜亦有保护作用,近年来也有学者将其作为治疗脑梗死的辅助用药,发现其同样具有良好的治疗效果[10]。本实验表明,白藜芦醇可有效减轻脑梗死小鼠的神经功能损伤症状,并有效降低梗死后脑水肿的严重程度,这与刘金梅等[3]的研究结果一致,其发现白藜芦醇可有效降低腔隙性脑梗死患者的血液黏度和体内炎性反应,缓解脑梗死后的临床症状,但目前白藜芦醇发挥脑保护作用的主要机制尚不明确。线粒体是为细胞提供能量的重要细胞器,当缺血缺氧发生时氧化应激及炎症反应的形成可导致线粒体功能障碍,促进脑水肿的发生[11]。但线粒体的基因修复系统效率很低,机体保持mtDNA功能完整的主要机制是通过诱导线粒体生物合成增加而代偿线粒体功能的降低[12]。为此我们进而探讨了脑组织中线粒体生物合成相关基因表达及mtDNA拷贝数的变化。
线粒体生物合成是缺氧、低氧状态下细胞的一种适应手段,该过程可受到多种因素调控,其中PGC-1α、PPARδ、NRF1和TFAM等基因被认为在细胞线粒体生物合成中起着关键调节作用[13]。PGC-1α作为一种共激活因子,可与PPARδ结合,从而使自身发生分子构象改变,促进二者的复合体与组蛋白羟基转移酶结合,增加基因组转录活性[14]。同时PGC-1α表达上调时可激活下游的核呼吸因子NFR-1和NRF-2,进而激活呼吸链相关基因COXⅣ和COXⅤ等基因转录,共同参与协调氧化呼吸链蛋白的表达,促进线粒体生成[15]。另外PGC-1α还可活化TFAM,激活mtDNA编码的氧化磷酸化蛋白的转录,从而促进线粒体进行生物合成[16]。本实验发现,脑梗死后的脑组织中PGC-1α、PPARδ、NRF1和TFAM 基因表达显著上调,mtDNA拷贝数明显增加,表明缺氧造成线粒体损伤后,激活了PGC-1α/TFAM通路,促使mtDNA发生了代偿性扩增。这可能是由于氧化应激反应在造成mtDNA损伤的同时,本身还能作为第二信使,触发呼吸核因子、线粒体转录因子等基因的表达,促进线粒体合成以降低受损mtDNA所占比例,从而代偿氧化供能功能的下降[17];另外脑梗死后可刺激组织乙酰胆碱合成的增加,从而抑制线粒体畸形改变,并促进线粒体的合成,使DNA拷贝数增加[18]。当应用白藜芦醇后,可见大鼠的线粒体生物合成基因表达进一步升高,且mtDNA拷贝数显著提高,表明白藜芦醇可能是通过激活PGC及下游通路,促进mtDNA的生物合成,从而增强缺血缺氧脑组织的能量供应,进而改善脑水肿程度,发挥脑保护作用。这可能是由于白藜芦醇能够通过激活沉默信息调节因子,将p53蛋白第382位赖氨酸残基去乙酰化,从而抑制p53的活性[19],促进PGC及下游基因表达,保障mtDNA拷贝数代偿性增加[20]。
综上所述,本实验通过构建脑梗死小鼠模型,初步探讨了白藜芦醇对脑水肿及线粒体生物合成的影响,为解释白藜芦醇发挥脑保护作用的机制提供了基础支持。但脑梗死的发病是多种因素共同造成的结果,其发生发展也涉及多条通路及靶基因,这仍有待挖掘。若能进一步探讨白藜芦醇对其他通路的影响,或许可为脑梗死的临床治疗用药乃至开发白藜芦醇的新用途提供帮助。
[参考文献]
[1] 丁利静,李菲,石京山,等.淫羊藿苷对大脑中动脉阻塞诱导的缺血性脑卒中模型大鼠的保护作用(英文)[J].遵义医学院学报,2015,38(2):137-145.
[2] 董雯,李保玉,屈园利,等.补阳还五汤治疗脑梗死恢复期气虚血瘀证的Meta分析[J].中西医结合心脑血管病杂志,2016,14(6):580-585.
[3] 刘金梅,张昕娟,孙静,等.白藜芦醇辅治对腔隙性脑梗死后炎性反应及血液流变学的影响[J].临床合理用药杂志,2015,8(22):7-8.
[4] Wong R H,Coates A M,Buckley J D,et al.Evidence for circulatory benefits of resveratrol in humans[J].Ann N Y Acad Sci,2013,1290(12):52-58.
[5] 胡捷先,陈献华.脑缺血后谷氨酸通路及其调控的研究进展[J].复旦学报:医学版,2016,43(6):724-731.
[6] Malakhova L,Bezlepkin V G,Antipova V,et al.The increase in mitochondrial DNA copy number in the tissues of gamma-irradiated mice[J].Cell Mol Biol Lett,2005,10(4):721-732.
[7] Chen J,Sanberg P R,Li Y,et al.Intravenous administration of human umbilical cord blood reduces behavioral deficits after stroke in rats[J].Stroke,2001,32(11):2682-2688.
[8] 许静,王光义.针刺对脑缺血再灌注损伤大鼠脑水肿和脑梗死面积变化的调节[J].辽宁中医药大学学报,2010,12(10):47-49.
[9] 宋海燕,王仙丽,伊生勇.恶性脑梗死伴脑水肿的研究进展[J].武警后勤学院学报:医学版,2016,25(7):593-596.
[10]任俊伟,杨琴.白藜芦醇对脑缺血/再灌注氧化应激损伤保护机制的研究进展[J].中国药理学通报,2011,27(4):448-451.
[11]朱志安,张红,高远征.创伤性脑水肿脑组织乳酸及线粒体SOD、MDA水平的变化[J].中国临床神经外科杂志,2000,16(2):48-50.
[12]付浩,杨小飒,余东堃,等.凋亡抑制剂zVAD对脑缺血再灌注小鼠外周血线粒体DNA拷贝数的影响[J].遵义医学院学报,2016,39(6):593-596.
[13]李强,翟宇,张婷,等.脑缺血再灌注后线粒体氧化应激损伤的动态变化[J].中国临床神经科学,2014,22(3):241-247.
[14]李伟文,陆松敏.过氧化物酶体增殖物激活受体γ共激活因子-1的研究进展[J].国外医学·临床生物化学与检验学分册,2005,23(1):21-22.
[15]Dorn G W,Vega R B,Kelly D P.Mitochondrial biogenesis and dynamics in the developing and diseased heart[J].Genes Dev,2015,29(19):1981-1991.
[16]LeBleu V S,O′Connell J T,Gonzalez H K N,et al.PGC-1α mediates mitochondrial biogenesis and oxidative phosphorylation in cancer cells to promote metastasis[J].Nat Cell Biol,2014,16(10):992-1003.
[17]付浩,胡文静,王志宏,等.脑缺血再灌注小鼠线粒体DNA拷贝数与神经功能损伤相关性研究[J].现代中西医结合杂志,2017,26(1):4-6.
[18]Sun L,Zhao M,Yu X J,et al.Cardioprotection by acetylcholine: a novel mechanism via mitochondrial biogenesis and function involving the PGC-1α pathway[J].J Cell Physiol,2013,228(6):1238-1248.
[19]Wilking M J,Singh C,Nihal M,et al.SIRT1 deacetylase is overexpressed in human melanoma and its small molecule inhibition imparts anti-proliferative response via p53 activation[J].Arch BiochemBiophys,2014,563(8):94-100.
[20]Sahin E,DePinho R A.Axis of ageing: telomeres,p53 and mitochondria[J].Nat Rev Mol Cell Biol,2012,13(6):397-404.

