绿原酸对胃癌SGC-7901细胞增殖及诱导因子AIF表达的影响
白建伟,王 峰,潘 鸿,赵 兰,粟立羽,李 岩
(1.遵义医学院 公共卫生学院劳动卫生与环境卫生学教研室,贵州 遵义 563099;2.遵义医学院 公共卫生学院预防医学教研室,贵州 遵义 563099;3.遵义医学院 公共卫生学院食品与营养学教研室,贵州 遵义 563099;4.遵义医学院 公共卫生学院卫生毒理学教研室,贵州 遵义 563099)
绿原酸是从中药、果蔬等物质中提取的一种天然的多酚类化合物,具有抗炎、抗氧化、抗菌和抗肿瘤等作用[1-2]。绿原酸能有效抑制结肠癌、肺癌、肝癌等癌细胞的生长,抑制作用与剂量无依赖性[3-4],目前尚不清楚绿原酸对胃癌细胞是否也有抑制作用。刘洁等[4]研究发现,绿原酸对Lewis肺癌移植瘤小鼠和H22肝癌移植瘤小鼠的胸腺、脾脏均无明显影响,这表示绿原酸在发挥抗肿瘤活性的同时并没有对免疫器官产生损伤。绿原酸能通过Caspase依赖性凋亡途径诱导细胞凋亡[5],但能否通过AIF介导的非Caspase依赖性线粒体途径诱导胃癌细胞凋亡尚不清楚。
本实验采用不同浓度的绿原酸处理中分化人胃癌SGC-7901细胞,研究绿原酸对SGC-7901细胞增殖的影响,以及不同浓度绿原酸作用于胃癌细胞后,非Caspase依赖途径中凋亡诱导因子AIF的变化,为胃癌治疗提供新的思路和方向。
1 材料与方法
1.1 主要试剂与来源 绿原酸(Sigma公司,纯度>95%),人胃癌SGC-7901细胞株(中国科学院上海细胞所),DMEM培养基(Hyclone),胎牛血清FBS(Hyclone),青链双抗(上海生工),噻唑蓝(Sigma),细胞线粒体分离试剂盒(碧云天),JC-1 探针(碧云天),Trizol(invitrogen),PCR引物来源(生工),SYBRGreen PCR试剂盒(Thermo F-415XL),逆转录试剂盒(Thermo #K1622),BCA 蛋白定量试剂盒(凯基),30%丙烯酰胺(无锡菩禾),PBS 磷酸盐缓冲液(无锡菩禾),蛋白预染Marker(Thermo),PVDF膜(millipore)。
1.2 方法
1.2.1 药品配制 称取155 mg的绿原酸粉末溶于1 mL的无水乙醇中,配成终浓度为155 mg/mL的绿原酸母液。使用时,需稀释1 000倍。
1.2.2 细胞培养 用含10%胎牛血清的DMEM培养基,体外培养人胃癌SGC-7901细胞,37 ℃、5%CO2培养箱中培养。隔天换一次液,观察细胞生长状况,待细胞长到70%~80%后,进行后续实验。
1.2.3 MTT法检测细胞存活率 将细胞浓度调整为2×105个/mL,每孔加入200 μL细胞悬液(96孔板),置于37 ℃,5% CO2培养箱内培养24 h,每组设3个实验学重复;按预设梯度(4.84 μg/mL、9.69 μg/mL、19.375 μg/mL、38.75 μg/mL、77.50 μg/mL和155 μg/mL)加入稀释好的绿原酸溶液,继续分别培养12、24、48、72 h;培养结束前4 h每孔再加入10 μL MTT溶液;培养结束后,弃上清,每孔加入100 μL DMSO溶液;酶标仪测定570 nm波长下各孔的吸光值,计算3个复孔吸光值(A),按照公式计算出SGC-7901细胞的存活率:细胞存活率(%)=(实验组A值-调零组A值)/(对照组 A 值-调零组组A值)(设:对照组细胞存活率为100%)。
1.2.4 细胞线粒体和胞浆蛋白分离 收集细胞,用预冷的PBS重悬细胞,600×g,4 ℃离心5 min,弃上清;加入1.0 mL线粒体分离试剂,重悬细胞,冰浴10 min;用超声波细胞粉碎仪处理细胞,600×g,4 ℃离心10 min;取上清液移至新的EP管中,11 000×g,4 ℃离心10 min;上清液为胞浆蛋白,沉淀即为细胞线粒体。
1.2.5 JC-1检测SGC-7901细胞线粒体膜电位变化情况 将细胞浓度调整为1×105个/mL,每孔加入3mL细胞悬液 (6孔板);37 ℃,5% CO2培养箱内培养24 h;加药前将培养基换成无血清培养基,设不加药对照组,加药组按照19.375、38.75、77.5 μg/mL进行加药处理细胞;培养24 h后收集细胞,用无菌的PBS洗涤细胞两次;加入500 μL JC-1工作液(现用现配),37 ℃,5% CO2的培养箱中孵育30 min;用PBS洗涤细胞两次,荧光倒置显微镜观察细胞荧光变化。
1.2.6 荧光定量 PCR 法检测AIF基因的表达情况(见表1)。
表1引物名称、序列及产物大小
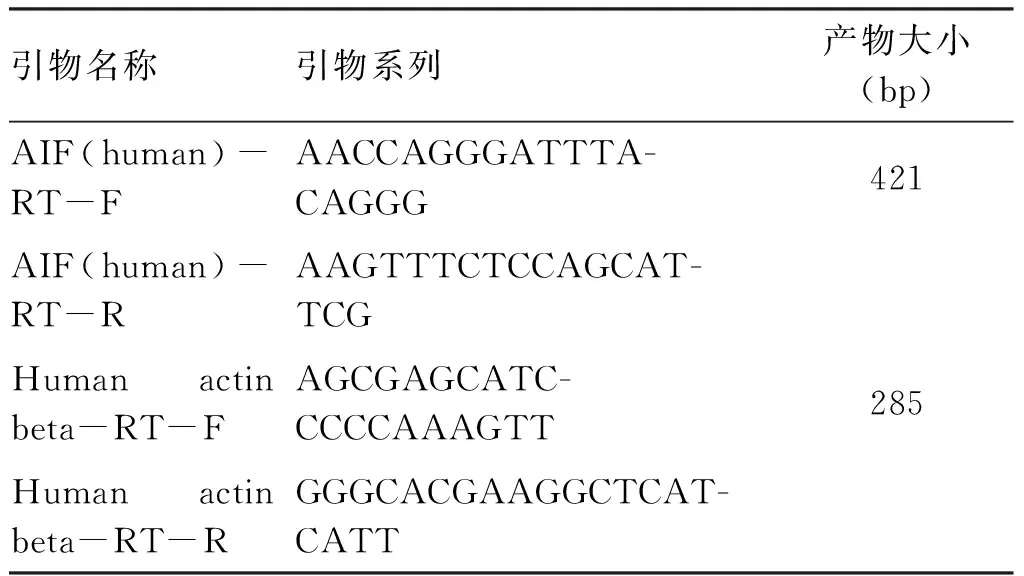
引物名称引物系列产物大小(bp)AIF(human)-RT-FAACCAGGGATTTA-CAGGG421AIF(human)-RT-RAAGTTTCTCCAGCAT-TCGHumanactinbeta-RT-FAGCGAGCATC-CCCCAAAGTT285Humanactinbeta-RT-RGGGCACGAAGGCTCAT-CATT
将处理好的细胞用适量的Trizol 裂解液充分裂解,向离心管中加入200 μL预冷的氯仿,剧烈振荡后室温静置10 min;12 000×g,4 ℃,离心10 min;吸取上层水相约500 μL转移至新的离心管中,加入500 μL的异丙醇,颠倒混匀6~8次,-20 ℃冰箱放置30 min;10 000×g,4 ℃,离心15 min;弃上清,75%乙醇洗涤沉淀2次(4 ℃,8 000×g,离心5 min),弃上清,滤纸吸净残存乙醇,自然干燥5~10 min;20 μL DEPC处理水,溶解RNA;测定RNA浓度;按照逆转录试剂盒操作说明书进行逆转录;扩增程序为:热变性 95 ℃ 10 min,扩增(95 ℃ 20 s,62 ℃ 30 s,72 ℃ 30 s)40个循环;数据采用仪器自带软件分析。
1.2.7 Western blot 法检测AIF蛋白的表达情况 将处理好的细胞用RIPA裂解液充分裂解,12 000×g,4 ℃,离心10 min,取上清,进行蛋白质定量后,加入适量蛋白上样缓冲液,煮沸 10 min,离心后取上清待用,制备SDS-聚丙烯酰胺凝胶,上样后,依次进行电泳-电转-封闭-一抗孵育(AIF 1∶2 000)-二抗孵育(兔抗 1∶2 000)-凝胶成像系统检测。
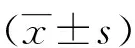
2 结果
2.1 绿原酸对人胃癌SGC-7901细胞增殖的影响 MTT结果显示(见图1),4个时间点变化趋势基本一致,随着绿原酸的浓度增加,对SGC-7901细胞的生长抑制率也逐渐增加。然而12 h时绿原酸作用于细胞的时间较短,对细胞的抑制效果不太明显,而24、48、72 h时整体变化基本一致,因此选择给药后培养时间为24 h。4.84、9.69、19.375、38.75、77.50、155 μg/mL绿原酸作用于细胞24 h后,抑制率分别为(5.28±3.93)、(7.51±3.87)、(18.94±0.95)、(51.61±0.59)、(66.23±0.71)、(71.07±1.98),浓度为19.375、38.75、77.50 μg/mL时抑制率增加明显,标准差小,差异有统计学意义(P<0.01),因此选择后续实验的给药浓度为19.375、38.75、77.50 μg/mL。以上结果表明不同浓度的绿原酸均能抑制SGC-7901细胞的生长,呈剂量依赖性。
A:12 h;B:24 h;C:48 h;D:72 h。*表示与对照组相比,P<0.05;**表示与对照组相比,P<0.01。图1 绿原酸对胃癌SGC-7901细胞的存活率的影响
2.2 绿原酸处理人胃癌SGC-7901细胞后线粒体膜电位的变化 JC-1是一种具有通透性的荧光染料,能随着线粒体膜电位的变化而变化。当线粒体膜电位高时,JC-1浓度也随之增加,呈现红色荧光;当线粒体膜电位低时,JC-1浓度也随之降低,呈现绿色荧光。图2结果显示,对照组红色荧光很强,表明线粒体膜电位较高;而用药组随着用药浓度的增加,红色荧光逐渐减弱,绿色荧光逐渐增强,表明线粒体膜电位逐渐下降。
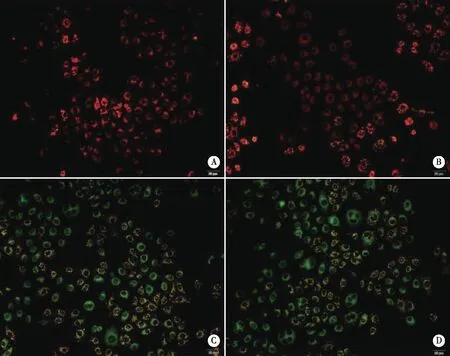
A:对照组;B:19.375 μg/mL;C:38.75 μg/mL;D:77.5 μg/mL。图2 绿原酸处理胃癌SGC-7901细胞后膜电位的变化
2.3 绿原酸对人胃癌SGC-7901细胞AIFmRNA表达量的影响 qRT-PCR结果显示(见图3),绿原酸作用于SGC-7901细胞24h后,与对照组相比,用药组AIF基因的表达水平明显升高,差异有统计学意义(P<0.01)。中浓度组(38.75 μg/mL)、高浓度组(77.50 μg/mL)AIF的表达水平显著高于低浓度组(19.375 μg/mL,P<0.01,P<0.01)。
2.4 绿原酸对人胃癌SGC-7901细胞AIF蛋白表达量的影响 Western blot结果显示(见图4),绿原酸作用于SGC-7901细胞24 h后,与对照组相比,线粒体中AIF的蛋白表达量明显降低,而细胞质中AIF的蛋白表达量显著升高,差异均有统计学意义(P<0.05);绿原酸浓度越高,线粒体中AIF的蛋白表达量越低,而细胞质中AIF的蛋白表达量越高。提示绿原酸能促进AIF从线粒体转运到细胞质,从而发挥促凋亡作用。
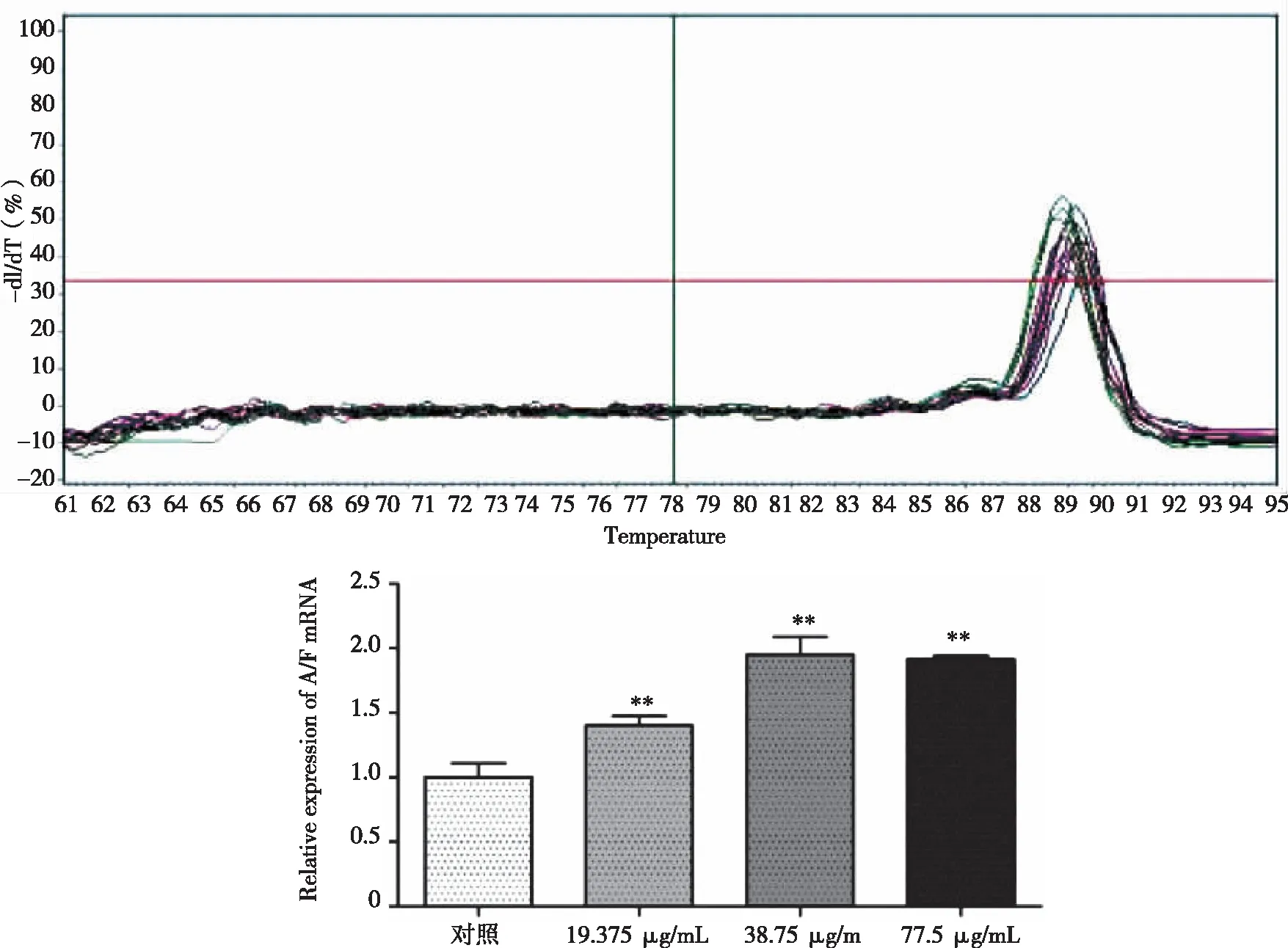
**表示与对照组相比,P<0.01。图3 绿原酸对AIF基因表达量的影响
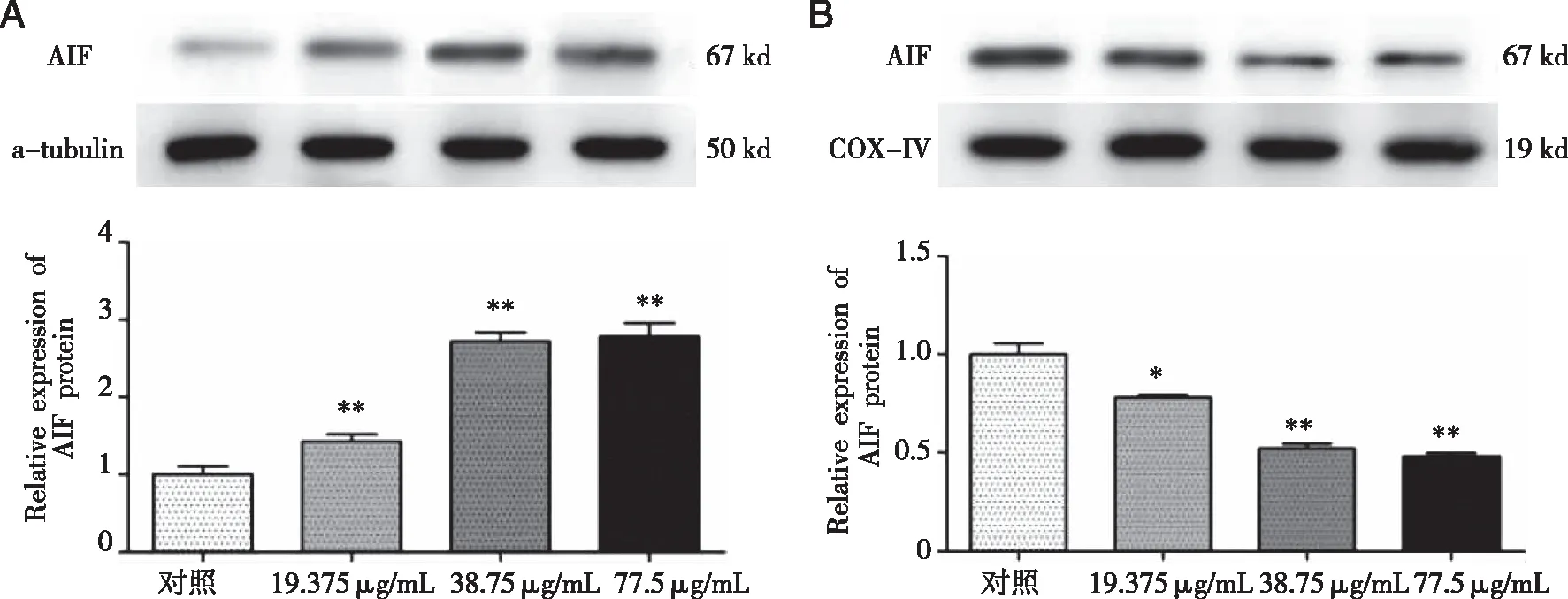
A:细胞质;B:线粒体;*表示与对照组相比,P<0.05;**表示与对照组相比,P<0.01。图4 绿原酸对AIF蛋白表达量的影响
3 讨论
胃癌是全球第三大癌症,发病率仅次于肺癌和肝癌[6]。多数胃癌在确诊时已处于晚期,需要手术联合化疗进行治疗,目前临床上常用的化疗药物普遍存在副作用大、耐药性等不良反应,而天然抗癌药物对机体的低毒性,是临床治疗迫切需要的[7-8]。因此,对于天然抗癌药物的研究显得尤为重要。
绿原酸是一种有前景的癌症治疗药物,能抑制多种癌细胞的增殖,如人视网膜母细胞瘤HXO-RB44[9]、人鼻咽癌细胞株CNE-1[10]、乳腺癌[11]等,其抑制作用的发挥可能与抑癌基因的表达增加及细胞周期蛋白的表达降低有关。细胞凋亡是生物体进行自我更新和自我调节的一种重要手段,是生物体维持自身正常生理功能的重要保障。线粒体是细胞凋亡的调控中心,当细胞受到凋亡刺激后,线粒体外膜的通透性增高,将位于内外膜间的线粒体蛋白释放到细胞质或细胞核中,通过Caspase依赖和非依赖两种途径,诱导细胞凋亡[12]。AIF是Caspase非依赖途径中最保守的促凋亡蛋白,是细胞凋亡的起始因子和效应因子,在胃癌SGC-7901细胞中高表达[13]。AIF同时也是维持线粒体正常生理功能的重要蛋白,前体蛋白分子量为67 kDa,正常情况下存在于线粒体内外膜间,受凋亡刺激后,AIF会裂解为成熟蛋白,通过激活钙蛋白酶和(或)组织蛋白酶从线粒体转运到细胞质最后转至细胞核,促使染色体凝集,导致细胞凋亡[14]。
本实验研究显示,绿原酸能抑制胃癌SGC-7901细胞的增殖,抑制率随着药物浓度和作用时间的增加而增加。线粒体膜电位的降低是早期细胞凋亡发生的一种特异性标志,有研究显示Aβ 1-42寡聚体可通过促进AIF从线粒体向细胞核转位,介导大鼠神经细胞的凋亡[15]。本研究通过荧光显微镜观察发现,绿原酸作用于胃癌SGC-7901细胞后绿色荧光增强,表明细胞发生了早期凋亡。细胞受到凋亡刺激,会促使AIF从线粒体移位至细胞质,这一点也在本研究中得以验证。Western blot结果显示线粒体中AIF蛋白的表达量随着药物浓度的增加呈上升趋势,相反,细胞质中AIF蛋白的表达量随着药物浓度的增加呈下降趋势。有研究显示穿心莲内酯可诱导SKOV3、A431细胞凋亡,其诱导凋亡可能与线粒体膜电位下降有关[16]。
综上所述,绿原酸能抑制胃癌SGC-7901细胞的增殖,并降低线粒体膜电位,促进AIF从线粒体转移至细胞质,从而可能诱导细胞发生凋亡。
[参考文献]
[1] Olthof M R,Hollman P C,Katan M B,et al.Chlorogenic acid and caffeic acid are absorbed in humans[J].Journal of Nutrition,2001,131(1):66-71.
[2] 王丽萍,郭栋,王果,等.中药绿原酸的研究进展[J].时珍国医国药,2011,22(4):961-963.
[3] 孙秋艳,刘艳,汪茜,等.绿原酸对Lewis肺癌小鼠及人A549肺癌的实验研究[J].华西药学杂志,2010,25(5):536-538.
[4] 刘洁,张洁,王璐,等.绿原酸抗肿瘤及与阿霉素联合用药后的增敏作用研究[J].中药药理与临床,2009,25(2):43-45.
[5] 刘云龙,宋卓,彭冰洁,等.绿原酸对Fas/FasL途径介导的非酒精性脂肪肝细胞凋亡的影响[J].中国食物与营养,2015,21(7):67-70.
[6] 邵妤,寇露露,李烜,等.细胞信号通路在胃癌中的研究进展[J].山西医药杂志,2016,45(17):2021-2024.
[7] Verlato G,Marrelli D,Accordini S,et al.Short-term and long-term risk factors in gastric cancer [J].J World J Gastroenterol,2015,21(21):6434-6443.
[8] 杨静,程玉,王明娟,等.Caspase-3、Caspase-9在胃癌组织中的研究进展[J].承德医学院学报,2016,33(6):506-509.
[9] 赵静滨,何熹微,姚素艳,等.绿原酸对视网膜母细胞瘤细胞株HXO-RB44的生长抑制作用[J].西安交通大学学报:医学版,2016,37(5):734-738.
[10]姚素艳,李全胜,郑德宇.绿原酸对体外培养的人鼻咽癌细胞株CNE-1的作用[J].西安交通大学学报:医学版,2014,35(6):837-842.
[11]Zhang J Q,Yao Z T,Liang G K,et al.Combination of lapatinib with chlorogenic acid inhibits breast cancer metastasis by suppressing macrophage M2 polarization[J].浙江大学学报,2015,44(5):493-499.
[12]向军军,赖菁菁,胡跃强.近3年线粒体介导细胞凋亡的研究进展[J].中西医结合心脑血管病杂志,2016,14(13):1497-1499.
[13]Kang S K.A Phenolic compound,5-caffeoylquinic acid (chlorogenic acid),is a new type and strong matrix metalloproteinase-9 inhibitor:isolation and identification from methanol extract of Euonymus alatus[J].Life Sciences,2005,77(22):2760-2769.
[14]于翠娟,王成济,杨安钢.AIF及AIF依赖的细胞凋亡[J].医学分子生物学杂志,2003,25(6):351-354.
[15]杨梅,任真奎,官志忠,等.Aβ1-42寡聚体在非Caspase依赖性细胞凋亡通路中的作用机制[J].贵州医科大学学报,2017,42(3):253- 257.
[16]石静,梁勇刚.穿心莲内酯对人皮肤基底细胞癌A431细胞生长、凋亡及增殖细胞核抗原蛋白表达的影响[J].解剖学报,2013,44(1):73- 78.

