转基因玉米MON88017测量不确定度的评定
宋 君, 李 洁, 常丽娟, 王 东,张富丽, 刘文娟, 雍 彬
(1. 四川省农业科学院 分析测试中心, 四川 成都 610066; 2.四川省农业科学院 农村经济与农业信息研究所, 四川 成都 610066;3. 四川师范大学 生命科学学院, 四川 成都 610101)
转基因玉米MON88017品系(商品名称为YieldGardTMVTTMRootwormTMRR2)是孟山都公司(Monsanto Company)于20世纪90年代开发的“双抗”(杀虫兼抗除草剂)转基因玉米.该品系人为构建了2个表达框:增强启动子eCaMV35S、终止子hsp调控的杀虫基因Cry3Bb1表达框和启动子ract、终止子NOS调控的抗除草剂基因CP4-epsps表达框.转基因玉米MON88017品系经过安全评价后,已有20多年的商业化种植历史.1995年美国首次商业化种植转基因玉米MON88017,2006年日本和加拿大开始种植该转基因玉米品系,2010年巴西和阿根廷也开始商业化种植转基因玉米MON88017,洪都拉斯在2013年批准商业化种植该品系[1].转基因玉米MON88017主要用于食品、饲料生产和加工的原材料或直接食用.我国于2010年批准进口该转基因作物但仅用作加工的原材料,禁止商业化种植.虽然转基因生物在许多国家已经批准用作食品生产和加工的原材料,但由于种种原因消费者不完全接受转基因食品.为了保护消费者的权益,许多国家出台了转基因食品的阈值标识管理政策,食品中转基因成分的质量分数超过规定的阈值必须进行标识[2].因此,对于国际贸易和标识管理,转基因生物及产品的精准检测及测量不确定度评定尤为重要.
由于转基因成分的定量检测过程比较复杂、涉及多个中间量的测量以及目标片段的(最终)间接测量,对测量结果的影响因素较多(多次液体转移、校准曲线两次拟合、目标片段两次绝对定量等).目前,评估影响测量因素及大小的方法有多种,但得到学术界和计量领域广泛认可的方法主要有“不确定度传播”(Law of Uncertainty Propagation,该法文件化为Guide to the Expression of Uncertainty in Measurement,GUM)和“概率密度分布传播”(Propagation of Probability Distribution,又名Monte Carlo Method,MCM)2种方法.虽然“GUM”和“MCM”都是基于统计学的测量不确定度评定方法,但是二者原理不同:前者是对各影响因子的均值及其不确定度(包括自由度等)通过数学模型进行传递,后者是对各影响因子的整个概率分布进行传播[3-4].对于测量不确定度的评定,因GUM法存在“输出量为正态分布等假设”的局限[5],所以GUM法不适用于所有测量不确定度的评定.关于测量不确定度评定的研究与应用主要集中在物理、化学和机械制造等领域[6-10],在生物领域的应用相对较少[11],在转基因生物定量检测领域的研究与应用更是鲜有报道,仅见文献[12-13],但这些评定结果未经MCM验证,尚不知GUM法是否适用于转基因生物定量检测的不确定度评定.为了了解“GUM”和“MCM”方法在评定转基因成分测量不确定度中的差异及验证“GUM”方法是否适用于转基因成分测量不确定度的评定,本文首次采用“GUM”和“MCM”方法对转基因玉米MON88017的测量不确定度进行评定,比较2种方法评定转基因成分测量不确定度的差异和确定GUM法在转基因成分测量不确定度评定中的适用性.
1 材料与方法
1.1材料、试剂和仪器用质量分数为100%的转基因玉米MON88017粉末作为标准物质校准实时荧光PCR仪(拟合校准曲线).质量分数为1.5%的转基因玉米MON88017混合样品(粉末)作为测试样品(试样);DNA提取和实时PCR试剂采用北京TIANGEN生化技术有限公司生产的植物基因组DNA提取试剂盒和Real Time PCR试剂盒(探针型);超微量分光光度计(Thermo,USA)、实时PCR系统(Applied Biosystem Incorporation,Foster city,USA)分别用于DNA质量检测和测量标准物质、试样的内源基因zSSIIb和MON88017分子片段的绝对质量(ng或copies);引物和探针采用本实验室设计、报道的序列[14].
1.2DNA提取、校准曲线拟合及PCR体系配制称取质量分数为100%的转基因玉米MON88017粉末和试样各100 mg,按照植物基因组DNA提取试剂盒说明书操作.
将提取到的质量分数为100%转基因玉米MON88017粉末的DNA溶液80 ng/μL,先稀释到50 ng/μL,然后再以体积比1∶10稀释成4个质量浓度梯度(浓度点):5、5×10-1、5×10-2、5×10-3ng/μL.根据Arumuganathan等[15]报道的玉米基因组大小,100 ng玉米DNA相当于3.65×104拷贝DNA.分别取3 μL上述4个质量浓度点的DNA溶液作为扩增模板校准PCR仪(拟合标准曲线),每个DNA溶液质量浓度点做3次平行校准试验.
25 μL PCR体系中包含 3 μL DNA梯度校准溶液(或50~100 ng试样DNA),Taqman®Master mix(2×)12.5 μL,上/下游引物(10 μmol/L)各1 μL,探针(10 μmol/L)0.5 μL,补充灭菌水至25 μL.试样PCR反应重复32次.PCR反应程序为95 ℃,10 min;95 ℃,15 sec;60 ℃,1 min(40 cycles).
2 数学测量模型
(1)式为转基因成分定量检测的校准曲线
Ct=m×lgA+k,
(1)
式中,A为内源、外源基因的绝对质量(单位:ng或copies),Ct是A的响应值(循环数阈值),k和m分别为校准曲线的截距和斜率.
将试样内源、外源基因的Ct值代入(1)式,计算获得试样内源、外源基因的绝对质量.根据(2)式计算试样中外源基因的质量分数C(最终输出量)
C=A外/A内×100%,
(2)
式中,A外、A内分别为试样中外、内源基因的绝对质量.
3 不确定度评定
3.1MCM在转基因玉米MON88017测量过程的校准曲线拟合阶段,从校准子A和Ct(输入量)的概率分布(probability distribution function,PDF)(根据已知信息、资料等设定输入量的PDF)中分别随机抽取M=106个样本量,然后将获得的2个106个样本量(校准子A和Ct)分别通过数学模型(1)和Sega等[16]报道的方法获得模型(1)的中间输出量m和k.再从测试样品Ct的PDF中抽取106个样本量,通过数学模型(1)获得测试样品内源、外源基因的绝对质量A内、A外(中间输出量),最后分别从A内和A外的PDF中分别抽取106个样本量,通过数学模型(2)获得测试样品中转基因玉米MON88017的质量分数C(最终输出量)的PDF、平均值、标准不确定度以及在95%包含概率下的包含区间.MCM评定中的所有计算由MATLAB程序完成.
3.2GUM法为了与MCM评定的不确定度成分一致,GUM法只考虑转基因玉米MON88017测量过程中不确定度贡献较大的成分:32次重复测量试样贡献的不确定度(A类)、用于PCR仪校准的系列DNA稀释液产生的不确定度(B类)、校准曲线拟合的不确定度(B类)以及整个实验中液体转移产生的不确定度.
根据一阶泰勒级数近似和GUM法[3],试样中转基因玉米MON88017质量分数(C)的测量不确定度
u(C)=
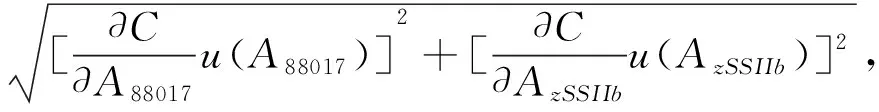
式中∂C/∂A88017、∂C/∂AzSSIIb分别是u(A88017)、u(AzSSIIb)的灵敏度系数,分别由(4)、(5)式确定.
∂C/∂A88017=1/AzSSIIb,
(4)
(5)
u(A88017)和u(AzSSIIb)分别是A88017和AzSSIIb的合成不确定度,通过(6)、(7)式计算获得.
u(A88017)=
(6)
u(AzSSIIb)=
(7)
式中,u(rep88017)、u(repzSSIIb)是32次重复测量试样中A88017、AzSSIIb的不确定度(A类),u(cali)是校准曲线拟合产生的不确定度(B类),u(pip)是包括系列DNA稀释液和PCR体系配制中液体转移产生的不确定度(B类).
A类不确定度采用Bessel公式计算:
(8)
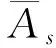
根据GUM法[3],作为非统计计算的B类不确定度u(cali)和u(pip)由(9)和(10)式计算:
u(cali)=
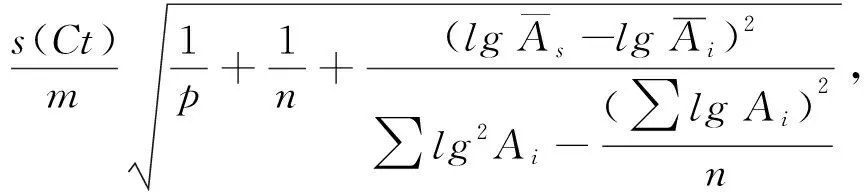
u(pip)=U(pip)/k,
(10)
式中,U(pip)是测量中使用的移液器的扩展不确定度,k为包含因子.各类量程移液器的不确定度通过“方和根”[17-18]合成得到整个实验中移液器产生的总移液不确定度u(pip).(9)式中的s(Ct)为校准曲线拟合的标准误差,由(11)式计算:
式中,n为校准测量次数,Cti是实时PCR仪对第i个校准子的响应值(热循环数阈值),Ai为第i个校准子.
转基因玉米MON88017质量分数C的扩展测量不确定度
U=kp×u(C),
(12)
式中,kp是特定包含概率下的包含因子,u(C)为转基因玉米MON88017质量分数C的合成不确定度.
4 结果
4.1MCM评定结果标准物质校准实时定量PCR仪的结果见表1和表2.校准子的Ct响应值的标准方差SD都在0.02~0.64范围内,显示每个校准子的三次校准的平行性较好.测试样品中MON88017质量分数测定结果(重复测量32次试样的结果)见表3.转基因玉米88017测量过程中输入/出量(影响因子)遵守的概率分布和各输入/出量的平均值、标准不确定度和95%包含区间见表4(Ct11~Ct53和Ct11#~Ct53#分别表示zSSIIb基因和88017测量中标准物质各质量浓度点的响应值;CtS1~CtS32和CtS1#~CtS32#分别表示试样32次重复测量zSSIIb基因和88017片段获得的Ct值;AzSSIIb和A88017分别表示试样中zSSIIb和88017片段的绝对质量;C表示试样中88017片段的质量分数;mzSSIIb和m88017分别为zSSIIb基因和88017片段的校准曲线的斜率;kzSSIIb和k88017分别为zSSIIb基因和88017片段的校准曲线的截距).根据最小二乘法原理、校准子与其响应值Ct的概率分布,拟合得到的zSSIIb基因和88017片段的校准曲线方程分别为y=-3.34x+31.81和y=-3.23x+33.06.将试样Ct的概率分布输入到zSSIIb基因和88017片段的校准曲线方程获得输出量AzSSIIb和A88017的平均值分别为396.80和5.99 ng,标准不确定度分别为6.62和0.14,95%包含概率的包含区间分别为383.98~409.92 ng和5.73~6.25 ng.把输入量AzSSIIb和A88017的概率分布输入测量模型(2)式,获得最终输出量88017片段质量分数C的平均值、标准不确定度和95%包含概率的包含区间分别为1.51%、4.23×10-4和1.43%~1.59%.试样中转基因玉米MON88017的质量分数为1.51%,接近理论值(1.50%),测量结果的相对偏差为0.7%,不确定度远远小于0.1%.在95%的概率下,转基因玉米MON88017的相对含量测量值落在1.43%~1.59%范围内.
在所有不确定度成分中,不确定度最大的成分是AzSSIIb(6.62),其次是第5个校准子(0.005 ng/μL及其对应的Ct51、Ct52、Ct53和Ct51#、Ct52#、Ct53#)产生的不确定度(0.64和0.52).此外,除第2个校准子(5 ng/μL及其对应的Ct21、Ct22、Ct23和Ct21#、Ct22#、Ct23#)、kzSSIIb和k88017的不确定度较小外(小于0.1),其余成分的不确定度在0.1~0.3.不确定度最小的成分是最终输出量C(转基因玉米MON88017的质量分数).
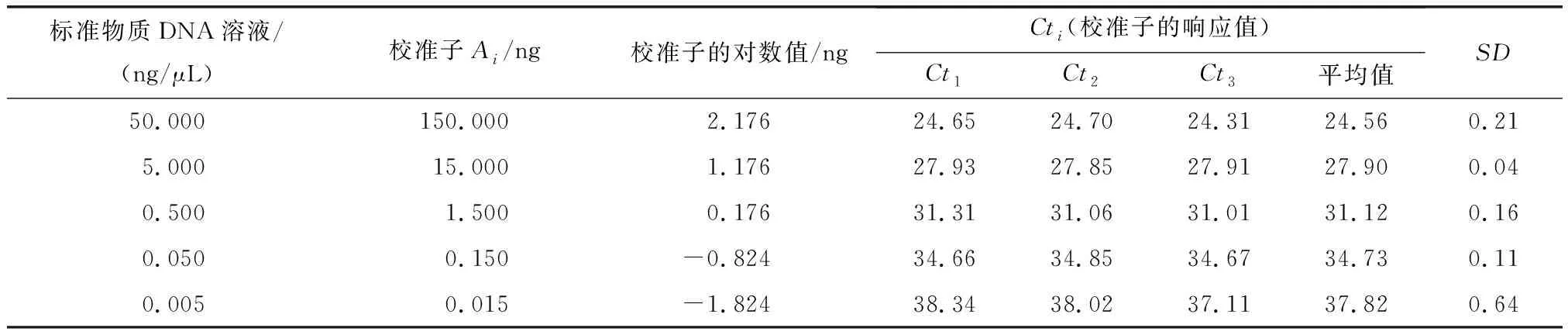
表 1 zSSIIb内源基因校准曲线拟合
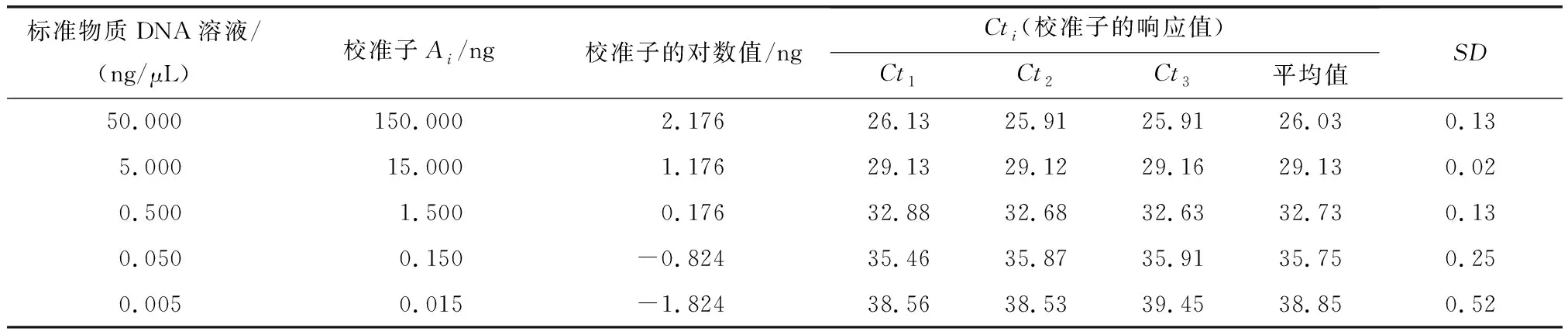
表 2 88017片段校准曲线拟合
4.2GUM评定结果将表1、表2的校准曲线拟合数据(B类评定)、表3的重复测量32次试样的结果(A类评定),代入(3)~(9)、(11)~(12)式计算得到内源基因zSSIIb的重复性实验的不确定度uzSSIIb(rep)、校准不确定度uzSSIIb(cali)以及MON88017片段的重复性实验的不确定度u88017(rep)、校准不确定度u88017(cali)见表5.在本次转基因玉米MON88017质量分数测量过程中,使用1 000 μL量程的移液器转移625 μL液体2次、320 μL液体2次;使用100 μL量程的移液器转移90 μL液体4次、50 μL液体4次、40 μL液体2次、30 μL液体1次、22 μL液体91次、18 μL液体1次;使用10 μL量程的移液器转移10 μL液体4次、3 μL液体91次.根据本实验室1 000、100、10 μL量程的移液器校准证书,3种量程移液器的标准不确定度(扩展不确定度除以包含因子)分别为1.731、0.462和0.069 μL.根据(10)式和“方和根”方法[17-18]分别计算得到转移液体625 μL产生的不确定度uV625(pip)、320 μL产生的不确定度uV320(pip)、90 μL产生的不确定度uV90(pip)、30 μL产生的不确定度uV30(pip)、50 μL产生的不确定度uV50(pip)、40 μL产生的不确定度uV40(pip)、22 μL产生的不确定度uV22(pip)、18 μL产生的不确定度uV18(pip)、10 μL产生的不确定度uV10(pip)、3 μL产生的不确定度uV3(pip)以及整个实验中移液产生的总不确定度u(pip)(表5).采用GUM法获得的zSSIIb基因和88017片段的校准曲线方程分别为y=-3.33x+31.63和y=-3.25x+32.63.试样中转基因玉米MON88017的质量分数为1.54%(表3),与理论值(1.50%)的相
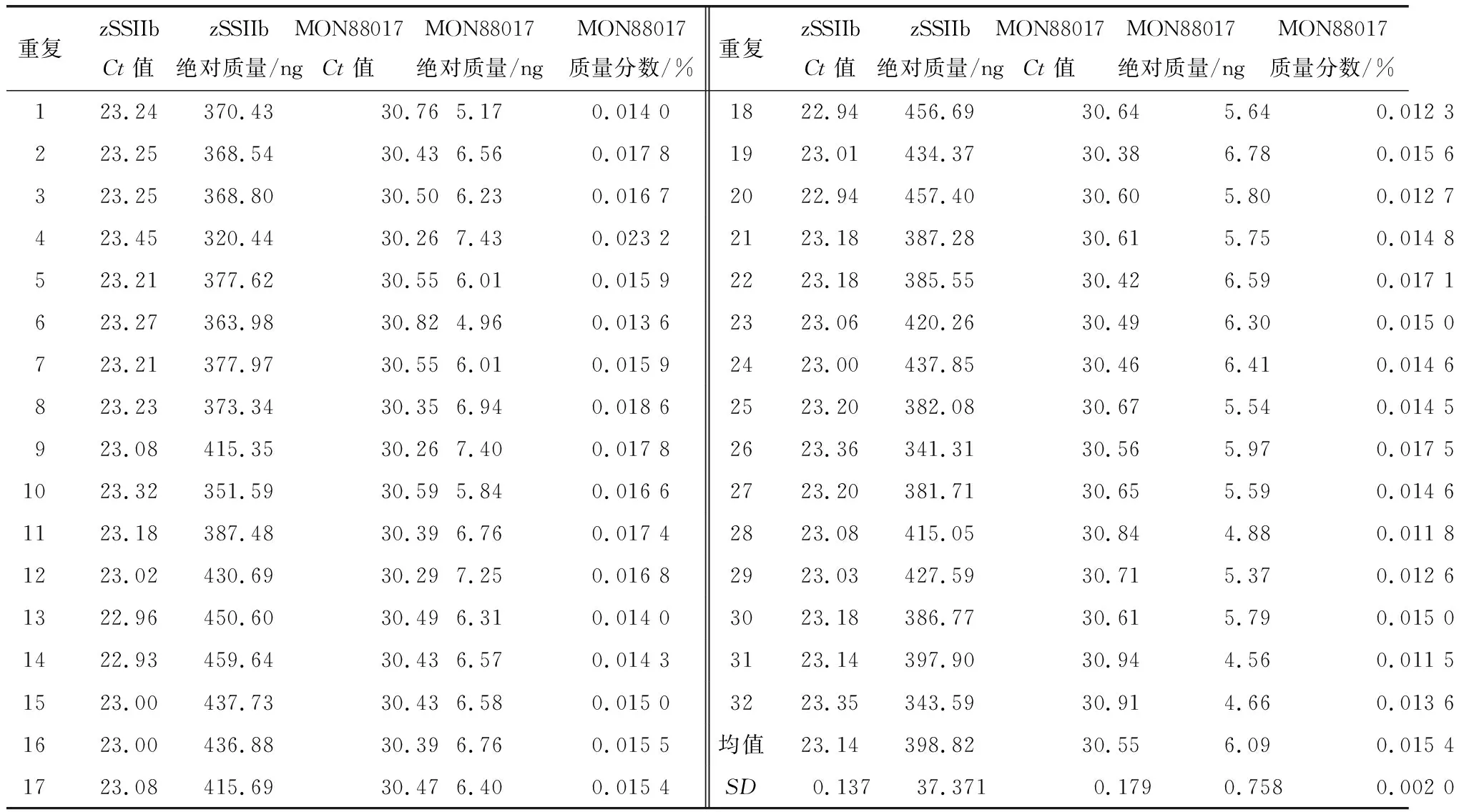
表 3 测试样品中MON88017质量分数测定结果
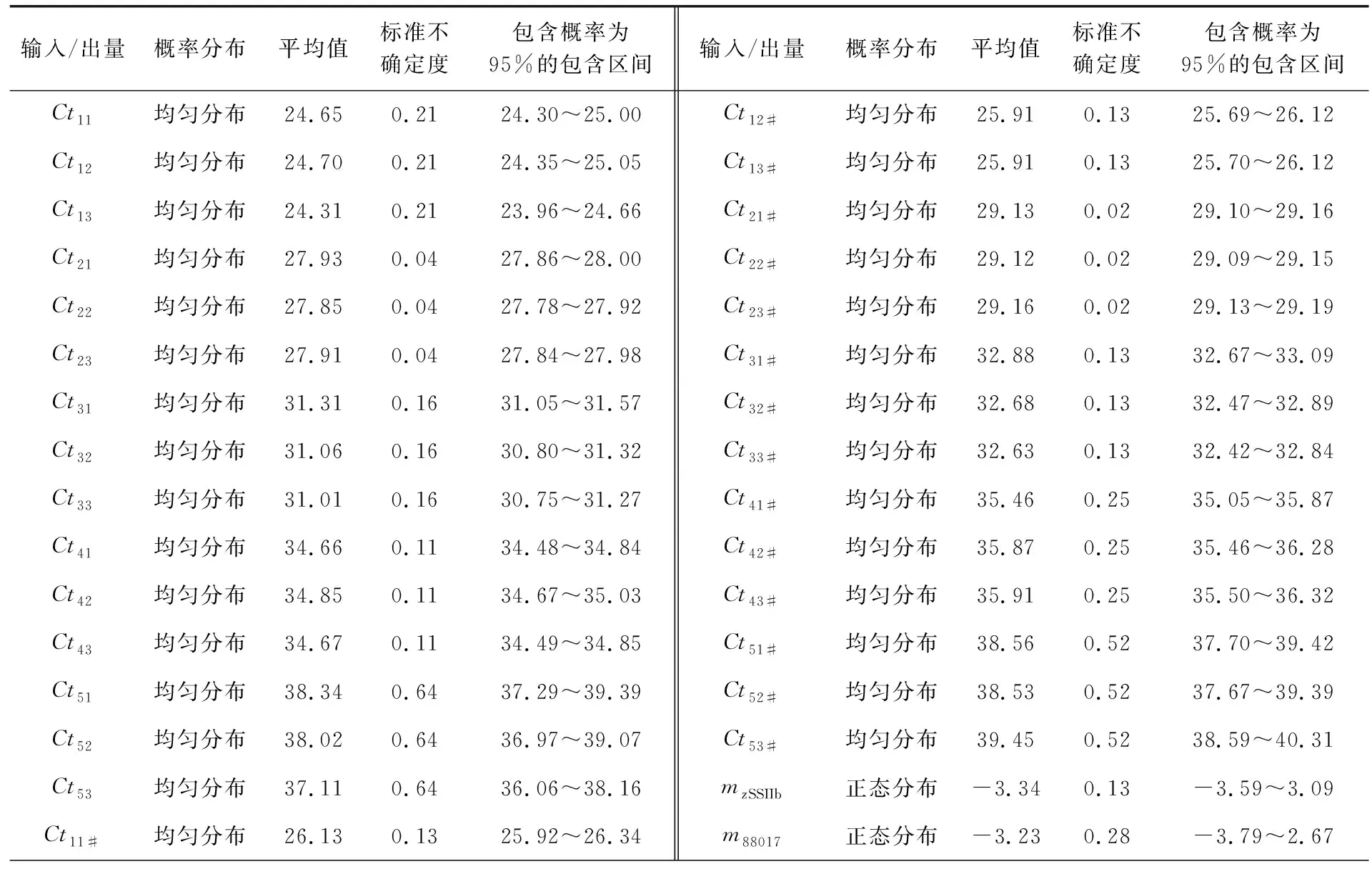
表 4 各输入/输出量的分布及不确定度和95%置信度的包含区间
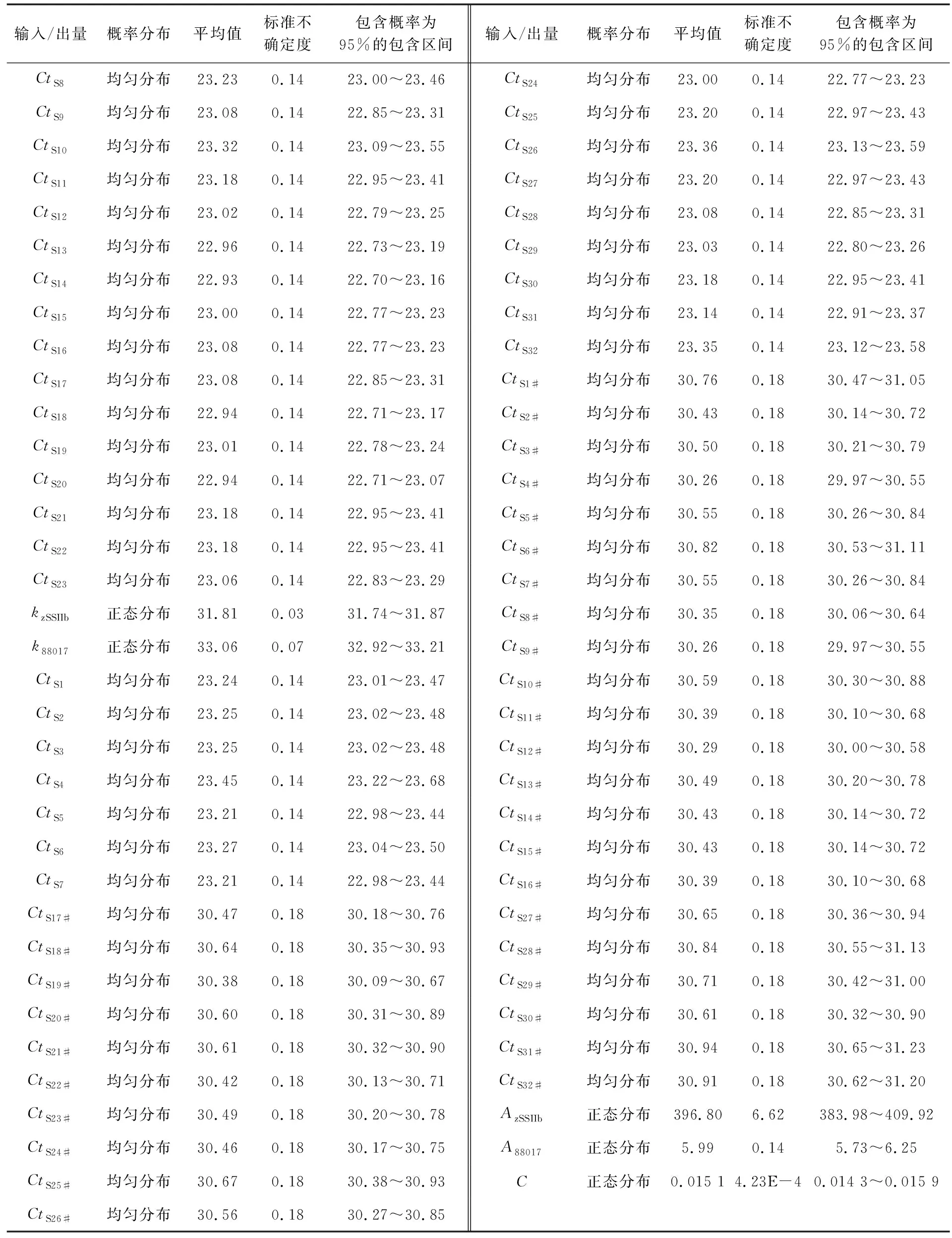
表 4(续)
对偏差为3%,标准不确定度为0.1%(表5).在包含概率为95%时,kp=2,根据(12)式获得转基因玉米MON88017质量分数的扩展不确定度为0.2%,即在概率为95%的条件下,转基因玉米MON88017质量分数的测量值落在1.34%~1.74%范围内.
在GUM法评定的不确定度成分中,不确定度贡献最大的成分是u(AzSSIIb)和uzSSIIb(rep)(分别为6.621 0和6.606 4),其次是u(pip)(0.321 4),最小的不确定度成分为转基因玉米MON88017质量分数的不确定度u(C)(表5).
MATLAB程序运行产生的混合样品中转基因玉米MON88017质量分数的概率密度分布为正态分布,如图1所示.
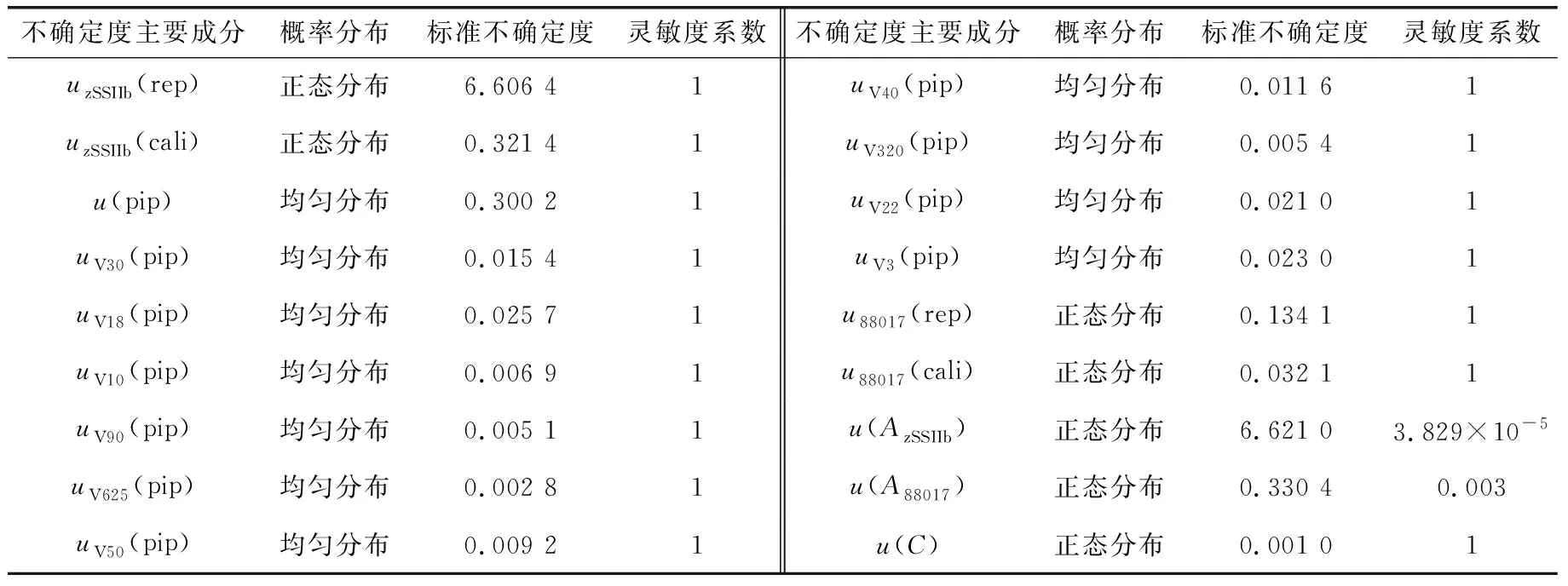
表 5 用GUM法评定MON88017玉米测量不确定度主要成分的概率分布、标准不确定度和灵敏度系数
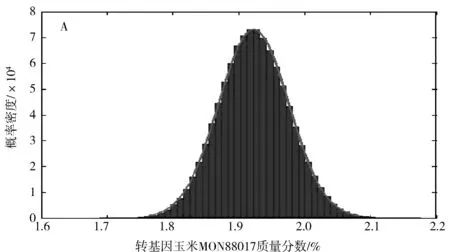
4.3MCM与GUM法评定结果的比较从转基因玉米MON88017质量分数的测量结果来看,2种方法(MCM为1.51%,GUM法为1.54%)的测量结果都接近理论值(1.50%),但是MCM获得结果的相对偏差(0.7%)小于GUM法获得的相对偏差(3%);MCM计算得到转基因玉米MON88017质量分数的不确定度为4.23×10-4,远远小于GUM法评定得到的不确定度2×10-3(0.2%);在95%的概率下,MCM计算得到转基因玉米MON88017质量分数的测量值分布在1.43%~1.59%范围内,比GUM法评定得到的范围1.34%~1.74%窄.这些结果说明,MCM的评定结果优于GUM法的评定结果.此外,转基因玉米MON88017质量分数的概率分布在MCM与GUM法中都呈“钟型”正态分布(图1A和图1B),说明GUM法适用于转基因生物测量不确定度的评定.
5 讨论
测量不确定度是评估检测结果可靠性的重要参数,尤其是当检测结果位于限量值附近时,对产品的符合性判断必须依靠检测结果的不确定度才能做出正确判断.本研究的评定结果发现2种方法计算得到的转基因玉米MON88017质量分数的概率分布都呈正态分布,充分说明了GUM法适用于转基因生物测量不确定度的评定.本实验中尽管GUM法适用于评定转基因生物测量不确定度,但由于MCM从每一个变量的概率分布中随机抽取“海量”样本(106个)进行传递,所以MCM评定得到的95%概率下测量值分布范围要小于GUM法得到的范围,不确定度远小于GUM法得到的结果.因此,比较发现MCM评定结果总体优于GUM法的结果.
从本研究采用MCM与GUM法评定转基因玉米MON88017质量分数的不确定度过程可以看出,GUM法相对MCM存在一些局限,如应用GUM法需要考虑输出量的概率分布是否为正态分布,需要应用偏导数计算各输入量的灵敏度系数等(当测量模型复杂时,灵敏度系数的偏导数难求).MCM是对GUM法不确定度评定的一种补充方法,适用范围较GUM法大.虽然MCM相对于GUM法有很多优势,但是由于MCM是建立在模拟产生“海量”实验数据基础上进行的测量不确定度评定,所以必须依靠计算机辅助才能完成.
测量不确定度的评定除了可以评估实验数据的可靠性外,还可以根据不确定度成分对不确定度的贡献大小,找出影响实验结果的主要因素.本研究中,MCM与GUM法都发现AzSSIIb绝对质量的不确定度最大,这可能与特定质量的标准物质或试样中细胞的裂解率、DNA的提取率差异大有关.因此,转基因生物的测量结果不采用基因的绝对质量表示,而采用基因的质量分数来表示.除此外2两种方法都显示液体转移产生的不确定度对测量结果的影响较大.事实上,在转基因生物及产品的定量检测中,从配置系列不同质量浓度的校准子、制备PCR混合液、分装各种液体到添加DNA模板等,累计使用不同量程的移液器转移各种不同液体上百次.转基因生物定量检测中使用的移液器都是微量移液器,维护和使用不当都会降低移液器的准确度,加上吸头可能与移液器不匹配或吸头对转移液体的高吸附性等原因导致移液在转基因生物检测过程中贡献了较大的不确定度.因此,提高移液的准确度,降低移液的不确定度是提高转基因生物定量检测质量的主要因素.

