乌鳢β-肌动蛋白cDNA克隆与表达分析
李 锐, 文正勇*, 覃川杰, 邹远超,王 均, 贺 扬, 袁登越
(1. 内江师范学院 生命科学学院, 四川 内江 641100;2. 内江师范学院 长江上游鱼类资源保护与利用四川省重点实验室, 四川 内江 641100)
肌动蛋白(actin)是构成细胞的基本骨架主要成分,广泛分布于动植物等真核生物细胞中,主要参与细胞的分裂、细胞器运动、染色体运动、细胞激化、mRNA加工和运输等许多重要生理过程[1-3].肌动蛋白家族包括6种异构体、2种平滑肌型(α-血管平滑肌型和γ-内脏平滑肌型)、2种横纹肌型(α-骨骼肌型和α-心肌型)和2种细胞质型(β-细胞质型和γ-细胞质型)[4-5].β-actin的氨基酸序列在脊椎动物中十分保守:刘秀霞等[5]报道鱼类、两栖类、鸟类、哺乳类等不同类群脊椎动物β-actin氨基酸序列同源性均在96%以上;覃川杰等[6]报道宽体沙鳅(Sinibotiareevesae)的β-actin氨基酸序列与凡纳滨对虾(Litopenaeusvannamei)等无脊椎动物具有较高的同源性,与鲢(Hypophthalmichthysmolitrix)、非洲爪蟾(Xenopuslaevis)、小白鼠(Musmusculus)等脊椎动物的同源性高达95%~99%,提示该基因的生理功能在不同物种之间具有很高的保守性.此外,β-actin在不同的组织细胞中能较高较稳定地表达,且不容易随年龄的变化而改变,因此在研究某基因的mRNA相对表达量时,β-actin常常被用作内标基因[7].目前,包括鳜鱼(Sinipercachuatsi)[5]、宽体沙鳅[6]、黄鳝(Monopterusalbus)[8]、鳡鱼(Elopichthysbambusa)[9]、松江鲈鱼(Trachidermusfasciatus)[10]、大鳞副泥鳅(Paramisgurnusdabryanus)[11]等在内的多种硬骨鱼类β-actin基因已经被成功克隆,将为这些鱼类功能基因的转录调控研究奠定良好的基础.
乌鳢(Channaargus)隶属鲈形目(Perciformes)、攀鲈亚目(Anabantoidei)、鳢科(Channidae)鳢属(Channa),又叫财鱼、乌鱼、黑鱼、生鱼、斑鱼等,俗称乌棒,是一种凶猛的肉食性鱼类.乌鳢营养丰富、味道鲜美,一直被认为是食疗和滋补的佳品[12].目前我国除新疆、西藏地区外,其他省份各大水系均有分布[13].乌鳢作为我国的大宗水产养殖品种,对我国的国民经济收入具有较大的贡献,据2016年中国渔业年鉴统计,2015年我国乌鳢总产量49.5万t,在大宗淡水养殖鱼类中排第9位.同时,乌鳢作为特种水产养殖品种,对四川的渔业经济也具有重要贡献:2015年四川省乌鳢产量8 977 t,占全国总产量1.8%,且产量逐年上升.内江地处成渝之间,拥有川南最大的水产养殖水面,水产养殖总产量位居四川前三,同时也是乌鳢主养区之一.随着生物技术的快速发展,对乌鳢在分子生物学方面的研究越来越多:胃蛋白酶原基因[14]、脑型芳香化酶基因[15]、MHC[16]、STAT1[17]及Foxl2[18]等许多功能基因被克隆,这些功能基因的转录水平研究都需要管家基因作为内标,β-actin已广泛作为内参基因使用,对其进行研究显得十分重要.本研究首次克隆了乌鳢的β-actin基因的cDNA序列,并对其进行了生物信息学分析,进一步对其组织表达进行了检测,以期为其他功能基因的研究以及转基因乌鳢的生产奠定理论基础.
1 材料与方法
1.1试验用鱼及暂养管理试验用乌鳢购于内江市桂湖街农贸市场,为人工养殖乌鳢,暂养于内江师范学院长江上游鱼类资源保护与利用四川省重点实验室.乌鳢暂养于100 L水族箱中,水温(22±0.5) ℃,水体溶氧保持在(7.5±0.6) mg·L-1之间,且每2 d换水族箱中的水约1/3,新换用水均有充分曝气.每天晚上7点投喂饵料,饵料占体质量比为5%,未吃完饵料及时捞出.
1.2组织样品获得经暂养2周后,选取健康无病、活力好的4尾乌鳢用于试验(其中1尾用于克隆,另3尾用于组织分布),平均体质量为(150±5.6) g.试验鱼经MS-222麻醉后,置于冰上并迅速取出脑、肝脏、心脏、肌肉、脂肪(肠系膜脂肪)、脾脏、肾脏(中肾)、胃、眼、鳃、性腺共11个组织,样品立即放入液氮中冷冻,然后放于-80 ℃冰箱备用.
1.3β-actin基因cDNA序列克隆将健康乌鳢解剖后,取适量肝脏组织,利用Trizol法提取总RNA,经琼脂糖凝胶电泳检测合格后,用Eppendorf核酸分析仪测定其浓度,并取1 μg总RNA按照TaKaRa反转录试剂盒操作说明合成第一链cDNA,保存于-80 ℃冰箱备用.
从实验室测得的乌鳢性腺转录组数据库(未公布)中获得β-actin的mRNA部分核心序列片段,经NCBI数据库BLAST比对确认后,结合GenBank已公布的其他鱼类β-actin保守序列设计两对性引物,分别是:
cDNA-F1:5′-CACGCGTAACTCACCTGAAC-3′,
cDNA-R1:5′-GGCATACAGGTCTTTACGG-3′,
cDNA-F2:5′-CCTTCCTTCCTCGGTAT-3′,
cDNA-R2:5′-GCACTTTATTGGGATTGTT-3′.
以乌鳢肝脏cDNA为模版,进行RCR扩增,反应程序为:95 ℃预变性3 min,95 ℃ 30 s,56 ℃ 45 s,72 ℃ 1 min 30 s,共计34个循环,最后72 ℃延伸10 min.PCR产物经质量分数2.0%琼脂糖凝胶电泳分离检测后,用TaKaRa胶回收试剂盒分离纯化,再与pMD18-T克隆载体连接并转化到感受态细胞E.coli DH5,挑取阳性克隆送往上海立菲生物技术有限公司测序.
1.4β-actin序列分析根据测序结果拼接组装获得乌鳢β-actin的cDNA序列,在NCBI核酸数据库作BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)比对分析,通过在线软件ORF Finder(http://www.ncbi.nlm.nih.gov/orffinder/)预测乌鳢β-actin的开放阅读框,进一步用Primer 5.0软件预测蛋白序列,并将序列提交NCBI数据库.通过Motif Scan程序(http://hits.isb-sib.ch/cgi-bin/PFSCAN)分析乌鳢β-actin蛋白的功能位点,TMHMM server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析跨膜结构,并用DNAMAN 8.0软件分析乌鳢β-actin蛋白的相对分子质量、等电点、氨基酸组成等特征.
1.5分子系统发育分析通过BLAST比对,从GenBank下载获得的其他物种的β-actin核酸序列和蛋白序列,选取大西洋鲑、虹鳟、斑马鱼、乌鳢、爪蟾、小白鼠和人共7个物种的蛋白序列用BioEdit 7.1软件进行氨基酸序列比对分析.由于β-actin在不同物种间蛋白序列具有很高的保守性,因此选用核苷酸序列进行分子系统发育分析[5].选取22个物种的β-actin核酸序列,通过ClustalX 2.0[19]进行多重序列比对分析,用DAMBE软件[20]进行各序列的碱基替代饱和性检验,然后用MEGA 6.0软件[21],采用邻位相接法(Neighbor-Joining),构建乌鳢及其他21个物种β-actin基因的系统发育树(序列信息见表1),并用Bootstrap重复1 000次计算各分支的置信度.

表 1 用于进化分析的物种序列信息
1.6β-actin组织表达用Trizol法提取各组织总RNA.各组织RNA经混合后,取1 μg RNA按照TaKaRa反转录试剂盒操作说明合成cDNA,以特异性引物:
β-actin qF:5′-CTCCACTCAACCCCAAAG-3′,
β-actin qR:5′-GAGCGTAGCCCTCATAGA-3′
进行半定量PCR.PCR扩增体系为:dd H2O 20.25 μL、10×Buffer 2.5 μL、dNTP 0.5 μL、上下游引物各0.5 μL、cDNA模板0.5 μL、rTaq酶0.25 μL,共计25 μL体系.PCR反应条件为:95 ℃预变性3 min,95 ℃变性30 s,56 ℃退火45 s,72 ℃延伸30 s,共计34个循环,最后72 ℃延伸5 min.PCR产物经质量分数为1.5%琼脂糖凝胶电泳后,置于凝胶图像采集系统中采集图像.
2 结果
2.1乌鳢β-actincDNA序列的克隆与特征分析以乌鳢肝脏cDNA为模板,扩增获得长度为909和965 bp两个PCR产物片段,经过测序及组装后,得到一个全长为1 813 bp的乌鳢β-actin cDNA序列.序列经BLAST比对确认后,上传NCBI数据库(GenBank登录号:KX925979).经预测,乌鳢β-actin cDNA序列包含一个1 125 bp的开放阅读框(ORF),共编码375个氨基酸,起始密码子为ATG,终止密码子为TAA;蛋白功能位点分析显示,在氨基酸序列的53~63位、104~116位及356~364位是乌鳢的β-actin信号位点;在cDNA末段发现了PloyA加尾信号(aataaa)(图1).

图 1 乌鳢β-actin cDNA序列及推导氨基酸序列
2.2乌鳢β-actin序列特征分析乌鳢β-actin蛋白由375个氨基酸组成,预测相对分子质量约为41.73 kDa,理论等电点PI为5.16,由20种氨基酸组成,其中甘氨酸(Gly)数目占比最高为7.73%,色氨酸(Trp)数目占比最低为1.07%(图2).跨膜预测结果显示,乌鳢β-actin蛋白没有跨膜区.多重序列比对显示:β-actin蛋白序列在各物种之间具有很高的保守性,除了个别位点存在氨基酸替换外,其余氨基酸序列完全相同.与鱼类相比,乌鳢的β-actin蛋白序列第2位氨基酸是天冬氨酸(Asp)而大西洋鲑和虹鳟的第2位氨基酸是谷氨酸(Glu),乌鳢β-actin蛋白序列的第319位氨基酸由丝氨酸(Ser)替换为丙氨酸(Ala);与四足类动物相比,乌鳢β-actin蛋白序列的第228位氨基酸是甘氨酸(Gly),而四足类动物是丙氨酸(Ala),乌鳢的第279位氨基酸是酪氨酸(Tyr),而小鼠和人是苯丙氨酸(Phe)(图3).
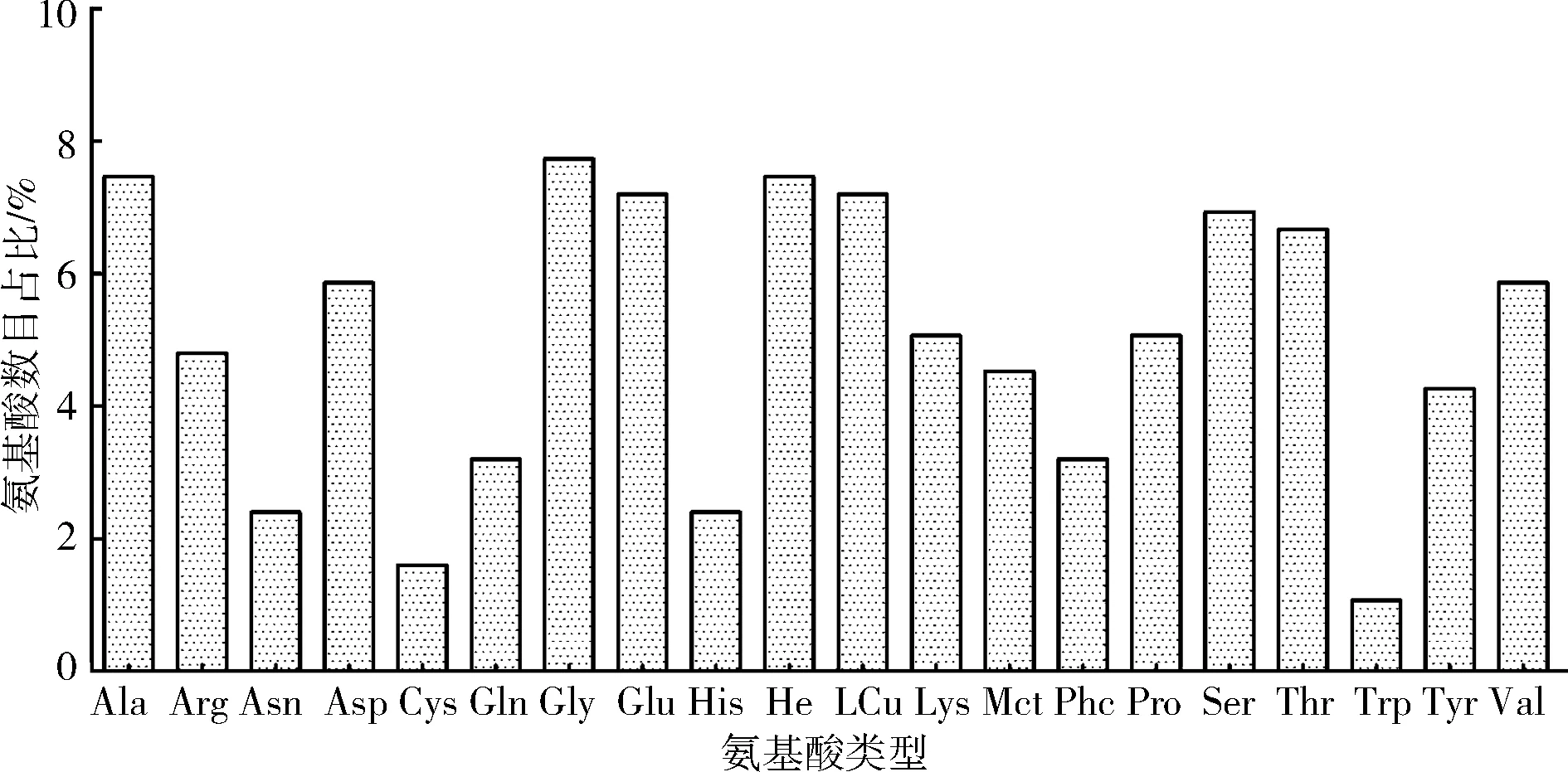
图 2 乌鳢β-actin氨基酸组成分析

图 3 乌鳢与其他动物β-actin氨基酸序列的多重比对
2.3乌鳢β-actin氨基酸与其他物种的同源性分析基于β-actin氨基酸的同源性分析显示,乌鳢与其他18种动物的β-actin蛋白序列同源性很高,均在98%以上.其中,与人的同源性最低为98.4%,与黄鳝、莫桑比克罗非鱼、石斑鱼的同源性最高为99.4%,与斑马鱼、大鳞大麻哈鱼、大西洋鲑、鳡、黑棘鲷、虹鳟、鲫鱼、军曹鱼、鲮鱼、塞内加尔鳎、星斑川鲽、非洲爪蟾、鸡及小家鼠等动物的同源性介于这两者之间(见表2).
2.4乌鳢β-actin基因系统发育分析用DAMBE软件对乌鳢等22种动物的β-actin核苷酸序列进行了核苷酸替代饱和性检验,结果表明该基因的碱基替换率均未达饱和,具有系统发育意义.基于Kimura双参数模型用MEGA 6.0软件以邻接法构建了β-actin基因的系统进化树,结果见图4.乌鳢首先与大西洋鲑、虹鳟、鳜鱼、金头鲷、罗非鱼等鲈形目鱼类聚类为一支,再与人、家鼠、变色龙等脊椎动物构成的单支并列聚合为一起,最后再与斑马鱼、鲫鱼等鲤形目鱼类聚为一支,非洲爪蟾和原鸡处于进化树的根部.系统发育结果与乌鳢的分类地位基本一致.
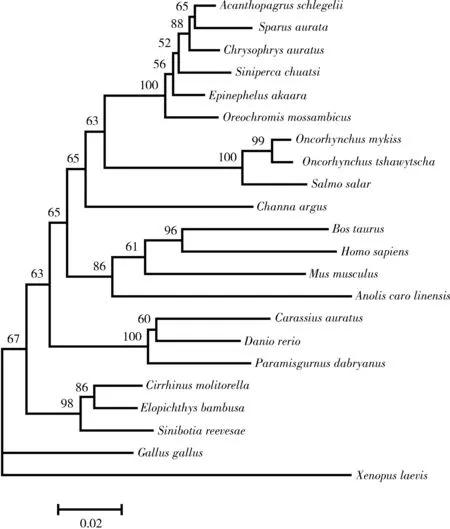
图 4 基于β-actin核苷酸序列的NJ系统进化树
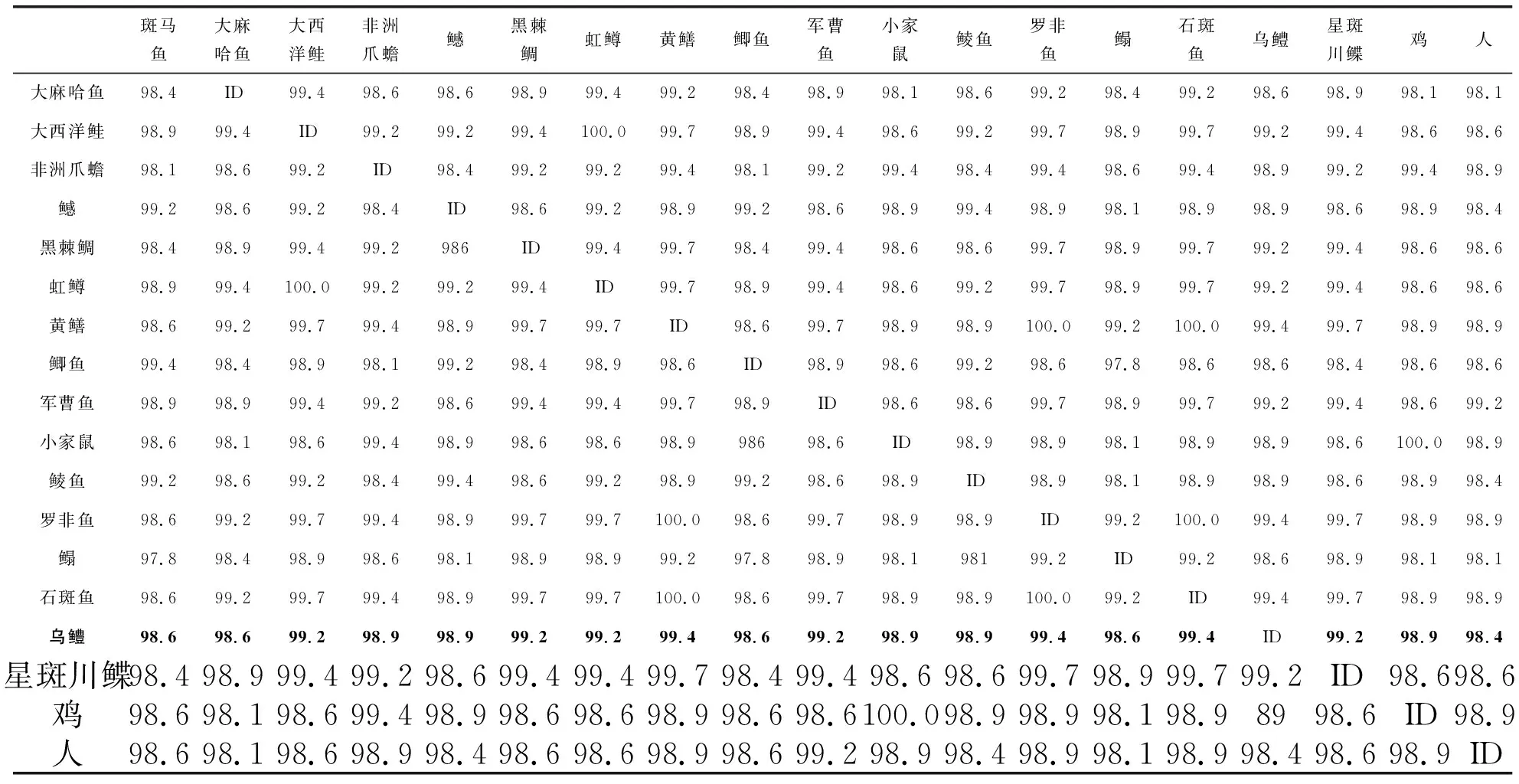
表 2 乌鳢β-肌动蛋白与其他动物的同源性比较%
2.5乌鳢β-actin组织表达分析用获得的乌鳢β-actin cDNA序列跨内含子设计一对PCR引物,以各组织cDNA为模版进行半定量PCR反应,PCR产物用琼脂糖凝胶电泳检测.结果显示,β-actin基因在乌鳢肝脏、鳃、脑、眼、心脏、肾脏、肌肉、性腺、胃、脾脏、脂肪等组织均有表达,且特异性很高,PCR产物条带亮度除了在性腺组织中略低外,在其他各组织的亮度差别不大,结果如图5所示.

图 5 乌鳢β-actin基因组织表达
3 讨论
本研究利用RT-PCR的方法克隆获得了乌鳢β-actin基因的cDNA全序列.序列全长1 813 bp,包含一个1 125 bp的开放阅读框,共编码375个氨基酸,与鳜鱼[5]、宽体沙鳅[6]、鳡鱼[9]、大鳞副泥鳅[11]等鱼类编码的氨基酸数目一致.氨基酸序列对比发现,乌鳢β-actin除个别氨基酸与其他脊椎动物有差异,其余的氨基酸序列完全相同,氨基酸序列高度相似性可能与β-actin具有相同的生理功能密切相关[3,6].氨基酸序列分析显示,乌鳢β-actin蛋白具有3个actin信号位点,这一结果与鳜鱼[5]和宽体沙鳅[6]相同,进一步表明不同鱼类具有相同的生理功能.跨膜结构域分析表明,乌鳢β-actin蛋白不存在跨膜域结构,不属于膜蛋白,此结果与宽体沙鳅具有3个跨膜域的结果不一致,可能与预测软件不同有关.此外,氨基酸组成分析显示,乌鳢β-actin由20种氨基酸组成,其中甘氨酸(Gly)数目占比最高为7.73%,色氨酸(Trp)数目占比最低为1.07%,这一结果与宽体沙鳅等其他动物的氨基酸含量保持一致.氨基酸同源性分析显示,乌鳢β-actin蛋白序列与斑马鱼、虹鳟、黄鳝、莫桑比克罗非鱼、石斑鱼、非洲爪蟾、小鼠、人等动物的同源性很高,均在98%以上,这一结果与鳜鱼[5]、宽体沙鳅[6]、鳡鱼[9]等其他鱼类的研究结果相同,进一步阐述了β-actin蛋白在不同物种之间的保守性.
许多学者认为,由于β-actin蛋白的氨基酸序列在不同物种之间的高度保守性,因此以氨基酸序列构建的系统发育结果不能反映真实的物种之间的进化关系,而以核苷酸序列构建进化树较为科学[5,9].本研究以β-actin核苷酸序列构建系统发育树,结果显示,乌鳢首先与大西洋鲑、虹鳟、鳜鱼、金头鲷、罗非鱼等鲈形目鱼类聚为一支,再与人、家鼠、变色龙等脊椎动物构成的单支并列聚合为一起,最后再与斑马鱼、鲫鱼等鲤形目鱼类聚为一支,非洲爪蟾和原鸡处于进化树的根部.表明β-actin基因的进化与物种的进化历程保持基本一致,这一结果与文献[5,9]等观点一致.
由于β-actin在不同的组织细胞中能较高较稳定地表达,且不容易随年龄的变化而改变,因此常常作为内标基因,广泛应用于功能基因转录表达研究[7].组织表达分析显示,乌鳢β-actin基因在肝脏、鳃、脑、眼、心脏、肾脏、肌肉、性腺、胃、脾脏、脂肪等组织均有表达,且PCR产物条带亮度除了在性腺组织中略低外,在其他各组织的亮度差别不大,表明乌鳢β-actin基因在各组织表达相对恒定,可以作为内标基因的候选基因.这一结果与宽体沙鳅的研究结果[6]一致,但与大鳞副泥鳅的研究结果[11]不一致,表明β-actin基因的组织分布仍然具有一定的物种特异性,这可能与动物体的生活环境及生理状态等因素有关.
4 结论
本研究成功克隆并获得了乌鳢β-actin基因的全长cDNA,并对该蛋白的氨基酸序列进行了分析,进一步构建了该基因在不同物种之间的系统发育树,最后对该基因的组织分布进行了检测.本文首次研究了乌鳢β-actin基因,将为今后乌鳢其他功能基因的研究提供基础资料,同时也为乌鳢β-actin基因的启动子研究以及转基因乌鳢的培育奠定理论基础.

