osw2对酿酒酵母孢子固定化酶影响的分析
赵 强, 李子杰, 中西秀树, 高晓冬
(江南大学 生物工程学院,江苏 无锡,214122)
酿酒酵母细胞当生长条件比较恶劣,缺乏氮源并在非发酵型的碳源存在下,进行减数分裂,进而产生单倍体孢子[1-2]。酿酒酵母营养细胞壁由两部分组成[3-4],从内到外依次是 β-葡聚糖(β-glucan)和甘露糖蛋白(mannoprotein),然而成熟的孢子壁是一个具有四层的层状结构,由内到外依次是甘露糖蛋白、β-葡聚糖、壳聚糖 (chitosan),以及二酪氨酸(dityrosine)层[5-6]。孢子壁的组装过程是有序一次组装的,只有前一层组装完成,后一层才能开始组装[7-8]。壳聚糖层和二酪氨酸层的主要作用是增强孢子对外界环境的抵抗能力[9-10]。DIT1基因参与二酪氨酸在胞质中的合成反应即催化L-酪氨酸形成二酪氨酸[11-12],敲除DIT1基因会导致二酪氨酸层不能形成,因而dit1Δ突变株孢子壁不含二酪氨酸层且最外层为壳聚糖层[13-14],但是壳聚糖层完整存在[15]。osw2Δ突变株孢子壁虽然具有二酪氨酸层[16-17],但是却具有乙醚敏感性,可能是由于OSW2基因的缺失会导致二酪氨酸层的网状结构大小发生改变[18-19],具体作用机理目前还未知。
酵母孢子作为固定化酶的载体已经成功被应用,本实验室之前的研究已经证明osw2Δ突变株孢子是比较优良的固定化酶载体,而OSW2基因的具体功能以及osw2Δ突变株孢子与野生型孢子壁有哪些不同之处目前还不清楚[18],本研究以α-半乳糖苷酶[20]作为目标蛋白,基于孢子固定化酶催化不同分子量大小底物的活性[21],找到osw2Δ突变株和野生型AN120孢子壁孔径大小的不同,并研究孢子壁对不同外界条件处理后的保护性作用。此外研究表明,在不同酵母孢子壁突变体中表达分泌型绿色荧光蛋白(green fluorescent protein,GFP)时,不同突变体会表现出不同的GFP渗漏率,其中ydr326cΔ与osw2Δ相似均具有较低的渗透率,而ydl186wΔ的渗透率稍高一些[22]。本研究选取ydl186wΔ、ydr326cΔ两种基因缺陷型,并构建osw2Δydl186wΔ和osw2Δ ydr326cΔ双缺陷型菌株,研究不同突变株孢子固定化酶的催化活性。
1 材料与方法
1.1 菌株与质粒
酿酒酵母菌株 AN120,缺陷型菌株 dit1Δ,osw2Δ,ydl186wΔ,ydr326cΔ,osw2Δydl186wΔ,osw2Δ ydr326cΔ,MEL1和 MEL1-3HA表达所用质粒pRS426-TEFpr相关信息见表1,引物相关信息见表2。
1.2 培养基
酵母营养生长与产孢培养基[23]
YPAD培养基:酵母浸出粉10 g,蛋白胨20 g,腺嘌呤30 mg,加水至900 mL,121℃高压灭菌15 min,培养基冷却至55℃,加入100 mL单独灭菌的质量浓度为200 g/L的葡萄糖。
缺陷培养基(SD):无氨基酵母氮源(YNB)6.7 g,琼脂粉 20 g(固体培养基),加水至 900 mL,
121℃高压灭菌15 min,培养基冷却至55℃,加入100 mL单独灭菌的质量浓度为200 g/L的葡萄糖和2 g缺少相应氨基酸的氨基酸混合物。
预产孢培养基(YPAce):酵母浸出粉10 g,蛋白胨20 g,醋酸钾20 g,加水定容至1 L,121℃高压灭菌15 min。
产孢培养基(2%KOAC):醋酸钾 20 g,加水定容至1 L,121℃高压灭菌15 min。
大肠杆菌生长培养基
LB培养基:酵母浸出粉5 g,胰蛋白胨10 g,NaCl 10 g,加水至 1 L,121℃高压灭菌15 min。
1.3 试剂与溶液配制
PCR产物纯化试剂盒、琼脂糖凝胶电泳胶回收试剂盒、质粒小量抽提试剂盒,蜜二糖以及脱脂奶粉购于生工生物工程 (上海)有限公司;DNA连接酶、限制性内切酶购于TaKaRa公司(大连);棉籽糖购置于J&K百灵威科技;水苏糖购于阿拉丁;β-葡聚糖酶、Percoll梯度离心液、Glucose assay试剂盒购于美国 Sigma-Aldrich公司 (上海);Anti-HA Mouse mAb 一抗、Anti-βActin Mouse mAb 一抗、Goat-Anti-Mouse IgG,HRP 二抗购于 TRANS;SDSPAGE凝胶配制试剂盒,ClarityTM Western ECL Substrate显色剂购置于碧云天生物技术研究所。

表1 本研究中所用的菌株和质粒Table 1 Strains and plasmids used in this study
DNS试剂:首先溶解6.9 g结晶酚于15.2 mL 10%NaOH溶液中。并用水稀释至69 mL,在此溶液中加入6.9 g亚硫酸氢钠;然后称取255 g酒石酸钾钠加到300 mL 10%NaOH溶液中,再加入800 mL 1%3,5-二硝基水杨酸溶液;将上述两种溶液混合即可[24-25]。
1.4 主要仪器
PCR仪器购于日本takara公司;SDS-PAGE凝胶电泳仪、凝胶成像仪购于美国伯乐公司;紫外分光光度计购于美国GE;冷冻干燥机购于日本EYELA;移液枪、台式高速冷冻离心机购于德国Eppendorf;nano drop 2000 spectrophotometer购于赛默飞;ImageQuantTMLAS 4000 mini购于美国GE。

表2 本研究中的引物Table 2 Primers used in this study
1.5 质粒和菌株构建
本实验室已有质粒pRS424-TEFpr-MEL1和pRS424-TEFpr-MEL1-3HA,在此基础上构建pRS426-TEFpr-MEL1和pRS426-TEFpr-MEL1-3HA。构建方法如下:用SpeⅠ和XhoⅠ双酶切处理质粒,并将它们连接到经过相同酶双酶切处理的质粒pRS426-TEFpr上。
osw2Δydl186wΔ 和 osw2Δydr326cΔ 双重缺陷菌株的构建均是在osw2Δ单倍体的基础上分别敲除ydl186wΔ和ydr326cΔ获得相应的双重缺陷型单倍体菌株,再将对应的单倍体菌株进行融合获得双重缺陷型双倍体菌株。双重缺陷菌株的具体构建方法如下:以pFA6a-TRP1位模板,分别以HXO294和HXO295,HXO298和HXO299为引物,通过PCR扩增获得相应的敲除片段,然后将获得的相应片段通过线性DNA醋酸锂法转化osw2Δ4B和osw2Δ16D单倍体酿酒酵母,涂布到选择性SD-TRP固体培养基进行选择性培养,挑取转化子,然后分别以HXO296和 HXO297,HXO300和 HXO301为验证引 物 ,PCR 验 证 后 获 得 osw2Δydl186wΔ 和osw2Δydr326cΔ单倍体菌株,最后将成功敲除的相应单倍体菌株融合为双倍体菌株osw2Δydl186wΔ(HS9)和 osw2Δydr326cΔ(HS10)。
1.6 α-半乳糖苷酶在酿酒酵母孢子上的表达、固定和纯化
将重组质粒pRS426-TEFpr-MEL1分别转化到酿酒酵母野生型 AN120菌株和 osw2Δ,dit1Δ,osw2Δydl186wΔ,osw2Δydr326cΔ 四 种 缺 陷 型 菌 株中,挑取阳性转化子在SD-Ura平板上扩培,接种适当酵母阳性转化子扩培菌株于5 mL SD-Ura液体培养基中,30℃过夜培养,取1 mL过夜培养液转接至 30 mL YPAce中,30℃摇床培养约24 h(至OD600=1.0),然后 6 000 r/min,离心 1 min 收集酵母细胞,并将菌体转接至30 mL 2%乙酸钾产孢培养基中,30℃摇床培养1 d,通过显微镜观察测定产孢率,本实验所用孢子产孢率均在90%以上。为了获得单个游离孢子,需进行孢子的子囊破碎与纯化,具体操作方法如下:8 000 r/min,1 min收集子囊孢子,并用无菌水洗2次,将收集的子囊孢子重悬于1 mL原生质体缓冲液中(50 mmol/L pH 7.5磷酸缓冲液,1.4 mmol/L 山梨醇,40 mmol/L β-巯基乙醇),之后加入 20 μL Lyticase(1 mg β-葡聚糖酶溶于 500 μL 50% 的甘油中)。 37℃处理 1 h,8 000 r/min,1 min收集所有处理后的孢子,去除上清,沉淀用原生质体缓冲液洗2次,重悬于原生质体缓冲液中,充分混匀,超声破碎获得单个游离孢子。将获得的单个游离孢子用Percoll密度梯度离心的方法进行孢子纯化[26],具体方法如下:首先,孢子经0.5%Triton-X洗涤数次,然后重悬于1 mL 0.5%Triton-X中,将其全部加至Percoll梯度离心液 (从上到下依次为50%,60%,70%,80%Percoll+10%2.5 M 蔗糖和0.5%Triton-X) 最上层,15 000 g,4℃离心 1 h,离心后,去除上面三层,纯化的孢子位于最下层,加适量无菌水稀释后,9 000 r/min离心5 min,弃上清,细胞沉淀经0.5%Triton-X洗涤数次,离心收集细胞。将上述获得的湿孢子溶于适量无菌水,然后进行冷冻干燥:首先-20℃冷冻预处理约2 h,然后在-50℃,25 Pa下,置于冷冻干燥机EYELA FD-1000处理72 h。经过处理后可获得干燥的孢子粉末。
1.7 检测野生型AN120菌株和osw2Δ菌株固定化酶对不同底物的催化效率
α-半乳糖苷酶(Mel1p)催化 α-1,6-半乳糖苷健的水解,本实验选取3种含有α-1,6-半乳糖苷健且分子大小不同的糖作为底物,蜜二糖(melibiose)、棉子糖(raffinose)、水苏糖(stachyose),分别属于二糖、三糖、四糖。这3种糖均能被α-半乳糖苷酶降解,蜜二糖被分解为半乳糖和葡萄糖;棉子糖被分解为半乳糖和蔗糖;水苏糖被分解为半乳糖和蔗糖。α-半乳糖苷酶酶活测定在2 mL反应体系中进行,反应体系为1 mL 0.2 mol/L HAc-NaAc缓冲液(pH 4.6),1 mL 5% 底物,10 mg孢子。 37℃下反应2 h后,沸水浴10 min终止反应。α-半乳糖苷酶酶活分析检测用高效液相色谱(HPLC)进行分析,检测条件为:Bio-Rad Aminex HPX-87C色谱柱(250×4 mm),流动相为超纯水,流速为 0.3 mL/min,柱温为80℃,使用5450示差检测器。一个酶活单位U定义为:37℃下,1 mg孢子反应10 min所产生的半乳糖的量(mg)。
1.8 游离酶的制备和孢子固定化酶保护性实验检测
游离酶制备:转化有MEL1质粒的野生型酵母菌首先在5 mL SD缺陷型培养基中30℃过夜预培养,然后经30 mL SD缺陷型培养基放大培养,离心收集上清,用Amicon-Ultra超滤管(截留分子量为10 kDa)浓缩至 200 μL,每次实验取 10 μL。
SDS处理方法介绍如下:称取10 mg的干孢子粉末,10 μL浓缩蛋白,分别将它们悬浮溶解在1 mL 2%或10%SDS溶液中,然后加入1 mL 5%的底物,37℃下反应2 h,反应完成后沸水浴10 min终止反应。对照组为未经SDS处理,只将其溶解在缓冲液中。
8 mol/L Urea处理方法:收集超声破碎纯化后的单个游离孢子,将其悬浮在1 mL 8 mol/L尿素中处理1 h,对照组在缓冲液中静止1 h,水洗3次,然后分开进行孢子冻干 (用于固定化酶酶活测定)或8 mol/L尿素提取孢子蛋白 (用于western blot分析蛋白表达量)。
当以蜜二糖为底物时,检测试剂盒为Glucose assay购买于美国Sigma-Aldrich公司;当以棉子糖为底物时,检测试剂为DNS试剂(除特殊说明外,本实验结果均由试剂盒检测得到)。
1.9 蛋白免疫印迹分析8 M尿素处理对孢子固定化酶的影响
将重组质粒pRS426-TEFpr-MEL1-3HA转化酿酒酵母AN120野生型与osw2Δ突变株,产孢,收集超声破碎纯化后的单个游离孢子,用8 mol/L尿素处理1 h,收集处理后的孢子,将其悬浮在8 mol/L尿素中,并加入一定量的蛋白酶抑制剂,置于冰上,玻璃珠破碎1 h使孢子完全破碎,孢子内蛋白全部溶解于尿素中,15 000 r/min 4℃,离心30 min,收集上清,nanodrop测定蛋白浓度。上样量为50 μg蛋白,保证总蛋白量一致,实验组Anti-HA为一抗,对照组Anti-Actin为一抗,二抗均为Goat-Anti-Mouse IgG,HRP。
2 结果与讨论
2.1 双缺陷型突变菌株的PCR验证
由于基因敲除片段会有一定的概率插入到染色体的其他位置上,这样会导致选择性培养基生长的转化子有可能是假阳性转化子,为了避免这种情况的发生,要将转化子酵母基因组提取出来进行PCR验证。为了验证转化子 osw2Δydl186wΔ和osw2Δydr326cΔ,分别以 HXO296 和 HXO297,HXO300和HXO301为引物,转化子酵母基因组作为模板,同时以osw2Δ突变株酵母基因组作为对照组模板,通过PCR扩增获得不同大小的产物,琼脂糖凝胶电泳结果如图1所示,osw2Δydl186wΔ目的条带大小为 1 156 bp,对照组为 1 089 bp,osw2Δydr326cΔ 目的条带大小为1 106 bp,对照组为4 528 bp。
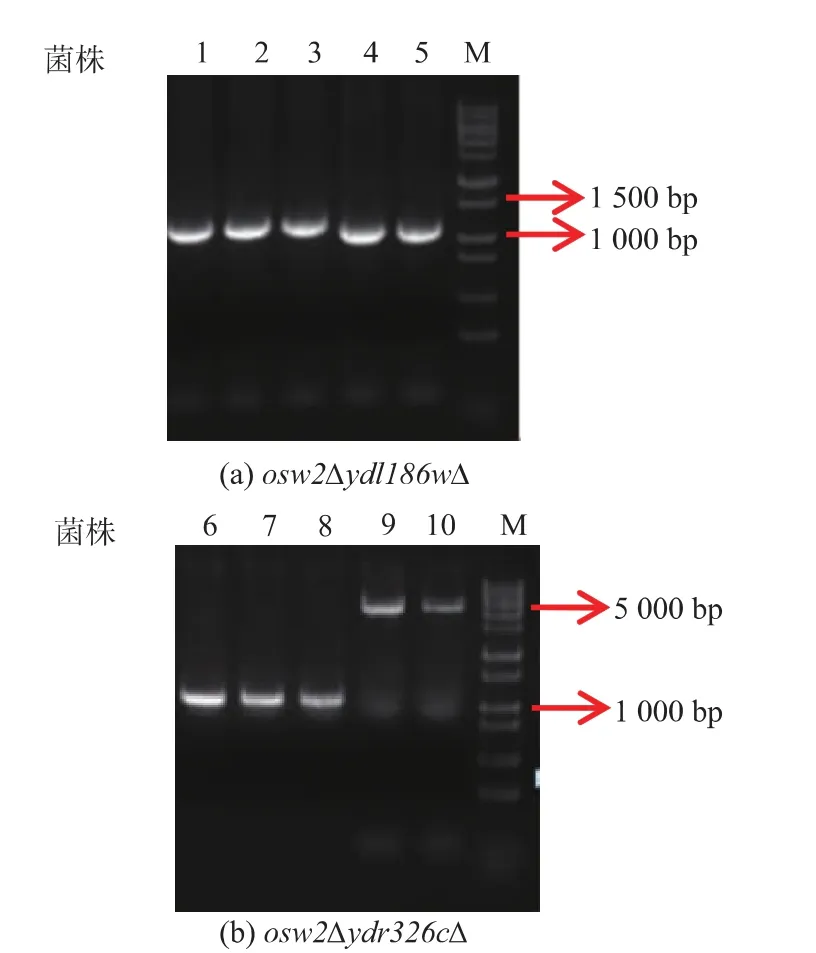
图1 PCR验证基因敲除Fig.1 PCR identify of gene knockout
2.2 野生型AN120与osw2Δ突变株酵母孢子壁孔径大小对比
为了比较野生型AN120和osw2Δ突变株酵母孢子壁的结构差异,分别选取3种分子量大小不同的糖作为底物,HPLC检测对比两种孢子对不同底物的催化活性,结果如图2所示。3种不同底物的孢子固定化酶活检测均说明osw2Δ突变株酵母孢子固定化酶的活性要高于野生型AN120酵母孢子,但随着底物分子量的增大,酵母孢子固定化酶的活性随之降低,野生型AN120与osw2Δ突变株之间孢子固定化酶的活性差异也逐步增大。图2(b)显示,当以棉子糖(三糖)为底物时,野生型AN120酵母孢子固定化酶有一定活性,然而,图2(c)显示,当以水苏糖(四糖)为底物时,野生型AN120酵母孢子固定化酶没有活性,由此可以猜测,野生型AN120酵母孢子壁的结构不能允许四糖大小的底物通过,如果把酵母孢子壁看作是具有一定孔径的结构,那么野生型AN120酵母孢子壁的的孔径大小介于三糖和四糖之间。图2(c)显示,当以水苏糖(四糖)为底物时,osw2Δ突变株酵母孢子固定化酶仍然有活性,因此,osw2Δ突变株酵母孢子壁的孔径大小应大于四糖。
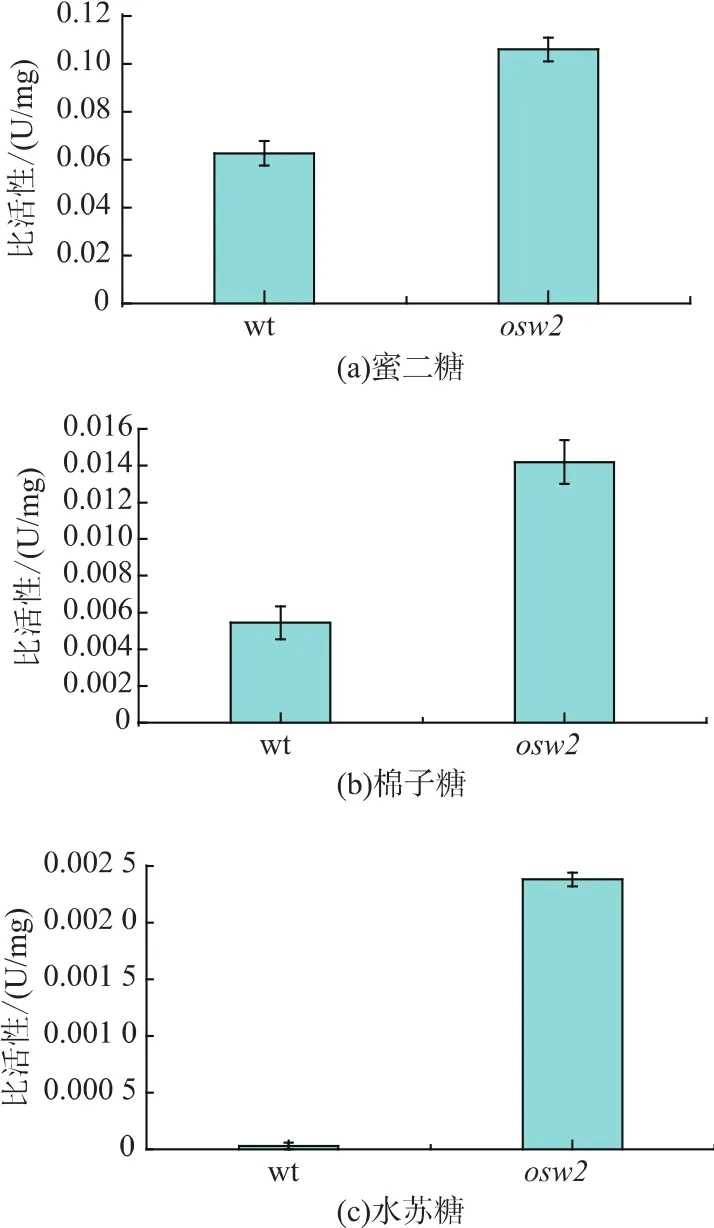
图2 孢子固定化酶催化不同底物的活性Fig.2 Activity of encapsulated enzyme with different substrates
2.3 孢子固定化酶可抵抗一定浓度SDS的处理
为了研究野生型AN120与osw2Δ突变株酵母孢子对固定化酶的保护性作用,本实验分别用2%和10%SDS处理孢子固定化酶和游离酶,分别选取蜜二糖和棉子糖为底物来检测酶的相对活性,将各自未进行处理的酶活作为对照组,活性设为1。以蜜二糖为底物,用2%SDS分别处理游离酶和孢子固定化酶,检测酶的相对活性,结果如图3所示。实验说明,孢子固定化酶几乎可以完全抵抗2%SDS的处理。以棉子糖为底物,用10%SDS分别处理游离酶和孢子固定化酶,检测酶的相对活性,结果如图4所示。实验说明,孢子固定化酶仍可部分抵抗10%SDS的处理。
2.4 酶活测定与蛋白免疫印迹分析尿素对孢子固定化酶的影响
尿素作为一种小分子物质,更容易进入孢子内,蛋白质中含有肽键,尿素中含有酰胺键,根据相似相容原理,尿素可以溶解蛋白质。实验用8 mol/L尿素处理野生型与osw2Δ突变株孢子固定化酶,以蜜二糖为底物,通过葡萄糖测定试剂盒测定固定化酶的活性,结果如图5所示。实验说明,osw2Δ突变株孢子固定化酶经8 mol/L尿素处理后,酶活降低80%,而野生型AN120孢子固定化酶经8 mol/L尿素处理后仅降低不足30%,因此猜测8 mol/L尿素更容易进入osw2Δ突变株孢子中,溶解孢子固定化酶。为了验证这一猜测,进行western blot蛋白免疫印迹实验,直观分析孢子固定化酶的含量,结果如图6所示。经过8 mol/L尿素处理后,osw2Δ突变株孢子固定化酶的含量降低很多,而野生型AN120却变化不大,结果更进一步说明了8 mol/L尿素可进入osw2Δ孢子内部,溶解固定化酶,降低固定化酶含量,降低酶活。

图3 2%SDS处理后游离酶和孢子固定化酶的相对活性Fig.3 Relative activity of enzyme after 2%SDS treatment

图4 10%SDS处理后游离酶和孢子固定化酶的相对活性Fig.4 Relative activity of enzyme after 10%SDS treatment
2.5 多种突变株孢子固定化酶活性测定
为了对比多种突变菌株孢子固定化酶的活性,分别选取蜜二糖和棉子糖为底物进行研究对比,结果如图7所示。当以蜜二糖为底物时,osw2Δ,ydr326cΔ,osw2Δydl186wΔ,osw2Δydr326cΔ 突变株固定化酶的活性均比较高,差异不大;而当以棉子糖为底物时,osw2Δ,osw2Δydl186wΔ,osw2Δydr326cΔ三个突变株固定化酶的活性明显高于其他突变株与野生型。综合考虑,对于催化分子量较大的底物,osw2Δ,osw2Δydl186wΔ,osw2Δydr326cΔ 三个突变株固定化酶催化活性更有优势。说明这些突变株均能成功固定化酶并具有活性,实验结果是由试剂盒测定并分析得到,由于测定方法的不同,所以比HPLC测定结果整体偏高,但趋势均为一致。

图5 8 mol/L Urea处理后孢子固定化酶的相对活性Fig.5 Relative activity of encapsulated enzyme after 8 mol/L Urea treatment

图6 8 mol/L Urea处理后osw2Δ孢子固定酶量明显降低Fig.6 osw2Δ spore encapsulate enzyme decrease significantly


图5 不同突变株固定化酶的活性Fig.5 Specific activity ofdifferentmutantstrains encapsulate enzyme
3 结 语
本研究将α-半乳糖苷酶成功固定在多种孢子突变菌株上,并着重研究了野生型与osw2Δ突变株固定化酶在对不同底物的催化效率,对外界不良因素的抵抗能力之间的差异等多方面因素,发现了野生型孢子壁最大只允许处于三糖与四糖之间分子量大小的物质通过,而对于osw2Δ突变株孢子壁可以允许四糖或者可能大于四糖的物质通过,在接下来的工作中希望通过尝试五糖、六糖等更大分子的糖作为底物进行研究,找到osw2Δ突变株以及其他突变株孢子壁结构的最大通过物质。通过8 M尿素处理实验的结果发现osw2Δ突变株孢子固定化酶的含量下降尤为明显,目前对于OSW2基因具体影响孢子壁结构的哪一部分还不清楚,后期将会深入研究OSW2基因的具体作用。

