运动改善高血压肠系膜动脉LTCC和BKCa通道功能的表观遗传调控机制
张严焱,徐召霞,陈 渝,李珊珊,石丽君
运动改善高血压肠系膜动脉LTCC和BKCa通道功能的表观遗传调控机制
张严焱,徐召霞,陈 渝,李珊珊,石丽君
北京体育大学 运动生理教研室, 北京 100084
目的:探讨有氧运动改善自发性高血压大鼠肠系膜动脉平滑肌L型电压门控钙通道(voltage-gated L-type Ca2+channel,LTCC)和大电导钙激活钾通道(large-conductance Ca2+-activated K+channel,BKCa)功能的表观遗传机制。方法:12周龄雄性自发性高血压大鼠(Spontaneously hypertensive rat,SHR)及正常血压大鼠(Wistar-Kyoto,WKY),随机分为正常血压安静组(WKY-SED)、正常血压运动组(WKY-EX)、高血压安静组(SHR-SED)和高血压运动组(SHR-EX),运动组进行中等强度跑台运动训练。12周后,取肠系膜动脉,分别采用膜片钳,钙成像、免疫蛋白印迹、qPCR、亚硫酸氢盐测序技术观察血管平滑肌LTCC、BKCa通道全细胞电流,BKCa单通道门控特性,钙火花,LTCC α1c、BKCaα和β1亚基mRNA、蛋白表达,α1c、β1基因启动子区甲基化水平,miR-328表达。离体实验,进行血管平滑肌原代培养,转染miR-328 mimic和miR-328 inhibitor使之过表达或沉默,干扰48 h后检测α1c亚基mRNA、蛋白表达变化。结果:1)有氧运动后,WKY和SHR运动组收缩压均分别显著低于各自安静对照组;2)运动显著减弱SHR肠系膜动脉平滑肌LTCC和BKCa全细胞电流密度的上调;3)运动降低高血压BKCa通道开放概率(P)及钙火花幅值的升高;4)运动显著抑制了SHR肠系膜动脉BKCaβ1亚基mRNA、蛋白表达上调;高血压时β1基因启动子区呈去甲基化,经有氧运动后甲基化水平升高;5)LTCC α1c蛋白表达在SHR-SED组显著上调,SHR-EX组α1c表达下调;肠系膜动脉miR-328表达与α1c亚基蛋白表达呈高度负相关;6)转染miR-328 mimic 48 h后,α1c亚基蛋白表达显著下降;miR-328 inhibitor组,α1c亚基表达稍上调无显著差异。结论:规律有氧运动可有效降低SHR血压,引起β1亚基启动子区甲基化,调控miR-328在转录后靶向抑制α1c亚基表达,是运动改善高血压肠系膜动脉BKCa和LTCC通道功能重构的表观遗传机制之一。
运动;离子通道;DNA甲基化;微小RNA
高血压是重要的全球性公共卫生问题,困扰着全世界约1/4的人口;同时也是中风,冠状动脉疾病,心衰等心血管疾病和肾脏病变的主要危险因素[22]。在高血压的病理过程中始终伴随着外周阻力动脉的血管张力的增加以及血管舒张能力的下降[10]。小动脉和微动脉是外周阻力形成的主要部位,除了神经-体液调节之外,血管平滑肌细胞(vascular smooth muscle cell,VSMC)能直接调控血管收缩,其膜上离子通道的正常活动是血管平滑肌兴奋收缩过程的关键。有研究表明,高血压下观察到的血管张力增加与VSMC膜上的“离子通道重构”有关[20],其中,Ca2+和K+通道在调节细胞内钙水平、控制静息膜电位和细胞收缩中扮演着重要的角色[12,20,30,33]。
VSMC膜上表达多种K+和Ca2+通道。大电导钙激活钾通道(large-conductance Ca2+-activated K+channel,BKCa)是最为重要的K+通道家族成员之一,其广泛分布于VSMC上,在膜去极化和局部[Ca2+]i升高条件下激活;参与调节静息膜电位(Em),同时,BKCa通道的开放是血管平滑肌舒张的重要机制[5,6,28,30]。L型电压门控钙通道(voltage-gated L-type Ca2+channel,LTCC)也在膜去极化条件下激活,VSMC兴奋,膜去极化,导致LTCC通道电压依赖的开放,Ca2+内流,全胞钙升高,诱发VSMC收缩机制[15,29,37]。因此,LTCC和BKCa通道之间的平衡在调控膜去极化-超级化,VSMC收缩-舒张以及血管张力中起重要作用。
规律有氧运动是有效预防和控制高血压的非药物治疗方法,诸多研究表明,有氧运动与VSMC离子通道功能改善存在密切关系[1,2,31,32],但目前运动调控血管平滑肌离子通道功能的潜在机制仍不清楚。近年来,随着表观遗传学迅速发展,表观遗传(epigenetic)修饰搭建起了环境-基因之间的桥梁或中介,而高血压的发生正是由多种遗传和环境因素相互作用引起的[22];同时,与基因突变所不同的是,表观遗传改变具有可逆性,可作为高血压治疗的有效新药物靶点。规律运动作为环境表观遗传调制器,可在不影响DNA编码的前提下,通过诱导表观遗传修饰调控高血压相关基因的表达水平,改善心血管功能[25,36]。
表观遗传修饰主要包括DNA甲基化,组蛋白质修饰和非编码microRNA。DNA甲基化是指基因组DNA在DNA甲基转移酶作用下使CpG二核苷酸5’端的胞嘧啶,被选择性地添加甲基,转变为5’甲基胞嘧啶[21]。DNA甲基化可从转录前水平调控下游功能蛋白,关闭某些基因的活性[21]。近期研究表明,启动子区甲基化水平能够调控VSMC离子通道表达和功能[11,18,23]。microRNA(miRNA,miR)是一类高度保守内源性非编码小分子RNA,它能与靶基因mRNA分子特异性结合,直接降解靶mRNA或负向调控mRNA的翻译,是重要的转录后调控[9]。miRNA作为表观调控的重要组成部分在心血管系统中高度表达,参与调节VSMC离子通道功能[16,19]。在肺动脉和心肌细胞中,miR-328均被证实能够靶向作用于LTCCα1c亚基[16]。那么,规律运动作为一种良性刺激,是否能够使得DNA启动子区甲基化状态发生逆转,或引起miRNA改变,进而影响LTCC和BKCa通道的表达和功能变化,改善血管舒缩功能,目前尚不清楚。
因此,本研究旨在观察原发性高血压时,肠系膜动脉LTCC和BKCa通道功能变化,并从表观遗传角度,探讨启动子区DNA甲基化以及miR-328在运动干预高血压肠系膜动脉血管平滑肌LTCC和BKCa通道功能中的作用。
1 材料与方法
1.1 实验动物分组及运动方案

1.2 电生理记录
1.2.1 肠系膜动脉平滑肌细胞急性分离
大鼠腹腔注射戊巴比妥钠(50 mg/kg),麻醉后,取肠系膜动脉,剥离干净后置于无钙分离液中;将肠系膜动脉2~3级剪成1 mm的小段,室温平衡5 min后,置于酶消化液中,37℃恒温水浴箱中消化27~30 min。待消化完全后,置于室温下分离液漂洗3次终止消化,每次5 min。然后用抛光后的玻璃吸管轻轻吹打,吸取细胞悬液经滤网过滤至细胞浴槽内,4℃贴壁待用。
酶消化液组成成分:2 mg/ml牛血清白蛋白(BSA)、 4 mg/ml木瓜蛋白酶(Papain)、1 mg/ml二硫苏糖醇(DDT)、0.6 mg/ml F型胶原酶溶于分离液中。分离液组成成分(mmol/L):137 NaCl、5.6 KCl、1 MgCl2、 10 HEPES、10 Glucose、0.42 Na2HPO4,0.44 NaH2PO4, 4.2 NaHCO3,NaOH调pH至7.3。
1.2.2 全细胞电流记录
LTCC电流测定采用膜片钳全细胞电压钳记录模式;细胞在-80 mV钳制电压,检测电压为-70~+70 mV,阶跃10 mV,持续200 ms。所测电流信号经Axon 700B amplifier放大,低通滤波2 kHz,采样频率10 kHz。在Clampfit 10.2软件控制下,进行A/D、D/A转换,采用pCLAMP 10.2软件包进行数据采集并分析。为了增大单位电流,用Ba2+替代Ca2+作为电荷载体,以限制电流衰减。电极内液成分(mmol/L):130 CsCl、10 HEPES、3 Na2ATP、0.1 Na2GTP、1.5 MgCl2、10 Glucose、10 EGTA、0.5 MgATP,CsOH调pH至7.3。细胞外液成分(mmol/L):20 BaCl2、10 HEPES、5 Glucouse、1 MgCl2、124 choline chloride,CsOH调pH至7.4。
全细胞K+电流(IK)采用传统电压钳记录模式。细胞外液成分(mmol/L):134 NaCl、6 KCl、1 MgCl2、1.8 CaCl2、10 Glucose、10 HEPES(pH 7.4)。电极内液成分(mmol/L):110 K-Asp、30 KCl、1 EGTA、3 Na2ATP、0.85 CaCl2、10 Glucouse、10 HEPES(pH 7.2)。电流-电压(I-V)曲线获得条件:细胞钳制电压在-80 mV,逐步去极至+70 mV,阶跃+10 mV,脉冲时程为350 ms。细胞外液孵育BKCa通道特异性阻断剂IbTX(100 nmol/L),IbTX敏感电流即为BKCa通道电流。
1.2.3 单通道纪录
BKCa单通道电流采用膜片钳内面向外记录模式。细胞内外液采用对称性高K+(145 mmol/L)方式,电极电阻10~15 MΩ,电极内液成分(mmol/L):100 KCl、45 K-aspartate、1 EGTA、10 Hepes、5 Glucose(pH 7.4)。浴液中的游离Ca2+浓度([Ca2+]free)通过加入适量CaCl2和EGTA控制,所用CaCl2和EGTA的量利用WinMax C软件(http://maxchelator.stanford.edu/webmaxc/webmaxcS.htm)计算得到。单通道电流信号经Axon 700B amplifier放大,在Clampfit 10.2软件控制下,进行A/D,D/A转换,采样频率10 kHz,8极Bessel低通滤波2 kHz。每个电压下持续稳定记录至少2 min用于通道开放概率()分析,采用pCLAMP 10.2软件包进行数据分析。
1.3 钙成像
急性分离的肠系膜动脉平滑肌细胞种于玻底培养皿,贴壁30 min后,室温负载钙离子染料Fluo-4 AM(5 μmol/L)约25~30 min后,用含1.5 mmol/L CaCl2的分离液清洗3遍,每次10 min;分离液成分(mmol/L): 137 NaCl、5.6 KCl、1 MgCl2、10 HEPES、10 Glucose、0.03硝普钠(pH 7.4)。负载上Fluo-4 AM的平滑肌细胞将基于Leica DMi8全内反射荧光(total internal reflection fluorescence,TIRF)系统捕捉钙火花(Ca2+spark)信号,激发光488 nm,采样频率30~90 Hz,采样参数28 ms/page。
钙火花数据采用Image J图像处理软件(NIH,USA)和Matlab数学软件(MathWorks,USA)自编程序进行分析。采集图片导入Image J后,沿钙火花边缘圈出所需ROI(region of interest),得到ROI的平均灰度值(mean intensity),之后导入Matlab,经自编程序运行,得到每个ROI对应的钙离子荧光强度的变化曲线。钙火花分析为F/F=F-F/F-F,其中,为ROI的平均荧光强度,F为开始采集信号但无钙火花发生时所选细胞平均荧光强度值,F为图片背景荧光强度。本研究中钙火花的认定标准是F/F>1.2。
1.4 免疫蛋白印迹
肠系膜动脉平滑肌提取总蛋白,制备SDS-PAGE电泳样品,上样量为20 µg。电泳后,蛋白转移至PVDF膜,5% BSA封闭后,4°C过夜孵育一抗Rabbit polyclonal anti-α1c(1:200),Rabbit polyclonal anti-KCa1.1(1:300),Rabbit polyclonalanti-sloβ1(1:300),一抗均购于Alomone Laboratories。次日二抗anti-rabbit IgG-HRP(1:10 000,Proteintech Group)室温孵育1 h后,化学发光,置于Bio-Rad Chemi DOC XRS+成像系统(Bio-Rad Laboratories,USA)获取特异性免疫反应发光条带。β-actin或GAPDH作为内参蛋白。
1.5 RT-PCR
肠系膜动脉平滑肌提取mRNA,采用Maxima First Strand cDNA Synthesis Kit(ThermoFisher)反转成cDNA;Taqman Fast Advanced Master Mix进行扩增反应,扩增条件为50℃ 2 min,95℃ 2 min,之后扩增40个循环(95℃ 3s、60℃ 30 s)。LTCC α1c亚基()、BKCaα亚基()、BKCaβ1亚基()、内参基因β-actin的Taqman探针购于ThermoFisher。肠系膜动脉miRNA提取采用miRcute miRNA提取试剂盒(Tiangen,Beijing);RevertAid First Strand cDNA Synthesis Kit进行反转,反转时miR-328及其对应内参U6应用特异性茎环引物(miR-328:5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGG ATACGAACGGAAGG-3’;U6:5’-CTCGCTTCGGCAGCA CATATACT-3’);之后Power SYBR Green PCR Master Mix进行扩增反应,扩增引物miR-328:5’-ATTATATCTGGCCC TCTCTGC-3’,5’-TCGTATCCAGTGCAGGGTC-3’;U6:5’-CTCGCTTCGGCAGCACATATACT-3’,5’-ACGCTTCACG AATTTGCGTGTC-3’。目的基因表达以比较Ct法进行相对定量。
1.6 亚硫酸氢盐测序法(Bisulfite sequencing PCR,BSP)
提取肠系膜动脉基因组DNA,采用EZ DNA Methylation-Gold Kit (ZYMO Research,Orange)对基因组DNA进行亚硫酸氢盐处理。随后在和基因启动子区CpG岛外围(不含CpG位点)进行PCR扩增,产物2%琼脂糖检测,切胶,使用TIANgel Midi Purification Kit (Tiangen,Beijing)对DNA回收纯化;之后将PCR产物克隆至载体后,挑取10个克隆进行测序。基因引物:5’-GAATTTATTATGTTTTTTGGAGGTGA-3’,5’-ATCTCAACTCACTTAACTTTTACTCTACC-3’;基因引物:5’-AGAGAAAATAGAGGTTTAGAGAGGTGT-3’,5’-ATCAAATCTAAACACACAACTTACTCC-3’。甲基化结果以甲基化百分比表示:甲基化CpG/(甲基化CpG+未甲基化CpG)×100%。
1.7 VSMC原代培养及转染
取健康雄性、12周龄Wistar大鼠,乙醚麻醉,灭菌后,转移至超净工作台内。迅速取出肠系膜动脉0级,置于HBSS中,剥离外周脂肪组织,将动脉剪成7~9 mm长度;胶原酶37℃消化45 min后,剥离血管外膜和内皮;将剩余血管剪成1×1 mm碎片,置于弹性蛋白酶中37℃消化30~35 min后,巴氏吸管吹打直至组织碎片消失;离心后弃上清,加入含10%胎牛血清和1%抗生素的DMEM培养基重悬后,放入二氧化碳培养箱,48 h后换液。VSMC传至5~7代后进行后续转染实验,采用Lipofectamine RNAiMAX试剂将各miR-328干扰序列转染进细胞,miR-328 mimic (5’-CUGGCCCUCUCUGCCCUUCCGU-3’,5’-GGAAGGGCAGAGAGGGCCAGUU-3’);miR-328 inhibitor (5’-ACGGAAGGGCAGAGAGGGCCAG-3’);NC (5’-UUCUCCGAACGUGUCACGUTT-3’,5’-ACGUGACACGUUCGGAGAATT-3’)。在转染后 6 h,转染效率高低在荧光显微镜下通过荧光标记的siRNA (FAM-siRNA)实现;转染效率到75%以上即转染效果理想,可用于后续检测。48 h,提取mRNA和蛋白进行检测。
1.8 数据分析处理
数据以平均数±标准差(M±SD)表示。统计学分析采用SPSS 17.0统计分析软件,正态分布检验判断数据是否符合正态分布,在满足方差齐性检验下,在体实验进行双因素方差分析(Two-way ANOVA,高血压×运动);离体实验采用单因素方差分析(One-way ANOVA)。<0.05有显著性差异。
2 结果
2.1 有氧运动对高血压大鼠动脉血压的影响
12周龄SHR与WKY在体重上无显著差异;经12周有氧运动后,运动组体重(WKY-EX组:330.0±9.1 g;SHR-EX组:309.2±12.4 g)显著低于各自安静对照组(WKY-SED组:346.6±12.3 g;SHR-SED组:323.8±14.0 g;<0.05)。
采用尾动脉无创血压监测系统对WKY和SHR实验前后的HR、SBP、DBP、MAP进行测量。12周龄SHR组的收缩压为191.6±13.2 mmHg,显著高于WKY组(134.9± 6.4 mmHg,<0.05)。经12周有氧运动后,运动组的收缩压,无论是WKY-EX组(131.2±9.2 mmHg),还是SHR-EX组(182.9±8.4 mmHg)都分别显著低于WKY-SED(137.6±7.2 mmHg,<0.05)和SHR-SED组(197.8±18.0 mmHg,<0.05,表1)。
表1 有氧运动对WKY和SHR心率及血压的影响
Table 1 Effects of Exercise Training on HR and BP of WKY and SHR

注:*表示与WKY-SED组相比<0.05有显著性差异,#表示与SHR-SED组相比<0.05有显著性差异,下同。
2.2 运动减弱SHR肠系膜动脉平滑肌LTCC和BKCa电流
采用全细胞电压钳记录模式对各组肠系膜动脉平滑肌细胞LTCC和BKCa通道的电生理特性进行鉴定。
如图1-A,为记录到的各组全细胞Ca2+电流示意图,LTCC通道特异性阻断剂Nifedipine(100 nmol/L)能够抑制几乎所有的内向电流,提示,用Ba2+作为电流载体,记录到的Ba2+电流即为LTCC通道开放产生。为消除细胞表面积不同对钙电流大小产生的影响,所记录到的全细胞LTCC通道电流均采用膜电容进行标准化,即电流密度(pA/pF);得到图1-B,电流-电压(I-V)曲线图,最大内向电流峰值出现在+20 mV,各组肠系膜动脉VSMC最大钙电流密度分别为-10.5±1.1 pA/pF(WKY-SED组,n=14 cells),-12.6±1.0 pA/pF(WKY-EX组,n=16 cells),-17.1±2.2 pA/pF(SHR-SED组,n=20 cells),-12.4±2.4 pA/pF(SHR-EX组,n=18 cells);电生理实验中n均代表细胞个数,来源于6只实验动物。可以看出,SHR-SED组最大钙电流密度显著高于WKY-SED组(<0.05);而运动显著降低高血压LTCC通道电流(<0.05),但在正常血压组,运动却升高了WKY-EX组钙电流密度(<0.05)。
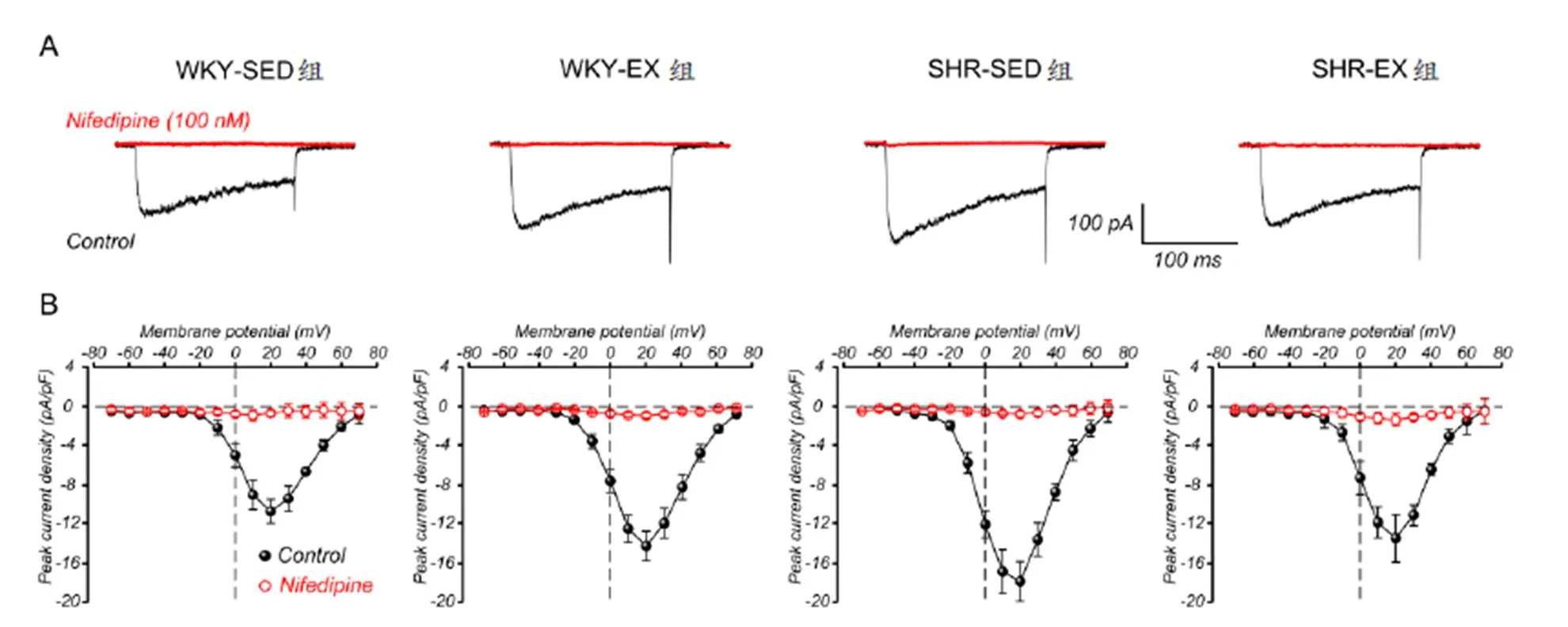
图 1 各组大鼠肠系膜动脉平滑肌细胞LTCC通道电流
Figure 1. Whole-cell LTCC Currents Recorded in Mesenteric Artery Myocytes from Four Groups
注:A为各组全细胞Ca2+电流(黑色)及100 nmol/L Nifedipine(红色)阻断后Ca2+电流代表图;B为各组肠系膜动脉平滑肌LTCC通道电流-电压(I-V)曲线图。
在静息膜电位方面,与WKY-SED组(-52.1±4.5 mV,n=30 cells)相比,SHR-SED组静息Em去极化(-38.0±3.6 mV,n=31 cells)。12周运动后,SHR-EX组静息膜电位为-44.3±2.7 mV(n=35 cells),显著高于SHR-SED组;运动对WKY静息Em无显著影响(-50.3±4.2 mV,n= 35 cells)。BKCa通道特异性阻断剂IbTX(100 nM)作用 10 min后,各组全细胞K+电流被显著抑制,得到BKCa通道在全细胞IK电流中的贡献。SHR-SED及WKY-EX组平滑肌细胞IbTX敏感电流,即BKCa电流均显著高于WKY-SED组(<0.05)(图2-A)。当钳制电位是+70 mV时,WKY-SED、WKY-EX和SHR-SED组BKCa电流密度分别是14.7± 0.8 pA/pF(n=10 cells)、27.6±2.9 pA/pF(n=9 cells)、43.2±3.3 pA/pF(n=10 cells)(图2-B)。在高血压组,有氧运动显著降低了SHR-EX组BKCa电流密度(25.4±2.7 pA/pF,n=12 cells,<0.05)。

图2 各组大鼠肠系膜动脉平滑肌全细胞K+电流
Figure 2. Whole-cell K+Currents Recorded in Mesenteric Artery Myocytes from Four Groups
注:A为各组全细胞K+电流(黑色)及100 nmol/L IbTX(红色)阻断后K+电流代表图。B为各组肠系膜动脉平滑肌BKCa通道电流-电压(I-V)曲线图。
以上结果提示,高血压引起肠系膜动脉平滑肌细胞LTCC和BKCa通道功能上调,而有氧运动可减弱高血压引起的这些改变。值得注意的是,在正常血压组,有氧运动没有降低反而增大了VSMC全细胞LTCC和BKCa通道电流。
2.3 运动抑制SHR肠系膜动脉平滑肌BKCa通道门控特性及钙火花功能改变
为检测BKCa通道全细胞电流变化是否与其单通道特性改变有关,本研究采用单通道内面向外记录模式对各组肠系膜动脉平滑肌细胞BKCa单通道功能及门控特性进行鉴定。在[Ca2+]free=1 μmol/L,钳制电压在+40 mV,与WKY-SED组相比,高血压BKCa通道开放概率(P)显著增大(<0.05);12周有氧运动后,SHR-EX组P显著低于SHR-SED组(<0.05),然而运动却增强了正常血压组BKCa通道活动,WKY-EX组P明显增加,显著高于WKY-SED组(<0.05)(图3-A、图3-B)。
局部[Ca2+]i升高,即VSMC胞内肌质网上RyR开放产生的钙火花(Ca2+spark)可激活附近的BKCa通道,因此,本研究采用钙离子成像技术检测了各组VSMC自发性钙火花变化情况。如图3-C所示,与WKY-SED组相比(1.21±0.06F/F,n=9 cells),WKY-EX组钙火花幅值稍升高但无显著差异(1.35±0.07F/F,n=12 cells,>0.05);SHR-SED组平滑肌细胞钙火花幅值显著增高(1.69±0.07F/F,n=14 cells,<0.05)。运动后,SHR-EX组细胞钙火花幅值为1.50±0.04F/F(n=10 cells),显著低于SHR-SED组(<0.05)。提示,钙火花活动改变可能是高血压肠系膜动脉血管平滑肌BKCa通道功能上调,及运动后BKCa通道活动改变的原因之一。

图 3 各组大鼠肠系膜动脉平滑肌BKCa单通道电流及钙火花特征
Figure 3. BKCaChannel Activity and Ca2+Spark Recorded in Mesenteric Artery Myocytes from Four Groups
注:A为HP=+40 mV,[Ca2+]free=1 μmol/L,各组肠系膜动脉平滑肌BKCa通道开放示意图;B为BKCa通道开放概率(P)统计图;C为各组平滑肌细胞钙火花代表图和钙离子荧光强度变化曲线图,图中白色圆圈示意代表钙火花区域。
2.4 各组肠系膜动脉血管平滑肌LTCC和BKCa通道蛋白及mRNA表达变化
免疫蛋白印迹及荧光定量PCR技术观察各组大鼠肠系膜动脉LTCC和BKCa通道亚基蛋白及mRNA表达改变。
如图4-A、图4-C所示,各组大鼠LTCC通道α1c亚基(240 KDa)蛋白表达,与WKY-SED组相比,SHR-SED组α1c亚基蛋白表达显著上调(<0.05),有氧运动显著下调SHR-EX组α1c表达量(<0.05)。但在正常血压组,运动显著升高而非抑制α1c亚基表达(<0.05)。分别选用α和β1亚基特异性抗体检测到125 kDa和28 kDa的蛋白表达(图4-B、4-D)。BKCa通道α亚基在各组间表达无显著差异。与WKY-SED组相比,SHR-SED组β1亚基蛋白表达显著上调(<0.05)。因此,高血压β1/α比值呈现显著性上升(<0.05)。提示,高血压时β1亚基上调较α亚基更为显著。经有氧运动后,WKY-EX组β1亚基表达发生上调(<0.05),而SHR-EX组较SHR-SED组β1亚基表达发生显著下调,β1/α比值亦呈显著下降(<0.05)。

图 4 各组大鼠肠系膜动脉LTCC和BKCa通道亚基蛋白表达
Figure 4. Protein Expression of LTCC and BKCaChannel Subunits in Mesenteric Arteries from Four Groups
注:A为各组肠系膜动脉LTCC通道α1c亚基及内参β-actin的Western blot条带;B为各组肠系膜动脉BKCa通道α和β1亚基及内参β-actin的Western blot条带;C为各组肠系膜动脉α1c亚基蛋白表达统计;D为各组肠系膜动脉α和β1亚基蛋白表达统计(各组n=6)。
qPCR结果如图5-A所示,WKY-SED、WKY-EX和SHR-SED组间大鼠LTCC通道α1c亚基mRNA表达无显著差异(>0.05);但有氧运动显著下调SHR-EX组α1cmRNA表达量(<0.05)。BKCa通道α亚基mRNA在各组间表达无显著差异。与WKY-SED组相比,WKY-EX和SHR-SED组β1亚基mRNA表达均显著上调(<0.05)。而经有氧运动后,SHR-EX组较SHR-SED组β1亚基mRNA表达发生显著下调(<0.05)。
2.5 运动对高血压肠系膜动脉CACNA1C和KCNMB1基因启动子区甲基化的影响
采用亚硫酸氢盐测序法检测了LTCC通道α1c基因()和BKCa通道β1基因()启动子区的甲基化水平,进一步探究高血压引起肠系膜动脉离子通道重塑及运动改善LTCC和BKCa通道功能的潜在表观遗传机制。
如图5-B所示,本研究分别选取了位于4号染色体基因启动子区538 bp长度、包含11个CpG位点的CpG岛区(216566309-216566846),以及位于10号染色体上的基因启动子区402 bp长度,包含7个CpG位点的区域(18911664-18912065)的甲基化水平进行了分析。
结果显示(图5-C、5-D),WKY-SED、WKY-EX和SHR-SED组肠系膜动脉基因启动子区甲基化程度未发现显著改变;运动后,SHR-EX组基因启动子区甲基化水平显著上调,发生超甲基化(<0.05)。对于基因,正常血压时,WKY-EX组肠系膜动脉基因启动子区显著去甲基化 (<0.05)。同时,与WKY-SED组相比,SHR-SED组基因启动子区甲基化水平亦发生显著降低(<0.05);但有氧运动后,SHR-EX组启动子区甲基化程度上调,表现为超甲基化(<0.05)。
2.6 运动经miR-328靶向调控LTCC通道α1c亚基表达
此部分本研究首先对各组miR-328表达进行检测,结果显示,正常血压时,WKY-EX和SHR-SED组肠系膜动脉miR-328表达均显著降低(<0.05)。有氧运动后,SHR-EX组miR-328表达显著上调(<0.05)(图6-A)。这与LTCC通道α1c亚基蛋白表达结果相反,提示,运动可能经miR-328靶向调控LTCC通道α1c亚基表达;后续进行离体实验,对肠系膜动脉VSMC分离培养和转染干预,进一步验证miR-328的靶向作用。
如图6-B所示,采用免疫荧光激光共聚焦成像,用平滑肌特异性肌动蛋白α-actin对培养后的VSMC进行鉴定,VSMC骨架蛋白α-actin清晰可变,证明培养的细胞为VSMC,纯度达到95%,无杂细胞污染,可用于后续转染实验。α1c亚基mRNA表达在转染后48 h无显著变化。而在转染miR-328 mimic 48 h后α1c亚基蛋白表达显著下调(<0.05);转染miR-328 inhibitor组α1c亚基蛋白表达稍上调(>0.05)(图6-D)。

图5 各组大鼠肠系膜动脉LTCC、BKCa通道亚基mRNA及DNA甲基化水平
Figure 5. mRNA and DNA Methylation Levels of LTCC and BKCaChannel Subunits from Four Groups
注:A为各组肠系膜动脉LTCC通道α1c亚基、BKCa通道α和β1亚基mRNA表达统计(各组n=6);B为、基因启动子区CpG岛区图谱;C为各组、基因CpG位点DNA甲基化情况,每个基因选取10个克隆进行测序,其中黑色圈代表甲基化位点,白色圈代表未甲基化位点;D为、启动子区CpG位点甲基化百分比水平统计(各组n=6)。

图6 VSMC转染后LTCC通道α1c亚基mRNA及蛋白表达
Figure 6. mRNA and Protein Expression of LTCC α1cSubunit After Transfection in VSMC
注:A为各组大鼠肠系膜动脉miR-328表达统计(各组n=6);B为平滑肌特异性肌动蛋白α-actin荧光标记的VSMC代表图;C为VSMC转染miR-328 mimic或inhibitor 48 h后LTCC通道α1c亚基mRNA表达统计;D为VSMC转染miR-328 mimic或inhibitor 48 h后LTCC通道α1c亚基蛋白表达统计(各组n=6),代表培养的细胞批数。&表示与NC相比,<0.05有显著性差异。
3 讨论
本研究结果表明,规律有氧运动可有效降低自发性高血压大鼠血压,引起β1亚基启动子区甲基化,调控miR-328在转录后靶向抑制α1c亚基表达,是运动改善高血压肠系膜动脉BKCa和LTCC通道功能重构的表观遗传机制之一。
有氧运动可有效降低高血压大鼠血压和心率,运动的降压作用涉及多种机制。例如,运动训练能够调节植物神经功能,降低交感神经兴奋性,降低心率,从而降低心输出量[35];此外,交感神经兴奋性降低,迷走神经兴奋性增加,使得外周小动脉痉挛得到缓解,达到降压作用[14];有氧运动降压的其他外周机制还包括外周血管阻力下降[7],内皮功能改善[34]等。而运动可逆转高血压引起的VSMC离子通道的病理重构,改善动脉功能,亦会对血压降低起到积极作用[31,32]。
LTCC是存在于VSMC上的一种主要钙通道,经LTCC内流的Ca2+是胞浆中Ca2+浓度升高的主要途径,也是引起VSMC收缩的基础。多年研究证实,VSMC膜上LTCC通道上调被公认为是高血压的一个标志性特征[8,29,37]。本研究中,采用膜片钳全细胞记录模式检测到,LTCC通道电流在高血压时显著增大,这与以往的研究是一致的。高血压时,VSMC膜上LTCC上调,导致胞内Ca2+浓度增加,引起外周阻力和血管收缩反应增大[8,37]。此外,血压与体内VSMC的LTCC通道数量呈高度正相关。高血压时L钙通道电流的这种增大被证明是由于其通道本身上调[38]以及膜电位的去极化[12]导致的。事实上,高血压动物血管LTCC通道功能上调极大程度是通道表达的增加。免疫印迹结果亦表明,与正常血压组相比,高血压大鼠动脉LTCC通道亚基α1c显著增加。此外,VSMC的去极化,是血管对血压升高的基本反应,同样是α1c亚基上调的主要刺激之一。本研究中,高血压组肠系膜动脉VSMC静息Em呈显著去极化状态,从而增大了Ca2+电流密度。经有氧运动后,SHR-EX组血压降低,静息Em超级化,伴随着LTCC通道电流、α1c亚基表达下调。BKCa通道是VSMC上表达最广泛的一类K+通道,其生理功能主要是通过负反馈机制来对抗管腔内压升高引起的肌源性收缩,从而确保重要器官稳定的血流灌注[30]。本研究结果证明,SHR肠系膜动脉平滑肌全细胞IK电流增加;BKCa通道特异性阻断剂IbTX作用后显示,BKCa电流在高血压时亦显著上调。以往的研究亦表明,SHR动脉平滑肌BKCa通道功能增强[26,31],而运动可以逆转高血压肠系膜动脉BKCa通道的功能上调。值得注意的是,在正常血压组,有氧运动引起SBP小幅度的下降,但却引起WKY-EX组LTCC和BKCa通道功能上调,与运动在高血压时的作用相反。提示,在正常血压时,运动引起离子通道的重塑是独立于血压变化的一种改变。
上文已经提到,BKCa通道可在局部[Ca2+]i浓度升高条件下激活,即近膜区钙火花能够活化其附近簇状分布的BKCa通道开放;可以说,钙火花的活动改变是BKCa通道活动改变的原因之一。钙火花是肌质网上单个RyR自发或者协同开放所产生的钙释放事件光学记录[27]。钙火花释放可使膜超级化,其结果是关闭电压依赖钙通道,阻止外钙内流,可以说钙火花具有强有力的负反馈调节机制,其净效应是降低全细胞Ca2+浓度,导致血管舒张[27]。因此,本研究采用活细胞实时钙离子成像技术结合全内反射荧光(TIRF)系统捕捉各组肠系膜动脉VSMC钙火花信号。TIRF系统的优势在于非常适合检测细胞膜表面或膜下200 nm区域的信号,同时,TIRF系统几乎没有任何背景荧光干扰,能在最大程度上提高图像的信噪比,优于传统激光共聚焦系统采集到的钙火花图像。SHR肠系膜动脉VSMC钙火花幅值显著增大,有氧运动后幅值下降。除钙火花外,BKCa通道固有生物物理特性、通道蛋白表达的改变都可引起高血压肠系膜动脉BKCa通道电流增大。蛋白免疫印迹分析BKCa通道β1亚基在高血压大鼠中的表达显著增多。单通道结果显示,高血压时BKCa通道的开放概率显著增加,这与β1亚基表达上调是一致的。因此,SHR肠系膜动脉平滑肌BKCa通道功能增加,首先归因于钙火花幅值的升高,其次单通道活动增强、β1亚基表达上调也是其重要原因,而有氧运动可逆转高血压引起的BKCa的病理性代偿上调。
综上所述,高血压时,肠系膜动脉α1c亚基表达上调,LTCC通道电流增大,VSMC胞内钙浓度升高;为代偿胞内升高的Ca2+,钙火花释放增加、β1亚基表达上调,进而引起BKCa通道功能代偿性增强。本研究证实了有氧运动可逆转高血压VSMC离子通道重构,下调高血压肠系膜动脉α1c和β1亚基表达,从而降低LTCC通道电流,延缓BKCa通道的病理性代偿增强,诱导动脉平滑肌功能恢复。
近年来,随着表观遗传学的新兴和发展,表观遗传学理论和技术已成为心血管领域新的研究热点之一,而环境、饮食、药物、体力活动等因素均可通过对基因的表观遗传修饰影响基因表达[3]。因此,表观遗传是环境-遗传物质间相互作用的结果,也是环境-基因之间的桥梁,并且把基因型和表型密切联系在一起[36]。DNA甲基化是最先发现研究最广泛的表观遗传修饰,可从转录前水平调控下游功能蛋白,关闭某些基因的活性,甲基化位点亦可随DNA的复制而遗传[21],而启动子DNA超甲基化或甲基化水平升高,通常能够抑制基因转录,直接沉默相关基因[21]。规律运动作为一种良性刺激,可使得DNA启动子内甲基化状态发生逆转,进而影响血管功能调控相关基因的表达,改善血管功能。本研究中,高血压时基因启动子区呈去甲基化,有氧运动可引起启动子区甲基化水平升高,这与β1亚基mRNA、蛋白表达以及功能改变的结果是一致的。因此,β1亚基启动子区甲基化水平在BKCa通道功能调控中起重要作用。以往也有研究证实,未怀孕的羊子宫动脉BKCaβ1亚基启动子区Sp-1转录因子位点高度甲基化,从而抑制转录因子结合,减弱BKCa通道活动[11]。对于LTCC α1c亚基,高血压未调控启动子区的甲基化水平,但运动引起高血压基因启动子区超甲基化,这也是运动导致高血压肠系膜动脉α1c亚基mRNA、蛋白表达及功能下调的原因之一。CpG位点的甲基化受到空间和时间因素的变化性影响,空间上包括组织或细胞的特异性,而时间上年龄、疾病、环境调控,都会引起有差异的甲基化水平[24]。因此,高血压或运动对基因的特异性影响可能是造成和甲基化水平差异的原因,但具体机制还需深入研究。而机体新陈代谢的改变被认为是引起表观修饰变化的基础,例如,三羧酸循环的中间代谢产物α-酮戊二酸是催化多种甲基化反应酶的底物和辅酶因子[13]。
除DNA甲基化外,本研究还探讨了miRNA介导的转录后调控机制。miRNA是一类不含遗传信息的非编码小RNA,主要对mRNA进行转录后的负向调节[17]。由于miRNA可以内源性地同时作用于与高血压有关的靶基因,因此,miRNA为全面深入了解高血压的表观遗传发病机制提供了很好的切入点。血管中表达有多种特异性的miRNA,其在血管的正常生长发育过程中必不可少[4]。本研究中,检测到各组肠系膜动脉miR-328表达与LTCC α1c亚基蛋白表达呈高度负相关。有文献报道,肺动脉高压时,miR-328可通过结合LTCC α1c亚基3’-UTR区,抑制α1c亚基表达,从而减弱了肺动脉对KCl的反应[16]。细胞转染实验亦证实,miR-328可靶向抑制α1c亚基表达,调控肠系膜动脉LTCC功能。此外,miR-328还可靶向作用于IGF-1R,引起肺动脉血管平滑肌发生细胞凋亡[16]。有报道,miR-210可靶向结合10-11易位甲基胞嘧啶双加氧酶-1(TET-1)mRNA 3’-UTR区,抑制TET-1表达,导致BKCaβ1亚基去甲基化过程受阻,β1亚基表达下调,子宫动脉BKCa通道功能受损[18]。可见,miRNA作为重要的转录后调控因子,可靶向作用于多种基因,调节动脉的结构和功能。
有研究表明,规律有氧运动作为一种环境表观遗传调制器,可在不影响DNA编码的前提下,通过诱导表观遗传修饰调控高血压相关基因的表达水平,在改善心血管功能中发挥着重要的作用。本研究通过膜片钳技术、钙离子成像、结合分子生物学检测、亚硫酸氢盐测序、细胞培养和转染等技术,从LTCC、BKCa通道全细胞电流、钙火花、BKCa单通道电流、通道亚基mRNA、蛋白表达,证明了有氧运动可有效改善高血压肠系膜动脉平滑肌LTCC和BKCa通道功能。并且,以DNA甲基化和miRNA为切入点,发现β1亚基启动子区甲基化,miR-328靶向抑制α1c亚基表达,是运动改善高血压肠系膜动脉BKCa和LTCC通道功能重构的表观遗传机制之一,为理解高血压发病的表观遗传机制以及高血压药物治疗新靶点的寻找提供了重要证据。
4 结论
规律有氧运动可有效降低SHR血压,引起β1亚基启动子区甲基化,调控miR-328在转录后靶向抑制α1c亚基表达,是运动改善高血压肠系膜动脉BKCa和LTCC通道功能重构的表观遗传机制之一。
[1] 鲁妮,陈渝,邱方,等.不同强度运动对自发性高血压大鼠肠系膜动脉CaV1.2通道重构的影响[J].体育科学,2015,35(6):57-63.
[2] 张严焱,刘雨佳,柏平,等.有氧运动抑制高血压脑动脉平滑肌RyR-BKCa通道功能耦联上调[J].体育科学,2017,37(1):55-61.
[3] 乔玉成,王卫军.规律运动干预人类衰老过程的表观遗传学机制研究进展[J].北京体育大学学报,2016,39(1):61-67.
[4] Albinsson S, Suarez Y, Skoura A,. MicroRNAs are necessary for vascular smooth muscle growth, differentiation, and function [J]. Arterioscler Thromb Vasc Biol, 2010, 30(6): 1118-1126.
[5] Amberg G C, Bonev A D, Rossow C F,. Modulation of the molecular composition of large conductance, Ca2+activated K+channels in vascular smooth muscle during hypertension [J]. J Clin Invest, 2003, 112(5): 717-724.
[6] Amberg G C, Santana L F.Downregulation of the BK channel beta1 subunit in genetic hypertension [J]. Circ Res, 2003, 93(10): 965-971.
[7] Azevedo L F, Brum P C, Mattos K C,. Effects of losartan combined with exercise training in spontaneously hypertensive rats [J]. Braz J Med Biol Res, 2003, 36(11): 1595-1603.
[8] Bannister J P, Bulley S, Narayanan D,. Transcriptional upregulation of α2δ-1 elevates arterial smooth muscle cell voltage-dependent Ca2+channel surface expression and cerebrovascular constriction in genetic hypertension [J]. Hypertension, 2012, 60(4): 1006-1015.
[9] Batkai S, Thum T. MicroRNAs in hypertension: mechanisms and therapeutic targets [J]. Curr Hypertens Rep, 2012, 14(1): 79-87.
[10]Brozovich F V, Nicholson C J, Degen C V,. Mechanisms of vascular smooth muscle contraction and the basis for pharmacologic treatment of smooth muscle disorders [J]. Pharmalcol Rev, 2016, 68(2): 476-532.
[11]Chen M, Dasgupta C, Xiong F,. Epigenetic upregulation of large-conductance Ca2+-activated K+channel expression in uterine vascular adaptation to pregnancy [J]. Hypertension, 2014, 64(3): 610-618.
[12]Cox R H, Lozinskaya I, Matsuda K,. Ramipril treatment alters Ca2+and K+channels in small mesenteric arteries from wistar-kyoto and spontaneously hypertensive rats [J]. Am J Hypertens, 2002, 15(10): 879-890.
[13] Etchegaray J P, Mostoslavsky R. Interplay between metabolism and epigenetics: a nuclear adaptation to environmen-tal changes [J]. Mol Cell, 2016, 62(5): 695-711.
[14]Fiuza-Luces C, Garatachea N, Berger N A,Exercise is the real polypill [J]. Physiology(Bethesda), 2013, 28(5): 330-358.
[15]Ghosh D, Syed A U, Prada M P,. Calcium channels in vascular smooth muscle [J]. Adv Pharmacol, 2017, 78: 49-87.
[16] Guo L, Qiu Z, Wei L,. The microRNA-328 regulates hypoxic pulmonary hypertension by targeting at insulin growth factor 1 receptor and L-type calcium channel-α1C [J]. Hyperten-sion, 2012, 59(5): 1006-1013.
[17]Hartmann D, Thum T. MicroRNAs and vascular dysfunction [J]. Vascul Pharmacol, 2011, 55(4): 92-105.
[18] Hu X Q, Dasgupta C, Chen M,. Pregnancy reprograms large-conductance Ca2+-activated K+channel in uterine arteries: roles of ten-eleven translocation methylcytosine dioxygenase 1-mediated active demethylation [J]. Hypertension, 2017, 69(6): 1181-1191.
[19] Hu X Q, Dasgupta C, Xiao D,MicroRNA-210 targets ten-eleven translocation methylcytosine dioxygenase 1 and suppresses pregnancy-mediated adaptation of large conductance Ca2+-activated K+channel expression and function in ovine uterine arteries [J].Hypertension, 2017, pii: HYPERTENSIONAHA.117.09864.
[20] Joseph B K, Thakali K M, Moore C L,. Ion channel remodeling in vascular smooth muscle during hypertension: Implications for novel therapeutic approaches [J]. Pharmacol Res, 2013, 70(1): 126-138.
[21]Jones P A. Functions of DNA methylation: islands, start sites, gene bodies and beyond [J]. Nat Rev Genet, 2012, 13(7): 484-492.
[22]Kearney P M, Whelton M, Reynolds K,. Global burden of hypertension: analysis of worldwide data [J]. Lancet, 2005, 365(9455): 217-223.
[23]Liao J, Zhang Y, Ye F,. Epigenetic regulation of L-type voltage-gated Ca2+channels in mesenteric arteries of aging hypertensive rats [J]. Hypertens Res, 2017, 40(5): 441-449.
[24] Lindholm M E, Marabita F, Gomez-Cabrero D,. An integrative analysis reveals coordinated reprogramming of the epigenome and the transcriptome in human skeletal muscle after training [J]. Epigenetics, 2014, 9(12):1557-1569.
[25] Ling C,Rönn T. Epigenetic adaptation to regular exercise in humans [J]. Drug Discov Today, 2014, 19(7): 1015-1018.
[26]Liu Y, Hudetz A G, Knaus H G,. Increased expression of Ca2+-sensitive K+channels in the cerebral microcirculation of genetically hypertensive rats: Evidence for their protection against cerebral vasospasm [J]. Circ Res, 1998, 82(6): 729-737.
[27]Nelson M T, Cheng H, Rubart M,. Relaxation of arterial smooth muscle by calcium sparks [J]. Sci, 1995, 270(5236): 633-637.
[28]Nieves-Cintrón M, Amberg G C, Nichols C B,. Activation of NFATc3 down-regulates the beta1 subunit of large conductance, calcium-activated K+channels in arterial smooth muscle and contributes to hypertension [J]. J Biol Chem, 2007, 282(5): 3231-3240.
[29]Pesic A, Madden J A, Pesic M,. High blood pressure upregulates arterial L-type Ca2+channels: is membrane depolarization the signal [J]. Circ Res, 2004, 94(10): e97-104.
[30]Rusch N J. BK channels in cardiovascular disease: a complex story of channel dysregulation [J]. Am J Physiol Heart Circ Physiol, 2009, 297(5): H1580-1582.
[31]Shi L, Zhang H, Chen Y,. Chronic exercise normalizes changes in Cav1.2 and KCa1.1 channels in mesenteric arteries from spontaneously hypertensive rats [J]. Br J Pharmacol, 2015, 172(7): 1846-1858.
[32]Shi L, Zhang Y, Liu Y,.Exercise prevents upregulation of RyRs-BKCacoupling in cerebral arterial smooth muscle cells from SHR [J]. Arterioscler Thromb Vasc Biol, 2016, 36(8): 1607-1617.
[33]Sonkusare S, Palade P T, Marsh J D,. Vascular calcium channels and high blood pressure: pathophysiology and therapeutic implications [J]. Vascul Pharmacol, 2006, 44: 131-142.
[34]Sun M W, Qian F L, Wang J,. Low-intensity voluntary running lowers blood pressure with simultaneous improvement in endothelium-dependent vasodilatation and insulin sensitivity in aged spontaneously hypertensive rats [J]. Hypertens Res, 2008, 31(3): 543-552.
[35]Véras-Silva A S, Mattos K C, Gava N S,Low-intensity exercise training decreases cardiac output and hypertens-ion in spontaneously hypertensive rats [J]. Am J Physiol, 1997, 273(6 Pt 2): H2627-2631.
[36]Wang J, Gong L, Tan Y,. Hypertensive epigenetics: from DNA methylation to microRNAs [J]. J Hum Hypertens, 2015, 29(10): 575-582.
[37]Wellman G, Cartin L, Eckman D,. Membrane depolarization, elevated Ca2+entry, and gene expression in cereb-ral arteries of hypertensive rats [J]. Am J Physiol Heart Circul Physiol, 2001, 281(6): H2559-2567.
[38]Wilde D W, Furspan P B, Szocik J F. Calcium current in smooth muscle cells from normotensive and genetically hyperten-sive rats [J]. Hypertension, 1994, 24(6): 739-746.
Epigenetic Regulation of Exercise-improved LTCC and BKCaChannels Function in Hypertension Mesenteric Arteries
ZHANG Yan-yan, XU Zhao-xia, CHEN Yu, LI Shan-shan, SHI Li-jun
Beijing Sport University, Beijing 100084, China.
Objective: To investigate the epigenetic mechanism of the voltage-gated L-type Ca2+channel (LTCC) and the large-conductance Ca2+-activated K+channel (BKCa) function in mesenteric arterial myocytes improved by regular aerobic exercise in hypertension. Methods: 12-week-old male SHR and WKY rats were randomly assigned to sedentary and exercise training groups, respectively. Exercise groups were performed a moderate-intensity treadmill running. After 12 weeks, patch clamp study, Ca2+image, Western blot, qPCR, bisulfite sequencing PCR were used to detect the LTCC and BKCachannel currents, BKCasingle channel gating properties, Ca2+spark, mRNA and protein expression of LTCC α1ctogether with BKCaα and β1 subunits, DNA methylation levels of α1cand β1 gene promoter region, miR-328 expression. In vitro experiment,miR-328 mimic and miR-328 inhibitor were transfected into cultured arterial myocytes to make miR-328 overexpressing or silencing, the mRNA and protein levels of α1csubunits were determined after 48 h transfection. Results: 1) After aerobic exercise, SBP in both exercise groups of WKY and SHR were significantly lower than that of their sedentary counterparts. 2) Exercise normalized the increased LTCC and BKCacurrent density of mesenteric arterial myocytes in SHR. 3) Exercise attenuated the increased single BKCachannel open probability () and the amplitude of Ca2+spark in hypertension. 4) Exercise inhibited the upregulated mRNA and protein expression of BKCaβ1 subunit in mesenteric arteries from SHR; β1 gene promoter was demethylation in hypertension, exercise increased the methylation level at β1 gene promoter of SHR. 5) The protein expression of LTCC α1csubunit was significantly increased in SHR, while decreased by exercise; the expression of miR-328 in mesenteric arteries was highly negative correlation with α1csubunit. 6) The miR-328 overexpression by transfecting miR-328 mimic decreased α1csubunit protein level significantly, while miR-328 inhibitor made α1csubunit a slight increase. Conclusions: Regular aerobic exercise efficiently reduces blood pressure of SHR, enhances β1 gene promoter methylation, mediates miR-328 inhibiting the α1cexpression at post-transcriptional level, which might be the epigenetic mechanism underlying exercise-improved BKCaand LTCC channels function in mesenteric arteries of hypertension.
G804.7
A
1000-677X(2018)11-0039-11
10.16469/j.css.201811004
2018-08-07;
2018-11-09
国家自然科学基金资助项目(31771312);北京市自然科学基金资助项目(5172023);中央高校基本科研业务费专项资金资助(2018XS004)。
张严焱,女,在读博士研究生,主要研究方向为运动和心血管生理学,E-mail:15210574247@163.com。
石丽君,女,教授,博士,博士研究生导师,主要研究方向为运动和心血管生理学,E-mail:l_j_shi72@163.com。

