β-Catenin在雨蛙肽诱导的胰腺腺泡细胞凋亡中的作用*
石 彪,孙建利,许再超,李艳兵,杜金龙,孙晓光,党翠玲
(承德市中心医院 1急诊外科, 2生殖医学科, 河北 承德 067000)
急性胰腺炎是一种严重危害人类生命健康的疾病,其发生机制与胰腺腺泡细胞过度凋亡有关。雨蛙肽(caerulein)是常用的构建急性胰腺炎模型诱导因子,具有很强的刺激胆囊收缩和分泌胰酶的作用,雨蛙肽可以诱导细胞内胰酶的活化,促进凋亡有关蛋白的表达,从而诱导胰腺腺泡细胞凋亡[1-2]。β-连环蛋白(β-catenin)主要存在于细胞膜上,参与细胞之间的黏附及基因的表达转录过程,在内皮细胞和成骨细胞等各种类型的细胞中广泛表达,β-catenin具有调控细胞的生长和凋亡等作用,在人类的多种疾病中异常表达[3-5]。最近的研究表明,β-catenin可能具有促进人胰腺腺泡细胞损伤后修复作用[6]。本次实验研究用雨蛙肽处理胰腺腺泡细胞,明确β-catenin在胰腺炎腺泡细胞凋亡中的作用,为明确胰腺炎腺泡细胞损伤机制奠定基础。
材 料 和 方 法
1 材料
大鼠胰腺腺泡AR42J细胞购自中科院上海细胞生物学研究所细胞库。pcDNA3.1-β-catenin由吉满生物科技(上海)有限公司构建;雨蛙肽购自Sigma;抗β-catenin抗体购自Santa Cruz Biotechnology;Lipofectamine 2000购自Thermo Fisher Scientific;cDNA合成试剂盒和real-time PCR试剂盒购自TaKaRa;抗CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)抗体和抗cleaved caspase-12抗体购自 Cell Signaling Technology;乳酸脱氢酶(lactate dehydrogenase,LDH)含量检测试剂盒和淀粉酶(amylase,AMY)含量检测试剂盒购自南京建成生物研究所。
2 方法
2.1细胞分组 AR42J细胞分成对照(control)组、caerulein组、pcDNA3.1+caerulein组和pcDNA3.1-β-catenin+caerulein组,共4组。处理方法如下:cae-rulein组:用不做转染处理的AR42J细胞经含有1×10-8mol/L雨蛙肽细胞培养液处理培养24 h;pcDNA3.1+caerulein组:收集稳定转染阴性对照pcDNA3.1的AR42J细胞,用含有1×10-8mol/L雨蛙肽细胞培养液处理培养24 h;pcDNA3.1-β-catenin+caerulein组:收集稳定转染β-catenin过表达载体pcDNA3.1-β-catenin的AR42J细胞,用含有1×10-8mol/L雨蛙肽细胞培养液处理培养24 h;control组:用不做转染处理的AR42J细胞经0 mol/L雨蛙肽细胞培养液培养24 h。质粒转染步骤同脂质体转染试剂Lipofectamine 2000,用G418筛选稳定转染的细胞用于后续实验。采用real-time PCR和Western blot法分别检测各组细胞中β-catenin表达的变化,明确雨蛙肽对AR42J细胞中β-catenin表达的影响及转染后的过表达效果。
2.2Real-time PCR检测β-catenin表达水平 取AR42J细胞,用TRIzol试剂提取各组胰腺腺泡细胞中的总RNA,RNA用DEPC去离子水悬浮溶解以后,分光光度计检测浓度,其A260/A280的比值应介于1.8~2.0之间,RNA在-80 ℃冰箱中保存。吸取0.5 μg的RNA进行cDNA反转录,程序为:50 ℃反应20 min、99 ℃反应5 min、5 ℃反应5 min。用Primer 5设计β-catenin引物,引物交由上海生工合成。β-Catenin的上游引物序列为5′-GCTACTTGTTCTGAGTGAAG-3′,下游引物序列为5′-ATGGAACCAGACAGAAAAGC-3′;内参照GAPDH的上游引物序列为5′-GGATTTGGTCGTATTGGG-3′,下游引物序列为5′-GGAAGATGGTGATGGGATT-3′。PCR程序为:95 ℃预变性2 min;94 ℃变性30 s、60 ℃退火30 s、72 ℃反应1 min,共35个循环。结果采用2-ΔΔCt值表示。
2.3Western blot检测β-catenin的蛋白表达水平 取AR42J细胞,在细胞中分别添加蛋白裂解液,按照BCA法对蛋白定量,把蛋白同5×loading buffer按照4∶1体积比混合后煮沸5 min。在每个上样孔内添加40 μg蛋白,SDS-PAGE凝胶用5% 浓缩胶,10%分离胶,在蛋白还没有到达分离胶之前用80 V电压电泳,到达分离胶之后把电压调整到100 V。电泳结束后,在4 ℃、250 mA条件下把凝胶上的蛋白电转移至PVDF膜,转膜进行90 min。PVDF膜用5%牛血清白蛋白在37 ℃封闭1 h以后,置于 I 抗中4 ℃过夜, I 抗按照1∶200稀释,再置于 II 抗37 ℃孵育1 h, II 抗按照1∶2 000稀释,用ECL显色试剂盒显色以后,GAPDH为内参照,用Quantity One分析各组目的条带水平。各组细胞中内质应激蛋白CHOP和cleaved caspase-12水平的检测方法同上。
2.4MTT法检测细胞活力 取AR42J细胞,按照2×107/L接种到96孔板内,按照方法2.1分组处理,培养24 h后,在每孔中加入20 μL的MTT,置于CO2培养箱中继续孵育4 h,将孔内的上清溶液吸弃,每个孔内加入150 μL DMSO,10 min后,酶标仪测定570 nm的吸光度(A)值,用不含细胞孔调零,把control组细胞活力作为100%,用caerulein、pcDNA3.1+caerulein和pcDNA3.1-β-catenin+cae-rulein各组吸光度值与control吸光度值比值变化作为各组细胞相对活力。
2.5二硝基苯肼法检测LDH漏出率 离心后收集各组细胞沉淀,用生理盐水洗涤以后,反复冻融5次以后,收集上清溶液,添加辅酶和基质缓冲液,放在37 ℃水浴中孵育15 min后,加入2,4-二硝基苯肼工作液,在37 ℃孵育15 min后,添加0.5 mol/L的氢氧化钠溶液,混合后,在室温中静置3 min,检测440 nm波长的吸光度值,用蒸馏水调零。同样方法检测培养液上清中LDH的水平。LDH漏出率(%)=上清中LDH吸光度值÷细胞总LDH吸光度值×100%。
2.6碘-淀粉比色法检测AMY漏出率 离心后收集各组细胞沉淀,用生理盐水洗涤以后,反复冻融5次以后,收集上清溶液,添加底物缓冲液,置于37 ℃中孵育8 min后,加入碘工作液,检测660 nm波长的吸光度值,用蒸馏水调零。同样方法检测培养液上清中AMY的水平。AMY漏出率(%)=上清中AMY吸光度值÷细胞总AMY吸光度值×100%。
2.7流式细胞术测定细胞凋亡 取各组细胞,添加冰预冷的PBS悬浮以后,吸取1 mL各组细胞悬浮液,以1 000×g离心10 min后,添加500 μL结合缓冲液混合,继续加入5 μL的PI和10 μL的Annexin V-FITC,室温避光反应10 min以后,立即用流式细胞仪测定各组细胞凋亡变化。
3 统计学分析
用SPSS 22.0统计软件分析数据。数据以均数±标准差(mean±SD)表示。两组间比较用独立样本t检验,多组间比较用方差分析并用SNK-q进行各组均数间的两两比较。以P<0.05为差异有统计学意义。
结 果
1 雨蛙肽处理后胰腺腺泡细胞中β-catenin表达水平降低
胰腺腺泡细胞经过雨蛙肽处理以后,细胞中的β-catenin的mRNA和蛋白水平均明显降低(P<0.05),见图1。这表明雨蛙肽诱导的胰腺腺泡细胞中β-catenin呈低表达。
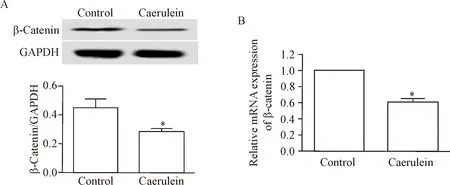
Figure 1.The expression of β-catenin in the pancreatic acinar cells after treatment with caerulein. A: the results of Western blot for determining the protein level of β-catenin in the AR42J cells after treated with caerulein; B: the quantitative analysis of the β-catenin mRNA level. Mean±SD.n=3.*P<0.05vscontrol group.
图1雨蛙肽处理后胰腺腺泡细胞中β-catenin的表达水平降低
2 转染pcDNA3.1-β-catenin促进雨蛙肽条件下胰腺腺泡细胞中β-catenin表达
胰腺腺泡细胞中转染pcDNA3.1-β-catenin后,经过雨蛙肽处理,细胞中的β-catenin的mRNA和蛋白水平均明显升高(P<0.05),见图2。
3 β-Catenin减少雨蛙肽刺激下胰腺腺泡细胞分泌LDH和AMY
雨蛙肽处理后的胰腺腺泡细胞的LDH和AMY漏出率明显升高,而过表达β-catenin后的胰腺腺泡细胞经过雨蛙肽处理后,细胞LDH和AMY漏出率明显降低(P<0.05),见表1。这表明β-catenin可拮抗雨蛙肽对胰腺腺泡细胞分泌LDH和AMY的促进作用。
4 β-Catenin提高雨蛙肽作用下胰腺腺泡细胞的活力
雨蛙肽处理后的胰腺腺泡细胞活力明显降低,而过表达β-catenin后的胰腺腺泡细胞经过雨蛙肽处理后,细胞活力升高(P<0.05),见表1。这表明β-catenin可拮抗雨蛙肽对胰腺腺泡细胞活力的抑制作用。
5 β-Catenin减少雨蛙肽作用下胰腺腺泡细胞凋亡
雨蛙肽处理后的胰腺腺泡细胞凋亡率明显升高,而过表达β-catenin后的胰腺腺泡细胞经过雨蛙肽处理后,细胞凋亡率明显降低(P<0.05),见图3。这表明β-catenin具有拮抗雨蛙肽对胰腺腺泡细胞凋亡诱导作用。
6 β-Catenin降低雨蛙肽作用下胰腺腺泡细胞中CHOP和cleaved caspase-12蛋白水平
雨蛙肽处理后的胰腺腺泡细胞中内质网应激蛋白CHOP和cleaved caspase-12水平明显升高,而过表达β-catenin后的胰腺腺泡细胞经过雨蛙肽处理后,细胞中CHOP和cleaved caspase-12水平明显降低(P<0.05),见图4。这表明β-catenin减少雨蛙肽诱导的胰腺腺泡细胞内质网应激。
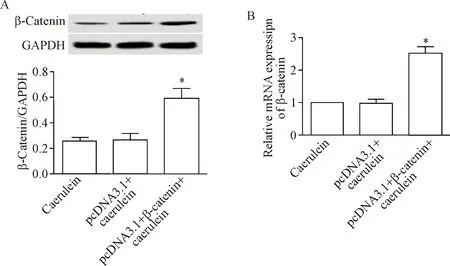
Figure 2.The expression of β-catenin in pancreatic acinar cells treated with caerulein after transfection. A: the results of Western blot for determining the protein level of β-catenin in the AR42J cells after transfection; B: the quantitative analysis of the β-catenin mRNA level. Mean±SD.n=3.*P<0.05vscaerulein group and pcDNA3.1+caerulein group.
图2转染后经雨蛙肽处理的胰腺腺泡细胞中β-catenin的表达水平
表1各组胰腺腺泡细胞LDH和AMY漏出率及细胞活力的变化
Table 1.The changes of LDH and AMY leakage rates and viability of pancreatic acinar AR42J cells in each group (Mean±SD.n=3)

GroupLDH leakage rate (%)AMY leakage rate (%)Cell viability (%)Control18.65±1.4520.56±2.59100.00 Caerulein28.46±2.17&35.29±3.48&73.46±6.23&pcDNA3.1+caerulein29.14±1.56&34.71±3.20&72.92±7.16&pcDNA3.1-β-catenin+caerulein22.84±2.34&∗28.55±2.76&∗88.25±8.11&∗
&P<0.05vscontrol group;*P<0.05vscaerulein group and pcDNA3.1+caerulein group.
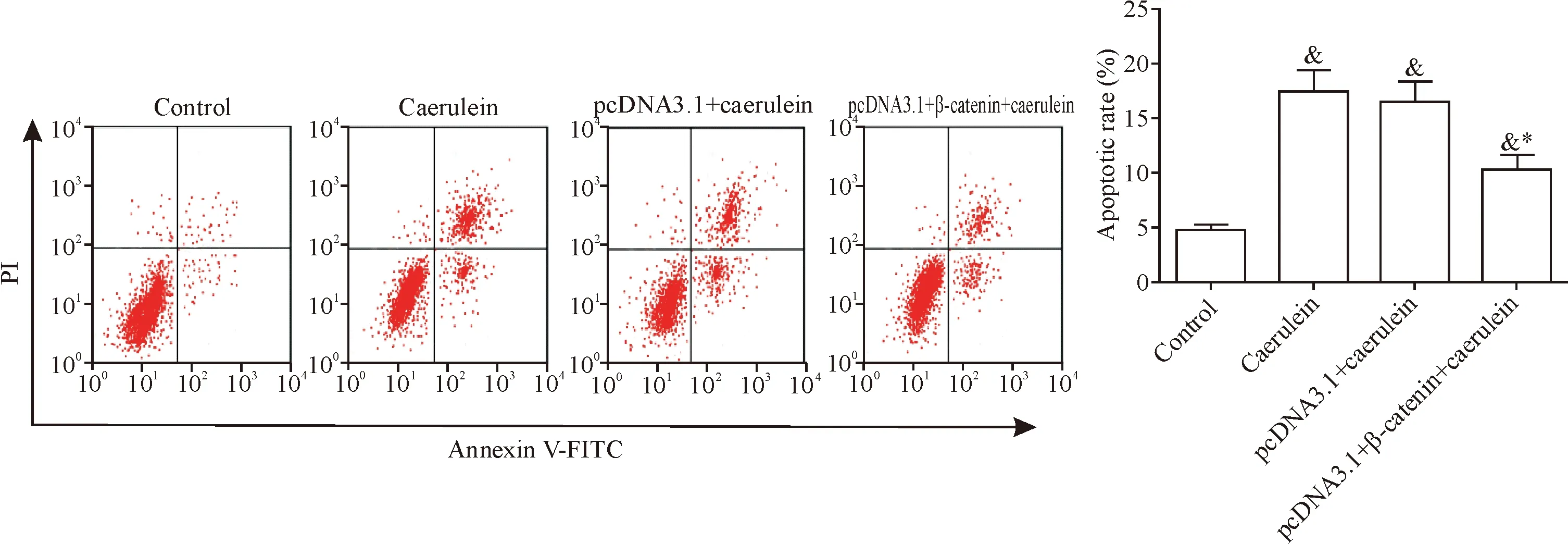
Figure 3.β-Catenin reduced the apoptosis of pancreatic acinar AR42J cells induced by caerulein. Mean±SD.n=3.&P<0.05vscontrol group;*P<0.05vscaerulein group and pcDNA3.1+caerulein group.
图3β-Catenin减少雨蛙肽诱导的胰腺腺泡细胞凋亡
讨 论
急性胰腺炎可以分为轻、中、重症,重症胰腺炎进展迅速,能够引起人体多器官功能障碍,急性胰腺炎的发生与胰酶激活后胰腺组织自身的消化有关,腺泡细胞损伤是胰腺炎发生的重要原因之一[7-9]。胰腺腺泡细胞是胰腺外分泌腺的主要组成部分,其可以分泌多种消化酶和电解质等物质,胰腺炎时,腺泡细胞中的胰酶异常活化,导致腺泡细胞发生自身消化,引起腺泡细胞凋亡,造成胰腺功能损伤[10-12]。
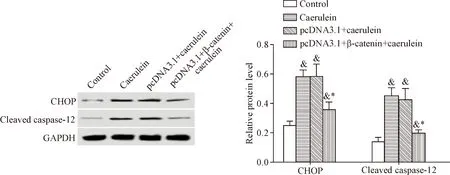
Figure 4.The effects of β-catenin on the expression of endoplasmic reticulum stress proteins in the pancreatic acinar AR42J cells induced by caerulein. Mean±SD.n=3.&P<0.05vscontrol group;*P<0.05vscaerulein group and pcDNA3.1+caerulein group.
图4β-Catenin对雨蛙肽诱导的胰腺腺泡细胞中内质网应激蛋白表达的影响
本实验的结果显示,雨蛙肽处理后的胰腺腺泡细胞活力降低,细胞LDH及AMY的漏出率均明显升高,细胞凋亡率升高,说明成功构建了胰腺炎腺泡细胞损伤模型。
β-Catenin最初作为一种黏附分子被发现,β-catenin蛋白含有C末端、N末端及12个重复的Arm结构,Arm结构组成一个超螺旋结构,参与细胞黏附,其N末端具有维持β-catenin稳定性的作用,C末端参与调控下游靶基因的转录[13-14]。β-Catenin在细胞膜和细胞浆中表达,在静息状态下,β-catenin多聚集在细胞膜上,只有少量的β-catenin游离于细胞浆内[15]。已经证实,β-catenin具有降低肿瘤细胞、心肌细胞等细胞凋亡水平的作用,在细胞生长中发挥促进作用,参与动脉粥样硬化、缺血损伤和肿瘤等疾病发生过程[16-18]。最近的研究显示,β-catenin对于胰岛功能障碍无明显作用,但能够促进胰腺腺泡细胞损伤修复[6]。本实验的结果表明,过表达β-catenin后胰腺腺泡细胞在经过雨蛙肽处理后,细胞的活力升高,细胞凋亡减少,说明β-catenin具有保护胰腺炎腺泡细胞损伤的作用。
细胞凋亡的发生是一个生理过程,与细胞内的多个信号传导及蛋白调控有关,内质网应激是近年来发现的除了死亡受体途径和线粒体途径之外的新凋亡途径,内质网在细胞内的分布极为广泛,与脂质、胆固醇等的合成密切相关,其可以通过caspase-12和CHOP等诱导细胞凋亡发生[19-22]。很多研究显示,内质网应激参与急性胰腺炎的发病过程,是急性胰腺炎腺泡细胞凋亡发生主要途径之一[23-24]。β-catenin具有抗凋亡作用,其参与内质网应激诱导的细胞凋亡发生,而对于其具体的靶向调控机制尚不明确[25]。本实验的结果显示,雨蛙肽处理后的胰腺腺泡细胞中CHOP蛋白水平及caspase-12活化水平均明显升高,并且β-catenin过表达可以减少CHOP表达及caspase-12活化水平,β-catenin能够减少雨蛙肽诱导的胰腺腺泡细胞内质网应激。
总而言之,β-catenin在急性胰腺炎腺泡细胞凋亡中发挥抑制作用,β-catenin具有减轻腺泡细胞损伤作用,其作用机制与降低内质网应激水平有关,β-catenin具体的如何靶向调控内质网应激机制尚未研究,本研究也只在一种胰腺腺泡细胞中进行了体外实验,后续会在原代腺泡细胞及体内进行验证。本实验结果明确了β-catenin在雨蛙肽诱导的胰腺腺泡细胞凋亡中的作用,为研究胰腺炎腺泡细胞损伤提供了实验依据。

