纳米金修饰电极对沙丁胺醇与蛋白结合作用的研究
魏瑞丽,李晓霞
(1.延安大学化学与化工学院,陕西延安716000;2.铜川市环境监测站,陕西铜川727031)
1 实验部分
1.1 仪器与试剂
LK2005A型电化学工作站(天津兰力科),金纳米修饰碳糊电极(AuNPs/CPE) 为工作电极,铂电极为对电极,参比电极为饱和甘汞电极(SCE)。Mini-1240紫外-可见分光光度计(日本岛津)。Prestige-21红外光谱仪(日本岛津)。沙丁胺醇 (Sal,中国药品生物制品检定所)。牛血清蛋白(BSA,北京奥博星生物技术公司)。实验中所有试剂均为分析纯,用水均为Millipore Milli-Q超纯水(大于18.2 M.cm) 。
1.2 实验方法
纳米金修饰碳糊电极(AuNPs/CPE)的制备参照文献方法[7]。pH 7.0 PBS缓冲溶液中,分别加入一定量的Sal、BSA,在0~1.0 V范围进行线性伏安法和方波伏安法扫描。紫外光谱和红外光谱测定见文献方法[8]。
2 结果和讨论
2.1 Sal与BSA结合作用的电化学研究
AuNPs/CPE在4.07×10-5mol/L Sal溶液及分别加入不同浓度的BSA的PBS( pH 7.0)缓冲液中进行线性伏安扫描,发现Sal在0.60 V处有1个灵敏的氧化峰(图1曲线a)。当加入BSA后,未发现产生新的氧化还原峰,且Sal的峰电位未发生变化,但峰电流降低(图1曲线b)。当继续增大BSA的浓度,峰电流明显下降 (图1曲线c)。推测加入BSA后,与Sal结合形成了非电化学活性的复合物,降低了溶液中游离Sal的浓度,导致AuNPs/CPE上峰电流降低。为了进一步研究两者的结合作用,试验采用了检测灵敏度更高的方波伏安法,对Sal与BSA的结合常数、结合比进行测定。线性关系曲线如图2所示。结果表明,当Sal与BSA形成结合比为1时,1/ΔIpa~1/[BSA]呈良好的线性关系,线性方程:1/ΔIpa=2×10-6/[BSA] (mol/L)+0.5673,r=0.9973。计算出Sal与BSA的结合常数为2.84×105L/mol。说明Sal与BSA之间有较强的结合能力。文献报道3个结构域构成了BSA的空间结构,每个结构域有2个亚结构域以槽口相对的方式形成圆筒状结构,几乎所有疏水性氨基酸残基都包埋在圆筒内部,构成疏水性腔。而在其外表面及疏水性腔体的入口处则布满了亲水性的氨基酸残基[9]。Sal小分子可以扦插到BSA分子疏水腔区域,Sal分子上的羟基可以与BSA主链的肽键-NH-CO-形成氢键,从而与BSA结合形成复合物,使溶液中游离的Sal有效浓度降低,导致AuNPs/CPE上氧化峰电流降低。此结论与图1结果、文献方法[10]报道一致。

(a) cBSA=0 ; (b)cBSA=2.49×10-7mol/L;
固定Sal浓度为4.07×10-5mol/L时,加入不同浓度的BSA后,发现峰电流的降低值ΔIpa与BSA的浓度呈良好的线性关系,线性范围:2.47×10-7mol/L~2.00×10-5mol/L,线性方程:ΔIpa(μA)=0.349+89530c(c/(mol/L),r=0.9912,BSA的检出限为8.23×10-8mol/L(S/N=3)。本法测定的检出限低于文献方法[11]报道。对1.48×10-6mol/L的BSA 11次平行测定,RSD为2.3%。本方法可望用于BSA的定量测定。

图2 1/ΔIpa~1/[BSA]的线性关系图
2.2 Sal与BSA结合作用的紫外光谱研究
图3为4.07×10-5mol/L Sal、BSA和Sal-BSA的紫外光谱图。BSA在278 nm处有一吸收峰(a),此特征吸收峰主要是BSA肽链上氨基酸分子大键的吸收峰。Sal在276 nm处有一吸收峰(b),Sal和BSA完全结合后,吸光度明显增大(c)。固定BSA浓度为4.07×10-5mol/L,加入一系列不同浓度的Sal,随着Sal浓度的增加,BSA的最大吸收峰略微红移(2 nm)且有增色效应(ABSA+Sal>ABSA),说明Sal与BSA存在相互作用。原因可能是Sal与BSA结合作用后,改变了BSA中氨基酸的构象微环境的变化,引起吸收峰增色红移。BSA分子中含有色氨酸、酪氨酸及苯丙氨酸等残基,能发射较强的内源荧光。在290 nm激发波长下,Sal在300~500 nm荧光范围内无荧光发射。实验中发现,当加入的Sal浓度不断增加,BSA的内源荧光强度降低,说明Sal能显著地猝灭BSA的荧光强度。温度分别为20 ℃,25 ℃,30 ℃和37 ℃时,考察了BSA荧光强度随Sal的变化,结果表明,随着温度的升高,方程的斜率猝灭常数Ksv逐渐降低了,说明Sal对BSA的荧光猝灭作用不是动态猝灭,而是生成了Sal-BSA复合物的静态猝灭,此结果与文献方法[10]报道一致。
考察了4种常见金属离子Zn2+,Mg2+,Fe3+和Cu2+对Sal与BSA结合作用的影响。结果表明,分别加入Zn2+,Mg2+,Fe3+和Cu2+后,Sal的紫外光谱曲线未发生变化,说明这些金属离子对Sal没有影响。分别将Zn2+,Mg2+,Fe3+和Cu2+加入BSA中,278 nm处BSA的吸收峰发生蓝移,说明4种金属离子与BSA发生了结合,生成了金属离子-BSA复合物,复合物的形成会改变了BSA的构象。从而影响到Sal与BSA的结合。

(a) BSA;(b) Sal;(c) BSA-Sal
2.3 Sal与BSA结合作用的红外光谱研究
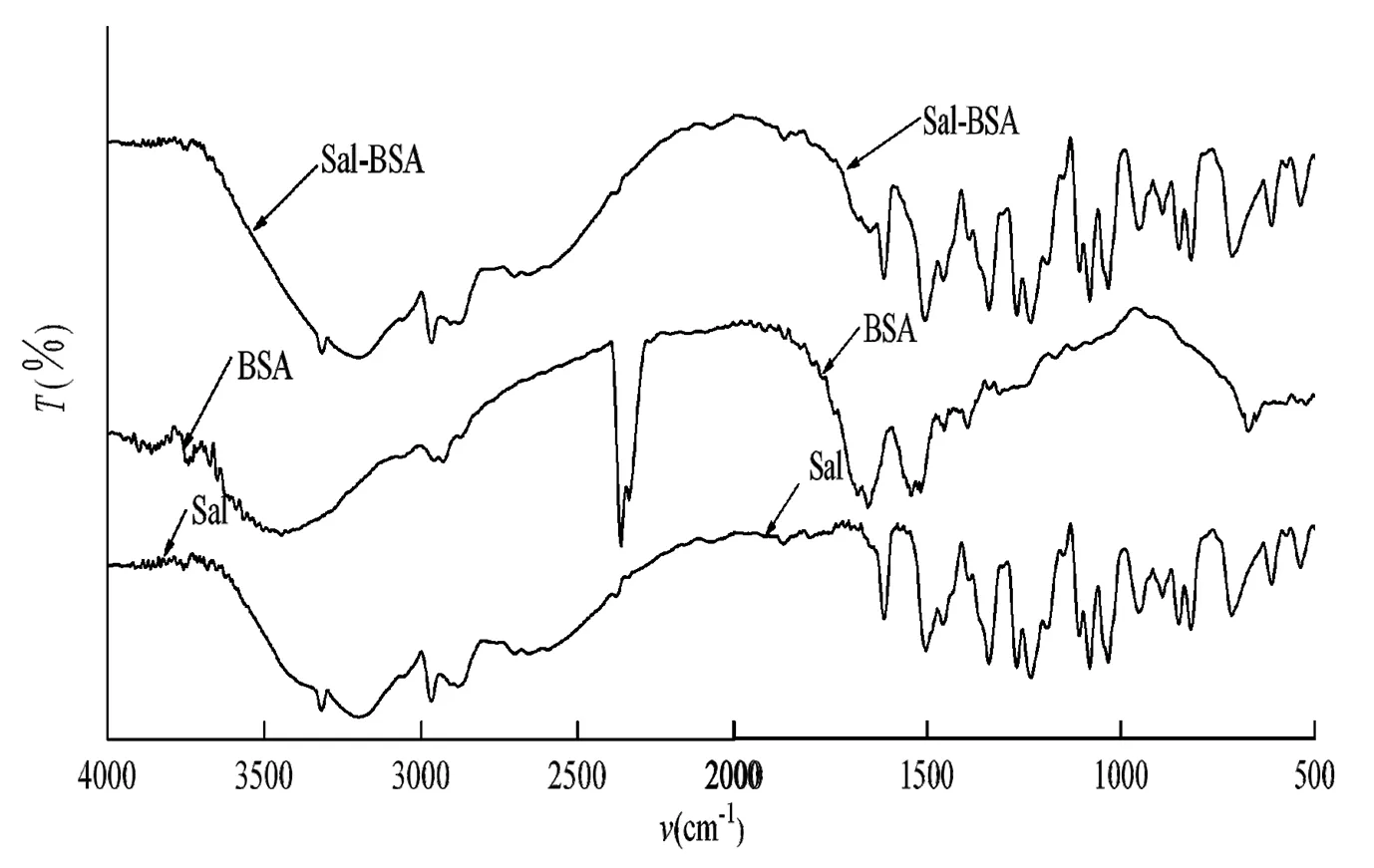
图4 Sal、BSA和Sal-BSA的红外光谱图
在4000~500 cm-1区域测定了Sal、BSA及Sal-BSA复合物的红外光谱(图4)。从图4可以看出,Sal的vN-H为2 548 cm- 1,vC-H为2 966 cm- 1,在Sal-BSA结合物中分别移至2 550 cm- 1、2 969 cm- 1,变化不明显。而在2 300 cm- 1~500 cm- 1区域,BSA分子中S-H的伸缩振动频率vs-H移动最为明显,BSA的vs-H为2 341 cm-1,Sal-BSA结合物的vs-H为2 391 cm-1,说明Sal分子与BSA分子中氨基酸残基的硫形成键合作用。BSA的δN-H=1 394 cm- 1、Sal-BSA结合物的δN-H=1 340 cm- 1,BSA分子中N-H变形振动频率δN-H的移动,表明BSA端基及残基中的氮原子也参与Sal的成键且有氢键缔合作用。此结果说明Sal与BSA发生了作用,使得BSA的多肽链的S-H和N-H作用,改变了BSA的构象。
3 结论
采用纳米金修饰碳糊电极电化学方法并结合紫外光谱、红外光谱法研究了Sal与BSA的结合作用。实验结果表明,Sal通过疏水作用扦插到BSA疏水微区内部,与BSA形成了非电化学活性的复合物。紫外光谱和红外光谱说明Sal与BSA结合引起BSA氨基酸的构象发生改变。4种常见金属离子Zn2+,Mg2+,Fe3+和Cu2+对沙丁胺醇与牛血清蛋白的结合起抑制作用。

