罗布麻宁减轻D-半乳糖诱导的老化大鼠听皮层线粒体氧化损伤
杜政德 熊伟 于树夔 柳柯 龚树生
首都医科大学附属北京友谊医院耳鼻咽喉科(北京100050)
老年性聋是听觉外周和听觉中枢年龄相关性退行性变[1]。中枢听觉系统的退行性变可影响听觉感知能力和言语识别能力[2]。由于听觉系统的组织不可能在人类活体取得,以及老化是一个长期缓慢的过程。因此,耳科学研究者利用很多衰老动物模型研究老年性聋的发病机制及干预。其中,D-半乳糖诱导的快速衰老动物是研究老年性聋较为理想的动物模型[3-5]。在之前的研究中,我们发现NADPH氧化酶是D-半乳糖诱导的老化大鼠听觉中枢活性氧的重要来源[4,6];在老化的过程中,NADPH氧化酶相关的活性氧可导致听觉中枢神经元线粒体氧化损伤,并启动依赖线粒体的细胞凋亡途径[4,6,7]。
目前,听觉系统年龄相关性退行性变的发病机制尚不完全清楚,有关听觉中枢老化相关机制及干预的研究相对较少。在本研究中,我们将使用NADPH氧化酶的抑制剂罗布麻宁(Apocynin,APO)[8,9],研究罗布麻宁对D-半乳糖诱导的老化大鼠听皮层氧化损伤的作用。本研究将进一步揭示NADPH氧化酶在听觉中枢老化过程中的作用,为老年性聋的发病机制的研究提供新的思路,为老年性聋的干预研究提供新的策略。
1 材料和方法
1.1 动物和处理
36只1月龄雄性Sprague-Dawley大鼠购自首都医科大学实验动物中心,适应性饲养1周后随机分为3组:①对照组:大鼠颈背部皮下注射生理盐水,每日1次,连续8周;②D-半乳糖组:大鼠颈背部皮下注射500mg/kg D-半乳糖(sigma,美国),每日1次,连续8周;③D-半乳糖+罗布麻宁组:大鼠颈背部皮下注射500mg/kg D-半乳糖+腹膜内注射50mg/kg罗布麻宁,每日1次,连续8周。所有动物均饲养在室温约20-22°C左右,12h昼夜交替的环境中,自由进食饮水。两组动物均无噪声暴露史,无其它药物使用史。所有实验动物的饲养和研究严格遵守首都医科大学实验动物管理规定。
1.2 氧化应激水平的评估
酶化学法检测H2O2和总超氧化物歧化酶(Total superoxidedismutase,T-SOD)活性,评估各组大鼠(每组4只)听皮层组织氧化应激水平。H2O2和T-SOD活性检测试剂盒购自南京建成生物工程研究所。
1.3 线粒体DNA氧化损伤产物的检测
免疫组织化学染色标记DNA氧化损伤产物8-羟基-2-脱氧鸟苷(8-hydroxy-2-deoxyguanosine,8-OHdG)[10]和线粒体内参蛋白COX IV,评估听皮层线粒体DNA氧化损伤。各组大鼠(每组4只)肌肉注射氯胺酮(30 mg/kg)和氯丙嗪(15 mg/kg)麻醉。0.1 M磷酸盐缓冲液(PBS)心脏快速灌注SD大鼠,继而4%多聚甲醛心脏灌注,取出脑组织,4℃冰箱固定过夜。第二天,将标本置于30%蔗糖溶液中脱水至脑组织沉底,OCT包埋脑组织,行冠状位切除至听皮层层面,厚度约10μm。听皮层组织切片放置于室温晾干,0.1 M PBS浸泡5min去除OCT后将切片置于0.3%Triton X-100+2%BSA(bovine serum albumin,牛血清白蛋白)中 破膜和封闭30min,加入小鼠来源的8-OHdG(1:500稀释,Abcam,美国)和COX IV(1:500稀释,Proteintech,中国)一抗4℃过夜,PBS冲洗3次;加入合适的二抗,37℃避光染色1h,PBS冲洗3次,含DAPI(标记细胞核)的封片剂封片激光共聚焦显微镜扫描。
1.4 线粒体超微结构的观察
各组大鼠(每组4只)肌肉注射氯胺酮(30 mg/kg)和氯丙嗪(15 mg/kg)麻醉后,处死大鼠,快速取出听皮层组织,置于2.5%戊二醛4℃固定过夜。0.1 M PBS冲洗,1%锇酸中室温下后固定2h,0.1磷酸缓冲液冲洗,上行梯度乙醇(50%、70%、90%乙醇各5min)、90%乙醇丙酮、90%丙酮5分钟,100%丙酮脱水5min。然后,浸入丙酮+环氧树脂812(1:1),再浸入环氧树脂812中2h,最后环氧树脂812中80℃包埋10h。用超薄切片机(Leica ultracut UTC,Germany)超薄切片(50nm),超薄切片置于300网孔的铜载网上,1%醋酸双氧铀、柠檬酸铅中各染色10min,最后透射电子显微镜下观察各组大鼠听皮层线粒体的形态。
1.5 线粒体功能的评估
酶化学法检测ATP和线粒体膜电位,评估各组大鼠(每组4只)听皮层组织线粒体功能。ATP和线粒体膜电位检测试剂盒购自南京建成生物工程研究所。
1.6 统计学方法
所有实验数据采用SPSS 13.0(SPSS Inc.,美国)统计软件行多因素的方差分析,所有实验数据用平均值±标准差表示,P<0.05为差异有统计学意义。
2 结果
2.1 罗布麻宁减轻D-半乳糖诱导的老化大鼠听皮层氧化应激水平
对照组、D-半乳糖组和D-半乳糖+罗布麻宁组大鼠听皮层H2O2水平分别为14.98±1.15 mmol/g protein、32.87±2.20 mmol/g protein和20.00±1.86 mmol/g protein,D-半乳糖组比对照组显著升高(F=17.898,P<0.01),而D-半乳糖+罗布麻宁组比D-半乳糖组则显著降低(F=-12.873,P<0.01)(图1A);对照组、D-半乳糖组和D-半乳糖+罗布麻宁组大鼠听皮层T-SOD活性水平分别为134.92±16.32 U/mg protein、75.80±10.76 U/mg protein和101.93±16.35 U/mg protein,D-半乳糖组比对照组显著降低(F=-59.128,P<0.01),而D-半乳糖+罗布麻宁组比D-半乳糖组则显著升高(F=26.138,P<0.05)(图1B)。
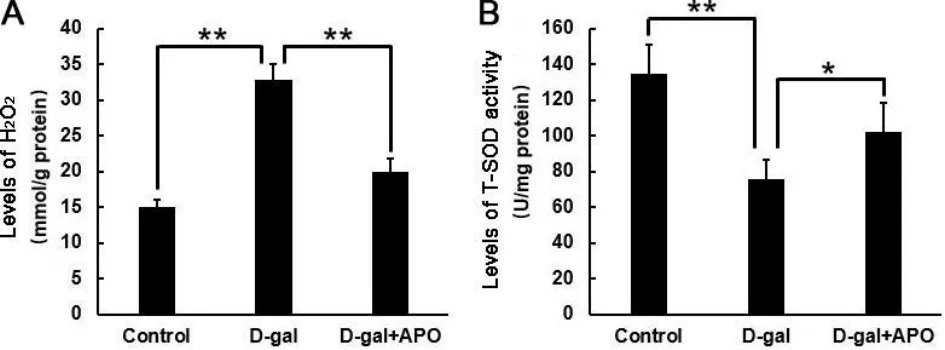
图1 (A)各实验组大鼠听皮层H2O2水平;(B)各实验组大鼠T-SOD活性水平。*P<0.05,**P<0.01。Control:对照组;D-gal:D-半乳糖组;D-gal+APO:D-半乳糖+罗布麻宁组;T-SOD:总超氧化物岐化酶。Fig.1 (A)Levels of H2O2in the auditory cortex of rats in different groups;(B)Levels of T-SOD activity in the auditory cortex of rats in different groups.*P<0.05,**P<0.01.APO,apocynin.D-gal,D-galactose.T-SOD,total superoxide dismutase.
2.2 罗布麻宁减轻D-半乳糖诱导的老化大鼠听皮层线粒体DNA氧化损伤
通过免疫组织化学染色激光共聚焦显微镜成像我们发现各实验组大鼠听皮层DNA氧化损伤标记物8-OHdG主要表达在COX IV标记的线粒体中,且D-半乳糖组比对照组显著升高(F=4.468,P<0.01),而D-半乳糖+罗布麻宁组比D-半乳糖组则显著降低(F=-3.253,P<0.01)(图2A、B)。
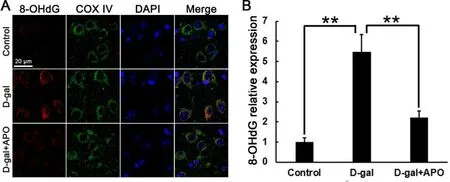
图2 (A)DNA氧化损伤产物8-OHdG(红色)在听皮层组织的表达,COX IV(绿色)标记线粒体,DAPI(蓝色)标记细胞核;(B)定量分析 8-OHdG 的表达。标尺=20 μm。**P<0.01。Control:对照组;D-gal:D-半乳糖组;D-gal+APO:D-半乳糖+罗布麻宁组。Fig.2 (A)The expression of 8-OHdG(red),a production of DNA oxidative damage,in the auditory cortex.COX IV(green)marks mitochondria.DAPI(blue)marks nuclei.(B)Quantitative analysis of 8-OHdG in the auditory cortex.Scale bar=20 μm.**P<0.01.8-OHdG,8-hydroxy-2-deoxyguanosine.APO,apocynin.D-gal,D-galactose.
2.3 罗布麻宁减轻D-半乳糖诱导的老化大鼠听皮层线粒体超微结构损伤
透射电子显微镜观察各实验组大鼠听皮层线粒体超微结构,对照组大鼠听皮层线粒体结构完整,线粒体基质电子密度致密,而D-半乳糖组大鼠听皮层线粒体基质电子密度明显降低,甚至出现空泡样变性,并可见溶酶体吞噬脂滴形成脂褐素,D-半乳糖+罗布麻宁组大鼠听皮层线粒体超微结构相较于D-半乳糖组明显改善(图3)。
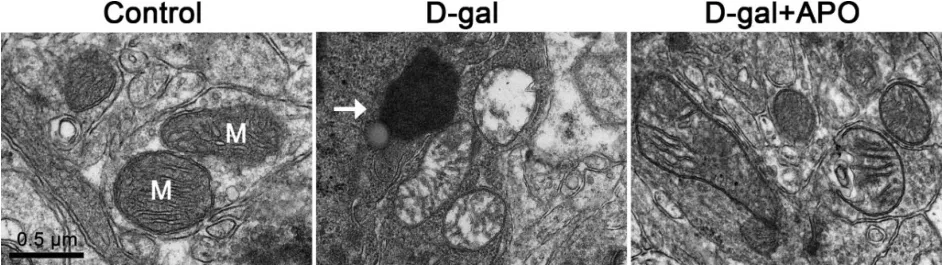
图3 各实验组大鼠听皮层线粒体超微结构。标尺=0.5 μm。M:线粒体;箭头:脂褐素。Control:对照组;D-gal:D-半乳糖组;D-gal+APO:D-半乳糖+罗布麻宁组。Fig.3 The mitochondrial ultrastructure in the auditory cortex of rats in different groups.Scale bar=0.5 μm.APO,apocynin.D-gal,D-galactose.M,mitochondria.
2.4 罗布麻宁提高D-半乳糖诱导的老化大鼠听皮层线粒体功能
对照组、D-半乳糖组和D-半乳糖+罗布麻宁组大鼠听皮层ATP水平分别为13.50±1.40 nmol/mg protein、6.11±1.75 nmol/mg protein和9.72±0.88 nmol/mg protein,D-半乳糖组比对照组显著降低(F=-7.388,P<0.01),而D-半乳糖+罗布麻宁组比D-半乳糖组则显著升高(F=3.605,P<0.01)(图4A);对照组、D-半乳糖组和D-半乳糖+罗布麻宁组大鼠听皮层线粒体膜电位水平分别为8.13±1.18、4.41±0.48和6.47±1.06,D-半乳糖组比对照组显著降低(F=-3.720,P<0.01),而D-半乳糖+罗布麻宁组比D-半乳糖组则显著升高(F=2.063,P<0.05)(图4B)。
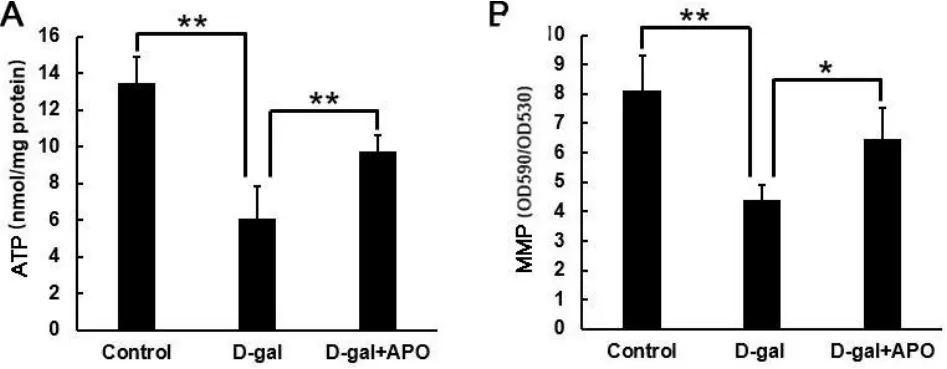
图4 (A)各实验组大鼠听皮层ATP水平;(B)各实验组大鼠线粒体膜电位水平。*P<0.05,**P<0.01。Control:对照组;D-gal:D-半乳糖组;D-gal+APO:D-半乳糖+罗布麻宁组。Fig.4 (A)Levels of ATP in the auditory cortex of rats in different groups.(B)Levels of MMP in the auditory cortex of rats in different groups.*P<0.05,**P<0.01.APO,apocynin.D-gal,D-galactose.MMP,mitochondrial membrane potential.
3 讨论
线粒体是机体能量代谢的场所,在能量代谢过程中,线粒体产生ATP的同时也产生活性氧[11]。由于线粒体缺乏组蛋白的保护,因此容易受到活性氧的损伤。在老化的过程中,由于机体对抗活性氧的能量减弱,导致线粒体氧化损伤的进行性加重,最终引起线粒体功能障碍,诱导凋亡发生增加[12]。先前的研究已经证实:在D-半乳糖诱导的老化大鼠早期,和对照组大鼠相比较,听力学上仅表现为听性脑干反应(auditory brain response,ABR)波幅的降低[13],而无ABR阈值的升高[13,14],但接受氨基糖甙类抗生素注射的D-半乳糖诱导的老化大鼠表现为更高的ABR阈值[14];同时,D-半乳糖诱导的老化大鼠组织病理学上表现为听觉外周[3]和听觉中枢[4,7]线粒体超微结构的损伤和线粒体DNA缺失突变的累积。上述前期研究结果充分说明:在衰老的早期阶段,听觉系统线粒体损伤可能不直接导致听阈的明显升高,但能增加听觉系统对外界有害刺激的敏感性。本研究的结果证实:罗布麻宁可有效降低D-半乳糖诱导的老化大鼠中枢听觉系统听皮层组织活性氧的产生,提高抗氧化能力,进而减轻线粒体超微结构损伤,最终改善线粒体功能。
NADPH氧化酶是机体内另一个活性氧的主要来源,NADPH 氧化酶和 P22phox、P47phox、P67phox等亚基结合,形成酶功能复合体,进而产生活性氧[15]。NADPH氧化酶抑制剂罗布麻宁可抑制P47phox和NADPH氧化酶的结合,从而影响酶功能复合体的形成,减少活性氧的产生[8,9]。我们之前的研究证实NADPH氧化酶的表达在D-半乳糖诱导的老化大鼠听觉中枢显著增加,NADPH氧化酶相关的活性氧产生可导致听觉中枢线粒体氧化损伤,线粒体功能明显下降,并激活依赖线粒体的细胞凋亡途径。因此,我们推测NADPH氧化酶的过表达可能是听觉中枢老化的重要原因[4,7]。
罗布麻宁又称为香草乙酮,是一种选择性的NADPH氧化酶抑制剂。罗布麻宁作为氧清除剂,抑制P47phox亚基与位于白细胞,单核细胞和内皮细胞膜上的NADPH氧化酶和P22phox亚基相结合,从而降低NADPH氧化酶活性,减少活性氧的生成,减轻氧化应激[8,9]。最新的一项研究也表明,罗布麻宁通过抑制大鼠脑缺血性损伤后活性氧的过来产生,减轻线粒体功能障碍和线粒体依赖的细胞凋亡,从而减轻大鼠脑缺血损伤的程度[16]。本研究证实NADPH氧化酶抑制剂罗布麻宁可有效降低D-半乳糖诱导的老化大鼠听皮层氧化应激水平,提高总超氧化物岐化酶、ATP和线粒体膜电位水平。因此,罗布麻宁可对中枢听觉系统老化起到干预性保护作用。

