孕酮回植通过调节内质网应激诱导的细胞自噬与凋亡阻止小鼠月经发生
于明明,谢 卓,金 华,王乾兴
(1.遵义医科大学 细胞生物学教研室,贵州 遵义 563099;2.习水县人民医院 医教科,贵州 遵义 564600)
月经发生的实质是体内雌孕激素水平急剧下降诱导的子宫螺旋动脉收缩,导致子宫内膜功能层缺血缺氧,进而子宫内膜细胞死亡、崩解、脱落[1]。临床实践推迟月经常为月经前3~7d口服孕酮(黄体酮)及其类似物(炔诺酮、甲地孕酮等),但用药一般不超过7d,否则易出现用药期间点滴状出血。说明外源性补充孕酮可以推迟月经的发生,也提示孕酮推迟月经的作用并不是无限期的,已经分化的子宫内膜细胞似乎有着既定的命运。研究发现月经期人子宫内膜中真核起始因子2α(eukaryotic initiation factor 2α,eIF2α)的磷酸化水平升高,并同时伴有内质网应激(endoplasmic reticulum stress,ERS)所致的关键蛋白活化所需的转录激活因子4(activating transcriptionfactor4,ATF4)和内质网特异性凋亡信号C/EBP同源蛋白(C/EBP-homologous protein,CHOP)表达增加,且可被米非司酮(孕酮拮抗剂)或salubrinal(eIF2α磷酸化抑制剂)所逆转[2~6]。提示内质网应激所致的eIF2α相关信号可能参与了孕酮撤退诱导的月经发生和孕酮对其调控的关键作用。但上述研究结果是在离体组织中得到的,在体情况下孕酮如何调控上述信号的表达还不清楚。本研究利用小鼠生理性孕酮撤退的月经模型进行孕酮回植实验,全面探索孕酮回植对小鼠月经发生过程中ERS所致的自噬关键信号通路PERK/eIF2α/ATF4和凋亡信号通路关键成员CHOP、Caspase12表达的调控情况,以期为月经发生机制的解析和临床月经调控的时机选择提供基础性技术资料。
1 材料与方法
1.1 实验动物与试剂 SPF级8~10周龄雌性健康C57BL/6J小鼠,购自斯贝福(北京)生物技术有限公司(许可证号:SCXK(京)2016-002),光照周期12 h(08:00-20:00),自由进食和摄水,21±1℃控温。本项研究动物实验获得遵义医科大学伦理委员会批准。雌激素(Estrogen)购自英国Alfa Aesar公司;孕酮(Progesterone)购自美国Sigma公司;山羊抗兔、山羊抗鼠IgG二抗购自北京中杉金桥生物技术开发公司;兔抗鼠PERK、鼠抗鼠ATF4、兔抗鼠CHOP多抗和鼠抗鼠GADPH单抗购自武汉三鹰生物技术有限公司;兔抗鼠p-PERK、p-eIF2α、eIF2α、Caspase12多抗购自北京博奥森生物技术有限公司;所有引物均由上海生工生物工程技术有限公司合成,引物序列为:PERK(F:GAGATCTGGCTCAAAGACGAAA;R:AAGGAGCTATGACTTCGATCTG)、eIF2α(F:GTCTCAGACCCATCTATCTTGG;R:CATACCTGGGTGGAGCTATTAG)、ATF4(F:GACCGAGATGAGCTTCCTGAACAG;R:CCGCCTTGTCGCTGGAGAACCACC)、CHOP (F:CTCCAGATTCCAGTCAGAGTTC;R:ACTCTGTTTCCGTTTCCTAGTT)、Caspase12(F:TGGCCCATGAATCACATCTAAT;R:TGGACAAAGCTTCAGTGTATCT)、GAPDH (F:TGGTGAAGACGCCAGTGGA;R:GCACCGTCAAGGCTGAGAAC);RNAiso Plus试剂盒和real-time PCR试剂盒购自日本TAKARA公司。
1.2 小鼠生理性孕酮撤退月经模型的建立及孕酮回植实验 参考本课题组前期工作进行[7]。将30只C57BL/6J雌鼠在乙醚麻醉下行双侧卵巢去除术。小鼠术后恢复1周以清除内源性雌孕激素的干扰,而后雌孕激素序贯干预,最后将20 μL花生油注入小鼠的子宫腔以诱导子宫内膜蜕膜化,49 h后移除孕酮皮埋管。将小鼠分为12 h组、16 h组和孕酮回植组(每组10只),其中12 h组和16 h组分别在皮埋管移除后12 h和16 h处死;回植组则在皮埋管移除后12 h再次回植皮埋管并在16 h处死。收集小鼠双侧子宫角,生理盐水冲洗后装入去酶EP管液氮中冻存或盛有固定液的EP管中待用。
1.3 real-time PCR检测PERK、eIF2α、ATF4、CHOP和Caspase12 mRNA表达 RNAiso Plus试剂盒提取小鼠全子宫总RNA,紫外分光光度计测定总RNA浓度。取2 μg总RNA逆转录成cDNA,20μL体系进行real-time PCR实验。反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共40个循环。以GAPDH为内参,目的基因的相对表达量以2-△△Ct表示。
1.4 蛋白印迹法检测t-PERK、p-PERK、t-eIF2α、p-eIF2α、ΑTF4 、CHOP和Caspase12蛋白表达 取约100 mg小鼠全子宫,加入1 mL混合液(组织裂解液、PMSF、蛋白酶抑制剂、蛋白磷酸酶抑制剂按100∶1∶1∶1配制)提取总蛋白,BCA法测定蛋白浓度。40 μg蛋白上样,80 V恒压电泳,冰上转膜,牛奶封闭,一抗(t-PERK 1∶1 000;p-PERK 1∶1 000;t-eIF2α 1∶1 000;p-eIF2α 1∶1 500;ATF4 1∶1 500;CHOP 1∶800;Caspase12 1∶2 000;GAPDH 1∶5 000)4 ℃孵育过夜。洗膜后常温孵育二抗2 h,ECL显影,Image Pro Plus进行条带分析。
1.5 免疫组化法检测p-PERK、p-eIF2α、ATF4、CHOP和Caspase12蛋白的原位表达 小鼠全子宫10%中性甲醛过夜固定后石蜡包埋,3μm连续切片,常规脱蜡水化后高压法修复抗原,一抗(p-PERK 1∶100;p-eIF2α 1∶150;ATF4 1∶100;CHOP 1∶50;Caspase12 1∶100)4 ℃过夜。PBS洗片后滴加二抗,37 ℃孵育30 min。DAB显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片后OLYMPUS光学显微镜下拍摄图像。
2 结果
2.1 小鼠子宫组织中PERK、eIF2α、ATF4的表达 如图1、图2,12 h组和孕酮回植组PERK、eIF2α和ATF4 mRNA表达量无明显差异,但均明显高于16 h组(P<0.05)。在蛋白水平上,各组子宫内膜组织中总PERK(t-PERK)和总eIF2α(t-eIF2α)表达未见显著差异;但其磷酸化蛋白(p-PERK、p-eIF2α)在12 h组和孕酮回植组是显著升高的,因而其活性表现形式(p-PERK/t-PERK、p-eIF2α/t-eIF2α的比值)及ATF4表达量显著高于16 h组(P<0.05)。如图3,免疫组化结果显示,p-PERK、p-eIF2α和ATF4蛋白在子宫内膜组织中的分布情况类似,表达于子宫内膜基底层与蜕膜化基质细胞交界处的基质细胞细胞质,且12 h组和孕酮回植组表达强度相似,均高于16 h组。

*:与12 h组相比较,P<0.05;#:与孕酮回植组比较,P<0.05。 图1 孕酮回植对小鼠子宫 PERK、eIF2α和ATF4 mRNA表达的影响(real-time PCR)

*:与12 h组相比较, P<0.05;#:与孕酮回植组比较,P<0.05。图2 孕酮回植对小鼠子宫PERK、eIF2α和ATF4蛋白表达的影响(Western blot)
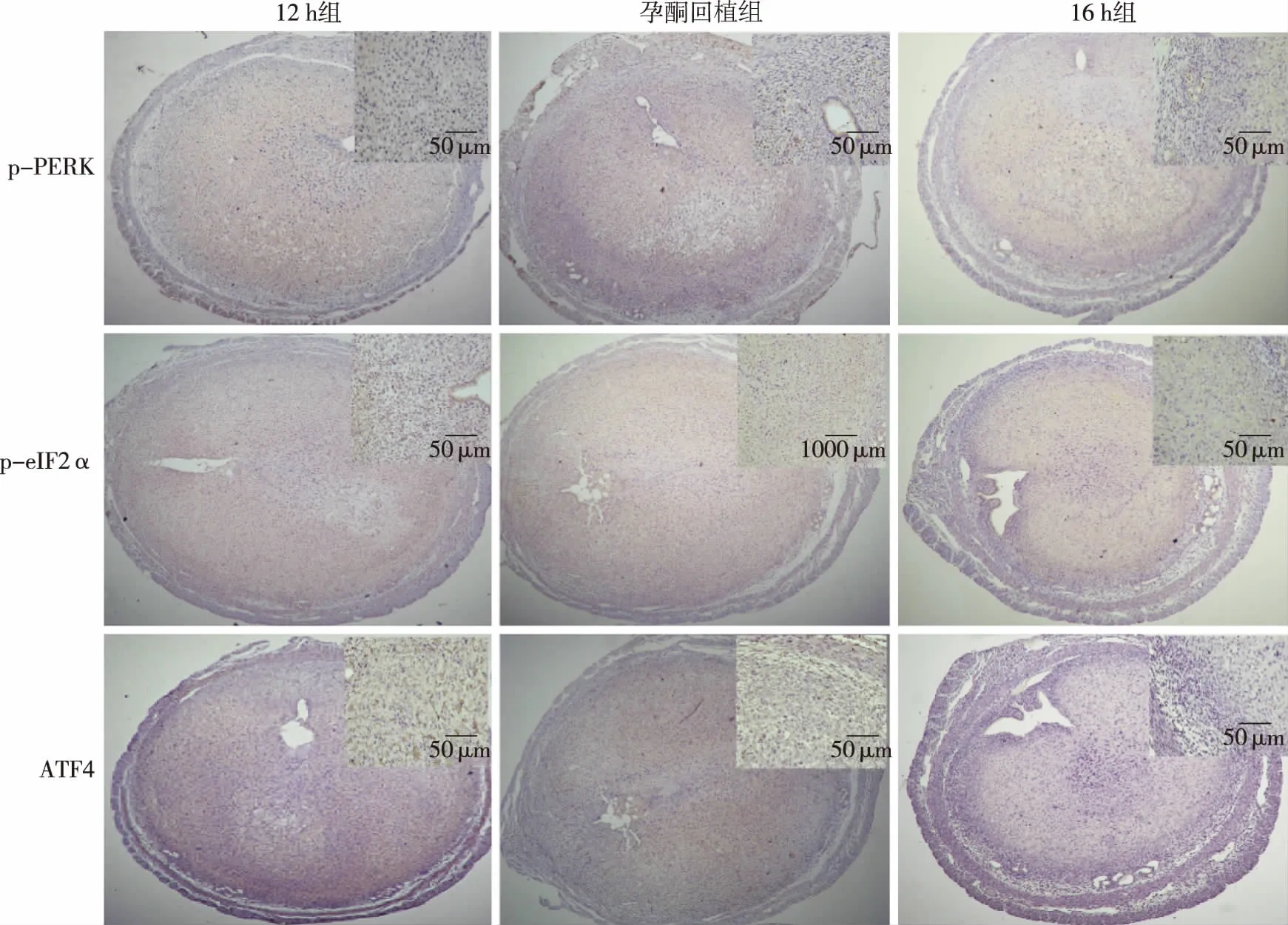
图3 孕酮回植对小鼠子宫p-PERK、p-eIF2α和ATF4 蛋白原位表达的影响(IHC,SP法)
2.2 小鼠子宫组织中CHOP和Caspase12的表达 如图4,孕酮回植组和12 h组的CHOP和Caspase12在mRNA和蛋白水平上的表达无明显差异,但均明显低于16 h组(P<0.05)。同时免疫组化结果显示,CHOP和Caspase12蛋白在12 h组和孕酮回植组表达强度类似,都显著低于16 h组,主要表达于充分蜕膜化的基质细胞和腺上皮细胞的细胞质(见图5)。

*:与12 h组比较,P<0.05;#:与孕酮回植组比较,P<0.05。图4 孕酮回植对小鼠子宫CHOP和Caspase12 mRNA和蛋白表达的影响
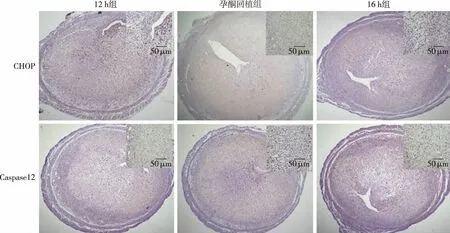
图5 孕酮回植对小鼠子宫组织CHOP和Caspase12蛋白原位表达的影响(IHC,S-P法)
3 讨论
月经周期贯穿于女性的整个生育期,月经是否规律对其生活质量影响巨大。阐明月经发生机制,将可为临床上经血过多、过少、痛经等子宫内膜异常出血相关疾病的治疗及月经周期的人工干预提供新的策略。
目前认为月经发生存在由血管外周细胞介导的可逆阶段和白细胞介导的不可逆阶段。在可逆阶段通过孕酮的补充可阻断子宫内膜的崩解[8],从而推测月经发生存在一个可为孕酮逆转的关键时期。这已在恒河猴[9]和小鼠模型中得到了证实,其中小鼠中这一关键时期在孕酮撤退后12 h,即在孕酮撤退后12 h回植孕酮能阻断月经发生,16 h回植则不能[7]。但孕酮是如何调控子宫内膜基质细胞的生存或死亡的?目前并不清楚。
细胞自噬是一个受基因调控的、涉及具有双层膜结构的自噬体形成,并将物质运输到溶酶体中降解的复杂过程[10]。正常情况下,细胞通过基础水平的自噬清除受损的蛋白质或细胞器,从而维持细胞稳态。研究表明,自噬缺陷小鼠表现出错误折叠的受损蛋白质的累积[11]。自噬与凋亡参与人类月经发生已有零星报道[12],但尚缺乏系统、全面的研究。PERK(protein kinase RNA-like ER kinase,蛋白激酶RNA样内质网激酶)是存在于内质网膜上的跨膜蛋白,其活性受到内质网腔中的葡萄糖调节蛋白78(glucose regulated protein 78,GRP78)的调节[11]。正常情况下,PERK与GRP78结合而无活性;当发生ERS时,特异性地触发未折叠蛋白反应(unfolded protein response,UPR),PERK与GRP78分离而磷酸化被快速激活[13-14],进而磷酸化eIF2α,下调细胞内蛋白合成的整体水平,减轻UPR而维持细胞生存;但当ERS进一步加剧时,eIF2α也可上调ATF4表达[3],进而直接上调CHOP表达而诱导细胞凋亡[15]。本研究通过在月经发生关键时期之前(孕酮撤退后12 h)回植孕酮,将其与孕酮撤退后12 h和16 h小鼠子宫中内质网应激诱导的自噬和凋亡情况进行比较。结果发现:虽然各组PERK、eIF2α总蛋白的表达无显著性差异,但在12 h组和孕酮回植组,其mRNA表达量、磷酸化形式的蛋白及其下游信号ATF4的表达量却显著高于16 h组。与此同时,内质网特异性凋亡信号CHOP和Caspase12 mRNA和蛋白表达模式刚好相反,即在12 h和回植组显著低于16 h组。由此提示,孕酮撤退后12 h,小鼠子宫内膜基质细胞产生了ERS,诱导UPR,激活PERK/eIF2α/ATF4信号通路的表达,增强自噬作用以清除异常蛋白质而维持细胞稳态。但当孕酮撤退时间延长到16 h,基质细胞的UPR反应进一步加重,内质网已无法有效清除积累的异常蛋白质,转而诱导内质网特异性的凋亡信号CHOP和Caspase12表达。这两种凋亡蛋白的表达一方面负反馈抑制其上游PERK/eIF2α/ATF4信号表达,另一方面介导各自的特异凋亡途径或共同协调诱导小鼠子宫内膜基质细胞的凋亡[16-17]。而这一效应可被在孕酮撤退后12 h回植孕酮所阻断,说明孕酮回植能有效维持较高水平的自噬并抑制内质网特异的凋亡蛋白表达,从而阻断小鼠月经的进程。需要指出的是,PERK和eIF2α的mRNA的变化趋势与其磷酸化蛋白的表达趋势一致,而与总蛋白表达趋势不符,说明这两种蛋白的活性可能不在翻译水平,而是在翻译后水平上的快速磷酸化而调控的[18-20]。
综上所述,孕酮撤退后12 h回植孕酮能有效阻断月经发生的进程,可能是通过维持小鼠子宫内膜基质细胞中ERS诱导的自噬信号通路PERK/eIF2α/ATF4表达并抑制凋亡关键信号CHOP和Caspase12表达来实现的。

