江苏盐城沿海滩涂湿地放线菌多样性及功能基因的筛选
郑 洁,庹 利,2,李 伟,保玉心,2
(1.遵义医科大学 研究生院,贵州 遵义 563099;2.遵义医科大学 医学与生物学研究中心 遵义市理化分析测试工程研究中心,贵州 遵义 563099)
放线菌因其次级代谢产物结构的复杂性和多样性而具有抗感染、抗肿瘤等生物活性[1]。目前在临床上应用的抗生素有3/4是由放线菌生产的[2]。如临床广泛应用的链霉素、阿奇霉素等[3]。随着抗生素的广泛使用,病原菌的耐药性急剧增强,使得现有抗生素越来越不足以应对这种局面,因此迫切需要新型抗生素,以适应病原菌对抗生素敏感性改变的速度[4-6]。放线菌在自然界中分布广泛,近年来,为了获取新的放线菌资源,人们逐渐将目光投向一些特殊环境[7]。沿海滩涂是介于陆地与海洋的生态系统交错区,受到海洋和陆地环境的双重影响,因此滩涂土壤中可能拥有独特的、既不同于陆地也不同于海洋环境的微生物资源[8-9]。有研究表明,滩涂沉积物中培养分离得到的细菌中有20%~30%属于新菌种[10]。在同属黄海区域的朝鲜半岛潮间带沉积物中,Lin等[11]分离到好氧菌株Marinimicrobiumkoreense和Marinimicrobiumagarilyticum;Bruns等[12]在德国北海潮间带沉积物中分离到厌氧菌株Muricaudaruestringensis;Choi等[13]分离到从属于Flavobacteriaceae的菌株Lutibacterlitoralis,这些结果表明滩涂土壤中可能具有独特的微生物资源。江苏盐城沿海滩涂湿地位于我国沿海地区中东部,属于从北亚热带向南暖温带过渡地带,是太平洋西海岸亚洲大陆边缘面积最大、原始生态保持最完好的海岸型天然湿地。目前,关于江苏盐城沿海湿地微生物特别是放线菌研究报道较少,纪元、张小蒙等只对江苏盐城沿海滩涂进行了简单的放线菌菌落计数[14-15]。对该地区放线菌的多样性及抗生素生物合成基因未见报道。本研究从江苏盐城沿海采集滩涂土壤样品,通过纯培养的方法对该地区的放线菌进行分离鉴定、多样性分析及抗生素生物合成基因筛选,以了解该地区放线菌分布特点,同时期待发现放线菌新物种或稀有放线菌,为新抗生素发现提供菌种储备,为进一步开发利用滩涂湿地放线菌资源开发和利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 土壤样品 2018年2月,围绕盐城市射阳县黄海海域每隔10~20 m设置采样点一个(样品采集地点见表1)。去除土壤表面覆盖的泥沙后,用无菌铲铲取20 cm深度土样后立即放入无菌封口袋中,放于4 ℃便携冰箱中保存运回实验室。共采集4个样本,分别标记Y1、Y2、Y3、Y4。
表1采集的土壤样品信息

样品采集地点Y1N33°41′23″,E120°33′57″Y2N33°41′23″,E120°33′57″Y3N33°41′23″,E120°33′58″Y4N33°41′23″,E120°33′57″
1.1.2 培养基 ①分离培养基:A、基础培养基:酸性酪蛋白5.0 g、柠檬酸钠3.0 g、酵母浸粉 10.0 g、KCl 2.0 g、蛋白胨5.0 g、MgSO4·7H2O 2.0 g、NaCl 40.0 g、琼脂20.0 g,加双蒸水定容至1 L,pH7.2;B、Marine agar 2216E合成培养基(MA):Marine broth 2216E (MB;美国BD)37.5 g,琼脂20.0 g,加双蒸水定容至1 L,pH7.2;C、改良TSA合成培养基:tryptic soy broth (TSB;美国BD)30.0 g,NaCl 20.0 g,琼脂20.0 g,加双蒸水定容至1 L,pH7.2;D、TSA合成培养基:Tryptic Soy broth(TSB;美国BD)30 .0 g,琼脂20.0 g,加双蒸水定容至1 L,pH7.2;E、改良ISP2培养基:酵母粉4.0 g,麦芽浸粉10.0 g,葡萄糖4.0 g,琼脂20.0 g,NaCl 20.0 g,加双蒸水定容至1 L,pH7.2;F、ISP2培养基:酵母粉4.0 g,麦芽浸粉10.0 g,葡萄糖4.0 g,琼脂20.0 g,加双蒸水定容至1 L,pH7.2。②纯化培养基:ISP2培养基:酵母粉4.0 g,麦芽浸粉4.0 g,葡萄糖4.0 g,琼脂20.0 g,加双蒸水定容至1 L,pH7.2。
1.1.3 抑制剂 萘啶酮酸20 mg/L,重铬酸钾60 mg/L[16],待培养基温度降至40~50 ℃时加入。
1.1.4 主要试剂和仪器 2×Easy Taq SuperMix、High Fidelity PCR SuperMix、pEASY-T1 Cloning Kit、EasyPure Quick Gel Extraction Kit、Trans-T1感受态细胞均购自北京全式金生物技术有限公司;DNA Marker、X-gal均购自上海生工生物工程有限公司;2×Taq PCR Master Mix购自北京康为世纪生物科技有限公司;PCR引物由上海生工生物工程有限公司合成;Chelex-100树脂,美国BioRad公司;Agarose、TAE缓冲液购自北京索莱宝公司;Tryptic Soy broth合成培养基和marine agar 2216E合成培养基购自美国BD公司。生物安全柜(BSC-1600IIA2),苏州安泰空气技术有限公司;生化培养箱(ZXSD-B1270),上海智城分析仪器制造有限公司;SHKE481HP型落地式恒温制冷摇床,美国Thermo公司;高压蒸汽灭菌锅,日本Tomy;Microfuge20 系列台式微量离心机(B31606),美国Beckman公司;电泳仪,北京市六一仪器厂;PCR扩增仪以及凝胶成像仪,美国BioRad公司。
1.2 方法
1.2.1 样品处理 取土壤样品置于无菌培养皿中,于菌种分离前2周自然风干研磨过筛,每个样品取2 g置于装有18 mL无菌水的离心管中,28℃、180rpm振荡过夜。
1.2.2 菌株分离培养、纯化及保藏 将预处理的土壤悬液进行梯度稀释,取200 μL 10-3稀释度样品接种于上述分离培养基平皿中,用灭菌后的涂布棒涂匀。倒置放入28 ℃培养箱中培养4~8周,及时观察分离培养基上的菌落形态,并挑取肉眼判断为放线菌的单菌落进行菌株编号,采用四区划线法接种于纯化培养基平板上,重复这一过程,直到得到纯菌株。得到的纯培养物接种于20%甘油中-80 ℃保藏。
1.2.3 基于16S rRNA基因序列的系统发育分析 ①16S rRNA基因测序和分析:菌株DNA提取按Chelex-100法进行[17-18]。PCR扩增引物为通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)。PCR反应体系:2(EasyTaqSuperMix 25 μL,27F引物2 μL,1492R引物2 μL,模板2 μL,无菌水19 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃ 10 min。PCR扩增产物经琼脂糖凝胶电泳检测,将电泳检测结果显示为阳性的PCR扩增产物送交上海生工生物工程股份有限公司进行序列测定。潜在新物种的16S rRNA基因序列使用High Fidelity PCR SuperMix扩增,反应体系及条件同上;PCR扩增产物经琼脂糖凝胶电泳检测,目标阳性条带切胶回收,将回收DNA片段连接到pEASY-1克隆载体后,转化至Trans1-T1感受态细胞中;利用抗性和蓝白斑筛选挑取阳性克隆子,接种于添加氨苄青霉素的LB液体培养基中,37 ℃、200 rpm培养10 h,菌液交由生工生物工程(上海)股份有限公司完成测序。②序列分析和系统发育树构建:测序获得的16SrRNA基因序列利用EzBioCloud(http://www.ezbiocloud.net)[19]数据库中的EzTaxon在线比对服务进行相关标准菌株的相似性比对搜索,确定菌株的分类学地位,并从中调出相关的标准菌株的序列作为参比对象,用Clustal X[20]软件进行多序列比对,采用MEGA 5.0[21]软件以邻接法(Neighbor-joining)[22]进行聚类分析并构建系统发育树,系统进化矩阵根据Kimura-2-parameter模型估算,重复取样1 000次进行自展值分析以评估进化树拓扑结构的稳定性。
1.2.4 抗生素生物合成基因(NRPS、PKSI和PKSII)的PCR筛选 放线菌基因组DNA的提取方法同上,以基因组DNA作为模板PCR扩增非核糖体多肽合成酶(NRPS)基因A结构域(引物A3F:5′-GCSTACSYSATSTACACSTCSGG-3′;A7R:5′-SASGTCVCCSGTSCGGTAS-3′)[23]、扩增I型聚酮合酶(PKSI)基因KS结构域(引物K1F:5′-TSAAGTCSAACATCGGBCA-3′;M6R:5′-CGCAGGTTSCSGTACCAGTA-3′)[24]和扩增II型聚酮合酶(PKSII)基因KS结构域(引物KSα:5′-TSGCSTGCTTGGAYGCSATC-3′;KSβ:5′-TGGAANCCGCCGAABCCTCT-3′)[24],三者扩增反应条件:96 ℃ 2 min;96 ℃ 1 min,60 ℃ 2 min,73 ℃ 1.5 min,35个循环;72 ℃ 8.5 min。PCR反应体系都为50 μL,其中模板DNA 2 μL,A3F/ A7R (10 μM)、K1F/ M6R (10 μM)、KSα/ KSβ (10 μM)分别为2 μL,2(Taq PCR Master Mix为25 μL,用ddH2O补至50 μL。PCR扩增产物用1%琼脂糖凝胶电泳进行检测,凝胶成像仪观察结果。
2 结果与分析
2.1 菌种分离结果 从江苏盐城沿海滩涂湿地收集的4份土壤样品,采用6种分离培养基分离放线菌,根据菌落形态初步排重,选择菌株进行16S rRNA基因序列扩增和序列分析,16S rRNA基因序列比对结果表明134株为放线菌,不同样品中放线菌出菌数见图1。

图1 不同样品中分离到的放线菌数量
不同培养基中分离的菌株具有特殊性,Curtobacterium为A培养基所分离,Microbacterium为B培养基所分离,Dietzia、Micromonospora、Paenarthrobacter、Pseudarthrobacter为C培养基所分离,Isoptericola为D培养基所分离,Mycetocola为E培养基所分离,Pseudarthrobacter为F培养基所分离。不同培养基中放线菌出菌数见表2。因此,根据分离到的菌株数目以及种属数目,比较好的培养基依次为D培养基、C培养基、E培养基、B培养基、F培养基、A培养基。
表26种培养基分离放线菌的效果
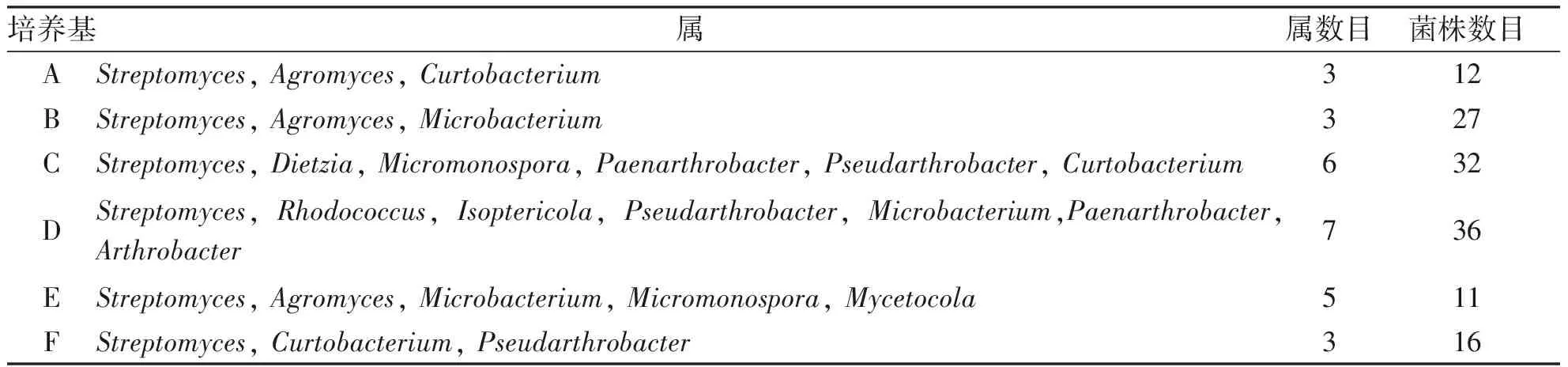
培养基属属数目菌株数目AStreptomyces, Agromyces, Curtobacterium312BStreptomyces, Agromyces, Microbacterium327CStreptomyces, Dietzia, Micromonospora, Paenarthrobacter, Pseudarthrobacter, Curtobacterium 632DStreptomyces, Rhodococcus, Isoptericola, Pseudarthrobacter, Microbacterium,Paenarthrobacter, Arthrobacter736EStreptomyces, Agromyces, Microbacterium, Micromonospora, Mycetocola511FStreptomyces, Curtobacterium, Pseudarthrobacter 316
2.2 土壤放线菌多样性分析 分离到的134株放线菌分布于放线菌域的4个目7个科12个属中,除优势菌链霉菌属(Streptomyces)外,还分离到微杆菌属(Microbacterium)、节杆菌属(Arthrobacter)、Paenarthrobacter、壤霉菌属(Agromyces)、短小杆菌属(Curtobacterium)、小单孢菌属(Micromonospora)、迪茨氏菌属(Dietzia)、红球菌属(Rhodococcus)、Pseudarthrobacter、白蚁菌属 (Isoptericola)、栖霉菌属(Mycetocola)稀有放线菌属。其中,链霉菌属为108株,占所分离菌株的80.6%,为优势菌属(见表3和图2)。所获得的稀有放线菌菌株以及种属数相对较高。
表3134株放线菌的多样性分布情况

目Order科Family属Genus菌株数量NO. of strains链霉菌目Streptomycetales链霉菌科Sterptomycetaceae链霉菌属Streptomyces108微球菌目Micrococcales微杆菌科Microbacteriaceae微杆菌属Microbacterium4栖霉菌属Mycetocola1壤霉菌属 Agromyces3短小杆菌属Curtobacterium4原小单孢菌科Promicromonosporaceae白蚁菌属Isoptericola2微球菌科Micrococcaceae节杆菌属Arthrobacter2Pseudarthrobacter3Paenarthrobacter3小单孢菌目Micromonosporales小单孢菌科Micromonosporaceae小单孢菌属Micromonospora2棒杆菌目Corynebacteriales迪茨氏菌科Dietziaceae迪茨氏菌属Dietzia1诺卡氏菌科Nocardiaceae红球菌属Rhodococcus1
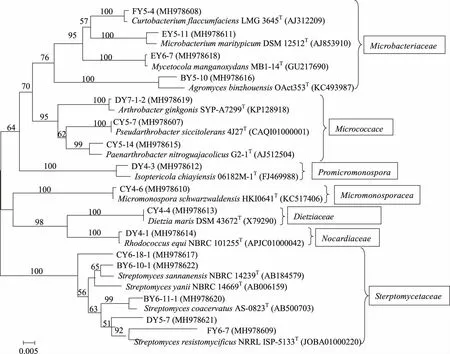
分支点上的数值为1 000次自举值分析所得值,仅显示大于50%的值;标尺0.005为进化距离。图2 基于16S rRNA基因部分序列构建的部分菌株的Neighbour-Joining系统进化树
2.3 放线菌新颖性分析 以98.65%作为区分两个原核物种的“金标准”[25],即菌株16S rRNA基因序列最大相似率低于98.65%的视为潜在新物种,对江苏盐城沿海滩涂湿地放线菌进行新颖性分析,发现分离获得的放线菌中,16S rRNA基因序列相似率低于98.65%的菌株共有1株,编号为BY5-10。对BY5-10进行16S rRNA基因克隆测序(16S rRNA基因序列长度为1490 bp),发现其与最近有效发表菌株AgromycesbinzhouensisOact353T(GenBank 登录号:KC493987)的16S rRNA基因序列相似率为98.35%,在基于16S rRNA基因序列构建的Neighbour-Joining(NJ)系统进化树中,菌株BY5-10在Agromyces属中与AgromycesbinzhouensisOAct353T聚为一簇(见图3)。基于相似率和进化树分析,推测菌株BY5-10为微杆菌科壤霉菌属的潜在新种。菌株EY6-7(16S rRNA基因序列长度为1483 bp)虽然与最近有效发表菌株MycetocolamanganoxydansMB1-14T(GenBank登录号:GU217690)的16S rRNA基因序列相似率为99.14%(高于98.65%),在基于16S rRNA基因序列构建Neighbour-Joining(NJ)系统发育树中,菌株EY6-7在Mycetocola属中与MycetocolamiduiensisCGMCC 1.11101T聚为一簇(见图4),但进化距离较远。基于进化树分析,推测菌株EY6-7为微杆菌科Mycetocola属的潜在新种。其确切的分类地位需要进行DNA-DNA同源性分析、细胞化学成分分析、形态特征分析、生理生化特性分析等结果来判断。
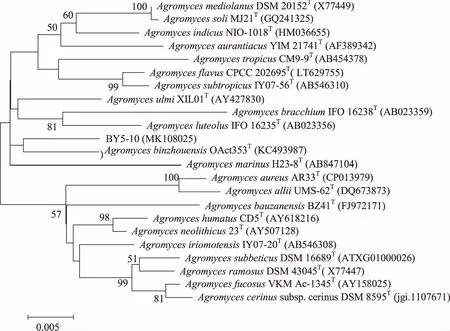
分支点上的数值为1 000次自展值分析所得值,仅显示大于50 %的值;标尺0.005为进化距离。图3 基于16S rRNA基因序列构建的菌株BY5-10与其相邻菌株的Neighbour-joining系统进化树
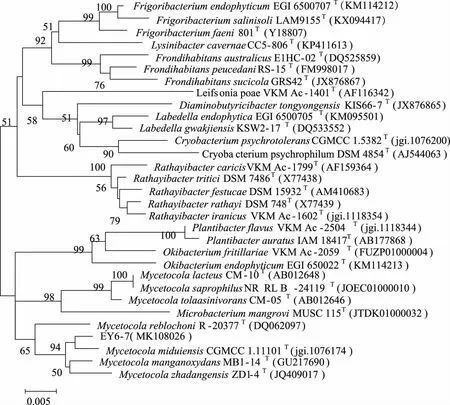
分支点上的数值为1 000次自展值分析所得值,仅显示大于50 %的值;标尺0.005为进化距离。图4 基于16S rRNA基因序列构建的菌株EY6-7与其相邻菌株的Neighbour-joining系统进化树
2.4 NRPS、PKS I和PKS II基因的PCR筛选结果 根据肉眼观察形态不同菌株中选取63株放线菌进行NRPS、PKS I和PKS II生物合成基因的PCR筛选。3种基因片段长度不同,NRPS基因片段长度在700~800 bp之间,PKS I基因片段长度在1 200~1 400 bp之间,PKS II基因片度长度在600 bp左右。结果显示其中55株放线菌含有至少1种生物合成基因,总阳性率为87.3%。如图5所示,含有NRPS基因的阳性菌株数为36株,含有PKS I基因的阳性菌株数为22株,含有PKS II基因的阳性菌株数为42株,3种生物合成基因均为阳性的菌株13株。部分菌株的NRPS、PKS I和PKS II基因筛选凝胶电泳图分别见图6A、B、C所示。这说明江苏盐城滩涂地区土壤放线菌具有一定抗生素合成的潜力。

图5 PCR筛选NRPS、PKS I和PKS II基因的阳性菌株数

图6 功能基因筛选电泳图
3 讨论
经过多年的发掘,陆地放线菌的研究非常普遍,从陆地放线菌中发现新菌种、新活性物质的几率正在逐渐下降[26]。而海洋放线菌由于生活在特殊的海洋环境中,其代谢途径独特复杂,形成的次级代谢产物在结构类型及生物活性方面都呈现出与陆地放线菌不同的特点和多样性[27]。沿海滩涂是海陆结合带的自然复合生态系统,兼具海洋与陆地生态系统的特点,是众多生物的栖息地。同时,滩涂也是一种不可再生的、重要的综合资源,具有巨大的经济效益和生态、环境、水文、地质等价值,开发潜力很大[28]。
本研究的样品采集自江苏省盐城射阳县,射阳县是江苏省滩涂面积最大的县,其沿海滩涂属淤泥质型海岸,地势平坦,自然属性优越。由于本研究选取的实验材料受沿海滩涂地区特有环境的影响,分离到的菌株具有一些海洋放线菌的特点。如分离到的链霉菌和小单孢菌属是海洋沉积物中的优势放线菌类群。
通常自然环境中只有不到1%的微生物能够被纯培养,虽然通过宏基因技术能够获得菌株群落结构和生物功能信息[29],但是纯培养放线菌的获得对研究了解放线菌次级代谢产物的生物合成途径或代谢通路仍是关键[30]。通过预处理方式、培养基配方或共培养方式获得难培养放线菌是当前微生物研究的重要内容之一[31]。本文通过综合各研究人员所用培养基营养成分,设计6种分离培养基分离放线菌。共分离到到分布于3个目7个科12个属的134株放线菌,除了优势菌属链霉菌外,还分离到微杆菌属(Microbacterium)、节杆菌属(Arthrobacter)、Paenarthrobacter、壤霉菌属(Agromyces)、短小杆菌属(Curtobacterium)、小单孢菌属(Micromonospora)、迪茨氏菌属(Dietzia)、Pseudarthrobacter、红球菌属(Rhodococcus)、Isoptericola、Mycetocola等稀有放线菌属,所获得的稀有放线菌菌株以及种属数相对较高。
天然活性化合物的分离和结构解析需要花费大量的时间和资金,往往伴随着极大的风险。因此,次级代谢产物生物合成基因筛选作为一种快速发现新型化合物的方法以及被广泛使用,大大提高筛选效率[32-36]。因为放线菌的大部分次级代谢产物是通过NRPS和PKS途径合成的[37],因此本研究对滩涂土壤可培养放线菌的NRPS、PKS I和PKS II等3种生物合成基因进行研究。从结果来看,63株放线菌中共有55株放线菌含有至少一种生物合成基因,总阳性率为87.3%,说明江苏盐城沿海滩涂湿地可培养放线菌具有较高的合成聚酮类化合物或非核糖体多肽类化合物的潜力,是后期放线菌分离方法研究的高质量材料,能为寻找新活性新结构化合物提供菌株,同时为新药的创制奠定研究基础。
江苏盐城沿海滩涂湿地中有着多样性丰富和新颖性的放线菌资源,具有从中发现放线菌新物种及新抗生素的潜力。

