截肢手术创伤对大鼠心脏电生理、心功能及eNOS通路的影响
赵桂香,刘志强,古丽扎尔·吐尔逊
(1.新疆医科大学第六附属医院心血管内科,乌鲁木齐 830002; 2.新疆医科大学第一附属医院心内管内科,乌鲁木齐 830054; 3.新疆喀什疏勒县解放军第947医院特诊科,新疆 喀什 844200)
截肢创伤属于特殊类型的创伤,手术前、后机体会发生应激反应,且延续至术后,损伤害患者身体健康,其中心血管系统是截肢创伤应激作用的重要靶器官[1]。创伤后机体发生炎症反应、氧化应激、Ca离子超载,导致冠状动脉供血不足、心律失常、心功能受损等[2]。调查显示[3],30%术后并发症、50%术后死亡原因均为围术期心血管事件,因此探究截肢创伤心功能变化情况对于临床治疗、预防围术期心血管事件,提高患者预后具有积极的意义。eNOS/NO通路在维持血管舒张、白细胞黏附以及抑制血小板凝集中发挥重要作用,多项研究指出该通路激活后对心肌缺血再灌注损伤中具有保护作用[4-5],然而eNOS/NO通路与截肢创伤后心功能的关系,目前尚不清楚,本研究通过复制左后肢截肢创伤模型,观察大鼠心脏电生理、心功能变化情况,并初步探究作用机制,以期为截肢创伤后心血管系统机制研究提供一定的参考。
1 材料与方法
1.1 实验动物
72只健康清洁级雄性Wistar大鼠,8周龄,体质量220~260 g,购于新疆医科大学基础研究室,[SCXK2015-0001][SYXK(新)2016-0008]。严格遵循动物伦理,伦理审批号:IACUC20170005,统一在温度25℃,湿度50%~60%,自然光照条件下喂养,期间大鼠自由饮水摄食,饲养1周后用于研究。
1.2 主要试剂与仪器
髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒(上海抚生实业有限公司,货号:A002097);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(南京建成生物工程研究所,货号:A003-1、A001-3);一氧化氮(NO)含量检测试剂盒(北京Solarbio公司;货号:BC1475);肿瘤坏死因子-ɑ (tumor necrosis factor-ɑ, TNF-ɑ)、白介素-6(interleukin-6,IL-6)、苏木精—伊红染色法 (hematoxylin-eosin staining,HE) 染色试剂盒(碧云天生物技术研究所,货号:P5318、PI326、C0105);Tunel染色试剂盒(Roche公司,瑞士,货号:11684817910);RIPA组织裂解液(碧云天生物技术研究所,货号:P0013C);B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白 (Bcl-2 associated X protein,Bax)一抗(R&D公司,美国,货号:AF810,AF820);eNOS、β-actin一抗(CST,美国,货号:9572、4967);MP-150型生理信号采集系统(Biopac,美国);VEVO3100小动物超声检测仪(VisualSonics,加拿大);ChemiDox XRS型凝胶成像仪(Bio-Rad,美国);XSP-BM21AY荧光显微镜(Olympus,日本)。
1.3 实验方法
1.3.1 动物模型制备[6]
采用3%异戊巴比妥钠以80 mg/kg腹腔注射麻醉大鼠,采取仰卧位,切开左侧腹股沟皮肤,游离股动静脉,于腹壁牵动静脉结扎,在膝关节上方1.3 cm处将股静脉与股动脉之外其它结构完全切除,最终将股静脉与股动脉剪断,复制左后肢创伤模型。
1.3.2 动物分组
将大鼠分为正常组(仅麻醉不进行截肢处理),截肢对照组、截肢0.25 h、截肢0.5 h、截肢0.75 h、截肢1.5 h,每组12只大鼠。
1.3.3 大鼠心电图(electrocardiogram,ECG)检测
用3%异戊巴比妥钠80 mg/kg麻醉大鼠后,利用生理信号采集系统行ECG检测,于皮下插入针型电极,记录标准II导联心电图,频率设定为10 kHz,扫描速率设定为200 ms,观察心率、QT间期、PR间期变化情况。
1.3.4 超声检测左心室功能
3%异戊巴比妥钠麻醉大鼠后,利用彩色多普勒超声检测仪,获取左心室长轴切面二维图像,对大鼠左室射血分数(left ventricular ejection fraction,LVEF)、左室短轴缩短率(left ventricular fractional shortening,LVFS),连续检测至少3个完整心动周期,求得平均值。
1.3.5 大鼠血流动力学检测
大鼠麻醉后,迅速将右颈总动脉分离,于远心端用丝线结扎,右侧颈动脉插管用40 U/mL肝素生理盐水浸润导管,观察压力曲线,待曲线呈正弦波形稳定10 min后检测左心室收缩压(Leftventeicular Left venteicular systolic pressuere,LVSP),左心室内压降低最高速率(+dp/dt max)以及左心室内压降低最高速率(-dp/dtmax)。
1.3.6 样本采集
采集各组大鼠尾静脉血,3000 r/min离心10 min,收集上清液-20℃保存备用。采集尾静脉血后,麻醉处死,迅速获取左心室心肌,将外膜脂肪除去后,一部分置于-80℃保存;一部分置于4%多聚甲醛中固定。
1.3.7 指标检测
严格按照试剂盒说明,检测血清和心肌组织中MPO、MDA、SOD、NO、TNF-ɑ、IL-6水平。MPO活性:1 g心肌组织湿片在37℃环境中被分解1 μmol过氧化氢为1 U/g。MDA采用硫代巴比妥酸(thiobarbituric acid,TBA)法。SOD水平采用邻苯三酚比色法;NO水采用Green法[7];TNF-ɑ和IL-6采用酶联免疫吸附法。
1.3.8 HE染色观察心肌组织形态学变化
常规制备石蜡切片,常规脱蜡脱水后,进行苏木精染色,10 min后水洗后,0.5%盐酸乙醇中分化后水洗,氨水中显蓝30 s后水洗,伊红染液复染2 min,水洗后梯度乙醇水合、二甲苯透明、中性树脂封片后,置于显微镜下观察心肌组织变化情况。
1.3.9 末端标记法(TdT-mediated dUTP nick-end labeling,TUNEL)法检测心肌组织细胞凋亡
常规制备石蜡切片,根据TUNEL试剂盒说明进行操作,检测心肌组织细胞凋亡情况。凋亡细胞在荧光显微镜下发绿色荧光,观察并保存图片,采用Image-J软件定量分析细胞凋亡指数,凋亡指数(apoptotic index,AI)=细胞凋亡数量/细胞总数×100%。
1.3.10 蛋白免疫印迹法检测心肌组织eNOS、Bcl-2、Bax蛋白表达
取出冻存心肌组织,采用RIPA组织裂解液提取蛋白,离心后,采用BCA法检测蛋白含量,采用SDS-PAGE电泳分离目的蛋白,将蛋白凝胶移至PVDF膜上行转膜反应,脱脂牛奶封闭后添加eNOS、Bcl-2、Bax、β-actin一抗抗体(稀释倍数为1∶500),4℃过夜孵育,添加HRP标记二抗(稀释倍数为1∶5000),室温下孵育2 h,采用ECL发光液进行曝光显影,于凝胶成像仪中观察条带,将β-actin为内参蛋白,用Image Pro-Plus软件定量分析相对表达量。
1.4 统计学处理
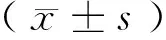
2 结果
2.1 截肢手术后大鼠ECG变化情况
与正常组相比,截肢对照组、截肢时及截肢后0.25 h大鼠心率、QT间期、PR间期无显著变化,差异无显著性(P>0.05);截肢后0.5 h,截肢后0.75 h心率逐渐升高、QT间期、PR间期逐渐降低,差异显著(P<0.05)。与截肢后0.75 h相比,截肢后1.5 h心率降低,QT间期、PR间期升高,差异显著(P<0.05)。见表1。
2.2 截肢后大鼠心功能及血流动力学指标变化情况
与正常组相比,截肢对照组、截肢时及截肢后0.25 h大鼠LVSP、+dp/dmax、-dp/dmax、LVEF、LVFS 无显著变化,差异无显著性(P>0.05);截肢后0.5 h,截肢后0.75 h LVSP、+dp/dmax、-dp/dmax、LVEF、LVFS逐渐降低,差异显著(P<0.05)。与截肢后0.75 h相比,截肢后1.5 h LVSP、+dp/dmax、-dp/dmax、LVEF、LVFS升高,差异显著(P<0.05)。见表2。
2.3 截肢后大鼠血清中氧化应激、炎症水平变化情况
与正常组相比,截肢对照组、截肢时及截肢后0.75 h大鼠血清MPO、MDA、SOD、TNF-ɑ、IL-6无显著变化(P>0.05);截肢后1.5 h MPO、MDA、TNF-ɑ、IL-6升高,SOD降低,差异显著(P<0.05)。结果如图1所示。
2.4 截肢后大鼠心肌组织中氧化应激、炎症水平变化情况
与正常组相比,截肢对照组、截肢时及截肢后0.25 h大鼠MPO、MDA、SOD、TNF-ɑ、IL-6无显著变化(P>0.05);截肢后0.5 h、0.75 h MPO、MDA、SOD、TNF-ɑ、IL-6升高(P<0.05),SOD降低(P<0.05)。与截肢后0.75 h相比,截肢后1.5 h MPO、MDA、、TNF-ɑ、IL-6降低(P<0.05),SOD升高(P<0.05)。结果如图2所示。
2.5 各组大鼠心肌组织形态学变化
正常组心肌组织染色均匀,细胞形态规则、排列整齐,未出现明显病理性改变;截肢后0~0.75 h,细胞排列疏松,伴有大量炎性细胞浸润,细胞呈破碎、坏死状,随着时间的延长,心肌组织病理损伤程度加重。截肢后1.5 h后心肌病理损伤程度有所减轻。结果如图3所示。
2.6 各组大鼠心肌组织凋亡情况
与正常组相比,截肢对照组、截肢时及截肢后0.25 h心肌细胞凋亡指数无显著变化(P>0.05);截肢后0.5 h、0.75 h心肌细胞凋亡指数逐渐升高,差异显著(P<0.05)。与截肢后0.75 h相比,截肢后1.5 h心肌细胞凋亡指数降低,差异显著(P<0.05)。结果如图4和图5所示。
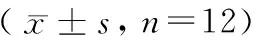
表1 各组大鼠EGG检测结果比较
注:与正常组比较,*P<0.05;与截肢0.75 h组比较,#P<0.05。
Note. Compared with the normal group.*P< 0.05. Compared with the amputation 0.75 h group,#P< 0.05.
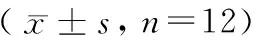
表2 各组大鼠心功能及血流动力学检测结果比较
注:与正常组比较,*P<0.05;与截肢0.75 h组比较,#P<0.05。
Note:Compared with the normal group.*P< 0.05. Compared with the amputation 0.75 h group,#P< 0.05.
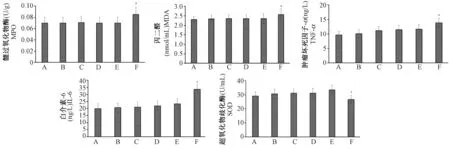
注: A、B、C、D、E、F分别表示正常组、对照组、0.25 h组、0.5 h组、0.75 h组、1.5 h组。与正常组比较,*P<0.05。图1 各组大鼠serum鼠MPO、MDA、SOD、TNF-ɑ、IL-6水平比较Note. A, B, C, D, E, and F represent the normal group, the control group, the 0.25 h group, the 0.5 h group, the 0.75 h group, and the 1.5 h group, respectively. Compared with the normal group, *P < 0.05.Figure 1 Comparison of the MPO, MDA, SOD, TNF- and IL-6 levels in the rat myocardium in each group

注:A、B、C、D、E、F分别表示正常组、对照组、0.25 h组、0.5 h组、0.75 h组、1.5 h组。与正常组比较,*P<0.05;与0.75 h组比较,#P<0.05。图2 各组大鼠心肌组织中MPO、MDA、SOD、TNF-ɑ、IL-6水平比较Note. A, B, C, D, E, and F represent the normal group, the control group, the 0.25 h group, the 0.5 h group, the 0.75 h group, and the 1.5 h group, respectively.Compared with the normal group, *P < 0.05. Compared with the 0.75 h group. #P< 0.05.Figure 2 Comparison of MPO, MDA, SOD, TNF-ɑ and IL-6 levels in myocardium of the rats in each group

图3 各组大鼠心肌组织的病理学变化。HE染色。Figure 3 Histological changes of myocardial tissues in the rats. HE staining
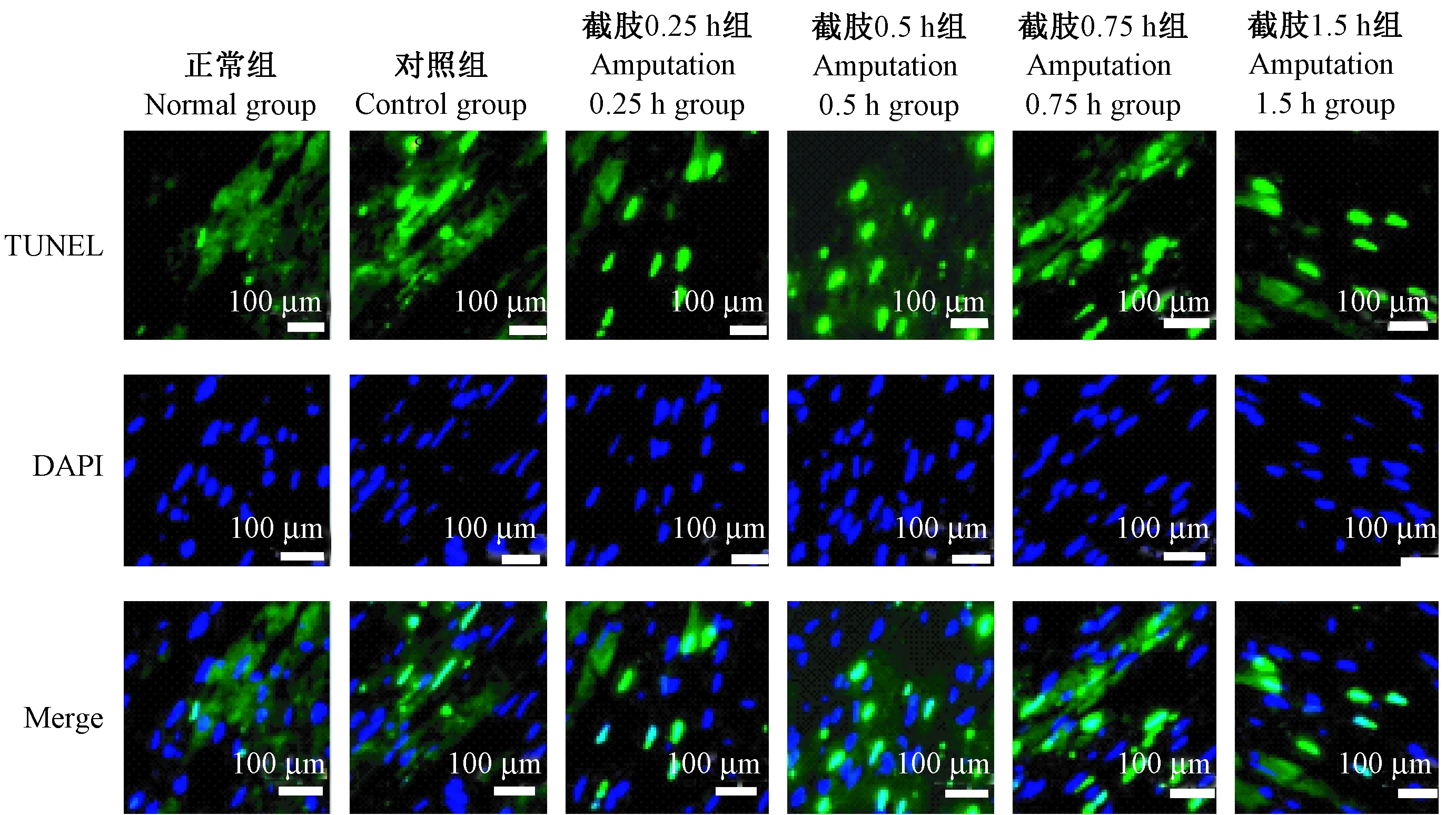
图4 各组大鼠心肌细胞的凋亡状况,TUNEL染色Figure 4 Apoptosis in cardiomyoaytes cells in the rats of each group. TUNEL staining.
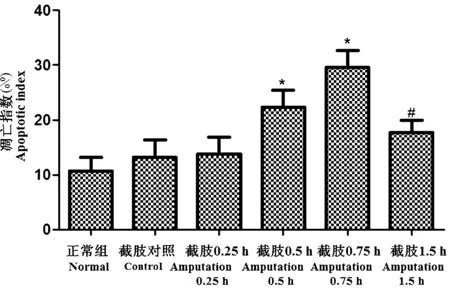
注:与正常组比较,*P<0.05;与0.75 h组比较,#P<0.05。图5 各组大鼠心肌细胞凋亡指数的比较Note. Compared with the normal group, *P < 0.05. Compared with the 0.75 h group, #P< 0.05.Figure 5 Comparison of the apoptotic indexes of cardiomyocytes in the rats of different groups
2.7 心肌组织中Bcl-2、Bax蛋白表达情况
与正常组相比,截肢对照组、截肢时及截肢后0.25 h组织中Bcl-2、Bax蛋白表达无显著变化(P>0.05);截肢后0.5 h、0.75 h组织中Bcl-2蛋白表达逐渐降低、Bax蛋白表达逐渐升高,差异显著(P<0.05)。与截肢后0.75 h相比,截肢后1.5 h Bcl-2蛋白表达升高,Bax蛋白表达降低,差异显著(P<0.05)。结果如图6和图7所示。
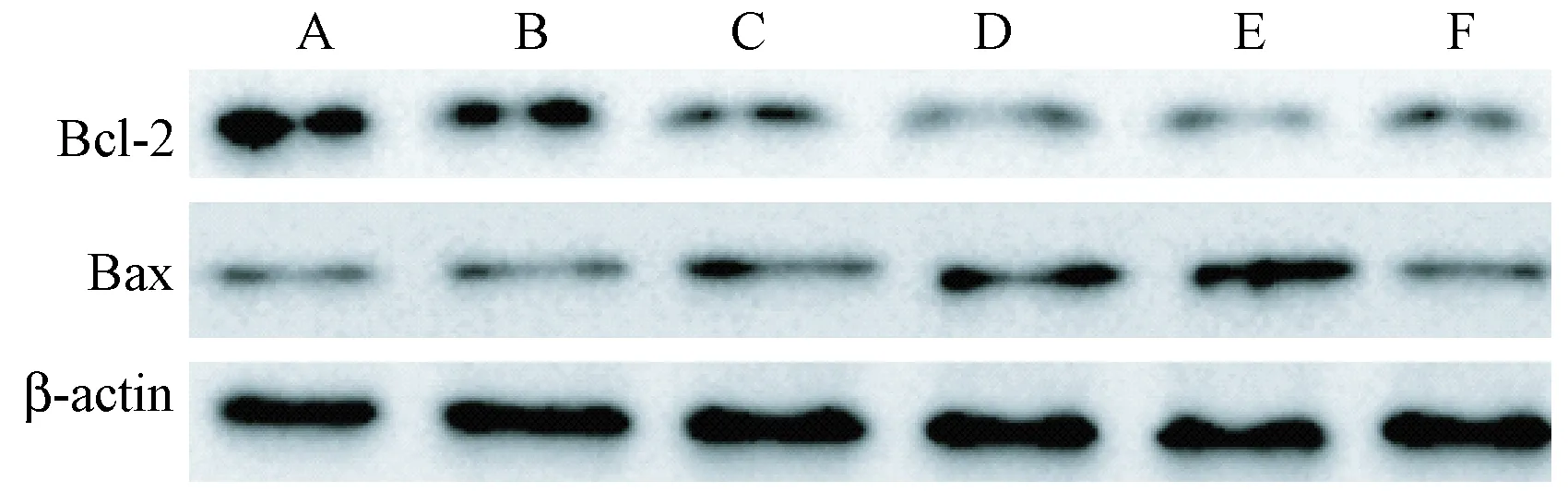
注:A、B、C、D、E、F分别表示正常组、对照组、0.25 h组、0.5 h组、0.75 h组、1.5 h组。图6 Western blot检测心肌组织中Bcl-2、Bax蛋白表达Note. A, B, C, D, E, and F represent the normal group, the control group, the 0.25 h group, the 0.5 h group, the 0.75 h group, and the 1.5 h group, respectively.Figure 6 Expression of Bcl-2 and Bax proteins in the rat myocardial tissues. Western blot.
2.8 各组心肌组织中eNOS/NO水平变化情况
与正常组相比,截肢对照组、截肢时及截肢后0.25 h心肌组织中eNOS 蛋白表达无显著变化(P>0.05);截肢后0.5 h、0.75 h组织中eNOS 蛋白表达逐渐降低,差异显著(P<0.05)。与截肢后0.75 h相比,截肢1.5 h eNOS 蛋白表达升高,差异显著(P<0.05);与正常组相比,截肢对照组、截肢时及截肢后0.25 h组织中NO水平无显著变化(P>0.05);截肢后0.5 h、0.75 h组织中NO水平逐渐降低,差异显著(P<0.05)。与截肢后0.75 h相比,截肢后1.5 h NO水平升高,差异显著(P<0.05)。结果如图 8所示。
3 讨论
截肢手术造成的创伤不但会损伤手术部位肢体,而且对机体重要器官如心、肝、肺等均会有一定程度的损伤。基础研究发现截肢创伤大鼠心肌组织染色后组织伴有炎细胞浸润,电镜提示心肌线粒体结构肿胀,且峭断裂,表明截肢创伤也会造成心脏损害,这可能是创伤后患者发生心律失常以及心功能障碍、心源性猝死的重要原因[8]。报道显示心律失常在围手术期并发症中发生率为10%~60%[9]。目前截肢术后心功能损害的发生机制以及治疗方法尚不明确。因此本研究通过探究截肢手术后大鼠电生理、心脏功能损伤情况,并初步阐明截肢创伤后心肌损伤的作用机理。
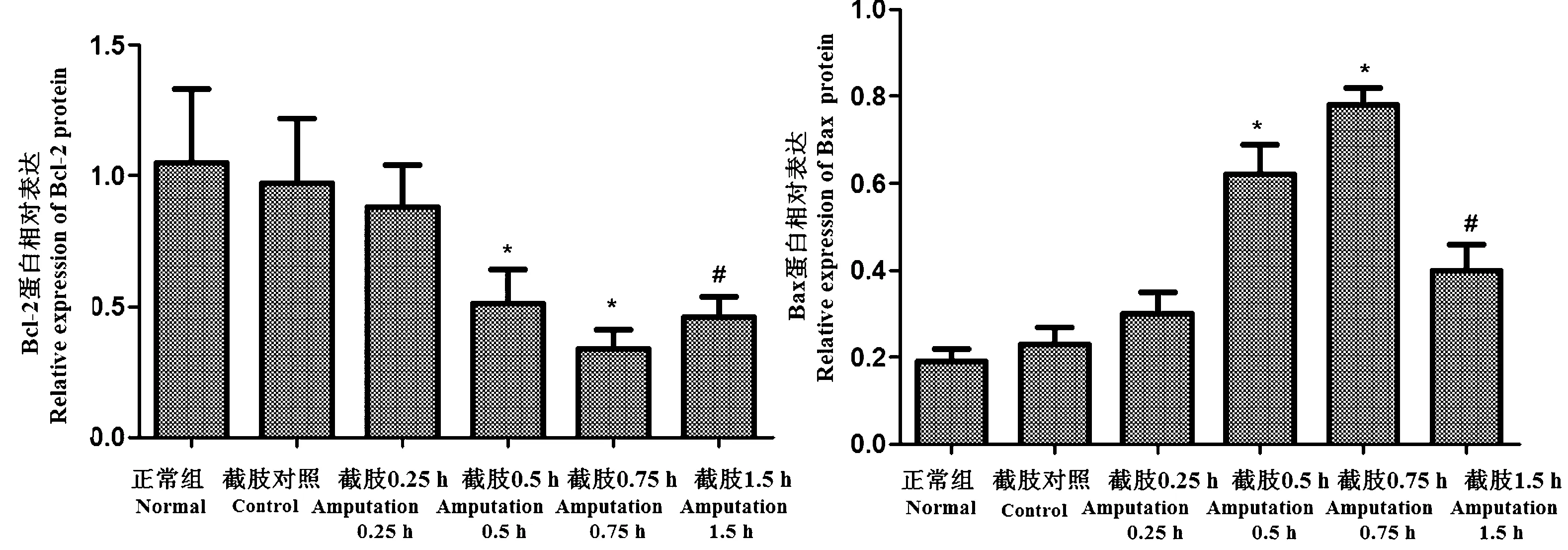
注:与正常组比较,*P<0.05;与截肢0.75 h组比较,#P<0.05。图7 各组心肌组织中Bcl-2、Bax蛋白表达比较Note.Compared with the normal group, *P < 0.05. Compared with the amputation 0.75 h group, #P< 0.05.Figure 7 Comparison of the expression of Bcl-2 and Bax proteins in the rat myocardial tissues of each group
肢体创伤后可使局部组织通透性升高、血管内皮损伤引发机体应激反应与炎症反应,且效应可达心脏,引发心律失常、心肌缺血、心脏功能受损等疾病[10]。本研究发现与正常大鼠相比,截肢手术后0~0.75 h内大鼠心率加快,PR间期、QT间期缩短,提示大鼠截肢创伤后心电图表现异常。LVSP为评估心肌收缩射血能力的主要指标,+dp/dmax、-dp/dmax为评估心肌收缩、舒张功能的主要指标,LVFS、LVEF均是评估左心室收缩能力的指标,以往研究显示LVSP、LVFS、LVEF三者水平的下降均表明左心室收缩能力的降低[11]。本研究发现截肢后大鼠LVSP、+dp/dmax、-dp/dmax、LVEF、LVFS水平均降低,且术后0.75 h降至最低,1.5 h水平升高,提示截肢手术会影响大鼠左心室功能,造成左心室舒张、收缩功能降低。本研究进一步通过病理学观察发现截肢后0~0.75 h,心肌细胞排列疏松,伴有大量炎性细胞浸润,细胞呈破碎、坏死状,随着时间的延长,心肌组织病理损伤程度加重,1.5 h后心肌病理损伤程度有所减轻,提示截肢后心肌组织出现病理性损伤,进而造成心室功能损伤。
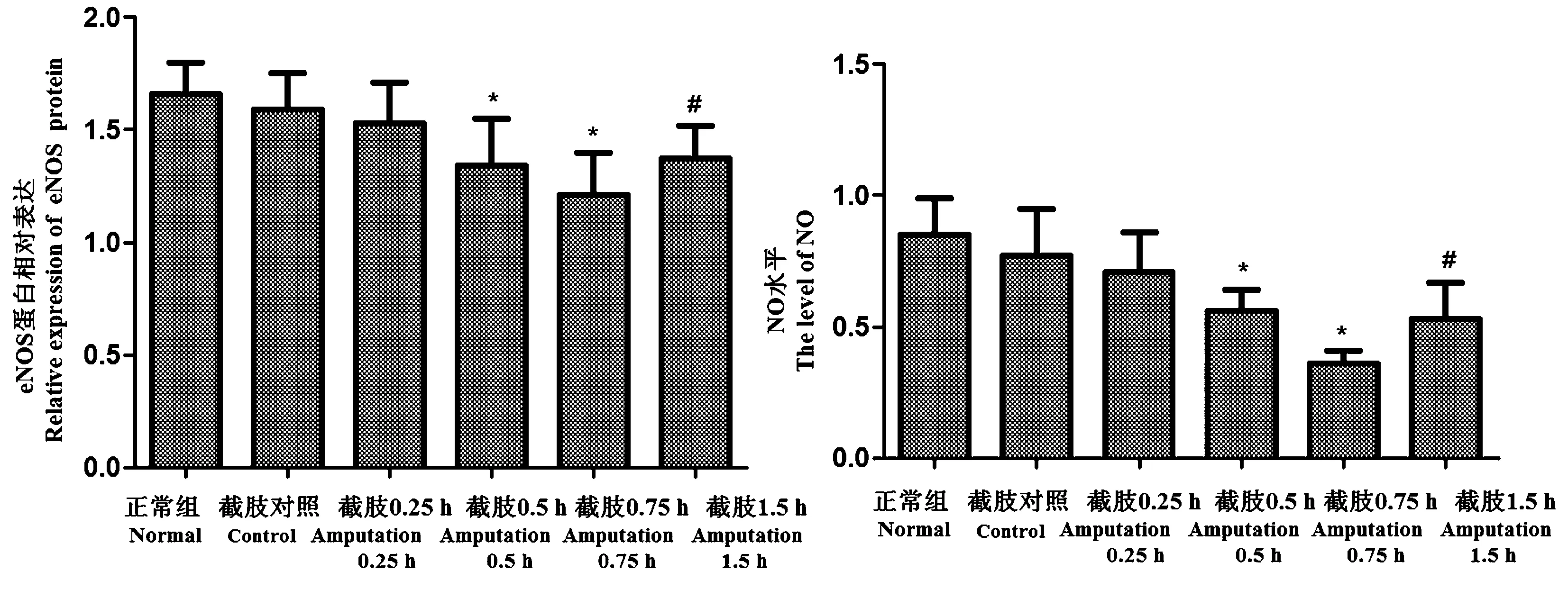
注:与正常组比较,*P<0.05;与0.75 h组比较,#P<0.05。图8 各组心肌组织中eNOS和NO水平比较Note. Compared with the normal group, *P < 0.05. Compared with the 0.75 h group, #P< 0.05.Figure 8 Comparison of eNOS and NO levels in the rat myocardial tissues of each group
正常生理状态下,体内自由基的合成与清除均处于动态平衡中,当受到病理性损伤后,机体中超氧负离子、羟自由基释放过多,造成膜磷脂、蛋白等氧化反应加剧,生成大量脂质过氧化物,损伤细胞膜完整性,导致细胞代谢功能受到障碍。MDA为机体中脂质过氧化物代谢产物,因此其水平的高低能够反应组织自由基水平或细胞损伤程度。基础研究显示近期较多研究证实脂质过氧化及自由基生成过多是心肌组织损伤的重要原因,心肌组织受损后,组织中自由基过多无法及时清除,影响心肌细胞的呼吸作用,最后导致细胞死亡[12-13]。本研究发现创伤后0~0.75 h心肌组织中MDA升高,SOD降低,在第0.75 h均达到最高值,1.5 h后MDA降低,SOD水平升高,而通过分析本研究大鼠血清中氧化应激、炎症水平变化情况结果显示,截肢对照组、截肢时及截肢后0.75 h大鼠血清MPO、MDA、SOD、TNF-ɑ、IL-6无显著变化;截肢1.5 h MPO、MDA、TNF-ɑ、IL-6升高,SOD降低,此结果与心肌组织氧化应激损伤结果有一定的差异,血清中各检测指标在1.5 h开始显著变化,而心肌组织在0.75 h开始显著变化。与心肌组织相比,血清中各检测指标变化时间延迟,由此可以说明心肌组织氧化应激损伤不是由于截肢部位释放的,提示截肢创伤后会造成心肌组织氧化应激损伤,可能是造成截肢创伤后心肌损伤的重要病理学原因。同时也就一步说明创伤后器官损伤会造成炎症反应失控,血管内皮释放较多黏附因子,促进中性粒细胞聚集、黏附,进一步释放大量TNF-ɑ、IL-6等炎性因子,损害组织器官[14-15]。本研究发现截肢创伤后心肌组织中0~0.75 h Bcl-2蛋白表达逐渐降低,Bax蛋白表达逐渐升高,随后在1.5 h Bcl-2蛋白表达升高,Bax蛋白表达降低,提示截肢创伤后心肌组织中炎症因子水平升高,造成炎性损伤,与HE染色结果相符合,提示心肌炎性损伤可能为截肢创伤后心肌手段的重要原因。
心肌组织损伤后可引发心肌细胞凋亡进而加重病理损伤,本研究采用TUNEL染色显示,与正常组相比截肢0.75 h内心肌细胞凋亡指数逐渐升高,1.5 h后心肌细胞凋亡指数降低,提示截肢后可引发心肌细胞凋亡,这可能为导致心肌损伤的重要原因。细胞凋亡过程涉及凋亡诱导蛋白Bax及抑凋亡蛋白Bcl-2,细胞正常状况下,Bcl-2、Bcl-XL、Bax以二聚体形式存在于线粒体内以阻碍细胞凋亡;细胞损伤后,Bax蛋白大量表达聚集于线粒体膜上,导致膜通透性增加,促使凋亡因子进入细胞内,激活caspase通路引发细胞凋亡[16-17]。本研究发现截肢创伤后心肌组织中0~0.75 h MPO、TNF-ɑ、IL-6水平逐渐升高,在第0.75 h均达到最高值,随后在1.5 h水平降低,提示截肢创伤后心肌组织中炎症因子水平升高,造成炎性损伤,与HE染色结果相符合,提示心肌炎性损伤可能为截肢创伤后心肌手段的重要原因。
NO是由eNOS催化精氨酸生成,在血管扩张中发生重要作用,在心肌损伤时时其水平的升高可抑制心室重构。以往研究显示内源性NO水平的降低导致血管舒张功能减弱,加重心肌损伤,而内源性NO水平与eNOS的活性密切有关,eNOS活性减弱则会导致NO释放减少,促进心力衰竭[18]。在动物中研究发现对激活eNOS/NO信号传导,可降低心肌梗死面积减轻心脏重构不良,因此激活eNOS/NO信号可抑制心肌梗死所致心脏重构[19]。本研究发现截肢创伤后0.75 h内NO水平、eNOS蛋白表达降低,截肢1.5 h NO水平、eNOS蛋白表达升高,提示eNOS/NO信号通路受抑与截肢后心肌损伤有关。
综上所述,截肢手术创伤后影响大鼠电生理、心功能,使大鼠发生缺血性心电图改变,心功能受损,引发心肌组织过度氧化应激、炎症损伤,其机制可能与eNOS/NO通路受到抑制有关,截肢手术创伤后心肌组织损伤机制较复杂,涉及较多信号通路,本研究仅对eNOS/NO通路变化情况进行研究,有关确切机制还有待后续深入探究。

