新生儿缺血缺氧性脑病低场强MRI表现与临床对照研究
曹 玲 吴婷婷
陕西省榆林市第一医院儿科新生儿病区 (陕西 榆林 719000)
缺血缺氧性脑病(hypoxic ischemic encephalopathy,HIE)是由各种围生期因素引起脑部缺氧及血流灌注减少所致的脑损伤,患儿病死率为15%~20%,且即便救治成功获得生存,也有30%几率产生永久性神经功能障碍相关后遗症[1],对其预后心身发育影响极为恶劣。磁共振成像(magnetic resonance imaging,MRI)作为多方位、多序列的无辐射成像检查方法,对脑灰白质辨识度较高[2]。尽管如此,我国幅员辽阔而各地区医疗条件参差不齐,因而中高场强扫描仪设备造价相对昂贵而推广应用受到一定限制,相比之下低场强MRI在基层医院更易于获得良好应用,然而目前仅在骨科疾患检查较为常见[3]。然而低场强MRI通常扫描时间较长且分辨率欠佳,且新生儿自制力较差,其检查结果是否能准确评估HIE病情尚有待考证。基于此,本研究旨在分析低场强MRI评估HIE患儿预后的效果与可行性,取得成果报道如下。
1 资料与方法
1.1 一般资料回顾性分析2014年10月~2017年9月期间,我院收治的82例HIE患儿临床资料,其中男性44例,女性38例;日龄为3~19d,平均(10.47±3.15)d;足月儿54例,早产儿28例;阴道分娩36例,剖宫产术分娩46例;5min Apgar评分为(4.07±1.16)分;宫内窘迫61例,滞产14例,前置胎盘/胎盘早剥7例,根据1年随访预后情况分为良好组(n=48)与不良组(n=34)。纳入标准:(1)缺氧史及临床表现均符合HIE相关诊断标准[4];(2)日龄≤28d;(3)家长同意接受低场强MRI检查;(4)检查后随访1年出现死亡、脑性瘫痪、癫痫、吞咽障碍及视听/认知障碍患儿纳入不良组,其他患儿纳入良好组。排除标准:(1)诊断出先天性中枢神经系统发育障碍;(2)伴有宫内感染、产伤、低钙血症等导致类似症状病症;(3)图像质量欠佳而无法做出诊断;(4)1年内随访失联。
1.2 仪器与检查方法患儿检查前10min予以口服10%水合氯醛30mg/kg镇静,采用GE公司生产的0.35T低场强开放式永磁型磁共振成像系统,给予颅脑线圈,令患儿保持舒适体位并垫软枕、空气负压袋固定头部,扫描轴位与矢状位如下序列,T1WI FLAIR:TR/TE=1700ms/23ms,T2WI FLAIR:TR/TE=7000ms/113.4ms,层厚8.0mm,视野240mm,矩阵256×160。
1.3 阅片与评估标准由科内经验丰富医师进行阅片,常规滤波优化对比度与亮度,观察皮层及皮层下白质、深部白质、基底节、丘脑、脑干、小脑、脑外间隙及脑室受累情况,获取脑水肿、颅内出血、白质软化、基底节/丘脑信号等判读信息。评分标准参照巴瑞华等[5]改良的HIE患儿MRI影像学评分方法,对如下5个项目进行评分,(1)分水岭区,0分:正常,1分:单个或局灶性白质损伤,2分:前/后部白质和(或)脑室周围白质损伤,3分:前/后部分水岭区皮质与白质损伤,4分:前后分水岭区灰白质界面不清且信号异常,5分:广泛灰白质界面不清;(2)基底节丘脑,0分:正常,1分:丘脑腹外侧核和(或)壳核后部局灶、轻度信号异常,2分:丘脑、豆状核信号异常;3分:2分标准+Rolandic区信号异常,4分:3分标准+Rolandic区以外的皮质或小脑信号异常;(3)内囊后肢,0分:正常,1分:信号强度减弱或对称性紊乱,2分:T1WI与T2WI信号反转或缺失性异常;(4)脑干,0分:正常,1分:前后脑桥局部信号异常且轻度对称性紊乱,2分:广泛异常髓鞘化/萎缩且丢失对称性;最高得分为13分,分数越高可提示HIE患儿为病情越严重。
1.4 统计学方法数据资料均采用SPSS19.0进行统计处理,分类变量以例数与百分率表示,组件比较采用Pearsonχ2检验;连续变量以(±s)表示,组间比较采用独立样本t检验;双侧检验结果中,均以P<0.05提示为有统计学意义。
2 结 果
2.1 两组影像学表现比较良好组低场强MRI下广泛脑水肿、颅内出血、脑白质软化及基底节/丘脑信号异常出现率明显低于不良组,差异均有统计学意义(P<0.05),见表1。
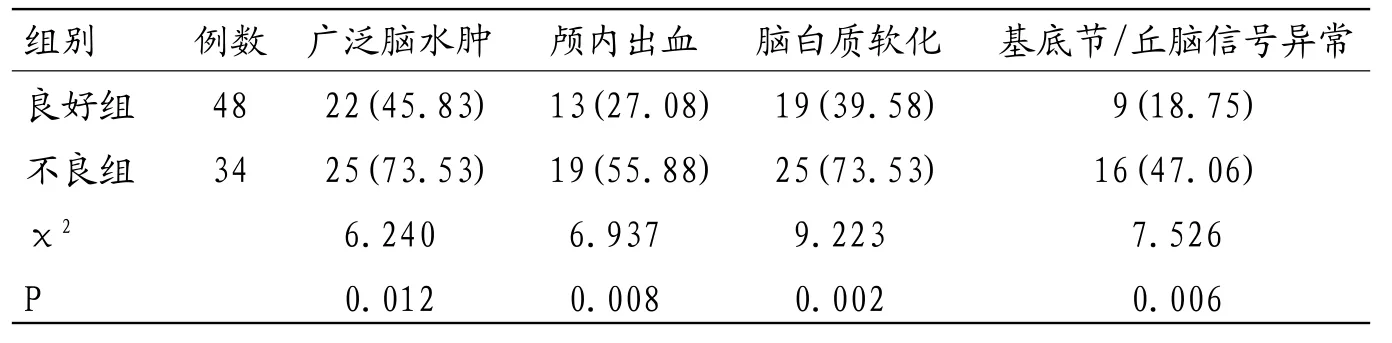
表1 两组患儿低场强MRI影像学表现比较[例(%)]
2.2 两组影像学评分比较良好组低场强MRI影像学评分各项目及总分均明显低于不良组,差异均有统计学意义(P<0.05),见表2。见图1-4。
表2 两组患儿低场强MRI影像学评分比较(±s,分)
组别 例数 分水岭区 基底节/丘脑 内囊后肢 脑干 总分良好组 48 2.68±0.84 2.17±0.70 1.16±0.36 1.07±0.33 7.08±1.20不良组 34 3.13±0.92 2.56±0.81 1.34±0.41 1.30±0.38 8.33±1.35 t 2.973 2.328 2.105 2.919 4.412 P 0.024 0.022 0.038 0.005 <0.001
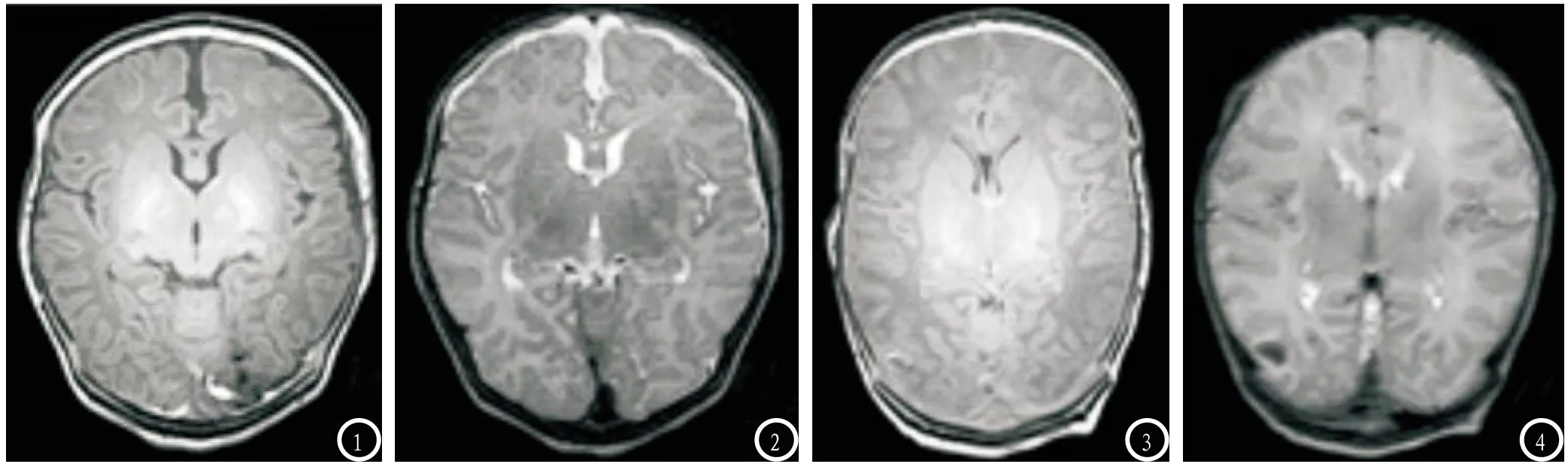
图1-2 良好组患儿,男,日龄5d。图1 为T1WI FLAIR图像。图2 为T2WI FLAIR图像。观察到灰质局部强化为典型水肿,白质环状高信号则识别为软化灶,评分为6分。图3-4 不良组患儿,男,日龄14d。图3 为T1WI FLAIR图像。图4 为T2WI FLAIR图像。观察到广泛强化为典型水肿,局部低信号提示颅内出血,侧脑室周围及半卵圆中心白质高信号识别为软化灶,评分为8分。
3 讨 论
既往临床通常根据HIE患儿临床表现、脑电图评估病情与预后,此类定性评估通常缺乏灵敏性,而颅脑超声虽成像全面,但易受到急性期颅内出血影响,导致其成像效果较差,颅脑CT虽灵敏度高,但也因存在电离辐射而较少应用于新生儿检查[6],因此通过MRI检查患儿脑部病变情况必要性较大。目前大型医院常用的中高场强MRI具有较高信噪比与空间分辨率,由于成像速度快,易于检测出HIE患儿颅内微小出血灶,同时借助灌注成像、弥散加权成像等功能成像序列[7],能获得更丰富病变信息。据相关文献报道,不同于中高场强MRI的低温超导体生磁,低场强MRI多依赖于稀土材料制备的永磁体,此类材料对温湿度要求较少,仪器运行、维护与保养费用相对低廉[8],与我国医疗领域国情发展契合度更高。本研究中,良好组低场强MRI下广泛脑水肿、颅内出血、脑白质软化及基底节/丘脑信号异常出现率明显低于不良组,这表明低场强MRI能通过影像表现有效对不同预后的HIE患儿做出明确诊断,有利于尽早采取合理干预措施。相关专家表示,低场MRI诊断HIE所需时间显著长于颅脑CT,但其图像仍较为清晰,不仅可准确识别脑实质与基底节损伤情况,获取脑室周围白质软化与髓鞘化的过程,还能突出颅脑CT与B超难以呈现的小灶性出血征象[9],因此将其推广应用有重要意义。
HIE患儿大脑缺氧、缺血发生后,神经细胞代谢出现异常,无糖氧酵解加速而乳酸堆积,其细胞膜与脑血管壁通透性获得提升,水电解质调节紊乱,导致广泛性脑水肿,继发颅内压增高与脑室受压变窄,T2WI下可出现点状高信号,尤其FLAIR序列下更为明显[10]。相关研究表明,HIE引起的血管通透性改变可导致血液外渗,进而引起脑实质与蛛网膜下腔出血,但少量出血容易被脑脊液稀释,异常信号可能受到掩盖[11],借助T2WI FLAIR能抑制水信号判别脑室旁室管膜下、小脑与皮层出血情况。本研究结果显示,良好组低场强MRI影像学评分各项目及总分均明显低于不良组,提示低场强MRI能通过半定量评分有效预测HIE患儿病情进展,临床应用效果与中高场强MRI平扫技术接近,有一定临床普及意义。研究中还观察到T2WI FLAIR下脑脊液呈现出非常规的高信号特征,可辨认为脑脊液搏动所产生的伪影,猜测是反转脉冲早期,流动脑脊液在扫描层面中,未接收到激励信号所致,而其脑脊液流速越快则信号越高,预备在往后的研究中可通过调整参数实现流动补偿来对其伪影进行优化。缪文捷[12]认为,小儿低场强MRI检查对操作人员技术娴熟要求更为严格,摆位动作需轻柔温和,预先启动设备并调试扫描程序,在不影响图像质量的前提下尽量缩减扫描次数与扫描视野,一次性检查以减轻患儿所受痛苦;其次也应尽量减少触觉、听觉刺激,必要时予以毛毯保暖、棉球塞耳等干预措施并邀请家长陪伴,确保患儿安静且顺利完成检查。
综上所述,不同预后HIE患儿在低场强MRI下影像学表现与评分差异性显著,临床早期检查有利于尽早诊断与评估病情,以期不断改善患儿预后,在基层医院有较大应用潜力。

