局部亚低温联合丁苯酞注射液治疗对急性脑梗死患者细胞凋亡及斑块稳定性的影响
邹蔷薇,王惠婕,何欣,陈敏
急性脑梗死(acute cerebral infarction, ACI)系神经内科常见病,多发于中老年群体,是指因脑组织的局部血液循环突然出现障碍而导致相应部位供血、供氧不足或缺乏,可诱发不同程度的神经功能缺损症状,且该病病情危重,通常呈进行性加重,具极高的致残、致死率,甚至危及生命[1]。ACI发病机制十分复杂,研究认为主要是血管粥样硬化和血栓形成所致,与脂质代谢、炎性反应、细胞凋亡及氧化应激等均密切相关。丁苯酞是我国自主研发的一类新药,其有效成分为消旋体1,3正丁基苯酚,可通过阻断脑损伤进程中的多个病理环节来改善脑局部血流量,以达到改善能量代谢、减少脑超氧阴离子自由基生成、抑制炎性因子表达等功效,具有较强的神经保护作用[2]。近年来,诸多文献证实亚低温疗法对外伤性及缺血性脑损伤具显著保护作用[3-4],其不仅能抑制再灌流时氧自由基的生成,亦可防止脑细胞出现凋亡,从而避免脑细胞进一步受损。但目前临床中局部亚低温联合丁苯酞治疗ACI的研究鲜见报道,为此笔者观察二者联用对神经细胞凋亡、斑块稳定性的影响,以期为ACI的临床治疗奠定实践基础,报道如下。
1 资料与方法
1.1 临床资料 收集2016年2月—2018年12月沈阳市红十字会医院神经内科治疗ACI患者104例的临床资料,随机数字表法分为2组,各52例。对照组男28例,女24例;年龄39~75 (57.40±13.68)岁;发病至入组时间0.7~4.8 (3.21±0.78)h;美国国立卫生研究院卒中量表(NIHSS)评分9~21 (15.83±5.91)分;合并症:高血压32例,糖尿病20例。观察组男30例,女22例;年龄38~75 (54.43±12.70)岁;发病至入组时间0.8~4.9 (3.17±0.82)h; NIHSS评分10~22 (15.92±5.87)分;合并症:高血压30例,糖尿病22例。2组临床资料比较差异无统计学意义 (P>0.05),具有可比性。本研究经医院伦理委员会审批通过,患者或家属知情同意并签署知情同意书。
1.2 选择标准 (1)诊断标准:所有参与患者均符合“中国急性缺血性脑卒中诊治指南(2014版)”[5]中关于ACI的诊断标准,且并经头颅CT或MR定位病灶确诊。(2)纳入标准[3]:①发病至入组时间<5 h;②近6个月内无大手术或脑血管意外史者;③TOAST分型为小动脉闭塞性卒中或大动脉粥样硬化性卒中;④入组前3个月未接受过抗凝、溶栓等药物治疗者。(3)排除标准:①合并脑部肿瘤、脑血管畸形等其他中枢神经系统疾病;②具有原发性免疫缺陷疾病者,或休克、恶性心律失常者;③合并血液系统疾病或心、肝、肾等严重器质性疾病;④伴有凝血功能障碍或有出血倾向者;⑤治疗期间接受其他方案治疗者。
1.3 治疗方法 入组后2组均予控制血压、营养支持、改善循环等常规治疗,同时予拜阿司匹林(拜耳医药保健有限公司生产)口服,起始剂量 300 mg/d,随后口服100 mg/d;阿托伐他汀钙片(辉瑞制药有限公司生产),20 mg/d,1次/d。在此基础上,观察组予局部亚低温联合丁苯酞治疗,具体如下:(1)采用HGT-200亚低温治疗仪(珠海和佳医疗设备股份有限公司生产),头部予以降温帽包裹,水温控制在6~12 ℃,使脑部温度维持在33~34 ℃。治疗过程中密切检测生命体征及电解质情况,待颅内压降至正常并维持24 h后开始复温,每4~6 h复温1℃。(2)丁苯酞注射液(石药集团恩必普药业有限公司生产) 25 ml加入0.9%NaCl注射液250 ml中静脉滴注,2次/d。2组治疗时间均为14 d。
1.4 观察指标与方法
1.4.1 临床疗效评估: 根据治疗后NIHSS评分的改善率进行疗效评估,改善率=(治疗前评分-治疗后评分)/治疗前评分×100%。以评分减少≥90%为治愈;评分减少45%~89%为显效;评分减少19%~44%为有效;评分减少18%或增加19%以内为无效。以(治愈+显效+有效)/总例数×100%计算临床总有效率。
1.4.2 ADL及NIHSS评分: 采用日常生活活动(ADL)评分测评生活质量,主要包括基本或躯体的日常生活活动能力和工具性日常生活活动能力,分值范围在0~100分,得分越高表明生活质量越高;采用NIHSS评分测评患者的神经缺损情况,分值范围在0~42分,分值越高则说明神经受损越严重。
1.4.3 IMT及斑块面积检测: 应用颈动脉彩色超声仪(深圳迈瑞生物医疗电子股份有限公司生产)检测颈动脉内膜中层厚度(IMT)及颈动脉斑块面积。
1.4.4 血清细胞因子检测: 分别于治疗前后晨起抽取患者空腹外周静脉血5 ml,低速离心后留取上层血清,采用酶联免疫吸附试验法进行测定。(1)斑块稳定性指标,血清基质金属蛋白酶-2(MMP-2)、凝集素样氧化低密度脂蛋白受体-1(Lox-1)、组织蛋白酶K(Cat K);(2)凋亡相关分子,细胞淋巴瘤-2蛋白(Bcl-2)、可溶性凋亡相关因子(sFas)、可溶性凋亡相关因子配体(sFasL)等含量。
1.4.5 记录不良反应: 治疗期间,记录患者因药物、亚低温疗法所引起的不良反应。
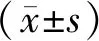
2 结 果
2.1 2组临床疗效比较 治疗14 d后,观察组总有效率为92.31%,高于对照组的76.92%,差异有统计学意义(P<0.05),见表1。
2.2 2组NHISS、ADL评分比较 治疗前2组NHISS、ADL评分比较差异无统计学意义(P>0.05);治疗14 d后2组ADL评分均上升、NHISS评分均降低,且观察组较对照组变化幅度更明显(P<0.01),见表2。
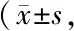
表2 2组患者NHISS、ADL评分比较分)
2.3 2组IMT、颈动脉斑块面积比较 治疗前2组IMT、颈动脉斑块面积比较差异均无统计学意义(P>0.05);治疗后14 d后2组IMT、颈动脉斑块面积均降低,且观察组较对照组降低更明显(P<0.01),见表3。
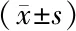
表3 2组患者IMT、颈动脉斑块面积比较
2.4 2组斑块稳定性指标比较 治疗前2组MMP-2、Lox-1、Cat K比较差异无统计学意义(P>0.05);治疗14 d后2组MMP-2、Lox-1、Cat K均呈下降趋势,且观察组较对照组降低更明显 (P<0.01),见表4。
2.5 2组凋亡相关分子比较 治疗前2组Bcl-2、sFas、sFasL比较差异无统计学意义 (P>0.05);治疗14 d后2组sFas、sFasL均降低、Bcl-2均增高,且观察组变化幅度较对照组更明显 (P<0.01),见表5。

表1 2组患者临床疗效比较 [例(%)]
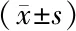
表4 2组患者斑块稳定性指标比较
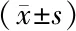
表5 2组患者凋亡相关分子比较
2.6 2组不良反应发生情况比较 治疗期间2组均无病死与脱失病例,且未见过敏、肝肾功能损害等明显不良反应。其中观察组出现轻微寒颤4例(7.69%),予以对症处理后症状消失。2组不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨 论
ACI是由于供应脑部血液的动脉粥样硬化、血栓或栓子堵塞,使得其血流突然大幅减少或被阻断,导致相应支配区域的脑组织软化及坏死,临床多表现为急性头痛、眩晕,并出现吞咽困难、言语不清等情况,严重者在短时间内即陷入昏迷。由此可见,动脉粥样硬化是发生急性脑血管病的主要诱因,故而逆转硬化斑块、改善血管通畅是治疗ACI的关键[6-7]。基于此,本研究通过亚低温联合丁苯酞治疗ACI,结果显示,患者脑损伤程度有所减轻,神经功能及生活质量改善,且动脉粥样硬化斑块稳定性增强,疗效肯定,这与胡晓等[8]研究结果相似。分析原因[9-10]:丁苯酞能够通过维护内皮平衡、调节脂质代谢、抑制氧化应激反应、改善血管壁周围炎性状态等多种机制保护动脉内膜,延缓动脉粥样硬化的进展。亚低温拥有抑制体内炎性反应、阻滞氧自由基释放、保护血脑屏障、改善脑组织内环境等诸多功效,可在一定程度上抑制血栓形成及动脉粥样硬化斑块破裂。两者作用机制是多靶点的,且可能发挥协同、增敏作用,增强神经保护及稳定动脉粥样硬化斑块的效果,进而达到治疗目的[11]。
Cat K是另一类蛋白酶分子,主要存在于纤维帽的平滑肌细胞、巨噬细胞中,其不仅可降解斑块纤维帽中的多种成分并降低斑块稳定性,亦能够造成颈动脉内膜中层增厚、粥样斑块形成,形成恶性循环[12]。MMP-2是基质金属蛋白酶家族的重要成员,该物质以酶原的形式从胞内分泌到胞外,经一系列蛋白酶级联反应而激活,可特异性地降解斑块中纤维骨架胶原,故其浓度与动脉内径的狭窄程度呈正相关[13]。Lox-1为近年来新发现的血小板激活剂,可与粥样斑块局部泡沫细胞内富含的Ox-LDL相结合,加速斑块形成并增加其不稳定性,致使脑血管事件发生,加重病情[14]。本研究比较2组血清中斑块稳定性指标含量的差异,发现局部亚低温联合丁苯酞治疗可有效增强粥样斑块稳定性,这是其阻止患者病情进展的直观证据。神经细胞凋亡时胞内大量分泌凋亡分子,并透过包膜进入循环血,故量化其表达量可以直观评估脑损伤严重程度、预估临床结局[15-16]。Bcl-2、sFas、sFasL均为最典型的凋亡分子,其中Fas系统是细胞凋亡调控信号途径的重要组成成分,Fas/FasL途径的激活可直接加速脑组织缺血、神经细胞凋亡,有利于疾病转归[17]。作为一种抗凋亡分子,Bcl-2的表达量与靶细胞存活及其对细胞毒素的抵抗性密切相关[18]。本结果表明局部亚低温联合丁苯酞治疗可抑制神经细胞凋亡、增强神经细胞的抗毒素能力,考虑原因可能为丁苯酞可通过抑制谷氨酸的释放并提高抗氧化酶的活性,来抑制细胞凋亡,同时亚低温亦能够促进神经元泛素合成及恢复细胞间信号传导,以改善细胞能量代谢,从而抑制神经元凋亡与坏死,两者可通过不同作用机制增强其抑制神经细胞凋亡能力。此外,本研究亦对104例ACI患者进行了治疗安全性分析,发现2组治疗期间均未出现严重不良反应,且在不排除阿托伐他汀钙、拜阿司匹林产生不良反应的情况下,观察组仅出现4例轻微寒颤,且经对症处理后症状消失,这一结果也与徐敉等[19]的研究结果相一致。
综上所述,局部亚低温联合丁苯酞治疗ACI疗效确切,可有效稳定动脉粥样硬化斑块,并在一定程度上抑制神经细胞凋亡,有利于患者神经功能恢复及预后质量的优化。但由于本研究仅进行了短期观察,对结果可信度造成一定影响,此为不足之处,有待长期、大样本研究加以证实。
利益冲突:无
作者贡献声明
邹蔷薇:设计研究方案,实施研究过程,论文撰写;王慧婕:提出研究思路,分析试验数据,论文审核;何欣:实施研究过程,资料搜集整理,论文修改;陈敏:进行统计学分析

