羟基喜树碱联合人类细胞因子诱导的杀伤细胞对肝癌细胞增殖的抑制作用研究
马庆庆 (贵州航天医院中心实验室,贵州 遵义 563000)
肝细胞癌作为全球第六大常见癌症和我国最常见的恶性肿瘤之一,早期诊断困难且临床病程短、疾病进展迅速,临床治疗方式主要为手术切除。但因确诊延迟致使多数患者丧失手术时机,中位生存期仅3~6个月,病死率较高[1]。10-羟基喜树碱(10-Hydroxycamptothecin,HCTP)是从珙桐科植物喜树中提取纯化的一萜烯生物碱类化合物,属于细胞S期特异性抗肿瘤药物,能通过有效抑制DNA拓扑异构酶-I ( TopoisomeraseⅠDNA,Topo-I-DNA) 的合成抑制癌细胞增殖,进而延缓肿瘤细胞生长,具有较强的抗癌活性[2]。细胞因子诱导的杀伤细胞(cytokine - induced killer ,CIK) 是一类兼具T淋巴细胞(T-lymphocyte,T cells)和自然杀伤细胞(natural killer cell,NK- cell)双重功能的杀瘤细胞[3], 不仅有针对肿瘤细胞的特异性杀伤,且对正常细胞的细胞毒性作用小。CIK细胞可通过白细胞介素-2(Interleukin-2,IL-2)和CD3单克隆抗体等细胞因子共同刺激患者外周血单个核细胞体外培养制备, 包括CD3+CD8+细胞、CD3+CD56+细胞和NK细胞[4]。日本的临床试验报道,CIK细胞免疫疗法降低了肿瘤切除术后的复发率[5]。本研究旨在评估体外CIK细胞和HCPT联合作用对人肝癌BEL-7402细胞株的协同效应。
1 资料与方法
1.1一般资料:HCPT购自Sigma公司,原药以二甲基亚砜(Dimethyl sulfoxide,DMSO)溶解并配成80 mmol/L贮存液, 每管1.0 mL分装后-20℃贮存备用; Ficoll人类淋巴细胞分离液购自天津灏洋生物制品科技有限公司; RPMI-1640培养液购自美国Gibco公司;γ-干扰素(Interferon-γ,IFN-γ)购自华大基因生物技术有限公司;CD3单克隆抗体购自美国Sigma公司;基因重组人IL-2、白细胞介素-1α(Interleukin-1α,IL-lα)购自美国Peprotech公司; AnnexinV -FITC 和PI试剂购自德国Miltenyi公司;人肝癌BEL-7402细胞购自中国科学院上海生命科学研究院细胞资源中心。
1.2方法
1.2.1CIK细胞制备:在取得健康志愿者知情同意的前提下采集外周新鲜血液50 ml,应用Ficoll密度梯度离心法分离外周血单个核细胞(Peripheral blood mononuclear cell,PBMC),将分离池的PBMC置于含10%胎牛血清的 RPMI-1640培养基中洗涤2次,获得纯度在90%以上的PBMC。将PBMC按1×106/ml的浓度悬浮于HL-1TM含10%胎牛血清的 RPMI-1640培养基中,加入INF-γ(1 000 U/ml),在5% CO2、37 ℃下培养24 h后加入CD3单抗(50 ng/ml)、IL-2(300 U/ml)、IL-lα(100 U/mL)。每3天半量换液一次,并补加IL-2(300 U/ml),在培养第7天和第14天,显微镜观察并计数细胞量和活力(活细胞应>80%),动态观察CIK细胞增殖情况[6]。
1.2.2流式细胞术鉴定CIK细胞免疫表型:收集培养至第14天的成熟CIK细胞,用含异硫氰酸荧光素的CD3抗体[3',6'-dihydroxy-5-isothiocyanato-3H-spiro(isobenzofuran-1,9'-xanthen)-3-one CD3 antibody,anti-CD3-FITC], anti- CD4-FITC,anti- CD8-PE,anti-CD56-PC5抗体标记,利用流式细胞术检测细胞表面CD3、CD8、CD56等分子的表达[7],并以健康志愿者新分离的PBMC作为对照。实验重复三次以减少误差。
1.2.3人肝癌BEL-7402细胞制备:将人肝癌BEL-7402细胞复苏株后常规培养于含10%胎牛血清的 RPMI-1640培养液中,37℃、5% CO2培养箱中培养3 d左右达细胞对数生长期后收集备用。
1.2.4HCPT的配制:用生理盐水溶解HCPT晶体并稀释其浓度为1 g/L贮存液, 每管1.0 ml分装后 -20℃保存, 使用时取出并用二甲基亚砜(Dimethyl sulfoxide,DMSO)稀释至所需浓度。
1.2.5MTT法检测HCPT对BEL-7402细胞增殖的抑制:取对数生长期的BEL-7402细胞,调整细胞浓度为1×106个/ml后接种于96孔板中, 5% CO2,37°C孵箱中培养24 h,待细胞贴壁后加入终浓度(共9个浓度)分别为0.031、0.063、0.125、0.25、0.5、1、2、4和8 mg/L的HCPT 溶液[8];同时设BEL-7402 空白对照,每个浓度重复3孔。分别培养至24 h、48 h、72 h三个时间点后每孔加入5 mg/L MTT溶液20 μl,继续孵育4 h后加入DMSO终止培养,酶标仪570 nm波长处检测各孔吸光度(absorbance,A值)。
1.2.6MTT法检测CIK细胞对肝癌细胞的杀伤活性:取对数生长期的BEL-7402细胞,调整细胞浓度为1×106个/ml后接种于96孔板中, 5% CO2,37 ℃孵箱中培养24 h,待细胞贴壁后加入CIK细胞,按效靶比[9](Effective target ratio,E∶T) 5∶1、10∶1、20∶1、30∶1、40∶1五种比例接种于对应的96孔板中;同时设BEL-7402细胞对照孔,每个浓度重复3孔。分别培养至24 h、48 h、72h三个时间点后每孔加入5 mg/L MTT溶液20 μl,继续孵育4 h后加入DMSO终止培养,酶标仪570 nm波长处检测各孔A值。
1.2.7MTT法检测CIK细胞和HCPT联合应用对BEL-7402细胞的杀伤活性:取对数生长期的BEL-7402细胞,调整细胞浓度为1×106个/ml后接种于96孔板中, 5% CO2,37 ℃孵箱中培养24 h,待细胞贴壁后加入含HCPT(前文中确定的HCPT最佳作用浓度)的DMSO溶液和CIK细胞(前文中确定的最佳CIK细胞E∶T 比例);同时设BEL-7402细胞对照孔,每个浓度重复3孔。对照组(仅10%胎牛血清的 RPMI-1640培养液)、HCPT组(含HCPT 0.5 mg/L )、CIK组(E∶T=20∶1)、协同组(HCPT 0.5 mg/L +CIK E:T=20∶1)5% CO2,37 ℃孵箱中培养24、48、72 h后,PBS洗涤两次,重悬细胞,使其浓度为1×106/ml。加入DMSO终止培养,酶标仪570 nm波长处检测各孔A值。
2 结果
2.1CIK细胞观察:CIK细胞培养至第7天和第14天,计数细胞量和活力(活细胞应>80%),动态观察CIK细胞增殖情况,见图1。

A图为培养培养7 d后的CIK 细胞形态,B图为培养14 d后CIK 细胞形态
2.2流式细胞术鉴定CIK细胞免疫表型:本研究采用含10%胎牛血清的 RPMI-1640培养基用于CIK细胞增殖,效果优于无血清培养基。收集培养至第14天的成熟CIK细胞,以健康志愿者新分离的PBMC为对照,利用流式细胞术检测细胞表面CD3、CD8、CD56等分子的表达,结果显示CD3+CD56+细胞比例可达23%。见图2。
2.3HCPT对BEL-7402细胞增殖的抑制:通过MTT法检测不同浓度HCPT对BEL-7402细胞增殖的抑制,酶标仪570 nm波长处检测各孔A值(以mean±SD表示),计算增殖抑制率[10]。增殖抑制率=[(1-实验组A值)/对照组A值]×100% 。确定了本实验HCPT的最佳作用浓度为0.5 mg/L。详见表1和图3。
2.4CIK细胞对肝癌细胞的杀伤活性:通过MTT法检测CIK细胞不同E∶T对BEL-7402细胞增殖的抑制,酶标仪570 nm波长处检测各孔A值(以mean±SD表示),计算增殖抑制率[10]。增殖抑制率=[(1-实验组A值)/对照组A值]×100% 。确定了本实验CIK细胞的最佳E∶T为和20∶l,详见表2和图4。

左图为培养14 d后CIK细胞表达CD3+CD8+的流式细胞图,右图为培养14 d后CIK细胞表达CD3+CD56+的流式细胞图
表1 不同浓度HCPT对BEL-7402细胞的作用[A值,mean±SD]

HCTP(mg/L)24 h48 h72 hControl0.641±0.0380.780±0.0351.069±0.0360.0310.620±0.0350.759±0.0361.042±0.0380.0630.611±0.0370.732±0.0331.018±0.0340.1250.592±0.0340.701±0.0340.853±0.0350.2500.523±0.0310.615±0.0320.688±0.0320.5000.466±0.0360.524±0.0330.554±0.0341.0000.341±0.0320.441±0.0310.491±0.0312.0000.349±0.0310.340±0.0320.470±0.0324.0000.337±0.0340.382±0.0330.448±0.0358.0000.322±0.0370.379±0.0320.406±0.033

图3 不同浓度HTCP对BEL-7402细胞增殖抑制率的影响
2.5CIK细胞和HCPT的联合应用对BEL-7402细胞的杀伤活性:收集HCPT组(含HCPT 0.5 mg/L)、CIK细胞组(E∶T=20∶1)、HCPT + CIK细胞组(HCPT0.5 mg/L +CIK细胞E∶T=20∶1)处理24 h、48 h、72 h后的BEL-7402细胞,PBS洗涤两次后重悬细胞至浓度为1×106/ml,加入DMSO终止培养,酶标仪570 nm波长处检测各孔A值。结果显示,HCPT + CIK细胞组对肝癌BEL-7402细胞的杀伤作用明显,较单用HCPT组或单用CIK细胞组具有显著优势(P<0.001)。详见表3。


E∶T24 h48 h72 hControl0.638±0.0460.776±0.0451.064±0.0435∶10.462±0.0450.518±0.0430.551±0.04410∶10.347±0.0430.439±0.0420.489±0.04120∶10.332±0.0410.337±0.0410.428±0.04230∶10.349±0.0440.373±0.0440.446±0.04340∶10.351±0.0430.366±0.0420.451±0.041

图4 不同浓度效靶比CIK细胞对BEL-7402细胞增值抑制率的影响
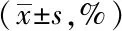

组别孔数药物作用时间24 h48 h72 hHCTP组1220.36±0.8928.91±1.5739.24±2.96CIK细胞组1221.73±0.7530.34±1.2841.67±2.81HCPT+CIK细胞组1235.04±0.9148.95±1.7456.36±2.48P值<0.001<0.001<0.001
3 讨论
HCPT可与Topo-I-DNA结合形成复合物,在 DNA 在大量复制活跃的S期, Topo Ⅰ剪切 DNA 双链,形成TopoⅠ-DNA的可裂解复合物。通过阻断DNA重构使双链DNA断裂,并在机体多种蛋白的协同作用下导致癌细胞凋亡,对多种恶性肿瘤疗效确切[11]。CIK细胞通过强大的细胞毒性作用,可通过直接杀伤、诱导凋亡和坏死等效应抑制肿瘤细胞生长,是当前临床上最广泛且常用的过继性细胞免疫治疗。研究表明,CIK细胞免疫辅助治疗能显著改善早期肝癌患者的预后,提高免疫治疗疗效的机制与其的细胞群组成密切相关[12]。
本研究通过采集健康志愿者外周新鲜血液,培养诱导成熟的 CIK细胞,在体外与肝癌BEL-7402 细胞共同培养,同时联合HCPT研究对肝癌BEL-7402 细胞的凋亡作用,其机制[13]主要为CD3+CD56+细胞有效地杀瘤作用和HCPT阻断通过Topo-I-DNA而发挥的至癌细胞凋亡的协同作用,通过MTT法选定HCPT的最佳浓度为0.5 mg/L,CIK细胞的最佳效靶比为20∶1。研究发现[14],HCPT联合CIK细胞对肝癌BEL-7402细胞的作用中,自身免疫环境发生变化,联合作用与单独作用相比具有协同效应,结果提示HCPT联合CIK细胞对肝癌BEL-7402细胞的抑制作用强于单用HCPT或CIK细胞治疗,差异有统计学意义(P<0.05),且存在着时间和剂量的依赖[15]。
综上所述,HCPT联合CIK细胞对肝癌BEL-7402细胞具有良好的抑制增殖和诱导凋亡作用,有望给临床治疗提供支撑。

