膀胱癌相关转录物1在胃癌组织中的表达及其对胃癌细胞增殖和自噬水平的影响
王甲南,崔大炜,吴曰清,陈建禄,李欣谕,金宏远,杨清波
[1. 遵义医科大学第五附属(珠海)医院普通外科,广东 珠海 519100;2.中国医科大学附属第四医院普通外科,辽宁 沈阳 110032]
胃癌是目前全球第5大常见恶性肿瘤,每年约有72.3万人死于胃癌[1]。早期胃癌切除术后患者5 a生存率为90%,晚期患者5 a生存率接近10%[2]。进展期胃癌一般采用手术和(或)化疗治疗,但复发和转移很常见[3-4]。疾病的诊断较晚和表现各异,加上普遍缺乏有效的治疗方法来对抗疾病的异质性,是造成高死亡率的主要原因[5]。虽然手术是胃癌的标准治疗方法,但早期发现、诊断和治疗是能够降低死亡率的唯一途径[6]。通过胃癌筛查可以降低胃癌特异性死亡率,提高胃癌患者的生存率[7]。因此,可靠的生物标志物对于简单、快速的癌症诊断以及可靠、广泛适用的治疗方案的选择具有重要意义。
长链非编码RNA(long non-coding RNA, lncRNA)目前被定义为长度超过200个核苷酸的一种非编码RNA,在人类正常和疾病状态中具有重要的调节作用[8]。许多lncRNA在胃癌中表达失调,与肿瘤发生、转移、预后或诊断密切相关,在胃癌的诊断和预后中显示出潜在的生物标志物作用[9]。自发现膀胱癌相关转录物1(bladder cancer associated transcript-1,BLACAT1)在膀胱癌组织中高度上调以来[10],lncRNA BLACAT1在多种实体瘤患者组织和血浆中也被发现显著上调[11-12]。BLACAT1上调驱动胃癌细胞的特性,影响肿瘤细胞的增殖、凋亡等[13]。然而,关于胃癌组织中BLACAT1与自噬的关系尚不清楚,BLACAT1在人胃癌组织和细胞系中的表达模式、生物学作用以及在胃癌进展中的潜在机制仍有待研究。本研究通过检测BLACAT1在人胃癌组织和细胞系中的表达情况,探讨其对胃癌细胞的增殖和自噬水平的影响以及对自噬调控的潜在机制,以探究胃癌治疗的新靶点。
1 资料与方法
1.1 胃癌标本收集收集2017年8月至2018年9月期间在遵义医学院第五附属医院进行手术切除并经病理检查确诊为胃癌的标本53例,均为原发病灶,并经2名病理科医师证实,离体后放入液氮中保存。全部患者术前未行放、化疗。本研究经医院伦理委员会批准,在患者签署知情同意书后进行。
1.2 主要试剂Trizol试剂购自美国Invitrogen公司;人正常胃上皮黏膜细胞系GES-1,胃癌细胞系SGC-7901、MGC-803、BGC-823均购自美国标准菌库;RPMI-1640培养基购自美国HyClone公司;体积分数10%胎牛血清购自美国Gibco公司;Trizol试剂购买自美国Invitrogen公司;cDNA试剂盒Prime Script RT kit购买自日本TaKaRa公司;RIPA裂解液购自上海碧云天公司;siRNA均购自上海吉玛公司;Lip2000购自美国Invitrogen公司。
1.3 方法
1.3.1 细胞培养与转染 GES-1、SGC-7901、MGC-803、BGC-823细胞系均在含体积分数10%胎牛血清和100 u/mL青霉素钠RPMI-1640培养基中培养,环境为含体积分数5% CO2的37 ℃湿润环境。靶向BLACAT1的小干扰RNA(small interference RNA, siRNA),包括si-BLACAT1、si-control和si-ATG3、si-NC由上海吉玛公司合成。si-BLACAT1序列如下:5’-GAATTAGAAGCGAGGGGTT-3’。BLACAT1过表达质粒购自上海吉玛公司,选用pcDNA3.1空白载体作为阴性对照。分别设立BLACAT1干扰组(si-BLACAT1)和阴性转染组(si-control),BLACAT1过表达组(pcDNA3.1- BLACAT1)和对照组(pcDNA3.1),ATG3干扰组(si-ATG3)和阴性转染组(si-NC)。
将SGC-7901、BGC-823细胞按每孔5×105个种于6孔板中,待细胞达到90%融合时,通过Lipofectamine 2000仪器,分别用si-BLACAT1和si-control、pcDNA3.1- BLACAT1和pcDNA3.1、si-ATG3和si-NC转染细胞。48 h后收获细胞用于实时定量PCR检测,72 h后用于Western blot检测。
1.3.2 实时定量PCR 采用Trizol试剂从胃癌细胞系和组织中提取总RNA。利用Prime Script RT kit合成cDNA。采用美国Invitrogen公司合成实时定量PCR引物,BLACAT1序列为:正向:5’-TGACGTCTTACTACACCCATCCT-3’,反向:5’-CTGCCACCTATAGGAAATGCG-3’。β-actin作为内部参照,以下引物序列被用来放大β-actin,正向:5’-CTACAATGAGCTGCGTGTGG-3’和反向:5’-AAGGAAGGCTGGAAGAGTGC-3’。对每个样本进行3次PCR扩增,并用2-ΔΔCT法计算并标准化BLACAT1表达。
1.3.3 免疫荧光试验 使用质量分数4%多聚甲醛固定胃癌细胞,然后用质量分数0.1% Triton x-100 处理细胞15 min。将稳定表达的胃癌细胞接种于细胞孔,待细胞贴壁且生长到70%左右分别加入si-BLACAT1和si-control、pcDNA3.1-BLACAT1和pcDNA3.1,再放入培养箱培养。后加入一抗、二抗,滴加DAPI复染核,在激光扫描显微镜下观察LC3发光情况。
1.3.4 Western blot 收集胃癌细胞,用RIPA裂解缓冲液裂解。提取等量的蛋白质(30 μg)经SDS-PAGE电泳分离, 然后转移到聚偏二氟乙烯膜。在含质量分数0.05% Tween-20的Tris缓冲液中,用体积分数5%脱脂牛奶封闭膜,然后与LC3Ⅰ、LC3Ⅱ、ATG3特异性抗体封闭过夜(15 000;美国Cell Signaling Technology公司)。后在37 ℃条件下与山羊、兔抗体IgG孵育(11 000) 2 h, 结合蛋白的可视化使用ECL和Bio-Imaging System检测。蛋白水平标准化用β-actin (110 000)。
1.3.5 CCK-8 法测定胃癌细胞增殖能力 取对数生长期的胃癌细胞接种于96孔板中(5×103个/孔),分别于24、48、72、96 h 后终止培养,加入质量分数10% CCK-8培养基,置于培养箱中孵育3 h。最后用酶标仪测定450 nm波长处的吸光度值(OD450)。
2 结果
2.1 BLACAT1在胃癌组织和细胞系中的表达胃癌组织中的BLACAT1的表达水平高于癌旁组织,差异有统计学意义(P<0.05,图1)。实时定量PCR用于分析GES-1、SGC-7901、MGC-803、BGC-823细胞系中BLACAT1表达。结果表明,各胃癌细胞系中BLACAT1表达高于正常胃细胞系,其中胃癌细胞系SGC-7901、BGC-823的BLACAT1表达水平相对较高,用于后续实验(P均<0.05,图1)。
2.2 敲除BLACAT1抑制胃癌细胞的增殖与si-control相比,si-BLACAT1质粒的敲除后BLACAT1降低率分别为70%与64%,差异均有统计学意义(P均<0.05,图2)。CCK-8用于检测敲除BLACAT1后对胃癌细胞系SGC-7901、BGC-823增殖能力影响。结果显示,敲除BLACAT1后胃癌细胞的增殖能力较si-control显著降低,差异有统计学意义(P<0.05,图3)。
2.3 敲除BLACAT1抑制胃癌细胞自噬与si-control相比,si-BLACAT1自噬标志蛋白LC3Ⅱ/LC3Ⅰ比例明显降低,表明细胞自噬水平受到抑制(图4)。免疫荧光实验用于进一步研究敲除BLACAT1对自噬水平影响,可见LC3荧光斑点在si-BLACAT1组中降低,即敲除BLACAT1能够抑制胃癌细胞的自噬水平(图5)。
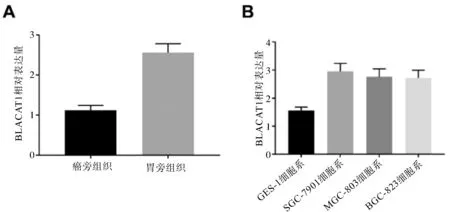
图1 lncRNA BLACAT1在胃癌组织(A)和细胞系(B)中的表达
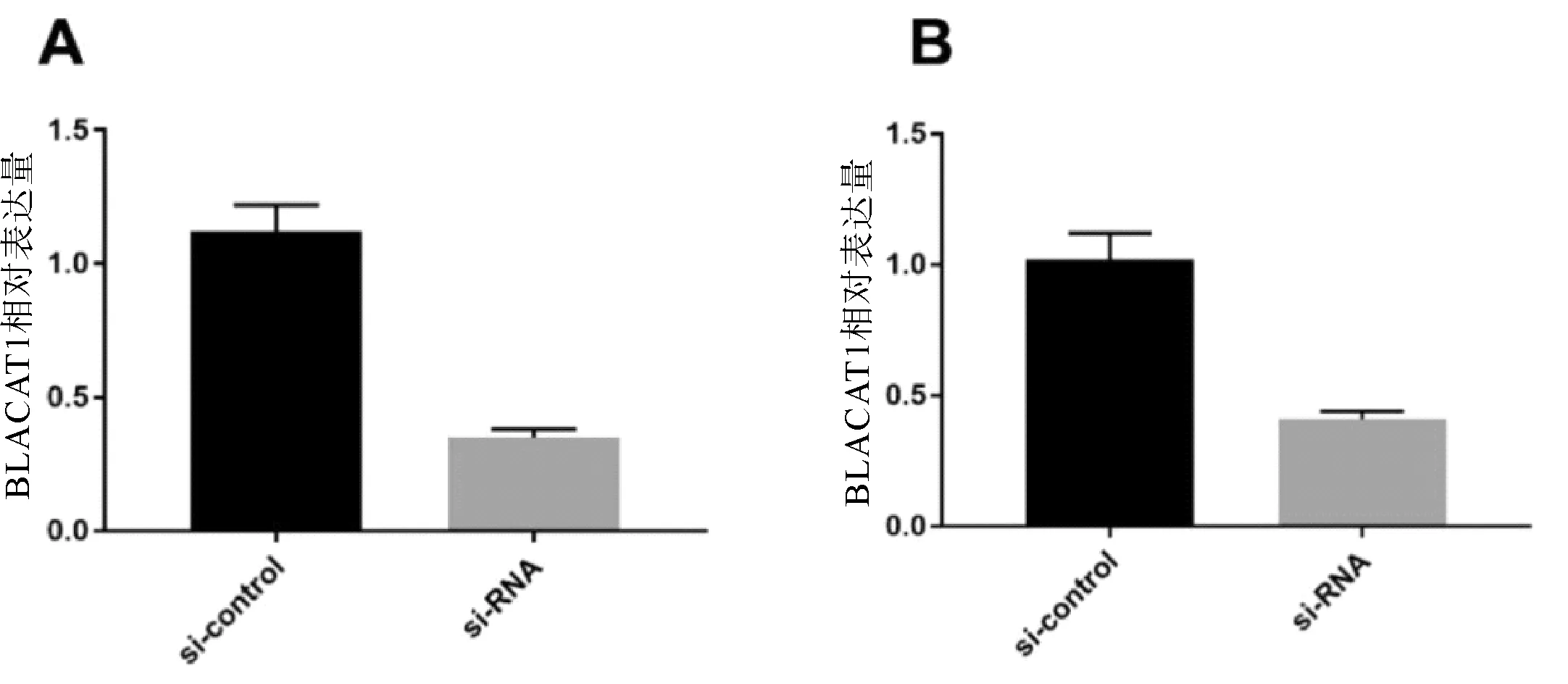
图2 敲除BLACAT1对SGC-7901(A)、BGC-823(B)细胞系增殖的影响
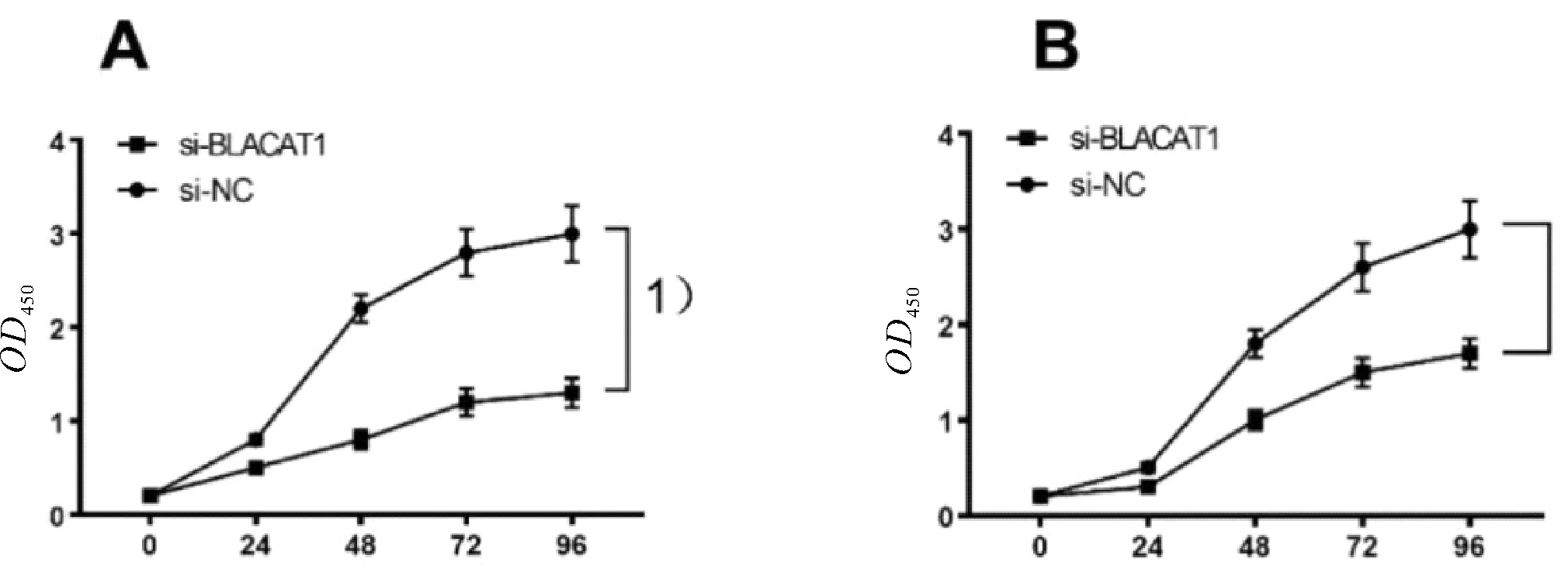
图3 敲除BLACAT1对SGC-7901(A)、BGC-823(B)细胞系增殖的影响
2.4 敲除BLACAT1抑制自噬相关蛋白ATG3的表达与si-control相比,敲除BLACAT1降低ATG3蛋白表达水平,即si-BLACAT1能够上调SGC-7901、BGC-823细胞系中ATG3的表达(图6)。
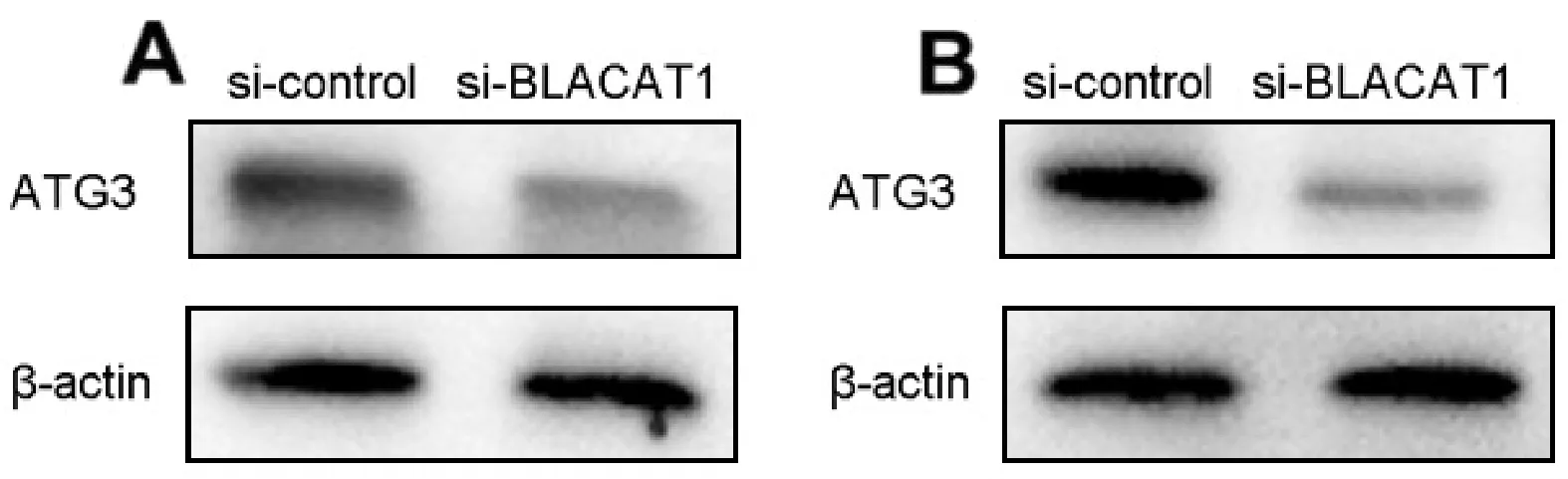
图6 敲除BLACAT1对SGC-7901(A)、BGC-823(B)细胞系自噬相关蛋白ATG3表达的影响
3 讨论
LncRNA通过调节基因转录和表观遗传信号等多种复杂机制,在调控肿瘤行为中发挥重要作用[8]。然而,关于lncRNA在胃癌组织中的表达和功能的数据有限。研究表明,lncRNA BLACAT1具有促癌活性,是结直肠癌[14]、膀胱癌[10]和胃癌[15]患者的预后不良的指标。本文结果显示,lncRNA BLACAT1在胃癌组织中的表达明显高于癌旁组织。LncRNA BLACAT1的诊断和预后价值一直被关注。例如,已证实多种恶性肿瘤患者的血清和组织中lncRNA BLACAT1的表达水平均较非恶性肿瘤者显著上调,且血清lncRNA BLACAT1具有较高的诊断性能[12],这表明lncRNA BLACAT1在胃癌诊断中可能具有生物标志物的潜力。在非小细胞肺癌中,lncRNA BLACAT1表达上调,沉默lncRNA BLACAT1可在体内外抑制增殖、迁移、侵袭,诱导细胞G0/G1期阻滞,lncRNA BLACAT1促进肿瘤细胞生长发挥致癌作用[16],我们证实了这一观察结果,体外敲除lncRNA BLACAT1可抑制胃癌细胞增殖,提示lncRNA BLACAT1可能是胃癌的致癌基因。
自噬是一种细胞内溶酶体参与蛋白质和细胞器降解的途径,与人类疾病和生理联系紧密[17]。近年来越来越多研究证实自噬与肿瘤发展的密切关系[18-19]。然而,在恶性肿瘤发展过程中,自噬被证明具有双重作用。在某些情况下,自噬是一种肿瘤抑制机制,但在另一些情况下,自噬促进肿瘤发生[20-21]。我们用si-BLACAT1转染胃癌细胞,抑制自噬体形成。而敲除BLACAT1时抑制肿瘤细胞的生长,提示BLACAT1可能通过促进自噬参与肿瘤发生过程。然而,尽管本研究有相关数据,但自噬与细胞凋亡尤其是肿瘤细胞凋亡的关系。
自噬涉及多个步骤:起始、成核、伸长、形成自噬体的膜的闭合、与溶酶体的融合以及大分子前体的循环,特定的自噬相关蛋白调节每个步骤[22]。ATG3的乙酰化增强了其与含磷脂酰乙醇胺脂质体和内质网的结合,是促进ATG8/LC3-磷脂酰乙醇胺缀合物形成的关键调节分子[23]。研究[24-25]发现,多种lncRNA可以通过ATG3调控自噬水平。但ATG3在胃癌中的作用目前尚未完全清楚。本研究发现,敲除BLACAT1抑制ATG3的表达,通过共转染pcDNA3.1- BLACAT1和si-ATG3后,胃癌细胞自噬水平受到显著抑制。说明BLACAT1对自噬的调控是通过ATG3实现的。
综上所述,本研究证实lncRNA BLACAT1在胃癌中表达升高。通过细胞学实验,我们发现lncRNA BLACAT1敲除可抑制胃癌细胞增殖和自噬;并且我们发现敲除lncRNA BLACAT1能抑制自噬相关蛋白ATG3的表达。这说明lncRNA BLACAT1对胃癌细胞自噬的调控可能与ATG3有关。本研究为lncRNA BLACAT1在胃癌发生、发展中的机制研究奠定了理论基础。
——分之有“术”

