肽类合成方法研究进展
于铁妹
(深圳瑞德林生物技术有限公司,广东 深圳 518000)
酰胺键在自然界分子中是非常常见的化学键,蛋白质作为酰胺键的代表性物质,在生物体内发挥着非常重要的作用,比如酶催化、信号传递和结构组成。此外,肽类具有许多重要的生物活性,如抗菌活性和信息素活性,在医药、农业和工业上都有广泛的应用。
肽的分类较为复杂,目前尚无较为一致的分类方法,根据肽链长度可分为二肽、三肽、寡肽、多肽、蛋白质。一般说来,肽链上氨基酸数目在10个以内的叫寡肽,10~50个的叫多肽,50个以上的叫蛋白质。人们习惯上也把寡肽中的二、三肽称为小肽。由于构成肽的氨基酸种类、数目与排列顺序的不同,决定了肽纷繁复杂的结构与功能。
传统的肽类合成方法是化学法。化学合成反应高度取决于肽链序列,随着肽链的复杂性增加,方法开发和分析变得至关重要。尽管化学法合成多肽取得了长足的进展,但是在长肽链、蛋白质合成上仍然是化学领域的巨大挑战。随着基因工程、酶定向进化技术的发展,逐渐开发出化学酶法及酶法。本文将分别介绍这几种肽类合成方法并进行比较。
1 化学法
目前,化学法合成肽类仍然是生产治疗性肽的首选方法,因为它可以合成几乎任何想要的肽序列,包括非蛋白氨基酸肽。一般来说,化学多肽合成包括保护、激活、缩合和去保护几个主要步骤。目前市场上肽类产品是由从2~50个氨基酸组成。随着肽链复杂性的增加,化学合成方法的开发和分析变得至关重要。化学合成路线中主要问题包括片段的低溶解性和消旋问题。随着肽链长度的增加,杂质的种类和含量增加,杂质与最终产品的结构很相似,将大幅增加纯化难度导致最终产品成本的增加。传统的化学合成方法包括液相合成(SPS)和固相合成(SPPS),新型化学合成方法有自然化学连接法(Native chemical ligation,NCL)。
1.1 液相合成
液相合成(SPS)是第一个发展起来的肽合成方法,它既包括逐步偶联反应,也包括肽段偶联反应。液相合成有多种偶联的方法,最常用的肽段偶联方法是羰化二亚胺法[1]。耦合剂DCC用于活化N端保护的氨基酸羧酸基团,在亲核试剂的进攻下形成酰胺键。加入偶联剂,如1-羟基苯并三唑(HOBt),可防止外消旋,提高效率。液相多肽合成是一种可规模化生产的方法,主要应用于小肽(<10个氨基酸)的合成。缺点是氨基酸需要保护,每一步反应后都需要分离和纯化中间体。因此,液相合成大于 10个氨基酸的长肽,合成步骤繁琐、耗时、高成本。另外一个问题是C端氨基酸在溶液中易消旋,因此首选的偶联位置是Gly-Xxx或Pro-Xxx。此外,随着肽尺寸的增加,片段的溶解度将成为偶联的主要问题[2]。
1.2 固相合成
固相肽合成(SPPS)是由Merrifield于1963年发明。SPPS可实现自动化肽合成,彻底改变了整个化学肽合成领域。目前,SPPS是合成中小型多肽(<50个氨基酸)的首选方法,多种药物肽的合成均采用SPPS方法。SPPS是将所要合成肽链的羟末端氨基酸的羟基以共价键的形式与一个不溶性的高分子树脂相连,然后以此结合在固相载体上的氨基酸脱去保护基后作为氨基供体与过量的另一活化羧基组成形成酰胺键,实现延伸肽链。SPPS的主要步骤包括缩合洗涤去保护中和及洗涤下一轮缩合操作,直到实现所要合成的肽链长度,最后将肽链从树脂上裂解下来,经过纯化等处理,即得多肽成品,如图1所示。其中α-氨基用Boc(叔丁氧羰基)保护的称为Boc固相合成法。α-氨基用Fmoc(9-芴甲氧羰基)保护的称为Fmoc固相合成法。Fmoc固相合成法是目前工业应用普遍采用的方法。
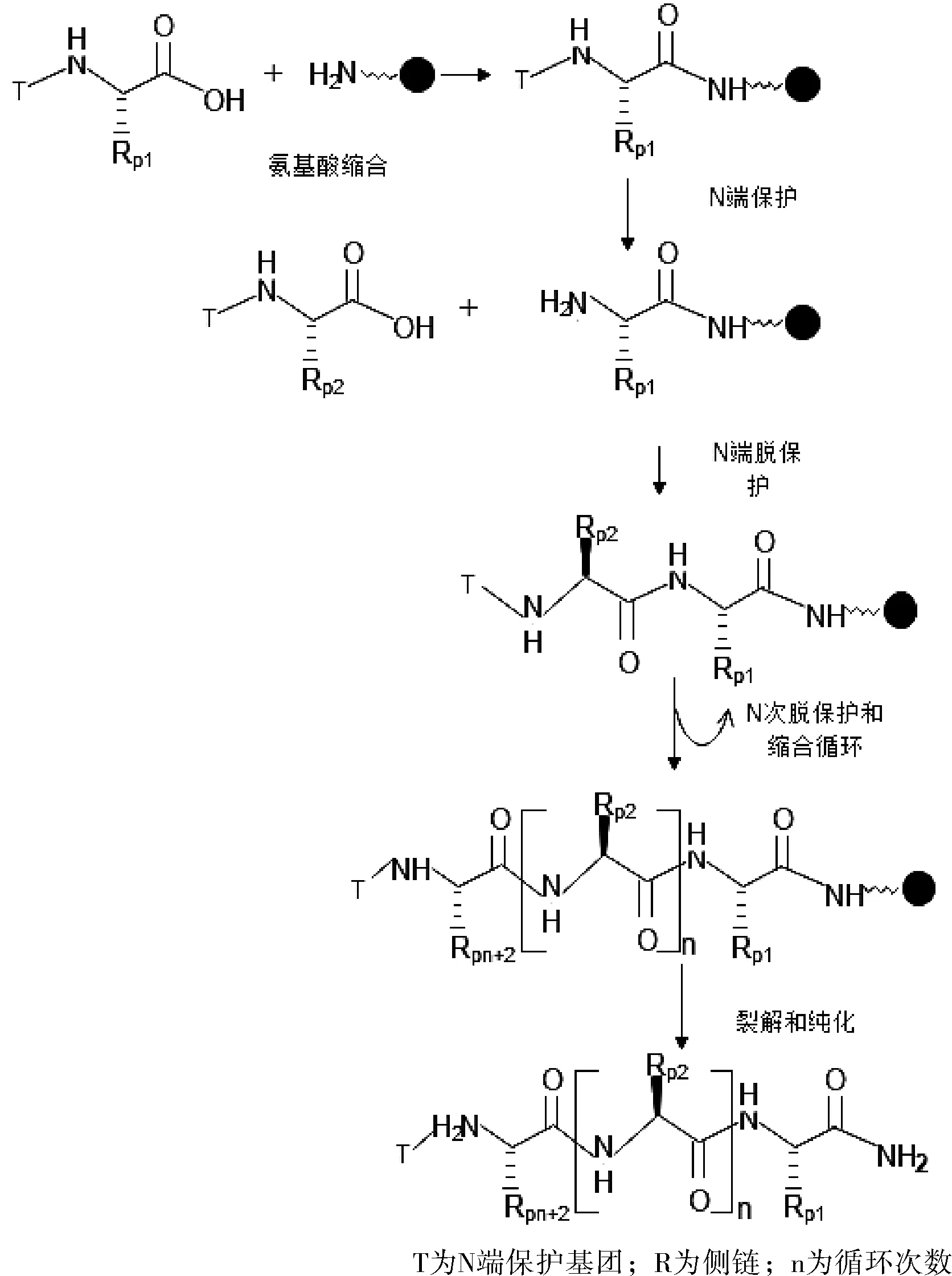
图1 固相合成(SPPS)多肽原理示意图
SPPS的缺点是每一次循环反应均需要大量的试剂,产生大量的废液(每生成1 kg多肽药物需要1000 L溶剂)[1]。后期需要昂贵的制备色谱去除具有类似结构的杂质,进一步增加了生产成本。SPPS的上述缺点也限制了其在多肽合成中的生产规模。此外,超过10个氨基酸的肽往往形成三级结构,使进一步的合成困难。因此,SPPS的工业化生产规模受到一定的限制。
1.3 NCL法(Native chemical ligation)
NCL是一个相对较新的化学合成方法,能够在缓冲液中将未保护的肽片段缩合形成新的肽链。NCL法是将硫酯形式的酰基供体肽段与亲核氨基供体通过两步反应进行缩合。第一步是可逆的硫与硫酯的交换反应,第二步是将S->N 酰基转移至新缩合的肽链上形成酰胺键,该反应自发进行且不可逆,如图2所示。NCL法已被成功用于200个氨基酸以上的蛋白质合成[3]。在缩合位置需要半胱氨酸参与反应是限制NCL法应用的主要原因。另外,需要昂贵的硫酯形式的酰基供体也限制了NCL法的工业化应用。
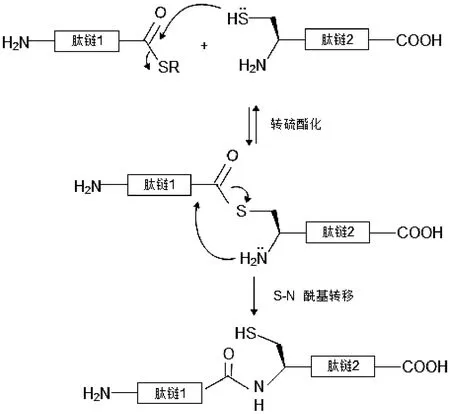
图2 NCL法合成多肽原理图
2 化学酶法合成多肽
将化学法与酶法结合用于肽类的合成方法称为化学酶法,用于化学酶法合成肽类的酶主要是蛋白酶。利用蛋白酶与化学法结合合成肽类具有明显的优势,反应过程氨基酸无需侧链保护,反应条件温和可防止外消旋化,并且可以引入所需的区域选择性、立体选择性和底物选择性。
蛋白酶在生物体类主要催化蛋白质的水解反应。随着非水相技术的发展,蛋白酶被证明在非水相反应体系中仍可催化反应并表现出很多特有的性能。本文将主要介绍用于多肽合成的蛋白酶sortase,butelase,subtiligase,peptiligase和omniligase。
sortase A来源于Staphylococcus aureus,广泛应用于肽和蛋白质的后修饰。Sortase A专一性识别C端为LPXTG(X为任意氨基酸)的序列,可将LPXTG中Thr与Gly之间的酰胺键断裂再与另一个带甘氨酸的肽链N端相连,实现肽、蛋白质的修饰和肽的合成。Sortase A 具有催化活力低,酶用量大,底物特异性强,同时水解副反应的存在导致底物转化率不超过50%等缺点。Butelase的发现克服了部分Sortase A的缺点,Butelase专一性识别C端Asx-His-Val的序列,可将AsX与His之间的酰胺键断裂再与另一任意氨基酸(Xaa)肽链的N端相连,实现肽的连接。Butelase的催化效率极高,仅需少量的酶在短时间内完成反应。Butelase1催化GFP与人生长激素(somatropin)环化反应在15 min完成,转化率95%[4]。尽管如此,Sortase A与butelase在肽链合成中仍具有明显的局限性:(1)明显的水解副反应,导致合成转化率较低,需到大量底物。(2)酶的底物专一性强,仅能识别催化特定的序列。(3)酶本身的不稳定性。因此针对蛋白酶法合成肽类的缺点,科学家们一直在探索改良方法,通过对蛋白酶的定向进化,不断提高蛋白酶的性能。Peptiligase是一种枯草芽孢杆菌蛋白酶的突变体。Peptiligase无需Ca2+离子,催化C端为carboxamidomethyl(Cam)-ester 的片段与氨基供体缩合成新肽链,底物转化率可达90%。同时,Peptiligase 热稳定性好(Tm=66 ℃),可耐受一定浓度的有机溶剂(如50% DMF)和复性剂(2M 尿素或盐酸胍)。Peptiligase 对氨基供体片段具有很强的特异性,偏向于催化N端为Gly、Ala和Ser的氨基供体片段。Toplak 团队在peptiligase的基础上,经过多轮定点突变,获得新突变体命名为Omniligase。Omniligase明显扩大了可催化的氨基供体范围。Omniligase不仅可用于化学酶法合成肽类,还可用于线性肽链的环化[5]。Nuijens[6]通过化学-蛋白酶法成功合成了克级规模的艾塞那肽。然而,在工业应用方面化学酶法还处于起步阶段。由于催化剂的性能在很大程度上决定了工业应用的可行性,因此酶的发现和改造仍是该领域的研究重点。
3 酶法合成肽类
ATP依赖型羧酸盐-胺连接酶可利用活化的羧酸形成乙酰磷酸中间体,催化羧酸(R3C-COOH)和(R3C-NH2)氨基供体缩合形成酰胺键。最早发现的形成酰胺键的ATP依赖型酶为生物素脱羧酶(EC6.3.4.14),D-Ala-D-Ala连接酶(EC6.3.2.4),谷胱甘肽合成酶(EC6.3.2.3)。其中D-Ala-D-Ala连接酶可利用D型氨基酸合成同型二肽(homodipeptide),谷胱甘肽合成酶已大规模应用于工业化生产谷胱甘肽。除以上酶之外能合成二肽和寡肽的还有L-氨基酸连接酶(LAL)。
LAL属于ATP依赖型连接酶超家族,该酶可以利用未保护的氨基酸合成二肽及寡肽。第一个报道的Lal来源于Bacillus subtilis 168,由ywfE基因编码,负责催化L-丙氨酸和抗荚膜菌素形成抗生素芽孢杆菌溶素(bacilysin)。研究表明,YwfE 催化氨基酸底物合成二肽,二肽的N端偏好结构小的氨基酸如丙氨酸、丝氨酸和甘氨酸。C端偏好大、中性的氨基酸如苯丙氨酸、甲硫氨酸和亮氨酸。很多不同来源的LAL相继被报道,如RizA,Rsp1486a,BL00235,PSPPH 4299,plu1440,TabS,FtyB。LAL具有不同的底物特异性,如Tabs合成N端为较大的氨基酸,可以生成多种有用的二肽[7]如Arg-Phe(降压作用),Leu-Ile(抗抑郁作用)和Leu-Ser(盐味增强剂)。LAL也可以用于发酵合成二肽,如以YwfE构建的工程菌合成L-Ala-L-Gln(丙谷二肽)[8]。最近LAL被发现也可生成三肽及以上的寡肽,RizB可催化底物Val和Arg-Ser合成三肽Val-Arg-Ser[9],Spr0969、BAD1200可合成更长的肽链。目前为止,还没有寡肽合成能力的LAL的晶体结构分析,对该类酶的结构分析更有利用于分析寡肽合成的机理。
4 肽类合成总结
本文将目前主要的肽类合成方法进行了介绍,包括化学法、化学酶法和酶法。现阶段并无一种方法可满足所有肽类的合成,合成方法的选择可根据肽的序列、长度和性质等方面进行分析。表1对以上各种方法在规模、肽链长度等多个角度进行了比较分析。在多肽合成中,化学法仍然是生产药物肽的首选方法,因为它可以合成几乎任何想要的肽序列,包括非蛋白质氨基酸肽。化学酶法技术还处于研究初期,随着化学酶法技术的发展,特别是基因工程、蛋白质工程技术在新型肽类连接酶的发掘和改造中的应用,将会开发出越来越多的具有特定性能的肽类连接酶,化学酶法在肽类合成中的应用将展现出越来越明显的优势。
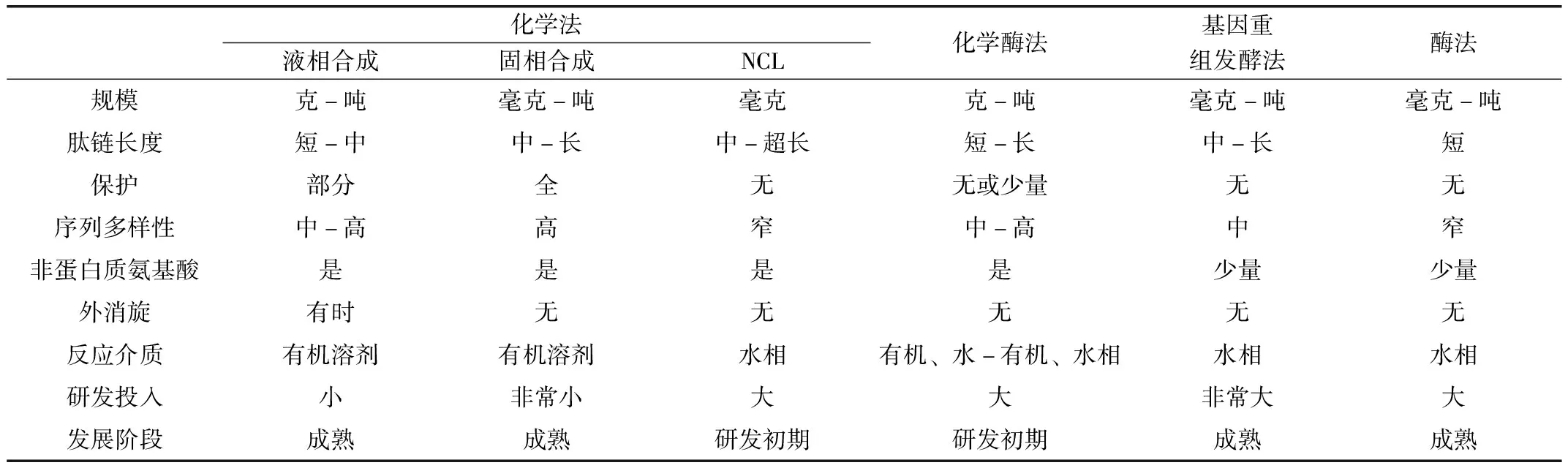
表1 肽类合成方法比较

