血浆外泌体提取方法的比较
吕丽华, 朱丽娜, 王 皓, 杨文静, 金安莉, 王蓓丽, 潘柏申, 郭 玮
(复旦大学附属中山医院检验科,上海 200032)
细胞外囊泡是由细胞分泌的磷脂双分子囊泡,外泌体是细胞外囊泡的一个重要分群,是直径为40~100 nm的膜性囊泡状小体[1]。外泌体是经细胞的内吞运输途径形成的,在形成过程中会携带细胞来源的活性分子,如核酸、蛋白质、脂质等,可介导细胞之间的信号交流,在肿瘤、神经系统疾病、心血管疾病等的发生、发展过程发挥重要作用[2-3]。外泌体的分离和鉴定对于研究其生物学功能及寻找疾病标志物是最基础也是最关键的步骤。目前,外泌体的提取方法包括超速离心法、膜亲和法、沉淀法、免疫磁珠法、超滤法、排阻色谱法等[4-5]。本研究拟选择超速离心法、膜亲和法、沉淀法提取并鉴定血浆外泌体,旨在了解及验证不同方法提取血浆外泌体的效率。
1 材料和方法
1.1 研究对象
随机选取2018年12月—2019年2月复旦大学附属中山医院进行体检的表面健康者8名,其中男4名、女4名,年龄21~36岁,所有对象体检结果均在参考区间内。采集所有对象静脉血10 mL,乙二胺四乙酸二钾抗凝,1 000×g离心10 min,分离血浆,然后4 ℃ 13 000×g离心15 min,用0.22 μm滤器过滤,按1 mL/管分装,置于-80 ℃冻存。本研究经复旦大学附属中山医院医学伦理委员会批准,所有对象均签署知情同意书。
1.2 仪器与试剂
ExoQuick试剂盒(沉淀法)购自美国System Biosciences公司。exoRNeasy Serum/Plasma Midi Kit(膜亲和法)购自美国QIAGEN公司。蛋白浓度测定试剂盒为Detergent Compatible Bradford Assay Kit,购自美国ThermoFisher Scientific公司。一抗抗体:CD63、TSG101购自美国Abcam公司,CD9购自美国CST公司;二抗抗体:辣根过氧化物酶标记的羊抗鼠IgG抗体、羊抗兔IgG抗体购自上海碧云天公司。 N30纳米流式检测仪(厦门福流生物科技有限公司),Zetasizer Nano ZS纳米粒度及Zeta电位仪(英国Malvern公司),Tecnai Spirit G2 BioTWIN透射电子显微镜(简称透射电镜,美国ThermoFisher Scientific公司)。
1.3 血浆外泌体提取
取出冻存于-80 ℃的血浆,冰上融化,取1 mL,分别利用超速离心法、膜亲和法和沉淀法提取血浆外泌体。
1.3.1 超速离心法 将1 mL血浆用36 mL 磷酸盐缓冲液(phosphate-buffered saline,PBS)稀释,加入L-100XP超速离心机(SW32Ti转子,美国贝克曼库尔特公司)的超速离心管中,配平,4 ℃ 100 000×g离心2 h,将上清缓慢吸去,留取最后1 mL沉淀,涡旋震荡混匀,吸取至SW41Ti转子配套的离心管中,用6 mL PBS稀释,装满离心管,配平,再次4 ℃ 100 000×g离心2 h,缓慢吸去上清,最终用100 μL PBS重悬沉淀。
1.3.2 沉淀法 按ExoQuick试剂盒说明书要求,吸取1 mL血浆,加入沉淀剂253 μL,吹吸混匀,4 ℃静置30 min,1 500×g离心30 min,弃上清,管底沉淀用100 μL PBS重悬沉淀。
1.3.3 膜亲和法 按照说明书要求,将Buffer XBP与过滤后的1 mL血浆样本1∶1混匀后,转移至分离柱中,500×g离心1 min,弃废液;加入10 mL Buffer XWP至分离柱,5 000×g离心5 min;将分离柱转移至新的收集管中,加入100 μL PBS至膜中央,室温孵育5 min后,5 000×g离心5 min,所得样本即为外泌体。
1.4 外泌体生物学特征鉴定与分析
1.4.1 外泌体的形态 取20 μL外泌体重悬液滴于电镜专用铜网上,静置3 min。随后用2 %磷钨酸溶液复染,室温静置5 min,用吸水滤纸吸干残留的多余液体,在60 W白炽灯下静置2~3 min,待样本干燥后,置于透射电镜下观察形态。
1.4.2 外泌体的颗粒直径 将已知直径的荧光二氧化硅纳米颗粒与外泌体样本混合后,在N30纳米流式检测仪上选用波长为532 nm的激光器,检测通道为散射通道和PE荧光通道,对样本混合体系进行检测。以系列二氧化硅纳米颗粒的直径及散射光强度绘制出标准工作曲线,对外泌体的折射率差异进行校正,将外泌体的散射光强度转变为直径参数,并计算出外泌体的颗粒直径。
1.4.3 外泌体动态光散射分析及Zeta电位测定 Zetasizer Nano ZS纳米粒度及Zeta电位仪利用动态光散射法原理分析样本的粒径分布情况,即体系中的颗粒因布朗运动而产生的散射光强度变化,检测器将散射光信号转化为电流信号,再通过数字相关器的运算得到颗粒在溶液中的扩散系数,最后计算出颗粒直径大小及其分布。将制备的外泌体悬液用PBS稀释,涡旋震荡混匀,置于样本池中。运用Zetasizer软件分析不同方法提取的外泌体的直径范围及Zeta电位。
1.4.4 外泌体蛋白的鉴定分析 外泌体蛋白悬液采用二喹啉甲酸(bicinchoninic acid,BCA)法进行定量检测,随后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS -PAGE),湿转1.5 h,5%牛血清白蛋白室温封闭2 h,三羟甲基氨基甲烷-吐温(trishydroxymethyl aminomethane-Tween,TBST)缓冲液洗涤,孵育一抗(1∶1 000),4 ℃孵育过夜。TBST缓冲液洗涤后加入相应二抗,室温孵育1 h,随后采用电化学发光法进行显影。
1.5 统计学方法
采用SPSS 24.0软件进行统计分析。采用Kolmogorov-Smirnov检验对计量资料进行正态性分析。非正态分布的数据以中位数(M)[四分位数(P25~P75)]表示,采用Welch's ANOVA对数据进行分析,事后检验采用两样本不等方差t检验[6]。以P<0.05为差异有统计学意义。
2 结果
2.1 透射电镜鉴定3种方法提取的外泌体的形态
超速离心法、沉淀法和膜亲和法提取的外泌体在透射电镜下均能观察到立体膜结构,呈现出茶托样或凹半球样,大小为40~100 nm,分散或聚集分布,但沉淀法混有较多的聚乙二醇(polyethylene glycol,PEG)和蛋白的聚沉物。见图1。
2.2 外泌体的颗粒直径
采用N30纳米流式检测仪检测外泌体的颗粒直径。超速离心法、膜亲和法、沉淀法提取的外泌体颗粒直径分别为65.5(55.5~77.5)、73.5(61.5~101.5)、64.5(54.5~77.5)nm。亲和法提取的外泌体直径大于超速离心法和沉淀法(P<0.05)。见图2。
2.3 动态光散射法测定外泌体直径及Zeta电位
动态光散射法测定超速离心法、膜亲和法、沉淀法提取的外泌体直径分别为190.1(164.2~220.2)、295.3(220.2~396.1)、68.06(37.84~122.4)nm,大于N30纳米流式仪的检测结果。此外,3种方法提取的外泌体膜的Zeta电位均为负电荷,提示其均为膜结构。见图3。
2.4 外泌体蛋白标志物的鉴定
免疫印迹法检测结果表明,超速离心法、膜亲和法、沉淀法提取的血浆外泌体均表达外泌体蛋白标志物。见图4。
2.5 外泌体提取效率评估及经济性比较

图2 超速离心法、沉淀法和膜亲和法提取的外泌体粒径分布
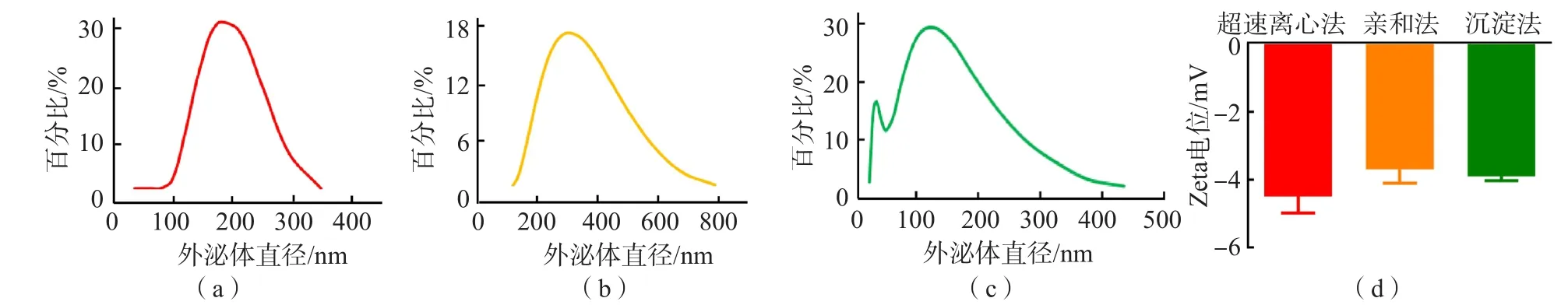
图3 动态光散射法检测外泌体的粒径及Zeta电位
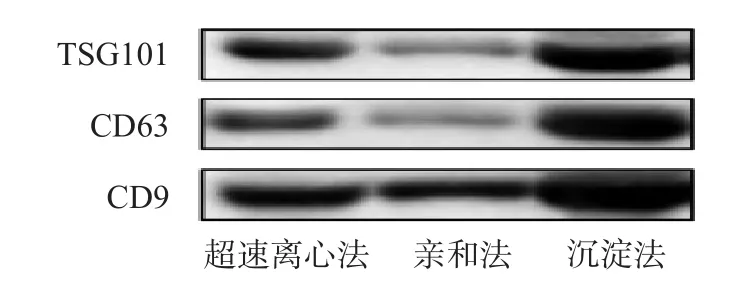
图4 免疫印迹法鉴定外泌体蛋白标志物
沉淀法提取的血浆外泌体蛋白总量和外泌体颗粒数均高于超速离心法和膜亲和法(P<0.05)。以外泌体颗粒数/蛋白总量比值表示外泌体的提取纯度。超速离心法的提取纯度高于膜亲和法和沉淀法(P<0.05)。超速离心法耗时且成本高,亲和法耗时最少、成本中等,沉淀法成本最低。见图5。
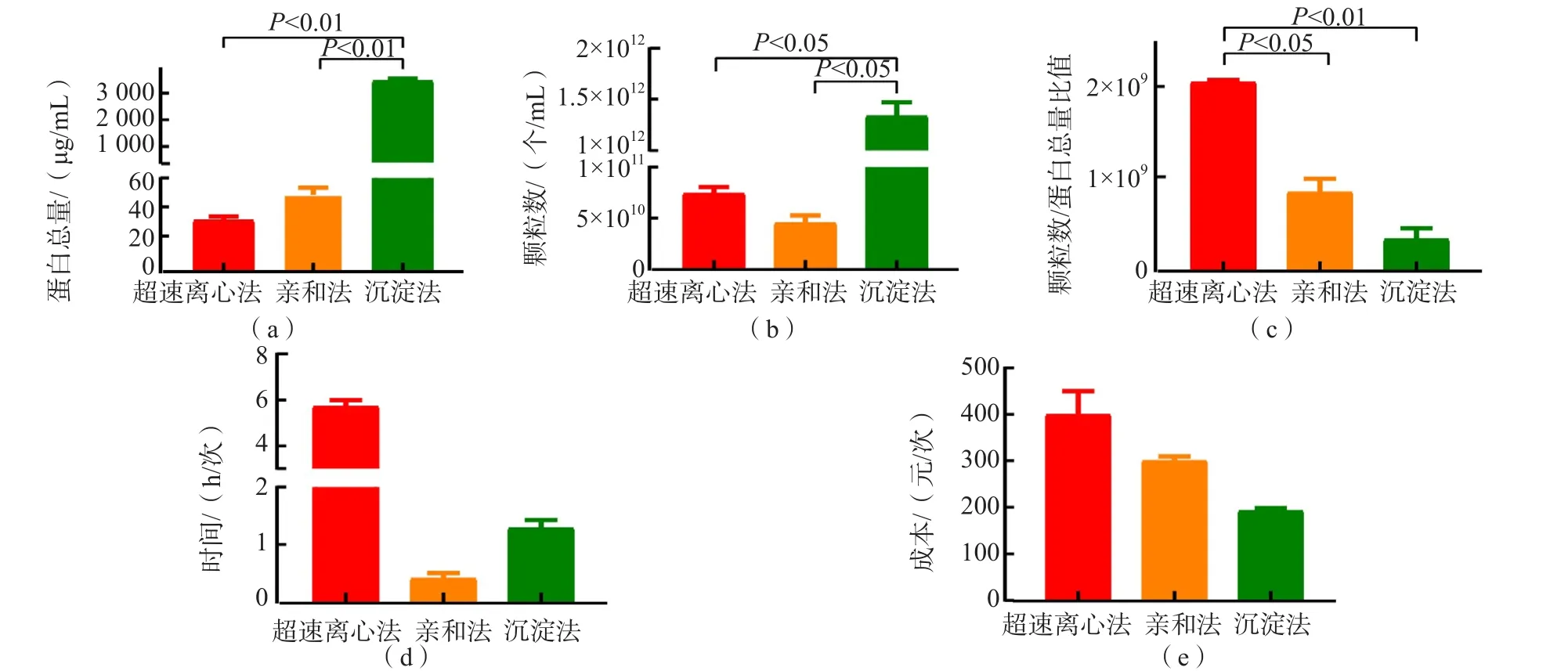
图5 超速离心法、膜亲和法、沉淀法提取外泌体的效率及经济性比较
3 讨论
外泌体参与了细胞之间的信号交流,在疾病的发生、发展中起重要作用,选择合适的提取方法是研究外泌体的第一步。国际细胞外囊泡协会导则提出,鉴定样本中存在细胞外囊泡的实验要求至少包括:(1)使用电子显微镜等对样本进行成像分析,证实膜泡结构;(2)通过纳米级别的分析技术测定膜泡群体的粒径情况;(3)使用免疫印迹法或流式等技术检测囊泡的蛋白标志物[7]。
本研究采用超速离心法、膜亲和法、沉淀法对血浆外泌体进行提取和鉴定。结果显示,在透射电镜下,外泌体均为茶托样或凹半球样立体膜结构。N30纳米流式检测仪的检测结果显示,膜亲和法提取的外泌体直径比超速离心法和沉淀法大。动态光散射法检测结果提示3种方法提取的外泌体均为膜性结构。超速离心法提取的血浆外泌体纯度最高,但最耗时、成本较高;膜亲和法提取步骤耗时最少、成本中等;沉淀法提取的血浆外泌体蛋白质浓度和颗粒数量最高、成本最低,但提取的纯度远低于超速离心法。
采用透射电镜观察沉淀法提取的外泌体,提示有蛋白质和PEG聚合物污染,与文献报道[9]相符。这些聚沉物对后续外泌体生物功能研究是否有影响值得商榷。也有学者使用沉淀法在细胞培养基中提取出背景干净、形态典型的外泌体[9],这可能与样本自身、外泌体提取过程或电镜样本制备等有关。
本研究采用N30纳米流式检测仪和动态光散射法对外泌体进行单颗粒层面的分析,弥补了前者不能测定外泌体的Zeta电位及后者不能计算颗粒数的缺陷,3种方法得到的血浆外泌体大小与文献报道[6,10]一致。虽然本研究动态光散射法测定外泌体的Zeta电位为负值,提示外泌体带负电荷,可能为膜状结构,但该方法测定的外泌体粒径偏大。此外,该技术对外泌体的检测不具有特异性,同时记录了其他颗粒的信息。有研究结果显示,动态光散射法对分布均一的单分散粒子群的检测较准确,但不适合细胞外囊泡的群体检测[11]。
超速离心法、膜亲和法、沉淀法提取的血浆外泌体均表达标志性蛋白。超速离心法和膜亲和法提取的外泌体表达的蛋白纯度较高,这是因为在提取过程中,血浆经过至少2次高倍数的稀释,已去除大部分血浆蛋白的污染,但不排除最后吸取样本时仍有残留蛋白。沉淀法提取的外泌体蛋白浓度最高,粒子数最多,这可能是因为助沉剂富集外泌体的同时会有大量其他囊泡或非囊泡组分与其发生共沉淀,造成结果假性增高,出现“高回收率、低特异性”的情况[11]。因此,通过颗粒数/蛋白总量比值评估外泌体提取效率时[12],沉淀法的提取纯度最低[13]。
综上所述,超速离心法作为最经典的方法,外泌体提取纯度高,适合于体积大且外泌体量多的样本,及于对外泌体纯度要求严格的实验。考虑到超速离心离法耗时长,1次检测的样本数量少,因此不适用于临床常规检测。膜亲和法操作简便、耗时短,也可有效提取外泌体,适用于外泌体RNA的相关研究[8]。沉淀法提取的外泌体量大,但混入的杂质较多,不易分离出特异性外泌体。对于低丰度表达的外泌体分子,可采用多种提取方法联合验证,提高其检出率。研发新的提取方法、改良或结合现有方法,使外泌体分离达到“高回收率、高特异性”是未来的研究方向,可为外泌体真正应用于临床打下坚实的基础。

