布鲁氏菌病的免疫逃逸机制及基因多态性的研究进展
苏 霄,赵世刚,2
1 研究背景
布鲁氏菌病又称马耳他热,波状热,地中海热等,是由布鲁氏菌属引起的全球严重的自然疫源性人兽共患病之一[1]。该病在我国被列为乙类法定报告传染病,它在东北、内蒙古、西北等牧区曾广泛流行,上世纪 70-80 年代末疫情趋于下降,但自 90 年代,发病人数逐年增多,成为我国发病数增长速度最快的传染病之一, 近年来布鲁氏菌病呈现由牧区向非牧区转移,由职业人群向非职业人群扩散的趋势,使我国疫情防治面临严峻形势[2]。由于缺乏有效的治疗方法,该病容易迁延不愈,此文章的目的是收集该病慢性感染形成的可能原因,包括毒力因子、逃逸机制、机体免疫反应的新变化。此外,收集了与布鲁氏菌病易感性及慢性感染形成有关的基因多态性的问题,这在以前的综述中较少提及。
2 布鲁氏菌病原学特征
布鲁氏菌是一种革兰染色阴性、需氧、非运动兼性细胞内寄生的短状杆菌或球状杆菌。布鲁氏菌根据致病性和宿主的不同可以分为 6个种,即马耳他布鲁氏菌(羊种布鲁氏菌,B.melltensis)、流产布鲁氏菌(牛种布鲁氏菌,B.abortus)、猪种布鲁氏菌(B.suis)、绵羊附睾种布鲁氏菌(B.ovis)、沙林鼠种布鲁氏菌(B.neotormae)、犬种布鲁氏菌(B.canis)[3]。造成人类感染的主要有3种:B.melitensis、B.abortus和B.suis.其中由大卫·布鲁斯发现的布鲁氏菌是引起人类布鲁氏菌病的主要原因[4]。但仍有罕见的布鲁氏菌属能感染人类,例如从海洋生物分离的2种布鲁氏菌种属B.ceti(鲸类海洋布鲁氏菌)和B.pinipialis(鳍足类海洋布鲁氏菌)[5]。此外,还有菌株 BO1和菌株BO2,作为非典型菌株分别从患有乳房植入物感染的人类患者和肺炎患者的肺活检中分离出来[6-7]。
3 布鲁氏菌感染宿主时的免疫特性
在感染的最初1 h,很少有生物能够在巨噬细胞内部氧自由基的攻击下幸存。但布鲁氏菌可以在巨噬细胞内部的吞噬体中存活并持续存在,从而导致慢性布鲁氏菌病。布鲁氏菌的致病性在很大程度上取决于入侵宿主的能力及在细胞内复制单位中繁殖的能力[8]。布鲁氏菌具有不同的毒力因子,使细菌可以在胞内长期存活造成感染状态。据报道,在体外模型中,有许多毒力因子参与了布鲁氏菌的逃逸机制,这里仅报道在大多数体外和体内实验模型中对形成长期感染有明显作用的毒力因子。这些毒力因子的发现可能对开发疫苗具有至关重要的影响。
3.1 毒力因子
3.1.1脂多糖(lipopolysaccharide,LPS) 革兰氏阴性菌外膜中存在的LPS是布鲁氏菌的主要致病因子。LPS包含脂质A、寡糖核心和O抗原。在布鲁氏菌属中,脂质A比其他肠杆菌科中的脂质更长,导致其与TLR-4的相互作用显着降低从而减少了促炎症因子的产生,使其不易被免疫系统消灭[9]。根据LPS的O-抗原的不同,布鲁氏菌属可以分为粗糙型和光滑型。光滑型菌株通过与脂质筏相互作用可以抑制巨噬细胞中的吞噬体-溶酶体融合从而影响巨噬细胞的杀菌作用。LPS增强了对于抗菌素阳离子肽(如a-防御素、NP-2和乳铁蛋白)以及一氧化氮(NO)[10]、自由基和溶菌酶的抗性,使具有非内毒素性质LPS的布鲁氏菌在宿主的抗菌攻击下表现的更稳定,并阻止免疫介体的合成[11]。因此,脂多糖是布鲁氏菌渗透到宿主细胞和避免被免疫系统杀死的重要成分。
3.1.2BvrR/BvrS 布鲁氏菌毒力相关调控(BvrS)和感觉(BvrR)蛋白组成布鲁氏菌二组分调节系统。它对溶酶体中布鲁氏菌的黏附、渗透、侵袭和逃逸起到了重要作用[12]。此外,该系统还控制细胞表面蛋白(例如Omp25和Omp22)的表达[13]。
3.1.3 IV型分泌系统相关毒力因子
3.1.3.1VirB操纵子编码的IV型分泌系统(T4SS) T4SS参与布鲁氏菌对宿主细胞的黏附,内化,细胞内运输和复制过程。T4SS是一个多蛋白复合物家族,由12个跨越被膜的多蛋白复合物VirB1-12 构成,可以在细菌外膜上形成一个“管道”,当装配完成后布鲁氏菌就会向宿主细胞“注射”效应蛋白操控细胞的信号通路和应激反应。目前已经确定了11种IV 型分泌系统效应蛋白,其中有3种蛋白功能较清楚,Btp1 蛋白可以引发宿主免疫相关蛋白 E3 介导磷酸化 TIRAP 分子的降解。TIRAP 是 TLR2 和 TLR4 信号通路的关键分子,该分子的降解会弱化布鲁氏菌感染过程中免疫应答信号的传导,从而有利于胞内生存[14]。RicA和 CstA与自噬溶酶体和胞内运输的形成有关[15]。T4SS还通过转运效应分子和中和细胞内的酸性环境来促成布鲁氏菌复制位的建立和细胞内存活。已经证明T4SS缺陷的突变布鲁氏菌不能在小鼠模型体内建立持续感染。
3.1.3.2VirJ VirJ编码一种参与细胞质复制的蛋白质,该蛋白质位于周质区域。这种蛋白质在两种IV型分泌系统(SepA和Bpe123)中起着至关重要的作用。另外,它可以与VirB操纵子编码IV型分泌系统(T4SS)的中心组件形成复合体,因此VirJ是分泌平台的一部分[16]。
3.1.3.3LuxR 型转录调控子 LuxR 型转录调控因子主要对细菌密度感应系统的变化做出应答,其中VjbR 和BlxR对T4SS也产生影响。VjbR 能诱导 100 多个基因表达,其包括外膜蛋白、virB 操纵子、环 β-1,2 葡聚糖合成酶Cgs等[17]。另一LuxR 型调控因子 BlxR 影响 virB 操纵子的表达和鞭毛基因的合成[18]。
3.1.4环状β-1,2-葡聚糖(CbG) CbG为布鲁氏菌细胞内存活提供必需的渗透压。这些葡聚糖在宿主细胞膜上的脂筏中起作用,并通过与溶酶体的融合来调节含有布鲁氏菌的液泡成熟促进其逃逸。因此,这种毒力因子在布鲁氏菌与脂筏的相互作用和布鲁氏菌的复制中起作用[19]。
3.1.5热休克蛋白60(Hsp60) Hsp60是布鲁氏菌表面表达的伴侣蛋白家族的一员,在入侵前与巨噬细胞表面上一种细胞病毒蛋白PrPC结合,从而促进布鲁氏菌与宿主细胞的黏附和细胞内复制[20]。
3.1.6布氏小体形成相关毒力因子 布鲁氏菌容易造成慢性持续性感染的关键特性是其能够适应细胞内营养不良、低氧、酸性pH和活性氧攻击的环境。这主要得益于布鲁氏菌可以在细胞内形成一种叫布氏小体的复制单位,在这个复制单位中,它可以生活在被感染的细胞中以完成感染周期。而布氏小体的形成主要得益于布鲁氏菌中各种毒力因子的存在,下面对这些毒力因子做一概述。
根据所得数据,阴平是一个平调,阳平则是一个升调,上声是一个高降调,去声同样是高降调,但调值差距比上声要小,入声归入阴平和去声。
3.1.6.1过氧化氢酶(CAT) 可以将H2O2氧化为H2O和O2从而保护细菌免受细胞内氧化剂的侵害[21]。
3.1.6.2超氧化物歧化酶(SOD) 可以将超氧化物分解成氧气和过氧化氢H2O2从而排除内源性活性氧的毒性作用,保护布鲁氏菌免受氧化杀伤[21]。
3.1.6.3尿素酶 可以将尿素水解成碳酸和两分子氨从而降低所在环境的pH值,为布鲁氏菌的生存提供适宜的酸性环境[22]。
3.1.6.4烷基过氧化氢还原酶(ahpc&D) 可以对布鲁氏菌有氧代谢产生的H2O2和氢过氧化物进行解毒从而防止氧化和氮氧化物的损伤[23]。
3.1.6.5细胞色素氧化酶(cydDCAB) 表达与适应细胞内低氧张力环境相关的基因,防止ROS的产生并在布氏小体中起解毒作用,从而促进布鲁氏菌在细胞内生长[24]。
3.1.6.6一氧化氮还原酶(norD)包含4种反硝化酶硝酸还原酶(Nar)、一氧化氮还原酶(Nir)、一氧化氮还原酶(Nor)和一氧化二氮还原酶(Nos)帮助布鲁氏菌在低氧压力下存活并缓解NO的毒性作用[25]。
3.1.6.7布鲁氏菌毒力因子A(BvfA) 可以被调节以应对细胞内酸性PH或巨噬细胞的攻击从而形成布鲁氏菌在细胞内存活及复制的布氏小体[22]。
3.1.6.8Nramp1基因 在最初阶段参与激活巨噬细胞和先天免疫应答,诱导多种对巨噬细胞有影响的蛋白[26],将吞噬体的pH调节至酸性范围。
3.2免疫逃逸策略 虽然在感染的第1小时内90%以上的布鲁氏菌会被杀死,但仍有一部分会存活下来并在被感染的细胞中复制[27]。这主要得益于布鲁氏菌利用多种策略来逃避免疫应答机制,从而在宿主体内建立持续感染。下面对这些策略做一概述。
3.2.1逃避先天性免疫 先天性免疫系统对早期控制细菌复制和成功根除细菌至关重要,但布鲁氏菌采用“隐蔽”的策略来应对先天免疫系统,避免了模式识别受体(PRR)的识别和随后强烈的炎症反应[28]。布鲁氏菌缺乏明显的毒力因子,其表面的脂多糖(LPS)、脂蛋白、脂质、鞭毛等都是较弱的固有免疫诱导剂,可以在某种程度上逃避PRRs的识别[29]。如LPS中的脂质A相比肠杆菌科具有更长的脂肪酸链(C28),因此大大减少了对TLR4的刺激并且减弱自身的毒性。VI抗原在LPS周围形成的被膜可限制其与TLR4的接触从而减少了对免疫系统的刺激[30]。LPS的O-抗原缺乏自由羟基,因此不能与补体C3结合,抑制了C3a和C5a的生成,造成C3补体系统的攻击减少和促炎细胞因子的产生[31]。因为布鲁氏菌的鞭毛缺乏激活TLR5的结构域从而无法激活由TLR5介导的炎症反应[32]。这都为布鲁氏菌控制布氏小体(Brucella-containing vacuole, BCV)到达内质网(endoplasmic reticulum, ER)处建立复制小室提供了时间。
3.2.2 调节获得性免疫
3.2.2.1干扰细胞因子产生 在感染的后期,适应性免疫是机体清除感染,建立具有记忆功能特异性免疫的重要途径。然而布鲁氏菌进化出“干扰”的策略,干扰从先天性免疫系统到获得性性免疫系统的信息传递,从而影响DCs的功能以逃避宿主的免疫反应。已有研究表明,感染布鲁氏菌的DC中MHC Ⅱ类分子、CD86和CD80的表达量降低,降低了其向特异性T细胞提呈抗原的能力从而抑制了促炎细胞因子(如IL-12、TNF-α)的分泌[33]。干扰素-γ介导的I型免疫反应对于清除布鲁氏菌是必不可少的。最近的研究表明,Btp1/TcpB、BrLPS和PrpA是与宿主免疫机制相互作用的重要免疫调节分子,其有能力抑制干扰素γ的分泌,增加IL-10的分泌,从而影响Th1型免疫反应[34]。除此之外,布鲁氏菌通过减少IL-12的分泌和阻止受感染的DC激活T细胞来干扰保护性Th1免疫反应的建立[35]。并且,未成熟的DC与CD4+幼稚T细胞的接触可能诱导调节性T细胞(Treg)活动,并通过转化生长因子β阻止Th1型反应[36]。这些发现表明,布鲁氏菌可以通过干扰细胞因子的分泌,以逃避适应性免疫。
3.2.2.2干扰模式识别受体 模式识别受体(pattern recognition receptor,PRR)是一类主要表达于固有免疫细胞表面可识别一种或多种PAMP的识别分子(包括表面识别受体家族TLR、胞内受体家族如NOD样受体家族和AIM2受体)。TLR信号通路是产生促炎性细胞因子的主要信号通路。赵世刚等人证实在布鲁氏菌病急性期TLR相关识别受体及分子通路与慢性期发生了显著变化[37]。布鲁氏菌利用其分泌蛋白干扰受感染DCs的TLR路径,以阻碍DCs的成熟。布鲁氏菌分泌的效应蛋白TcpB/Btp1可以诱导信号蛋白MAL的泛素化降解从而干扰TLR2和TLR4信号传导,以此阻断由其激活的炎症反应。另外TcpB/Btp1还可以抑制树突状细胞成熟,阻断MyD88信号通路,以减少TNF-α和IL-12的分泌,并降低慢性感染期间的CTL细胞毒性利于细菌的胞内寄生和繁殖[35]。最近几年的研究发现胞内受体家族如NOD样受体家族和AIM2受体在识别和清除布鲁氏菌的过程中也起到了重要的作用。但相关研究大多基于基础实验未在人体得到证实。TLR诱导IL-1b和IL-18细胞因子的前体形式表达,此后,依赖NLR的caspase-1激活从而调节其蛋白水解过程和释放[38]。最近,AIM2被确定为一种新型的细胞内受体,参与病毒和细菌感染过程,它识别胞质内病原体DNA从而激活炎症小体。鉴于布鲁氏菌的胞内生存特性,胞内识别受体可能在形成布鲁氏菌慢性感染过程中起到重要作用,对其调控因素的研究可能有助于防止布鲁氏菌病由急性期向慢性期转变。
3.2.3自噬途径的选择性颠覆 自噬是一种重要的宿主防御机制,可以用以消除胞内寄生菌。然而,有些细菌可以改变宿主细胞自噬来保护自身的生存或抑制自噬体的形成。最近的证据表明自噬相关蛋白在内质网衍生型BCV(rBCV)的形成中发挥关键作用,并有助于其完成细胞内生命周期,布鲁氏菌颠覆了宿主细胞膜的运输途径[39]。依赖Yip1A的IRE1α的激活上调了Sar1和COPII的表达,导致依赖ATG9和WiPI的大空泡形成[40]。这些发现表明布鲁氏菌病中IRE1α的表达促进了自噬起源空泡的形成,这些空泡将含有布鲁氏菌的液泡(eBCV)转化为rBCV[41]。这些发现表明,自噬蛋白的启动在rBCV向aBCV的转化过程中起重要作用,而Yip1A在布鲁氏菌的复制和rBCV的生物发生过程中也是必需的。因此,“颠覆”自噬是布鲁氏菌对抗宿主免疫应答的重要策略。
3.2.4抑制细胞凋亡 细胞凋亡指为维持内环境稳定,由基因控制的细胞程序性死亡。抑制凋亡是布鲁氏菌维持细胞内复制生态位的重要策略。布鲁氏菌以特定的钙依赖性方式显着提高了Nedd4活性,进而提高了钙蛋白酶2的降解并抑制巨噬细胞凋亡[42]。A20的上调抑制了NF-κB信号通路,从而抑制了caspase-8依赖性的巨噬细胞凋亡,达到了促进细菌的细胞内生长的目的[43]。此外,受布鲁氏菌感染的中性粒细胞和单核细胞具有显著上调各种黏附分子(如CD106和CD54)的能力,从而抑制了这些细胞的凋亡[44]。总的来说,这些证据表明抑制凋亡是布鲁氏菌逃避免疫反应完成细胞内复制的一种策略。
3.2.5小分子非编码RNA在布鲁氏菌感染中的作用 miRNAs是小分子非编码RNA的一部分,参与调控基因表达、细胞凋亡和信号转导。有证据显示,布鲁氏菌miRNAs可能在细菌逃逸免疫反应中起着重要的作用。Casewell等报道B.abortusmiRNAs、abcR1和abcR2在布鲁氏菌致病性和慢性感染中发挥重要作用[45]。有证据显示在受布鲁氏菌感染细胞中miR-92a、miR-93、let-7b、miR-1981和miR-181b等几种miRNAs与模拟感染细胞有差异表达,并认为这些miRNAs可能参与了免疫应答机制、自噬和凋亡[46]。Budak等人发现与急性布鲁氏菌病相比,慢性病患者的CD4+T细胞中28种miRNA的表达水平发生了显着改变,其中有27种以某种方式参与了MAPK信号通路、肌动蛋白细胞骨架的调节、内质网的内吞作用和内质网中的蛋白加工等过程,但在急性病例中未表达[47]。这些发现都暗示了miRNA可能在慢性布鲁氏菌病形成过程中起作用。
4 宿主免疫机制及新发现
4.1先天免疫反应 先天免疫反应是针对病原体的非特异性反应。在针对布鲁氏菌的初始免疫反应中,巨噬细胞和树突状细胞首先吞噬细菌然后将病原体衍生肽呈递给幼稚的T细胞以促进适应性免疫。在感染部位,中性粒细胞在先天免疫应答的早期阶段起到作用,在吞噬过程中,其向吞噬体递送抗菌颗粒,当颗粒融合后,释放出裂解酶和活性氧,从而杀死布鲁氏菌。先天性淋巴细胞包括自然杀伤(NK)细胞,NK T细胞和CDT细胞能够识别不受MHC限制的非肽抗原[48],通过促进颗粒和Fas配体介导的细胞毒性,活化巨噬细胞,产生IFN-c以及分泌颗粒溶素和cathelicidin抗菌肽来抑制布鲁氏菌在细胞内存活。Fas-FasL的相互作用会导致被感染的巨噬细胞死亡[49]。最近,已证明布鲁氏菌直接与血小板相互作用并触发其活化。血小板通过促进布鲁氏菌侵袭巨噬细胞而参与早期感染。它们还可以与感染的巨噬细胞建立复合物并充当载体。此外,血小板在巨噬细胞感染期间增加IL-1b、TNF-α、IL-8和巨噬细胞化学引诱子蛋白-1(MCP-1)的水平,并降低IL-10的水平。血小板可以调节布鲁氏菌介导的巨噬细胞感染,并促进炎症发生[50]。
4.2适应性免疫 适应性免疫是消除布鲁氏菌的第二道防线。吞噬细胞吞噬布鲁氏菌后,将MHC-I和II相关的细菌肽呈递给T淋巴细胞,T细胞通过其表面的受体识别肽-MHC复合物从而被激活,随后在抗原呈递细胞(APC)分泌的IL-12作用下,由幼稚T细胞分化为T辅助1型(Th1)细胞。Th1细胞产生的IL-2和IFN-c对于清除布鲁氏菌至关重要。IFN-c负责激活巨噬细胞的抗菌能力,提高APC上抗原呈递和共刺激分子的表达,动员细胞毒性T淋巴细胞(CTL)介导的细胞毒性和细胞凋亡[51]。因此,IFN-c是引发针对布鲁氏菌免疫应答的关键细胞因子。Th1反应的任何紊乱都可能导致慢性布鲁氏菌病的发生并导致不良预后的发生。B淋巴细胞是人体免疫功能的关键细胞,由于其具有免疫调节作用,因此被认为是布鲁氏菌最常见的细胞内生态位。Goenka等人认为在布鲁氏菌感染过程中B细胞可能增加IFN-c的产生并清除布鲁氏菌,其还发现B细胞中IL-10和TGF-b在清除布鲁氏菌感染过程中起到积极作用[52]。鉴于之前研究显示慢性感染中TGF-b会增加,而布鲁氏菌感染的B细胞会产生大量的TGF-b,证明B细胞与慢性布鲁氏菌病可能有关[53]。在布鲁氏菌感染的早期阶段,Th1细胞表达高水平,而在随后的阶段,TH2细胞表达水平增高,继而产生IL-4、5、10和13[54],在慢性感染的阶段检测到高水平的IL-5和TGF-b以及低水平的IFN-c。因此,免疫反应中细胞因子的极化表现或许可以表明布鲁氏菌病的进展过程[55]。Ganji等人提出,与急性布鲁氏菌病相比,慢性布鲁氏菌病中具有CD25/FoxP3β表型的调节性T细胞(Tregs)减少,调节性T细胞数量的减少导致了T细胞无反应和慢性感染的发生[56]。有报道显示,在活跃的人布鲁氏菌病中,调节性T(Treg)细胞数量增加,并且在成功治疗后下降[57]。另一方面,由于共刺激信号不足,慢性感染患者的CD25/Fox P3βTreg细胞显著减少,导致无法发挥作用[58]。
5 基因多态性与布鲁氏菌病的相关性
细胞因子基因编码区和非编码区的多态性可能影响细胞因子的产生水平,从而对免疫反应产生影响,这可能导致慢性布鲁氏菌病的发生。有研究已经鉴定出易患布鲁氏菌病的风险基因或可能的基因多态性,例如TGF-b1、TNF-α(308)、IL-6(174)和IFN-c(t874)。TGF b1和IL-10与布鲁氏菌病的耐药性相关,HLA-B27与慢性布鲁氏菌病有关[59]。此前的综述中有关报道较少,在此对与布鲁氏菌病形成可能相关的基因多态性的问题做一简单罗列。见表1。
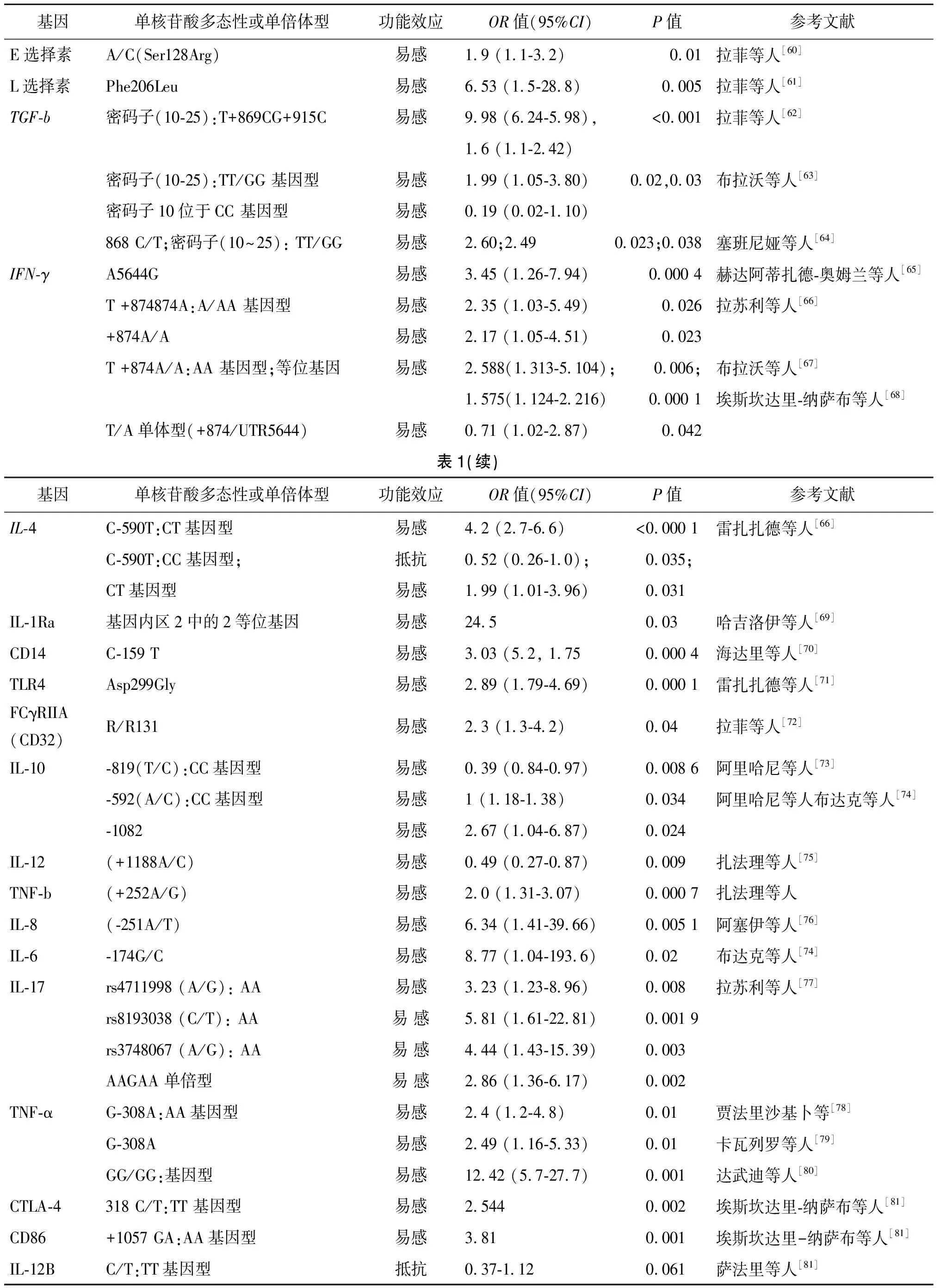
表1 分析单核苷酸多态性(SNPs)与布氏杆菌病的关联性和特性
6 结论与展望
这篇综述旨在对慢性布鲁氏菌病的成因提供片面的见解。尽管布鲁氏菌进入人体后会激活免疫反应,但得益于多种毒力因子和逃逸策略的存在,它成功逃避了免疫反应,很容易造成持续感染。由于缺乏可靠的诊断和治疗方法,布鲁氏菌病经常复发,慢性布鲁氏菌病也不时发生,目前使用的药物的副作用也使布鲁氏菌病成为严重的健康问题。尽管科研界对布鲁氏菌的不同方面进行了许多研究,包括新的毒力因子、适应能力、细胞内运输、对呼吸暴发的抵抗力、渗透机制、逃避宿主免疫系统和基因多态性,然而关于慢性感染的发病机制仍然不甚明了,新的研究发现细胞内受体(NOD样受体)在清除感染中可能起到积极作用,对此进行研究也许可以改进治疗策略,甚至可以开发出有效的人类疫苗。
利益冲突:无

