烟草种子内生真菌群落结构和多样性分析
谢红炼 汪汉成 史彩华 周浩 孙美丽

摘要:种子内生菌对种子的生长发育具有重要作用。为深入了解烟草种子内生真菌群落结构与多样性,以IIS区的rDNA为靶标序列,采用Illumina Miseq测序技术对K326、云烟85和云烟87烟草种子内生真菌群落结构组成和多样性进行测定分析。结果表明,3个品种烟草种子共获得342264条序列,聚类到110个分类操作单元(OTU),分别属于5个门、13个纲24个目、34个科、56个属。品种K326和云烟85种子内生真菌群落结构相似,多样性均高于云烟87。其中赤霉菌属Gibberella小画线壳属Monographella、链格孢菌属Alternaria、镰刀菌属Fusarium、红酵母菌属Rhodotorula、炭疽菌属Colletotrichum、隐球菌属Cryptococcus和曲霉菌属Aspergillus等在烟草种子中丰度较高。FUNGULD功能预测结果显示,烟草种子内生真菌包括以下功能菌群:植物病原菌、动物病原菌、内生菌、木材腐生菌、地衣寄生菌、土壤腐生菌、木材腐生菌等。烟草种子有丰富的内生真菌定殖,其中潜在的有益功能菌群包括镰刀菌、炭疽菌、隐球酵母菌、赤霉菌、曲霉菌等。
关键词:烟草种子;内生真菌;高通量测序;群落结构
植物内生菌是存在于根、茎、叶及种子等器官组织内部和细胞间隙,对寄主植物没有明显致病性的一类微生物。植物内生菌寄生在寄主植物体内,经过长期协同进化,与寄主植物形成了互利共生的关系。植物内生菌能够促进植物生长,提高植物抗病、抗逆、抗重金属的能力。同时,植物内生菌能分泌抗生素或者具有蛋白质溶解活性的次生代谢产物,与病原菌竞争生态位和营养物质,有利于寄主植物健康生长,且具有重要的生防意义。
种子内生菌可以提高种子萌发率,并能通过生长繁殖传播给子代植株,影响子代植株中菌群的定殖。谭仲夏等报道了云南烟草种子内部携带的真菌有链格孢菌(Alternaria alternata)、镰刀菌(Fusairium spp.)、腐霉(Pythium spp.)、芽枝孢菌(Cladosporium spp,)等真菌,发现不同产区的烟草种子所带的内生真菌种类差异不大,链格孢菌占比较高。以上研究均采用分离培养的方法,前人研究表明,纯培养获得的生物种类数量只占非培养检测微生物总数的0.190~109%,而内转录间隔区(IIS)扩增子测序可真实反应真菌群落结构与多样性,目前已用于医药、工业、农业等领域的微生物相关研究1214。本研究以云烟85、云烟87和K326烟草种子为材料,采用llumina测序技术对烟草种子内生真菌进行IS扩增子测序,全面研究煙草种子内生真菌群落组成与多样性,为今后烟草种子内真生菌的功能研究和利用提供理论参考。
1材料与方法
1.1烟草种子
本研究所采用的烟草种子共3个品种,其中,云烟85和K326裸种于2016年采自贵州烟草科学研究院福泉实验基地田间,未经洗涤;云烟87裸种于2016年采自贵州烟草科学研究院福泉实验基地田间,经水洗后置于阴凉处晾干,所有种子均保藏于贵州省烟草科学研究院-80℃低温冰箱。用流动的自来水冲洗种子表面附属物和泥土。每个品种的种子分别称取10g,依次用75%酒精和2%6NACIO溶液消毒30s和2min,再用无菌水漂洗3次。将最后一次的种子漂洗液涂布于PDA平板上,平板置于28℃生化培养箱内黑暗培养,以检测种子表面是否消毒完全,每个品种3次重复。3个品种种子样品编号分别为K326-1、K326-2、K326-3;Y85-1、Y85-2、Y85-3:Y87-1、Y87-2、Y87-3。
1.2烟草种子总DNA的提取
分别称取上述处理过的每个品种种子样品5g,转移至无菌研钵进行研磨,根据E.ZN.A.R)SoilDNAKit试剂盒操作说明书提取种子样品总DNA,样品总DNA纯度和浓度利用Nanodrop2000检测,其A260/A280检测值在1.82.0之间。
1.3烟草种子IS文库构建及高通量测序
以上述样品的总DNA为模板,利用真菌引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3)ITS2R(5'-GCTGCGTTCTTCATCGATGC-3)对样品基因组DNA ITS1-IS2区进行PCR扩增,利用AxyprepDNA凝胶回收试剂盒切胶回收PCR产物,PCR产物利用2%琼脂糖凝胶电泳检测目的片段大小,采用Quantifluor-ST蓝色荧光定量仪进行检测定量。检测合格后送至上海美吉生物医药科技有限公司进行lumina高通量测序。
1.4测序数据处理与统计分析
测序得到的原始数据过滤掉reads尾部质量值低于20bp的碱基,再过滤掉质控后低于50bp的reads;根据PE序列之间的重叠关系,使用Fash4(https://ccb.hu.edu/software/flashindex.html)对序列进行拼接,其中,重叠的部分需大于10bp,重叠区错配比需小于0.2,并调整系列方向得到优化序列。
利用Search软件平台(version7.0hpdrivecom/search,)在上述优化序列中提取非重复序列并去除单序列,按照97%6的相似性对非重复序列进行OTU聚类并去除嵌合体。利用RDPclassifier(hp:rpcme.msu.)贝叶斯算法对OU序列进行分类学分析,并比对Unie数据库(Release7.2hts:/unite.ut.ee/index.php),其比对值需高于70%。KAmothur(https:/mothur.org/wiki/calculators软件计算α多样性指数,以Shannon指数和Simpson指数分析烟草种子内生真菌群落的多样性,以Sobs指数分析烟草种子内生真菌群落的丰富度;利用R语言工具统计并绘制各分类水平的群落结构图,分析样品微生物群落结构;并利用R语言工具绘制群落热图和PCA分析图进行β多样性分析;比对FUNGUILD数据库,分析烟草种子内生真菌功能类群。数据分析均在上海美吉生物医药科技有限公司I-Sanger生信云平台上(htp:/wwi-sanger.com/project/index.huml)完成,以上方法与分析部分均参考文献[15]。
2结果
2.1测測序深度及OTU分析
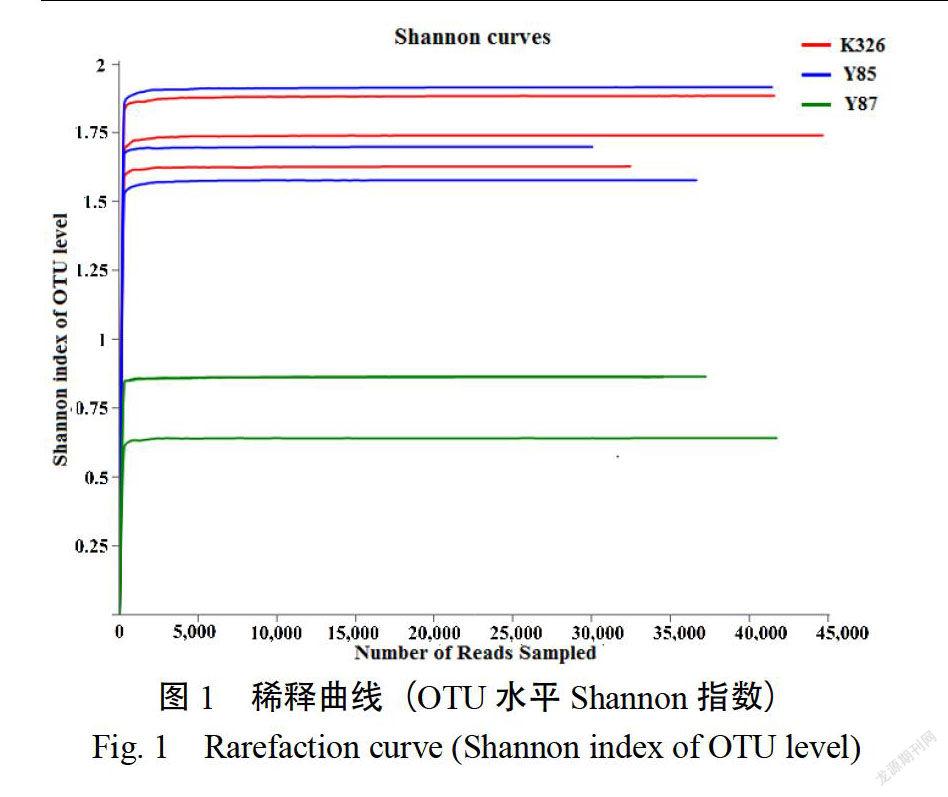
随着序列数量增加,稀释曲线逐渐趋于平缓当序列数达到3000时,稀释曲线基本饱和(图1),表明测序结果可以反映烟草种子内生真菌群落结构。9个样品共得到342264条序列和90937409个碱基,其中,样品K326得到119061条序列和29951225个碱基;云烟85得到108113条序列和27181204个碱基;云烟87得到115090条序列和33804980个碱基,所有序列的长度均在202~343bp之间每个品种种子的内生真菌在各分类水平的数量不同,其中样品K326中的数量最多,其次是云烟85,云烟87最少(表1)。3个品种烟草种子共有的内生真菌包括19个属和24个OTU(图2)。
2.2内生真菌群落Alpha多样性分析
根据生真菌群落alpha多样性指数(表2)可知,3个样品的覆盖率(coverage)均大于99.8%,表明测序数据基本覆盖了3个烟草样品中所有真菌的生物信息。Shannon指数和Simpson指数结果显示,云烟87的内生真菌群落多样性显著低于其他两个品种(Simpson指数越大,微生物群落多样性越低)。3个烟草种子的内生真菌群落丰富度指数(Sobs、Ace、Chao指数)大小依次为:K326》云烟85》云烟87。但Ace和Chao指数表明不存在显著性差异。
2.3内生真菌群落结构与组成
对所有OU序列进行分类,结果表明烟草种子内生真菌主要分布于子囊菌门Ascomycota和担子菌门Basidiomycota。K326、云烟85、云烟87子囊菌门的内生真菌分别占95.16%6、8897%6和98.13%,担子菌门的内生真菌分别占3.07%、1.83%和0049%(图3)。
从属的水平进行分析,K326与云烟85种子内生真菌群落间的差异较小,而这两个品种与云烟87相比存在显著差异。图4所显示为丰度大于001%的菌属,其中,K326种子赤霉菌属Gibberella占44.83%,链格孢菌属Alternaria占39.44%,镰刀菌属Fusariun占465%,隐球菌属Cryptococcus占2.32%,炭菌属Colletotrichum占1.19%,小画线壳属MonographellaI占0.53%,红酵母属Rhodotorula占0.55%;云烟85种子中赤霉菌属占43.66%,小画线売属占26.17%,链格孢菌属占10.41%,镰刀菌属占6.739%,红酵母属占1.07%,炭疽菌属占0.46%,隐球菌属占0.36%6;云烟87种子中曲霉菌属Aspergllus占95.69%,赤霉菌屬占0.18%,链格孢菌属占091%,镰刀菌属占0.11%,隐球菌属占0.03%,小画线売属占0.441%,红酵母属占0.019%6。
同时,在3个烟草(K326、云烟85、云烟87)种子中核盘菌科的真菌分别占3.139%、0.06%和0.71%种水平Circs图(图5)表明,3个品种种子在种水平丰度较高的菌种包含帚状曲霉菌Aspergillus penicillioides、错综赤霉菌Gibberella africans、Monographella cucumerina、玉米赤霉菌
Gibbberella zeae、浅蓝灰曲霉菌Aspergillus caesiellus、大隐球酵母菌Cryptococcus magnus、亮白曲霉菌Aspergillus candidius、桑帕约氏酵母菌Rhodotorula vanillic。其中,Aspergillus cibarius仅存在于云烟85和云烟87种子中。
2.4内生真菌群落Beta多样性分析
图6显示,PC1和PC2对样品群落的贡献率分别为87.88%和9.81%,是烟草种子内生真菌群落结构的主要影响因素,且PC1的影响明显大于PC2。3个品种的样品斑点彼此分开,内生真菌群落结构存在一定的差异性。在PC1的作用下,云烟87种子样品斑点与其他品种斑点拉开距离,PC1是云烟87种子内生真菌群落的主要影响因素,在PC2的作用下,K326和云烟85种子样品斑点间拉开距离,PC2是形成K326和云烟85种子内生真菌群落差异性的主要因素。
从属水平对3个品种的烟草种子内生真菌丰度进行排序,分别选取前30个属绘制群落热图(图7),热图上方的样本聚类树显示,每个品种的3个样品单独聚为一个分支,表明测序结果具有代表性,能够真实地反应各样品的群落结构与多样性。品种K326和云烟85种子样品聚为一个大分支,品种云烟87种子样品再与之类聚,表明K326和云烟85烟草种子内生真菌群落较为相似。
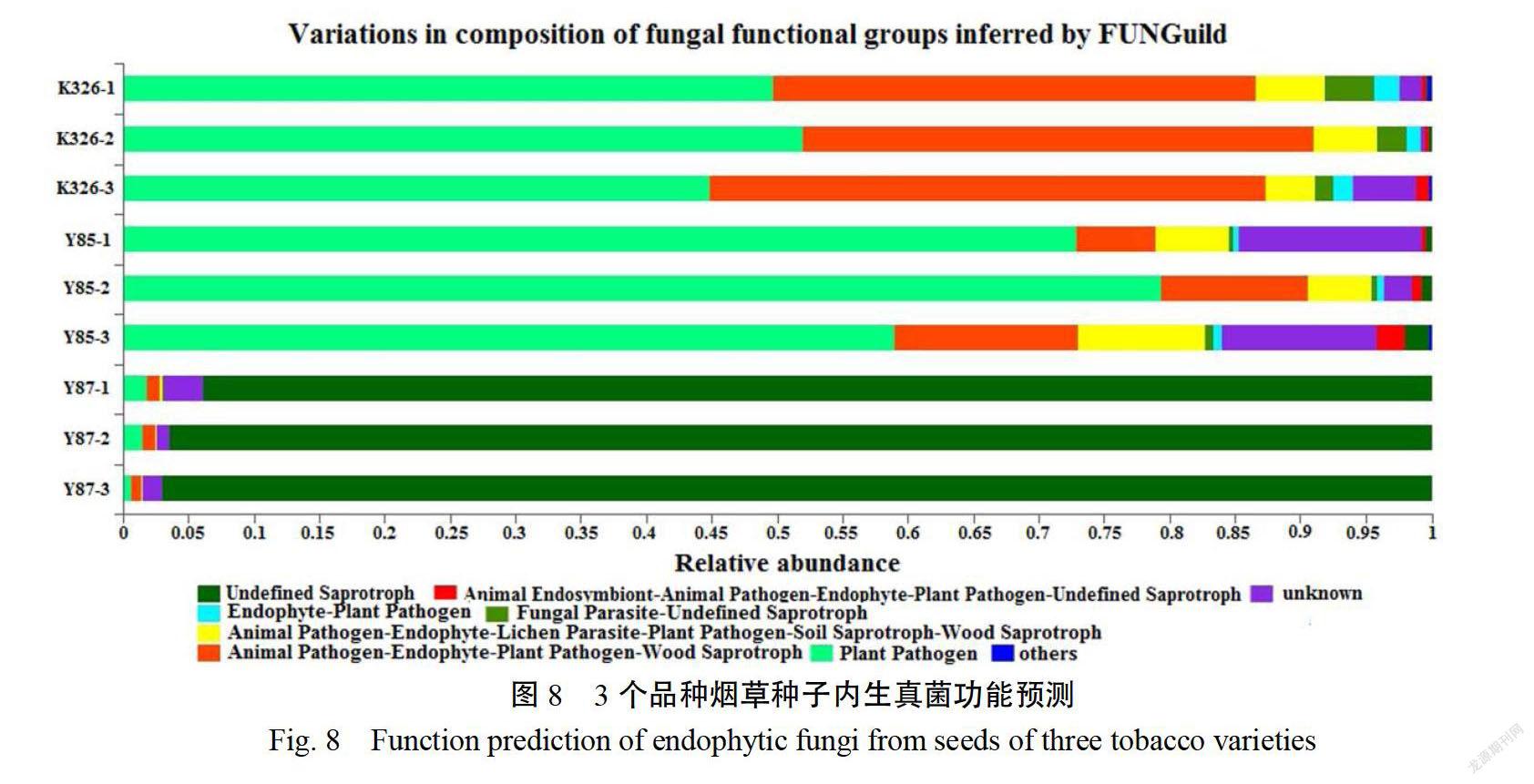
2.5内生真菌FUNGUILD功能预测
为了解烟草种子内生真菌群落功能,通过比对FUNGUID数据库对3个品种烟草种子内生真菌进行功能预测(图8)。结果表明,3个品种的烟草种子内生真菌的OTU分属于腐生营养型(Saprotroph)病理营养型(Pathotroph)、病理-腐生营养型(Pathotroph-Saprotroph)、病理-共生营养型(Pathotroph-Symbiotroph)、腐生-共生营养型(Saprotroph-Symbiotroph)、病理-腐生-共生营养型(Pathotroph-Saprotroph-Symbiotroph)。其中,云烟87种子内生真菌的功能群与其他两个品种存在显著差异,K326和云烟85种子内生真菌的功能群较为相似。云烟87种子内生真菌主要是未经定义的腐生菌群(93.819%~96.98%);K326种子内生真菌主要为植物病原菌(44899%~52.03%)、动物病原菌-内生菌植物病原菌-木材腐生菌(36.91%~42.45%)、动物病原菌-内生菌-地衣寄生菌-植物病原菌-土壤腐生菌-木材腐生菌(3.82%5.26%)、寄生真菌-未经定义的腐生菌(1.449%~3.87%6)、内生菌-植物病原菌1.15%~1.86%6)等类群;云烟85种子内生真菌主要为植物病原菌(5900%079.37%6)、动物病原菌-内生菌植物病原菌-木材浮生菌(5.97%6~14.00%)、动物病原菌-内生菌地衣寄生菌-植物病原菌-土壤腐生菌-木材腐生菌(5.64%~9.71%)、动物内生共生菌-动物病原菌-内生菌-植物病原菌-未经定义的腐生菌(0.3102.12)等类群。
3讨论
高通量测序硏究烟草种子内生真菌的可行性近年来,人们对种子携带微生物种类及其功能越来越重视。利用高通量测序技术研究种子内生真菌可以克服分离培养的生物信息量低的局限性,保证了内生真菌群落结构的完整性。本研究利用Ilumina高通量测序技术研究3个品种烟草种子内生真菌,共获得了S1-IS2区342264条有效序列和110个OTU,分布于56个真菌属,表明了烟草种子有丰富的内生真菌定殖,也证实了Illumina高通量测序技术研究烟草种子内生真菌的可行性。
3.2不同烟草品种种子内生真菌群落差异
3个品种烟草种子内生真菌主要分布于赤霉菌属、曲霉菌属、链格孢属、隐球菌属、红酵母属、炭疽菌属、镰刀菌属、小画线売菌属以及未经分类的核盘菌科,前人研究结果表明,这些真菌存在于各类种子中61,表明烟草种子与其他种子定殖的内生真菌种类具有相似性。已有研究表明,土壤生存环境、寄主植物基因型以及种子质量均会对寄主植物种子微生物群落造成影响啊。Alpha多样性及群落结构结果显示,K326和云烟85种子内生真菌群落结构与多样性相似,与云烟87存在差异性。云烟85和云烟87均以K326为父本、以贵烟2号为母本杂交而来,K326、云烟85和云烟87均抗黑胫病、根结线虫病等,但对赤星病的抗病能力有差异,K326为赤星病高感品种,云烟85和云烟87为赤星病中感和低感品种192。由属水平群落组成丰度图所示,K326种子中的链格孢菌明显高于云煙85和云烟87,这可能与其对赤星病的抗病性相关。
3.3烟草种子潜在有益生真菌
据内生菌相关研究表明,在植物内生菌中,镰刀属菌株对植株有明显的促生作用,使寄主体内的重金属Cd+、As+、Pb+含量显著下降2,对种子萌发具有促进作用2;炭疽属菌株对青病菌、黄瓜角斑病菌、番茄疮痂病菌等多种病原菌具有抑制作用,且具有良好的抗氧化作用2;内生胶孢炭疽菌Colletotrichum gloeosporioides代谢产物具有显著的磷脂酰肌醇3-激酶(PI3K)抑制活性2;曲霉属和赤霉属内生菌株也存在一定抑菌活性2。本研究3个品种的烟草种子也存在上述真菌属真菌,表明烟草种子内生真菌存在潜在的生防菌资源。本研究中的帚状曲霉菌可产生专性嗜盐青霉a淀粉酶2;大隐球酵母菌的代谢产物甘草酸苷可用于提取单葡萄糖醛酸甘草次酸(GAMG)P2;亮白曲霉菌可产生乳糖酶,乳糖酶可用于生产低乳糖乳制品2,还可用于黄酮类化合物的生物合成2;浅蓝灰曲霉菌可产生纤维素酶、木聚糖酶、锰过氧化物酶(MnP)和酯酶。帚状曲霉菌、大隐球酵母菌、亮白曲霉菌和浅蓝灰曲霉菌在烟草种子中的功能还有待进一步的研究证明。
3.4烟草种子内生真菌群落功能
FUNGUILD功能预测结果表明,3个品种烟草种子内生菌大部分都被定义为植物病原菌、动物病原菌-内生菌-植物病原菌-木材腐生菌和未分类的腐生菌等类群,病原菌与腐生菌类群丰度较高表明了较多病原菌和腐生菌寄生于烟草种子内,当种子离开植株后可能在适当的条件下使种子产生腐败或霉变。这也证实了许多植物病原菌能够以内生菌的营养方式在植物体内生长,但不会引起寄主出现病害症状,在一定条件下可以转变为“病原菌”,由此产生病害或腐败l-。链格孢属中的Literaria alternata会引起烟草赤星病,在本研究中,链格孢菌的丰度较高,内生的链格孢菌在烟草种子中是否在种子萌芽期转变为病原菌传播给子代还有待深入研究。但是在使用FUNGUILD来解析烟草种子内生真菌功能群时,观察到一些真菌功能解析不完全。例如Monog hella cucumerina仅被界定为病原菌,Aspergillus candidus仅被界定为腐生菌,但Monographella cucumerina和Aspergillus candidus也被报道为植物内生菌53,这表明FUNGUID数据库有待补充完善。
4结论
本研究通过高通量测序明确了3个品种烟草种子内生真菌的种类,主要分布于赤霉菌属、曲霉菌属、链格孢属、隐球菌属、红酵母属、炭疽菌属、镰刀菌属、小画线壳菌属。烟草种子内生真菌丰度可能与品种抗性相关。烟草种子中还存在着许多功能菌群,潜在的益生菌包括:镰刀菌、炭菌、隐球酵母菌、赤霉菌、曲霉菌等,可为今后在烟草种子内生真菌中筛选生防菌提供参考。对于种子内生真菌中的益生菌资源挖掘有待在今后的研究中陆续开展。
参考文献
[1]BACON C W, WHITE JF, STONE J K. An overview of endophytic microbes [M]. New York: Cambridge University Press, 2000: 3-29
[2]方珍娟,张晓,马立安.植物内生菌研究进展长江大学学报(自然科学版),2018,15(10):41-45
[3]宋薇薇,朱辉,余风玉,等.植物内生菌及其对植物病害的防治作用综述.江苏农业科学,2018,46(6):12-16
[4]杨玉锋,李保利.植物内生真菌在植物病害生物防治中的作用河南农业科学,2011,40(3):25-28
[5]新锦,赵庆,张晓梅,等.植物内生菌活性代谢产物最新研究进展微生物学杂志,2018,38(3):103-113
[6] BARRET M, BRIAND M, BONNEAU S, et al. Emergence shapes the structure of the seed microbiota J). Applied and Environmenta Microbiology,2015,81(4):1257-1266
[7] BERG G, RAALMAKERS J[M]. Saving seed microbiomes [J]. Isme Joumal,2018,12(5):1167-1170
[8] TRUYENS S, WEYENS N, CUYPERS A, et al. Bacterial seed endophytes: genera, vertical transmission and interaction with plants [J]. Environmental Microbiology Reports, 2015, 7(1): 40-50
[9]谭仲夏,方敦煌,白水富,等云南烟草种子内部真菌带菌检测.西南农业大学学报,200,24(5):428-430
[10] AMANN R I, LUDWIG W, SCHLEIFER K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation [J]. Microbiol Reviews, 1995, 59(1): 143-169
[11] FILIPPIS F D, LAIOLA M, BLAIOTTA G, et al. Different amplicon targets for sequencing-based studies of fungal diversity[J]. Applied and Environmental Microbiology, 2017, 83(17): e00905-17
[12] GUO Y J, WANGR L, ZHAO Y E, et al. Study on the relationship between microbial composition and living environment in important medical mites based on Illumina Miseq sequencing technology Journal of Medical Entomology, 2020, 57(4): 1049-1056
[13] XIE G F, WANG L, GAO Q K, et al. Microbial community structure in fermentation process of Shaoxing rice wine by Illumina-based metagenomic sequencing[J]. Joumal of the Ence of Food Agriculture,2013,93(12):3121-3125
[14] BERGSVEINSON J, PERRY B J, SHEEDY C, et al. Identifying the core bacterial and fungal communities within four agricultural biobeds used for the treatment of pesticide rinsates [J]. Journal of Applied Microbiology, 2018, 125(5): 1333-1342
[15]謝红炼,汪汉成,蔡刘体,等.烟草种子内生细菌群落结构与多样性微生物学报,2020,60(3):601-616
[16] KIAEDTKE S, JACQUES M A, RAGGI L, et al. Terroir is a key driver of seed-associated microbial assemblages [J]. Environmental Microbiology,2016,18(6):1792-1804.
[17] CHEN H M, WU HX, YAN B, et al. Core Microbiome of Medicinal Plant Salvia miltiorrhiza Seed: A Rich reservoir of beneficial microbes for secondary metabolism?[J]. International Journal of Molecular Sciences, 2018, 19(3): 672
[18] WALITANG DI, KIM CG, KIM K, et al. The influence of host genotype and salt stress on the seed endophytic community of salt-sensitive and salt-tolerant rice cultivars[J]. BMC Plant Biology2018,18(1):1-16.
[19]段旺军,王素琴,刘风兰,等.几个优良烤烟品种介绍河南农业科学,2002(1):15-17
[20]谭彩兰,李永平.烤烟新品种云烟85的选育及其特征特性,中国烟草科学,1997,22(1):7-10
[21]李永平,王颖宽,马文广,等,烤烟新品种云烟87的选育及特征特性.中国烟草科学,2001(4):38-42
[22]金慧清,程昌合,徐清泉,等烟草内生真菌对烟草生长和烟叶重金属含量的影响菌物学报,2017,36(2):186-192
[23]郭顺星.药用植物内生真菌生物学(上卷)[DM].北京:科学出版社,2016:443-447
[24]单体江,秦楷,谢银燕,等木麻黄内生真菌次生代谢产物及生物活性.华南农业大学学报,2019,40(3):67-74.
[25]YANG Z D, LI Z J, ZHAO J W, et al. Secondary Metabolites and PI3K Inhibitory Activity of Colletotrichum gloeosporioides, a fungal endophyte of uncaria rhynchophylla [J]. Current Microbiology, 201976(10):904-908
[26] ALI I, AKBAR A, ANWAR M, et al. Purification and characterization of a polyextremophilic a-amylase from an obligate halophilic Aspergillus penicillioides isolate and its potential for souse with detergents [J]. Biomed Research International, 2015(1): 245649
[27] KURAMOTO T, ITO Y, ODA M et al. Microbial production of glycyrrhetic acid 3-o-mono-b-d-glucuronide from glycyrrhizin by Cryptococcus magnus MG-27 [J].Bioence Biotechnology and
Biochemistry,2014,58(3):455-458
[28]张伟,范云六,姚斌亮白曲霉乳糖酶基因在毕赤酵母中的高效分泌表达及酶学性质研究.微生物学报,2005,45(2):247-252
[29] BURNS MK, COFFIN J M, KUROBANE, et al. Biosynthesis of chlorflavonin in Aspergillus candidus: a novel fungal route to flavonoids [J]. Journal of the Chemical Society. Chemical Communications. 1979: 426-427
[30] BATISTA-GARCIA R A, BALCAZAR-LOPEZ E MIRANDA-MIRANDA E, et al. Characterization of lignocellulolytic activities from a moderate halophile strain of Aspergillus caesiellus isolated from a sugarcane bagasse fermentation [J]. Plos One, 20149(8)e05893
[31] PROMPUTTHA I, LUMYONG S, DHANASEKARAN V, et al. A phylogenetic evaluation of whether endophytes become saprotrophs at host senescence J]. Microbial Ecology, 2007, 53(4): 579-590
[32] SONG Z W, KENNEDY P G, LIEW F J, et al. Fungal endophytes as priority colonizers initiating wood decomposition [J]. Functional Ecolo]gy,2017,31(2):407-418
[33]姜道宏.植物內生真菌及其展望.中国生物防治学报,2015,31(5):742-749.
[34]王佩,欧雅姗,张强,等烟草赤星病研究进展安徽农业科学,2018,46(21):33-36
[35]黄黎锋,谢恬,王秋艳,等.内生真菌HL-02及其在制备D-泛解酸内酯中的应用:CN10229894AP]2011-1-02
[36]马洁,郑纪勇,孙泽涛,等1株花柳珊瑚来源真菌Aspergillus candidus次级代谢产物及其生物活性研究.中国海洋药物,2016

