真菌核型分析方法概述与展望
李波 严莉洪 施碧红
摘 要:真菌的核型分析是指对真菌细胞染色体的形态特征及表征进行分析,包括染色体的数目、长度、着丝粒位置等内容的研究,可以为真菌分类、遗传进化及染色体变异等提供重要依据。介绍了真菌核型分析的常用方法及其原理、样品制备等,比较了各方法的优劣,为真菌染色体核型研究的方法选择与改进提供参考。
关键词:真菌;核型分析;染色体;展望
中图分类号:Q 933 文献标志码:A 文章编号:0253-2301(2021)01-0068-06
DOI:10.13651/j.cnki.fjnykj.2021.01.012
Abstract:The karyotype analysis of fungi refers to the analysis of the morphological characteristics and characterization of the chromosomes of fungal cells, including the study of the number and length of chromosomes and the position of centromeres, etc., which can provide an important basis for the classification, genetic evolution and chromosome variation of fungi. The common methods of fungal karyotype analysis, its principle and sample preparation were introduced in this paper, and the advantages and disadvantages of each method were compared, so as to provide reference for the selection and improvement of methods for the study of fungal karyotype.
Key words:Fungi; Karyotype analysis; Chromosome; Prospect
真菌種类繁多,数量可达数万种,在人类活动中发挥着各种各样的作用。有益的作用包括曲霉、青霉等属的真菌能够产生广泛的次生代谢物,是各种药物(如青霉素、洛伐他汀、生物碱等),以及有机酸、工业酶的重要生产者;还有些真菌被直接用于发酵食品的生产,如米曲霉和黑曲霉等长期用于清酒、酱油和普洱茶等的生产,是人类重要的经济物种[1]。有害的影响是有些真菌产生的毒素可直接对动植物带来危害,如黄曲霉毒素会引起人及动物肝脏的病变;由真菌引起的植物真菌病害占了植物病害的70%~80%,对农业生产造成巨大损失等[1]。
真菌核型分析是指对真菌细胞染色体的表型特征及表征进行分析,包括染色体的形态、数目、大小、带型等内容的研究。据报道的真菌核型分析显示,在不少真菌物种中,存在染色体大小或数量的变异[2],而且这种变异往往伴有表型差异,包括形态[3]、抗生素生产[4]或宿主范围[5]。对于无性植物病原真菌,染色体大小和数量的变异则导致有毒菌株或致病菌株的出现[2]。核型分析作为真菌分类及遗传研究的重要手段,它为真菌的进化与分类、染色体结构、形态与变异以及基因定位等提供了重要的研究基础和理论。开展真菌核型分析也是解析各类真菌对人类积极或消极影响的遗传机制的重要途径。
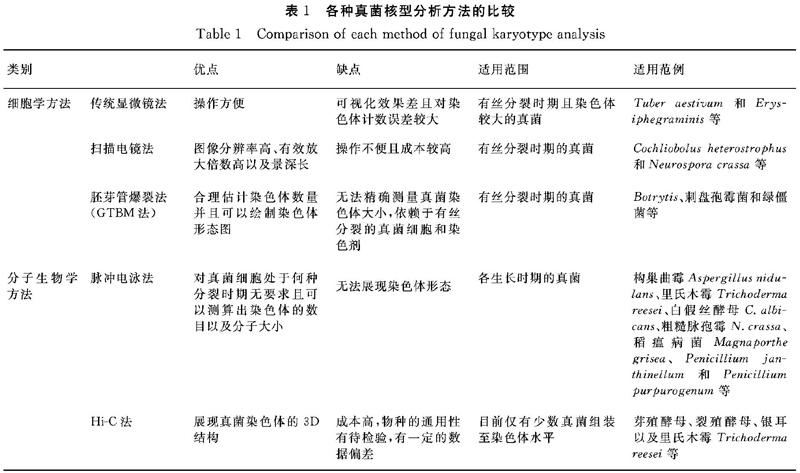
目前,真菌的核型分析方法主要分为细胞学方法和分子生物学方法两类,细胞学方法主要有传统显微镜法、扫描电镜法、胚芽管爆裂法;分子生物学方法主要有脉冲电泳法和HiC法等。通过概述上述方法的原理、创建与发展过程、样本制备等内容,比较分析了其各自的长处与缺陷,以期为真菌核型分析研究的方法选择与技术改进提供参考。
1 真菌核型分析方法
1.1 细胞学方法
1.1.1 传统显微镜法 真菌核型分析最关键的是确立真菌染色体的数目,染色体的数目是最准确、最直接的倍性测定方法[6-7]。传统光学显微镜法是观察真菌染色体最早的方法。一般来说,利用传统显微镜法观察处理真菌细胞样本的主要步骤有:首先获得有丝分裂中期的真菌细胞,再通过秋水仙素处理,其次用卡诺氏固定液(一般为3∶1)处理,最后使用Orcein染料染色观察。
采用传统显微镜观察真菌染色体操作简便,但要求真菌的染色体较大才能具有较好的效果。然而对大多数真菌来说,由于其染色体很小,即便细胞处于有丝分裂中期,染色体也是处于凝缩状态,在这种情况下,对真菌进行染色体形态分析以及计数就很困难。通常只能通过多次观察收集大量的数据求平均值来减少染色体计数的误差。但是这种误差在一些具体的真菌菌株上仍然不可避免,如在Nectria haematococca[8]中,使用传统显微镜法观察的染色体数目远小于其他方法所获得的染色体数目。传统光学显微镜对染色体可视化的效果比较差,极大地限制了其在真菌核型分析中的应用。以目前的研究条件,使用传统的光学显微镜观察真菌染色体的具体特征如着丝粒、随体等难度仍然较大,反之亦很难通过着丝点或者着丝粒等特征来识别染色体。但是通过一些真菌独有的特性可以辅助观察染色体。如Shirane等[9]利用染色体顶端的丝状结构来识别灰霉病菌Botrytis染色体。
然而通过独有特征方式来观察染色体不具有普适性。因此除了以上少数例子外,利用传统显微观察法,大部分真菌染色体的区分都是基于染色体相对长度的比较和排序。如,在Tuber aestivum中,Poma等[10]利用碘化丙啶染色通过共聚焦显微镜观察到5~6条染色体;在Erysiphe graminis中,Borbye等[6]则通过光学显微镜观察到7~8条染色体。
1.1.2 扫描电子显微镜法 扫描电子显微镜在观察真菌细胞样本时,其工作原理是电子束逐点在真菌样本表面扫描产生二次电子,采集二次电子信息以获得真菌样本的表面特征图像。在利用扫描电镜观察真菌样本前,首先真菌细胞需培养至有丝分裂中期时期,再用羟基脲或者噻苯咪唑处理培养以获得其有丝分裂中期的细胞核;其次分别用2.5%戊二醛溶液和卡诺氏固定液(6∶1,具体视真菌菌种而定)处理真菌细胞,其中卡诺氏固定液一般处理30 min;最后DAPI染色。
扫描电子显微镜具有图像分辨率高、有效放大倍数高以及景深长的优点。但是,它要求样本制备时选取有丝分裂中期的真菌细胞以方便观察;真菌细胞样本表面具有良好的导电性,并且样本里不能有太多的水分。对于一些不能导电的样品,一般需要喷金。这无疑增加了真菌细胞样本制备的步骤和试验成本[11]。与传统光学显微镜一样,也需要多视野观察,以此来确定染色体形态。扫描电镜法很少单独使用,常常是作为其他方法的补充,特别是在使用传统光学显微镜观察真菌染色体形态不清晰时使用。一般来说,在对真菌细胞进行核型分析时,不建议单独使用扫描电镜法,除非是实验室对真菌核型分析的研究方法已经成熟建立。
1967年,Neurath等[12]利用扫描电镜对人的染色体三维结构进行了广泛的研究。2004年Tsuchiya等[13]首次将扫描电子显微镜应用于真菌染色体的超微结构以及细胞核的可视化,利用扫描电镜观察到异旋孢腔菌Cochliobolus heterostrophus和粗糙脉孢霉Neurospora crassa有丝分裂中期染色体的三维图像,观察到高度浓缩且整体形状似圆柱形的染色体,并且着丝粒明显收缩。从扫描电镜中获得的三维信息可以揭示真菌细胞核分裂过程中染色质紧实形成浓缩染色体的方式[14]。
1.1.3 胚芽管爆裂制片法 胚芽管爆裂制片法(Germ tube burst method,即GTBM法)是Shirane等[9]于1989年创立的一种使用光学显微镜观察真菌染色体特有的方法。作者用甲醇、冰醋酸按照一定的比例混合处理分生孢子胚芽管或幼菌丝使其破裂,并进一步通过低渗高温处理使其排出染色体,在载玻片的表面扩散,此时和吉姆萨染料结合,可以较为准确地计数真菌的染色体数目。
GTBM法依赖于显微镜观察,但相对于传统显微镜法处理真菌细胞样本的方式较为新颖,一方面,对丝状真菌特别是有丝分裂中期的真菌具有良好的通用性;另一方面,GTBM法可以对染色体数量进行合理的估计,并给出染色体形态的信息[8]。但是,GTBM法无法精确测量真菌染色体大小。另外,GTBM法的效果依赖于能否准确找到真菌有丝分裂时间以及染色剂的效果。后续学者们从不同种类的真菌样品的处理方法以及固定液的配比等方面对GTBM法进行了改进[11,15],也有用荧光染料(一般为DAPI染料)代替吉姆萨染料或者是利用两种染料共同作用来观察和确定真菌染色体条数。
Taga等利用改进的GTBM法建立了真菌的有丝分裂细胞学模型[16],该模型确立了3种刺盘孢霉(Colletotrichum orbiculare、Colletotrichum graminicola和Colletotrichum higginsianum)的染色体形态以及染色体数量。目前使用GTBM法确定了真菌染色体数目的真菌主要有绿僵菌Metarhizium acridum菌株(10条)[15]、咖啡刺盘孢Colletotrichum kahawae菌株(11~14条,其中有多条小染色体)[17]、果生刺盘孢Colletotrichum fructicola菌株(>10条)等[11]。
1.2 分子生物学方法
1.2.1 脉冲电泳法 脉冲电泳是真菌核型分析的重要技术,其原理是将真菌的染色体DNA样品放在变电场中改变样本DNA的迁移方向,以分离不同大小的DNA分子,凝胶染色后观察DNA条带的位置和亮带个数来推算真菌染色体的大小以及数目。1984年Chwartz等首次将脉冲电泳技术用于酵母染色体的分离[18],1993年脉冲电泳技术被应用于真菌核型分析[19]。在真菌中较常用的脉冲电泳系统是箝位匀强电场脉冲电泳系统(即CHEF系统),运用此法首先分离了啤酒酵母和栗酒裂殖酵母的染色体[20-21],这2种酵母的染色体已经被作为参照物来测量其他真菌的染色体大小以及衡量真菌染色体的数目。一般来说,采用箝位匀强电场脉冲电泳(CHEF)时,要用低熔点琼脂糖对经酶解处理的真菌原生质体制作包埋块,此时要注意琼脂糖的浓度[22]。设置CHEF电泳条件时,也需要根据真菌的种类特别是真菌的染色体DNA分子大小进行调整。
脉冲电泳的分辨率主要取决于脉冲时间、电场强度等因素,其中最为关键的因素是脉冲电泳时间。若要分离长度较大的分子,可适当增加脉冲电泳时间。反之可适当减少脉冲时间。现阶段的脉冲电泳已经克服了失真严重的缺陷且可以分辨长度超过6 Mb的片段。虽然利用脉冲电泳法有许多优点,比如无须考虑所选的真菌细胞是否处于分裂中期,即可通过电泳图来测算染色体的大小和数目,但是无法从肉眼上直观地去观察染色体,且脉冲电泳所能分离的条带亦有一定的范圍(10 kb~10 Mb)[11,15]。此外,若真菌的多条染色体大小接近且都重叠在一起,脉冲电泳法亦无法分离之。
目前,脉冲电泳已广泛应用于真菌物种中染色体的计数和大小测算以及染色体的表征,如利用脉冲电泳测得Penicillium janthinellum[23]和Penicillium purpurogenum[24]的染色体数目分别为8条和5条,其大小则分别为2.0~8.0 Mb和2.3~7.1 Mb。经CHEF系统分离出染色体核型的真菌有构巢曲霉Aspergillus nidulans[25]、里氏木霉Trichoderma reesei[26]、白假丝酵母Candida albicans[27]、粗糙脉孢霉Neurospora crassa[28]、稻瘟病菌Magnaporthe grisea[29]等模式真菌。这些模式真菌染色体核型的测定,为后续其他真菌的染色体核型的测定提供了参考。
1.2.2 HiC技术法 染色体构象捕获(chromosome conformation capture,3C)及其衍生技术(HiC等)的发展补充了显微镜研究染色体的方法,可以从细胞群中获得关于染色体更高分辨率的数据[30]。尤其是HiC技术(High throughput 3C),作为高通量测序技术和染色体构象捕获技术相结合而衍生的新技术,可以更清晰地观察染色体的空间构象,深刻地理解染色体结构与功能、基因表达调节机制。随着测序技术的发展,许多处于重叠群水平的真菌基因组被公布。HiC技术可以将真菌零散基因组序列片段组装到染色体水平,并且可以明确这些序列在染色体上的顺序与方向。利用HiC技术分析真菌染色体的主要步骤有:首先使用固定剂(一般为甲醛)对真菌样品进行处理;其次,利用限制性内切酶对其进行酶切处理;最后,利用亲和素特异性结合生物素的原理,通过添加生物素标记的核苷酸结合测序技术,预测真菌的染色体3D结构[31]。利用高分辨率的HiC技术可以清晰地揭示真菌染色体层次分明的系列亚结构,如在细胞核内的线性一级结构、染色体当中的DNA的拓扑相关结构域(TAD)等结构以及多染色体的3D结构[31]。
HiC技术在研究真菌染色体方面遇到的难点在于基因位点间形成的接触数据规模的增加和HiC数据的偏差[32],以及缺乏精细的单倍体三维结构的特征及功能分析[33]。影响HiC技术流程的因素主要有细胞总量、样品降解、DNA总量、交联作用和生物素化标记[34-39]。另外,HiC技术的成本较高,也是阻碍其广泛应用于真菌染色体核型分析的原因之一。
2010年Tanizawa等[40]和Duan等[41]利用HiC技术成功构建了芽殖酵母和裂殖酵母的染色体3D结构。邓优锦等[42]则利用此技术将银耳的基因组组装至接近染色体水平。Hervé Marie-Nelly等[43]将全基因组染色体构象捕获及GRAAL算法应用于里氏木霉Trichoderma reesei的装配,获得了与已知的该物种核型一致的叠群数。但是,以上方法对于其他物种的通用性仍然有待检验。
2 真菌核型分析方法的比较
表1比较了上述几种真菌核型分析方法的优缺点。研究者可根据具体的真菌物种以及实验室的自身条件选择2~3种方法进行分析。总的来说传统显微镜结合胚芽管爆裂法以及脉冲电泳法是目前真菌核型分析较通用的方法;扫描电镜法和HiC法成本较高,尤其是HiC法在真菌中的应用仍在完善与发展中。
3 讨论与展望
真菌核型分析的关键在于对真菌染色体的形态观察以及数量确定。然而不同真菌的细胞生长繁殖方式差异大,许多真菌生活史中有性生殖和无性生殖并存。对这些真菌进行核型分析时,不同的方法得出的结论常常不同。如在Nectria haematococca[8]中,利用传统显微镜法、GTBM法以及脉冲电泳法对其进行染色体数目确定时,不同方法得到的染色体数目存在明显差异,这一方面由于真菌的染色體过小处于极限,而光学显微镜的分辨率不足以分辨其差异导致检测损失;另一方面因为真菌染色体的聚集、凝缩,使得对真菌染色体形态分析以及准确计数误差增加。
研究表明,使用单一的核型分析方法同时清晰地观察真菌的染色体形态、准确地确定染色体数量以及大小是非常困难的,联合使用细胞学方法和分子生物学方法是优选方案。Taga等[16]在3种刺盘孢霉(C.orbiculare、C.graminicola和C.higginsianum)联合GTBM法和脉冲电泳法准确地确定了其染色体数量和大小并且清晰观察到了其有丝分裂间期、中期以及后期染色体的形态,使真菌染色体核型分析技术取得较大突破;Ayukawa等[44]亦联合了GTBM法和脉冲电泳法在Fusarium oxysporum上观察到了其有丝分裂间期和中期时的染色体形态并且确定了其染色体数目和大小。这种染色体核型分析方法的建立为其他真菌完整的染色体核型分析提供了参考。本实验室在对丝状真菌灰黄青霉Penicillium griseovulfum的染色体核型分析中发现,采用传统的光学显微镜法很难观察到染色体形态,但结合GTBM法,初步观察到了灰黄青霉的染色体形态和数目(数据未发表),后续将结合脉冲电泳法确认观察到的染色体数目的准确性,并运用Hi-C技术进一步将实验室已完成的灰黄青霉基因组序列组装到染色体水平。
与传统单一的核型分析方法对丝状真菌进行染色体核型分析相比,联合使用GTBM法和脉冲电泳法有着明显的优势,如观察效果好、成本低等。但是GTBM法和脉冲电泳法在实际操作中也存在各自的难点。GTBM法是一种可以较好地分散真菌染色体的技术,但是它需要有丝分裂中期且其细胞核刚好裂开的真菌细胞。在实际操作中,真菌细胞有丝分裂中期的时间较难确定,需要间隔不同培养时间取样,并配合最适的固定液配比以及合适的染料等以准确确定细胞有丝分裂各个时期。在脉冲电泳实际操作中,凝胶浓度、脉冲时间、电压以及交换时间这些参数,需要根据具体的真菌染色体DNA分子大小,在充分的预试验基础上进行设置。
总之,真菌核型分析的关键在于对真菌的染色体的形态观察以及数量和大小的确定,这也是衡量真菌核型分析方法优劣与技术改进的标准。相比于动植物核型分析研究,真菌核型分析的研究相对滞后,为获得全面的真菌染色体形态图以及染色体正确的数量和大小,仍需创建发展新的技术手段。随着全基因组测序技术的快速发展,目前多种真菌的全基因组序列已被测序。3C及其衍生技术Hi-C等技术的发展及其在真菌核型分析中的应用,将为真菌的染色体核型分析提供精细的全方位解析图。真菌核型分析方法的发展与完善将与真菌的外部形态鉴定、基因组序列测序等一起为真菌分类和遗传学深层研究提供重要手段。
参考文献:
[1]HOUBRAKEN J,VRIES R P D,SAMSON R A.Modern taxonomy of biotechnologically important Aspergillus and Penicillium species[J].Advances in Applied Microbiology,2014(86):199-249.
[2]HORNOK L.Chromosomes,karyotype analysis,chromosome rearrangements in fungi[J].Acta Microbiologica et Immunologica Hungarica,1999,46(2-3):273-278.
[3]TAKAHITO,SUZUKI,YUKI,et al.Variation of colony morphology and chromosomal rearrangement in Candida tropicalis pK233[J].Journal of General Microbiology,1991,137(1):161-167.
[4]WALZ M,ULRICH KCK.Polymorphic karyotypes in related Acremonium strains[J].Current Genetics,1991,19(2):73.
[5]Cooley R N,Caten C E.Variation in electrophoretic karyotype between strains of Septoria nodorum[J].Molecular & General Genetics Mgg,1991,228(1-2):17-23.
[6]BORBYE L,LINDE-LAURSEN I,CHRISTIANSEN S K,et al.The chromosome complement of Erysiphe graminis f.sp.hordei analysed by light microscopy and field inversion gel electrophoresis[J].Mycological Research,1992,96(2):97-102.
[7]SANSOME E,BRASIER C M.Diploidy and Chromosomal Structural Hybridity in Phytophthora infestans[J].Nature,1973(241):344-345.
[8]TAGA M,MURATA M,SAITO H.Comparison of different karyotyping methods in filamentous ascomycetes-a case study of Nectria haematococca[J].Mycological Research,1998,102(11):1355-1364.
[9]SHIRANE N.Light microscopic observation of nuclei and mitotic chromosomes of Botrytis species[J].Phytopathology,1989,79(7):728-730.
[10]POMA A,PACIONI G,RANALLI R,et al.Ploidy and chromosomal number in Tuber aestivum[J].FEMS microbiology letters,1998,167(1):101-105.
[11]张欣.小染色体与果生刺盘孢致病分化关联性分析[D].杨凌:西北农林科技大学,2019.
[12]NEURATH P W,AMPOLA M G,VETTER H G.Scanning electron microscopy of chromosomes[J].Lancet,1968,290(7530):1366-1367.
[13]TSUCHIYA D,KOGA H,TAGA M.Scanning Electron Microscopy of Mitotic Nuclei and Chromosomes in Filamentous Fungi[J].Mycologia,2004,96(2):208-210.
[14]IWANO M,FUKUI K,TAKAICHI S,et al.Globular and Fibrous Structure in Barley Chromosomes Revealed by High-Resolution Scanning Electron Microscopy[J].Chromosome Research,1997,5(5):341-349.
[15]郭冰峰.綠僵菌染色体核型分析及其侵染相关基因的FISH分析[D].重庆:重庆理工大学,2014.
[16]TAGA M,TANAKA K,KATO S,et al.Cytological analyses of the karyotypes and chromosomes of three Colletotrichum species,C.orbiculare,C.graminicola and C.higginsianum[J].Fungal Genetics & Biology Fg & B,2015(82):238-250.
[17]PIRES A S,AZINHEIRA H G,CABRAL A,et al.Cytogenomic characterization of Colletotrichum kahawae,the causal agent of coffee berry disease,reveals diversity in minichromosome profiles and genome size expansion[J].Plant Pathology,2016,65(6):968-977.
[18]SCHWARTZ D C,CANTOR C R.Separation of yeast chromosome-sized DNAs by pulsed field gradient gel electrophoresis[J].Cell,1984,37(1):67-75.
[19]MILLS D,MCCLUSKEY K.Electrophoretic karyotypes of fungi:the new cytology[J].Mol.Plant-Microbe Interact,1990(3):351-357.
[20]CHU G,VOLLRATH D,DAVIS R W.Separation of large DNA molecules by contour-clamped homogeneous electric fields[J].Ence,1986,234(4783):1582-1585.
[21]VOLLRATH,DAVIS.Resolution of DNA molecules greater than 5 megabases by contour-clamped homogeneous electric fields[J].Nucleic Acids Research,1987,15(19):7865-7876.
[22]邢来君,李明春.电泳核型分析在丝状真菌研究中的应用[J].微生物学通报,1996,23(4):244-248.
[23]KAYSER T,SCHULZ G.Electrophoretic karyotype of cellulolytic Penicillium janthinellum strains[J].Current Genetics,1991,20(4):289-291.
[24]RENATO C,FRANCISCO F,FELIPE G,et al.Electrophoretic karyotype of the filamentous fungus Penicillium purpurogenum and chromosomal location of several xylanolytic genes[J].Fems Microbiology Letters,2001(2):379-383.
[25]BRODY H,CARBON J.Electrophoretic karyotype of Aspergillus nidulans[J].Proceedings of the National Academy of Sciences,1989,86(16):6260-6263.
[26]GILLY J A,SANDS J A.Electrophoretic karyotype of Trichoderma reesei[J].Biotechnology Letters,1991,13(7):477-482.
[27]MAGEE B B,KOLTIN Y,GORMAN J A,et al.Assignment of cloned genes to the seven electrophoretically separated Candida albicans chromosomes[J].Molecular & Cellular Biology,1988,8(11):4721-4726.
[28]ORBACH M J,VOLLRATH D,DAVIS R W,et al.An electrophoretic karyotype of Neurospora crassa[J].Molecular & Cellular Biology,1988,8(4):1469-1473.
[29]TALBOT N J,SALCH Y P,MA M,et al.Karyotypic Variation within Clonal Lineages of the Rice Blast Fungus,Magnaporthe grisea[J].Applied & Environmental Microbiology,1993,59(2):585-93.
[30]ETHIER S D,MIURA H,JOSE D.Discovering genome regulation with 3C and 3C-related technologies[J].Biochimica Et Biophysica Acta,2012,1819(5):401-410.
[31]郭曉强.Hi-C:高通量染色体构象分析技术[J].科学,2019,71(1):15-18.
[32]张卫.基于Hi-C数据的预测染色体三维结构的方法研究[D].北京:北京工业大学,2016.
[33]崔望.基于Hi-C数据的单倍型三维空间结构及功能分析[D].武汉:华中农业大学,2015.
[34]肖敏.基于Hi-C技术对易位染色体三维结构的初步探讨[D].桂林:广西师范大学,2018.
[35]BERKUM N L V,LIEBERMAN-AIDEN E,WILLIAMS L,et al.Hi-C:A Method to Study the Three-dimensional Architecture of Genomes[J].Journal of Visualized Experiments,2010(39):1-7.
[36]胡文桥,侯越,张峰,等.染色质构象解析技术:Hi-C及染色质构象信息提取[J].基因组学与应用生物学,2015,34(11):2319-2327.
[37]YAFFE E,TANAY A.Probabilistic modeling of Hi-C contact maps eliminates systematic biases to characterize global chromosomal architecture[J].Nature Genetics,2011,43(11):1059.
[38]MACCALLUM I,PRZYBYLSKI D,GNERRE S,et a1.ALLPATHS 2:small genomes assembled accurately and with high continuity from short paired reads[J].Genome Biol,2009(10):103.
[39]張香媛,何超,叶丙雨,等.全基因组染色质相互作用Hi-C文库制备的优化及其质量控制[J].遗传,2017,39(9):847-855.
[40]TANIZAWA H,IWASAKI O,TANAKA A,et al.Mapping of long-range associations throughout the fission yeast genome reveals global genome organization linked to transcriptional regulation[J].Nucleic acids research,2010,38(22):8164-8177.
[41]DUAN Z,ANDRONESCU M,SCHUTZ K,et al.A three-dimensional model of the yeast genome[J].Nature,2010,465(7296):363-367.
[42]邓优锦,明瑞光,谢宝贵.一种接近染色体水平的真菌基因组组装策略[C]∥中国菌物学会2019年学术年会,2019:1.
[43]HERV MARIE-NELLY,MARBOUTY M,COURNAC A,et al.High-quality genome(re)assembly using chromosomal contact data[J].Nature Communications,2014,5(1):5695.
[44]AYUKAWA Y,KOMATSU K,TAGA M,et al.Cytological karyotyping of Fusarium oxysporum by the germ tube burst method(GTBM)[J].Journal of General Plant Pathology,2018(84):254-261.
(责任编辑:柯文辉)

