金骨莲胶囊对炎症模型大鼠的抗炎作用及机制研究
付志丽 蒲健 李龚路 谭丹 郑林 李勇军 黄勇
中圖分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)09-1077-06
DOI 10.6039/j.issn.1001-0408.2021.09.09
摘 要 目的:研究金骨莲胶囊对炎症模型大鼠的抗炎作用及机制。方法:将48只大鼠随机分为空白对照组、模型组、金骨莲胶囊低、中、高剂量组(0.66、1.32、2.64 g/kg)和地塞米松组(阳性对照,0.945 mg/kg),每组8只。空白对照组和模型组大鼠灌胃等体积水,其余各组大鼠灌胃相应药物,每天给药2次,连续3 天。末次给药后30 min,模型组和给药组大鼠腹腔注射脂多糖(10 mg/kg)以复制炎症模型。腹腔注射6 h后,于大鼠尾静脉取血,采用酶联免疫吸附试验检测大鼠血清中肿瘤坏死因子(TNF-α)、白细胞介素1β(IL-1β)、IL-6、前列腺素E2(PGE2)的含量;测定大鼠肺组织湿质量/干质量(W/D)比值;采用苏木精-伊红染色法观察大鼠肺组织的病理学形态变化;采用逆转录-聚合酶链式反应法检测大鼠肺组织中TNF-α、IL-6、PGE2、IL-1β mRNA的表达水平;采用Western blot法检测大鼠肺组织中核因子κB(NF-κB)p65蛋白的磷酸化水平和NF-κB抑制蛋白α(IκBα)蛋白的表达水平。结果:与空白对照组比较,模型组大鼠血清中TNF-α、IL-1β、IL-6、PGE2的含量,肺组织W/D比值,肺组织中TNF-α、IL-1β、IL-6、PGE2 mRNA的表达水平和NF-κB p65蛋白磷酸化水平均显著升高,IκBα蛋白表达水平显著降低(P<0.05或P<0.01);大鼠肺组织中大量肺泡萎缩塌陷、壁增厚,可见肺实质化及大量炎症细胞浸润。与模型组比较,金骨莲胶囊各剂量组大鼠血清中TNF-α、IL-1β(低剂量组除外)、IL-6、PGE2的含量,以及肺组织中TNF-α(低剂量组除外)、IL-1β、IL-6(低、高剂量组除外)、PGE2 mRNA的表达水平均显著降低(P<0.05或P<0.01);金骨莲胶囊高剂量组大鼠肺组织W/D比值显著降低(P<0.05或P<0.01);金骨莲胶囊中剂量组大鼠肺组织中NF-κB p65蛋白磷酸化水平均显著降低(P<0.05或P<0.01),IκBα蛋白表达水平显著升高(P<0.05);大鼠肺泡结构较为清晰、壁轻度增厚,并见少量炎症细胞浸润。结论:金骨莲胶囊对炎症模型大鼠具有良好的抗炎作用,其作用机制可能与抑制NF-κB信号通路有关。
关键词 金骨莲胶囊;抗炎作用;炎症因子;核因子κB信号通路
Study on Anti-inflammatory Effect and Mechanism of Jingulian Capsule on Inflammatory Model Rats
FU Zhili1,2,3,PU Jian4,LI Gonglu1,3,TAN Dan4,ZHENG Lin1,LI Yongjun1,HUANG Yong1(1. Guizhou Provincial Key Labortary of Pharmaceutics/National Key Labortay of Efficacy and Utilization of Medicinal Plants, Guizhou Medical University, Guiyang 550004, China; 2. Dept. of Pharmaceutics, Guizhou Nursing Vocational College, Guiyang 551300, China; 3. College of Pharmacy, Guizhou Medical University, Guiyang 550004, China; 4. Guizhou Yibai Pharmaceutical Co., Ltd., Guiyang 550004, China)
ABSTRACT OBJECTIVE: To study the anti-inflammatory effect and mechanism of Jingulian capsule on inflammatory model rats. METHODS: Totally 48 rats were randomly divided into blank control group, model group, Jingulian capsule low-dose, medium-dose and high-dose groups (0.66, 1.32, 2.64 g/kg), dexamethasone group (positive control, 0.945 mg/kg), with 8 rats in each group. Blank control group and model group were given constant volume of water intragastrically, and other groups were given relevant medicine intragastrocally, twice a day, for consecutive 3 days. Thirty minutes after last administration, model group and administration groups were given lipopolysaccharide (10 mg/kg) intraperitoneally to induce inflammatory model. Six hours after intraperitoneal injection, the contents of TNF-α, IL-1β, IL-6, PGE2 in serum were detected by ELISA. The wet to dry weight (W/D) ratio of lung tissue were determined. HE staining was used to observe the pathological changes of lung tissue. RT-PCR was used to detect the mRNA expression of TNF-α, IL-6, PGE2 and IL-1β in lung tissue. Western blot assay was used to detect the phosphorylation of NF-κB p65 protein and the expression of IκBα protein in lung tissue. RESULTS: Compared with blank control group, the contents of TNF-α, IL-1β, IL-6 and PGE2 in serum, the W/D ratio of lung tissue, the expression of TNF-α, IL-1β, IL-6 and PGE2 mRNA and the phosphorylation level of NF-κB p65 protein in lung tissue of model group were significantly increased, and the expression of IκBα protein was significantly decreased (P<0.05 or P<0.01); a large number of alveolar atrophy and collapse, alveolar wall thickening, lung consolidation, and a large number of inflammatory cell infiltration could be seen in lung tissue. Compared with model group, the contents of TNF-α, IL-1β (except for low-dose group), IL-6 and PGE2 in serum, as well as the expression of TNF-α (except for high-dose group), IL-1β, IL-6 (except for low-dose, high-dose groups) and PGE2 mRNA in lung tissue were decreased significantly in Jingulian capsule groups (P<0.05 or P<0.01); the W/D ratio of lung tissue was decreased significantly in Jingulian high-dose group (P<0.05 or P<0.01); the expression of phosphorylation level of NF-κB p65 protein in lung tissue of Jingulian medium-dose group were decreased significantly (P<0.05 or P<0.01), while the expression of IκBα protein was increased significantly (P<0.05); the alveolar structure was clear, the alveolar wall was slightly thickened, and a small amount of inflammatory cell infiltration was seen in lung tissue. CONCLUSIONS: Jingulian capsule has good anti-inflammatory effect on inflammatory model rats, the mechanism of which may be related to the inhibition of NF-κB signal pathway.
KEYWORDS Jingulian capsule; Anti-inflammatory effect; Inflammatory cytokines; NF-κB signal pathway
炎症是机体对损伤因子产生的正常防御反应,机体很多疾病均与炎症有关[1],如风湿性关节炎、哮喘、肺炎等,严重的炎症会导致多器官衰竭、危及生命[2-3]。目前,治疗炎症的主要有非甾体类、糖皮质激素类药物,但这类药物的不良反应较多,不适宜长期使用[4]。研究发现,中药在治疗炎症方面具有疗效较好、毒副作用小等优点[5]。因此,开发抗炎类中药对临床治疗炎症具有重要意义。
金骨莲胶囊源于经典苗药组方,具有祛风除湿、消肿止痛的功效,为治疗风湿痹证的苗药独家品种,收载于《国家中成药标准汇编》[6]和《国家基本医疗保险和工伤保险药品目录》[7]。金骨莲胶囊由大血藤、八角枫、透骨香、汉桃叶和金铁锁组方而成,其组方药味含有大血藤素、八角枫总碱、汉桃叶有机酸等多种抗炎活性成分[8]。金骨莲胶囊前期基础研究薄弱,其研究主要集中于临床应用方面,如治疗风湿性关节炎、骨关节炎、急性软组织损伤等[9-10],但其抗炎作用机制尚不明确。
相关研究发现,炎症的产生与多种炎症介质的失控性释放有关,这些炎症介质的释放主要受到核因子κB(NF-κB)调节[11]。NF-κB是一种存在于真核细胞内的转录因子,在细胞的炎症反应、免疫应答等过程中起到关键性作用[12]。在结构上,NF-κB是一个二聚体,在活化的细胞中最常见的NF-κB二聚体形式是NF-κB p65或p50。正常情况下,NF-κB与其抑制蛋白IκBα结合,以无活性的三聚体形式存在于细胞浆中[13];当细胞受到外界信号的激活时,NF-κB与IκBα发生解离并活化,活化的NF-κB迅速从细胞浆转移到细胞核内,并与相应基因上的κB位点结合,启动转录程序,引起肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、IL-6、前列腺素E2(PGE2)等炎症因子释放,造成炎症级联放大反应[14]。基于此,本研究采用腹腔注射脂多糖(LPS)制备炎症模型大鼠[15],通过测定大鼠血清中TNF-α等相关炎症因子的水平、肺组织湿质量/干质量(W/D)比值,观察大鼠肺组织的病理学形态变化,检测肺组织中TNF-α等相关炎症因子的表达以及NF-κB p65蛋白的磷酸化水平和IκBα蛋白的表达水平,初步探讨金骨莲胶囊的抗炎作用机制,以期更好地指导其临床合理应用。
1 材料
1.1 主要仪器
本研究所用主要仪器有:680型酶标仪(上海伯乐生命医学产品有限公司),Water purifier型实验室专用超纯水机(沃特世科技上海有限公司),AE240型十万分之一电子天平(梅特勒-托利多仪器上海有限公司),Allegra 64R型低温高速离心机(美国Beckman Coulter公司),TGL-16G型高速离心机(上海安亭科学仪器厂),DHP-9052型恒温培养箱(上海捷呈实验仪器有限公司),ZH-2型涡旋混合器(天津药典标准仪器厂),Nanodrop2000型紫外-可见分光光度计(美国Thermo Fisher Scientific公司),Chemidoc XRS型凝胶成像仪、CFX Connect型熒光定量聚合酶链式反应(PCR)仪(美国BioRad公司),DYY-6C型电泳槽(北京六一生物科技有限公司),ECLIPSE CI型光学显微镜(日本Nikon公司)。
1.2 主要药品与试剂
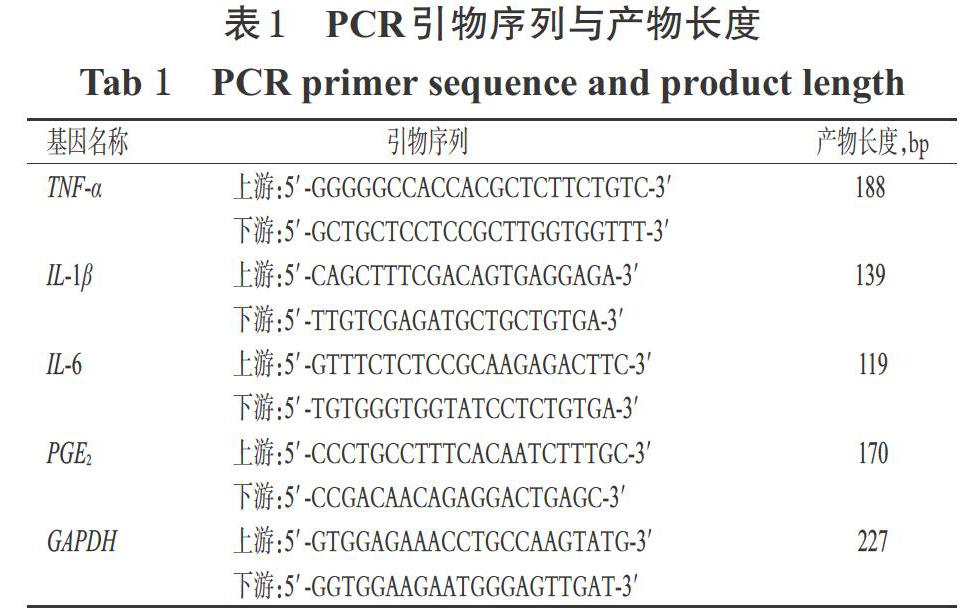
本研究所用主要药品与试剂有:金骨莲胶囊(贵州益佰制药股份有限公司,批号20190806,规格0.25 g),LPS(美国Sigma公司,批号039M4004V),地塞米松片(浙江仙琚制药股份有限公司,批号171007,规格0.75 mg),TNF-α、IL-6、IL-1β、PGE2酶联免疫吸附试验(ELISA)测定试剂盒(南京建成生物技术有限公司,批号分别为20191111、20190430、20190905、20190621),Trizol试剂(日本Takara公司,批号9109),苏木素-伊红(HE)染液(武汉市皮诺飞生物科技有限公司,批号10011),iScript cDNA Synthesis kit 反转录试剂盒、iTaqTM universal SYBR Green Supermix、ECL化学发光底物(美国BioRad公司,批号分别为170-8890、1725122、1705060),兔源磷酸化NF-κB p65(p-NF-κB p65)单克隆抗体(中国Abways公司,批号CY5095),兔源NF-κB p65多克隆抗体、兔源IκBα多克隆抗体、鼠源β-actin单克隆抗体(中国ABclonal公司,批号分别为ab16502、A19714、ab6276),辣根过氧化物酶标记的山羊抗兔免疫球蛋白G抗体(二抗)、BCA蛋白检测试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号分别为E-AB-1037、E-BC-K318-M);PCR引物由北京擎科生物科技有限公司合成(引物序列与产物长度见表1);其余试剂为实验室常用规格,水为纯净水。
1.3 动物
本研究所用动物为健康SD雄性大鼠,体质量(300±20) g,购于长沙天勤生物技术有限公司,动物生产许可证号为SCXK(湘)2019-0014。大鼠饲养于照明充足(12 h/12 h光暗调节)、空调通风良好、相对湿度50%、室温22 ℃的条件下。
2 方法
2.1 动物造模、分组与给药
将48只大鼠随机分为空白对照组、模型组、地塞米松组(阳性对照,0.945 mg/kg,剂量为临床等效剂量的3倍)和金骨莲胶囊低、中、高剂量组(0.66、1.32、2.64 g/kg,剂量为临床等效剂量的5、10、20倍),每组8只。空白对照组和模型组大鼠灌胃等体积水,其余组大鼠灌胃相应药物(临用时以水溶解),每天给药2次,连续3天。末次给药后30 min,除空白对照组腹腔注射等体积生理盐水外,其余组大鼠腹腔注射LPS(10 mg/kg)以复制炎症模型。腹腔注射6 h后,于各组大鼠尾静脉取血,室温静置20 min后,以3 000 r/min离心20 min,分离血清,然后采用ELISA法测定各组大鼠血清中TNF-α的含量。如果各组大鼠血清中TNF-α较空白对照组显著升高,则表明模型建立成功。
2.2 取材
确定造模成功后,于各组大鼠尾静脉取血,室温静置20 min后,以3 000 r/min离心20 min,分离血清样品。取血后,采用颈椎脱臼法处死大鼠,剖取其双肺,将左肺保存于-80 ℃冰箱中,用于PCR和Western blot实验检测;将右肺上叶以10%甲醛固定,用于肺组织病理学形态观察;将右肺下叶用于肺组织W/D比值的测定。
2.3 大鼠血清中TNF-α、IL-1β、 IL-6、PGE2的含量测定
取“2.2”项下各组大鼠血清样品,按相应试剂盒说明书方法操作,采用酶标仪于450 nm下测定血清中TNF-α、IL-1β、IL-6、PGE2的含量。
2.4 大鼠肺组织W/D比值测定
取“2.2”项下各组大鼠右肺下叶,用滤纸吸干其表面水分,并称质量,记为湿质量(W);然后于80 ℃恒温干燥箱中烘烤约48 h后,称质量,记为干质量(D);计算肺组织W/D比值,以反映肺组织的水肿程度。
2.5 大鼠肺组织病理学形态观察
取“2.2”项下固定于10%甲醛中的各组大鼠右肺上叶,经常规脱水、石蜡包埋、切片(厚度为3 μm)后,以HE染液进行染色,然后于光学显微镜下观察大鼠肺组织的病理学形态变化,并拍照。
2.6 大鼠肺组织中TNF-α、IL-1β、IL-6、PGE2 mRNA的表达水平检测
采用逆转录(RT)-PCR法进行检测。取“2.2”项下各组大鼠的左肺组织适量,按照试剂盒说明书方法操作提取总RNA,然后逆转为cDNA进行PCR。PCR反应体系(10 ?L)包括:PCR Mixture 5 ?L,上下游引物各0.5 ?L,cDNA 2 ?L,H2O 2 ?L。反应条件为:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸15 s,共45个循环。以GAPDH为内参,采2-ΔΔCt法计算TNF-α、IL-1β、IL-6及PGE2 mRNA的表达水平。
2.7 大鼠肺組织中NF-κB p65磷酸化和IκBα蛋白表达水平的检测啊
采用Western blot法进行检测。取“2.2”项下各组大鼠的左肺组织适量,剪碎,加入蛋白提取试剂,提取蛋白质,利用组织匀浆仪制备组织匀浆,于冰上裂解30 min,以12 000 r/min离心5 min,取上清液,经BCA蛋白试剂盒测定蛋白浓度后,加热变性处理10 min。取变性后蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,转膜,以5%脱脂奶粉封闭1 h;分别加入NF-κB p65一抗(稀释比例1 ∶ 500)、p-NF-κB p65一抗(稀释比例1 ∶ 500)、IκBα一抗(稀释比例1 ∶ 1 000)、β-actin一抗(稀释比例1 ∶ 10 000),于4 °C条件下孵育过夜;以TBST清洗5 min×5次,加入二抗(稀释比例1 ∶ 3 000)室温孵育1 h;以TBST清洗5 min×5次,加入ECL显色后,置于凝胶成像系统中成像。采用Alpha Ease FC 4.0软件分析图像,以p-NF-κB p65与NF-κB p65灰度值比值表示NF-κB p65蛋白的磷酸化水平,以IκBα蛋白与内参β-actin的灰度值比值表示IκBα蛋白表达水平。
2.8 统计学方法
采用SPSS 18.0软件进行统计分析。数据以x±s表示,采用单因素方差分析进行多组间样本均数比较,组间两两比较采用LSD检验。P<0.05表示差异有统计学意义。
3 结果
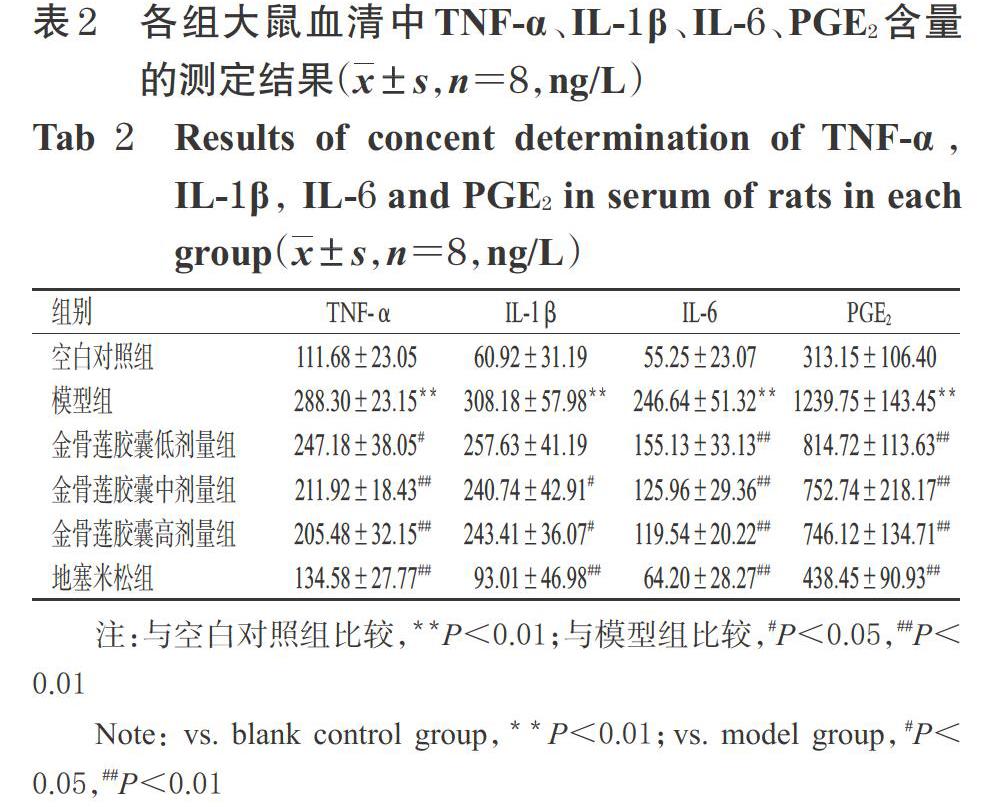
3.1 金骨莲胶囊对炎症模型大鼠血清中TNF-α、IL-1β、IL-6、PGE2含量的影响
与空白对照组比较,模型组大鼠血清中TNF-α、IL-1β、IL-6、PGE2含量均显著升高(P<0.01);与模型组比较,金骨莲胶囊低、中、高剂量组和地塞米松组大鼠血清中TNF-α、IL-1β(金骨莲胶囊低剂量组除外)、IL-6、PGE2含量均显著降低(P<0.05或P<0.01),详见表2。
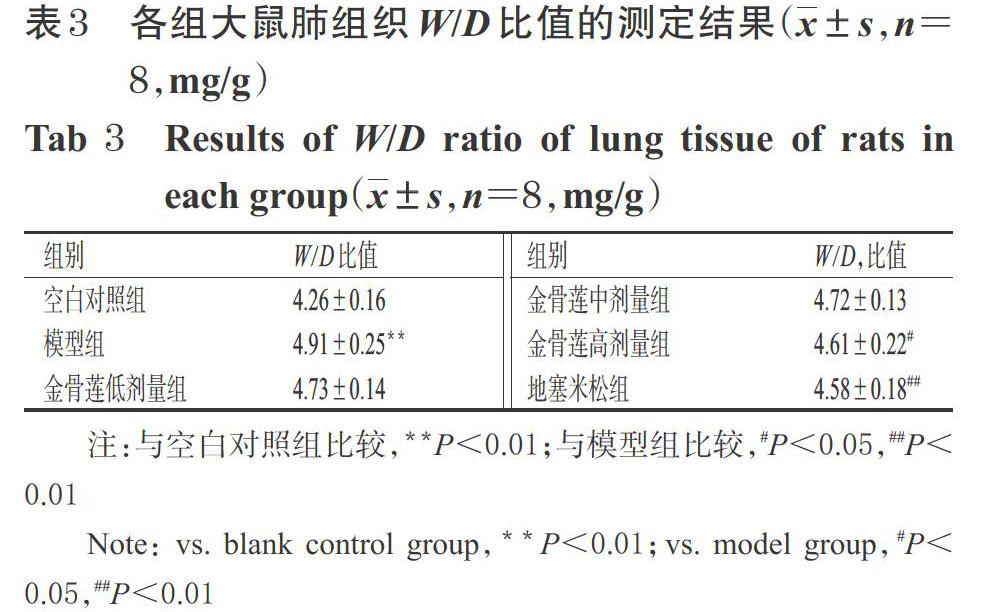
3.2 金骨莲胶囊对炎症模型大鼠肺组织W/D比值的影响
与空白对照组比较,模型组大鼠肺组织W/D比值显著升高(P<0.01);与模型组比较,金骨莲高剂量组和地塞米松组大鼠肺组织W/D比值均显著降低(P<0.05或P<0.01),详见表3。
3.3 金骨莲胶囊对炎症模型大鼠肺组织病理学形态的影响
空白对照组大鼠肺泡结构清晰、壁薄,肺间质无炎症细胞浸润;模型组大鼠肺组织出现大量肺泡萎缩塌陷、壁增厚,可见肺实质化以及大量炎症细胞浸润;金骨莲低、中、高剂量组和地塞米松组大鼠肺组织病理学改变较模型组有所减轻,肺泡结构较为清晰、壁轻度增厚,可见少量炎症细胞浸润,详见图1(图中箭头所指处为炎症细胞浸润)。
3.4 金骨莲胶囊对炎症模型大鼠肺组织中TNF-α、IL-1β、IL-6、PGE2 mRNA表达的影响
与空白对照组比较,模型组大鼠肺组织中TNF-α、IL-1β、IL-6、PGE2 mRNA的表达水平均显著升高(P<0.01);与模型组比较,金骨莲胶囊低、中、高剂量组和地塞米松组大鼠肺组织中TNF-α(金骨莲胶囊低剂量组除外)、IL-1β、IL-6(金骨莲胶囊低、高剂量组除外)、PGE2 mRNA的表达水平均显著降低(P<0.05或P<0.01),详见表4。
3.5 金骨莲胶囊对炎症模型大鼠肺组织中NF-κB p65磷酸化和IκBα蛋白表达的影响
与空白对照组比较,模型组大鼠肺组织中NF-κB p65蛋白磷酸化水平显著升高(P<0.05),IκBα蛋白表达水平显著降低(P<0.01);与模型组比较,金骨莲胶囊中剂量组和地塞米松组大鼠肺组织中NF-κBp65蛋白磷酸化水平显著降低(P<0.05),IκBα蛋白表达水平显著升高(P<0.05),详见图2、表5。
4 讨论
LPS是革兰氏阴性菌细胞壁中的一种组成成分,将其纯化后,可用于构建动物炎症模型,且此类模型是目前用于评价抗炎药物药效和探索其作用机制的有效体内模型[16]。因此,本研究采用腹腔注射LPS复制炎症模型,以探索金骨莲胶囊的抗炎作用及机制。在脂多糖的刺激下,炎症细胞因子的释放可导致中性粒细胞向肺组织聚集、活化,活化后的中性粒细胞进一步释放炎性细胞因子,从而破坏肺泡毛细血管屏障,导致肺通透性增加,形成肺水肿[17],使肺成为最易受损的器官[18-19];而经药物治疗后,可通过观察肺的W/D比值、组织病理改善情况等研究药物的抗炎作用。本研究结果显示,与空白对照组比较,模型组大鼠肺组织W/D比值显著升高,表明其出现了明显的肺水肿现象;与模型组比较,金骨莲胶囊高剂量组大鼠肺组织W/D比值显著降低,表明金骨莲胶囊可减轻大鼠的肺部水肿。肺组织病理学形态观察结果显示,模型组大鼠肺泡间隔明显增厚、大量炎症细胞浸润;经金骨莲胶囊干预后,其肺组织病变不同程度地减轻、浸润的炎症细胞减少,可见金骨莲胶囊可减少炎症细胞浸润,改善肺组织损伤,减轻LPS所致炎症反应,产生抗炎作用。
NF-κB通路是炎症反应的重要转导通路之一[20]。NF-κB未受刺激时主要以非活化状态存在于细胞质中,并可与抑制性的IκBα蛋白结合形成NF-κB/IκBα复合物,而其中IκBα蛋白的活化又被IκBα蛋白激酶复合物控制,该复合物可被外来刺激诱导活化,从而引起IκBα蛋白磷酸化,进而导致IκBα蛋白迅速泛素化降解,释放出NF-κB p65,使其恢复转录活性并转移到细胞核内,促进细胞炎症因子如TNF-α、IL-1β、IL-6等的表达[21-23],同时使环氧酶(COX)的表达增加,进而促进机体内PGE2的表达[24]。本研究结果显示,与空白对照组比较,模型组大鼠血清中TNF-α、IL-1β、IL-6、PGE2含量均显著升高,表明LPS使大鼠产生了全身炎症反应;与模型组比较,金骨莲胶囊各剂量组大鼠血清中TNF-α、IL-1β(低剂量组除外)、IL-6、PGE2的含量,肺组织中TNF-α(高剂量组除外)、IL-1β、IL-6(低、高劑量组除外)、PGE2 mRNA的表达水平均显著降低,表明金骨莲胶囊能通过降低上述炎症因子的表达而产生抗炎作用。进一步研究发现,金骨莲胶囊中剂量组大鼠肺组织中NF-κB p65蛋白磷酸化水平显著降低,IκBα蛋白表达水平显著升高,表明金骨莲胶囊抗炎作用可能与抑制NF-κB信号转导通路有关。
综上所述,金骨莲胶囊可抑制大鼠血清及肺组织中TNF-α、IL-1β、IL-6及PGE2等炎症因子的表达,减轻脂多糖诱导大鼠的炎症反应,其作用机制可能与抑制NF-κB信号转导通路有关。
参考文献
[ 1 ] 王肖辉,周霖,杜秋争,等.五味子甲素对四氯化碳诱导小鼠肝纤维化的保护作用及其机制研究[J].中国药房,2020,31(22):2725-2730.
[ 2 ] 李楠,李旭,刘伟伟,等.姜黄素固体脂质纳米粒干粉吸入剂的体外释药、体内急性毒性及对哮喘模型小鼠炎症反应的影响[J].中国药房,2019,30(3):332-338.
[ 3 ] ZHANG J S,XUE J L,XU B,et al. Inhibition of lipopolysaccharide induced acute inflammation in lung by chlorination[J]. J Hazard Mater,2016,303:131-136.
[ 4 ] 任玉娇,张伟.从补肾益气论防治糖皮质激素的不良反应[J].中医杂志,2016,57(15):1345-1347.
[ 5 ] 郭锦晨,刘健,汪元,等.中医药内外合治类风湿关节炎的研究进展[J].中国临床保杂志,2016,19(3):329-333.
[ 6 ] 国家药品监督管理局.国家中成药标准汇编:脑系经络肢体脑系分册[S].北京:国家药品监督管理局,2002:462- 464.
[ 7 ] 国家医保局,人力资源社会保障部.国家基本医疗保险、工伤保险和生育保险药品目录:2020年[EB/OL].[2021- 01-05].http://www.nhsa.gov.cn/art/2020/12/28/art_37_4220.
[ 8 ] 李广贤,乔卫平.金骨莲胶囊治疗骨性关节炎疗效及对患者IL-1、IL-6、TNF-α影响的研究[J].陕西中医,2018,39(12):1792-1794.
[ 9 ] 龚春燕,敖华蓉,吴金刚,等.金骨莲胶囊治疗急性软组织损伤的临床观察[J].中国处方药,2018,16(4):87-88.
[10] 李伟.金骨莲胶囊治疗骨性关节炎的临床观察[J].中医临床研究,2019,11(1):75-77.
[11] ABRAHAM E. NF-kappaB activation[J]. Critical Care Medicine,2000,28(4):N100-N104.
[12] SUN Z,ANDERSSON R. NF-kappaB activation and inhibition:a review[J]. Shock,2002,18(2):99-106.
[13] VICTOR V M,ROCHA M,FUENTE M D L. Immune cells:free radicals and antioxidants in sepsis[J]. Int Immunopharmacol,2004,4(3):327-347.
[14] LIU S F,MALIK A B. NF-κB activation as a pathological mechanism of septic shock and inflammation[J]. Am J Physiol Lung Cell Mol Physiol,2006,290(4):L622-L645.
[15] 陈志则,夏中元,孟庆涛.芦丁对内毒素诱导急性肺损伤模型小鼠的保护作用[J].中医学报,2018,33(2):209- 213.
[16] 曹承华,贺雅静,高荧苒,等.LPS介导的炎症反应过程及作用机制[J].河南大学学报(医学版),2017,36(1):70-76.
[17] 姜远旭.右美托咪定联合乌司他丁对脂多糖诱导大鼠急性肺损伤的保护作用及机制的研究[D].广州:南方医科大学,2014.
[18] ZHENG Y,GUO Z,HE W,et al. Ephedrine hydrochloride protects mice from LPS challenge by promoting IL-10 secretion and inhibiting proinflammatory cytokines[J]. Int Immunopharmacol,2012,13(1):46-53.
[19] 宣国平,张琳,钟明媚.脂多糖致大鼠急性肺损伤模型取材时间选择[J].中华实用诊断与治疗杂志,2015,29(2):136-138.
[20] 邢海波.脂多糖致大鼠急性肺损伤模型中部分炎症介质的变化与依达拉奉保护作用及其可能机制的研究[D].北京:北京协和医学院,2006.
[21] 王霞,蒋礼,何燕玲,等.黑骨藤中咖啡酰基奎宁酸类化合物体外抗类风湿性关节炎机制研究[J].中国药理学通报,2018,34(10):1362-1367.
[22] 杨世勇,何毅,宋大强,等.基于TLR4/NF-κB途径的白藜芦醇减轻LPS致小鼠急性肺损伤的机制研究[J].中国药房,2020,31(9):1034-1039.
[23] YUSUF S,SOENARTO Y,JUFFRIE M,et al. The effect of zinc supplementation on pro-inflammatory cytokines (TNF-α,IL-1 AND IL-6) in mice with Escherichia coli LPS-induced diarrhea[J]. Iran J Microbiol,2019,11(5):412-418.
[24] KWON O,AHN K S,PARK J W,et al. Ethanol extract of Elaeocarpus petiolatus inhibits lipopolysaccharide-induced inflammation in macrophage cells[J]. Inflammation,2012,35(2):535-544.
(收稿日期:2020-12-14 修回日期:2021-02-25)
(編辑:唐晓莲)

