HMGB1对LPS诱导A549细胞自噬表达的调控作用
农进,梁琼,廖林,李军,韦凌云,陆江玉,陈红,廖品琥
(1. 右江民族医学院附属医院,广西 百色 533000;2. 广西大学医学院,广西 南宁 530004;3. 右江民族医学院重症医学教研室,广西 百色 533000)
急性呼吸窘迫综合征(acute respiratorty distress syndrome,ARDS)是ICU病房中常见的一种严重综合征,随着俯卧位通气、体外膜肺氧合(ECMO)等高精技术的临床使用,其死亡率有所降低,但仍高达40%左右[1]。有研究显示过度的炎症反应失控是ARDS肺损伤的主要原因,然而使用炎症因子拮抗剂并不能有效降低病死率[2]。自噬性细胞死亡(autopohagic cell death,ACD)是近年来新发现的细胞死亡形式,有望成为ARDS新的治疗靶点。
高迁移率族蛋白B1(high mobility group box-1 protein,HMGB1)是一种重要的细胞外晚期炎症介质,在细菌感染、败血症及其它刺激诱导的ARDS体内外模型中,HMGB1可在细胞内、核内或细胞外水平调节自噬。HMGB1与自噬相互作用在不同细胞类型中有着不一样的机制,且依赖触发损伤的性质[3]。内毒素是感染的重要原因之一,其主要成分为脂多糖(Lipopolysaccharide,LPS),本实验使用LPS刺激A549细胞,探讨HMGB1对肺泡上皮细胞的自噬是否具有调控作用,为制定新的治疗策略打下基础。
1 材料与方法
1.1 主要试剂和仪器 A549 细胞购于中国科学院干细胞库;LC3a/b、HMGB1、β-actin购于Affinity;CCK-8试剂购于Fluorescence;转染试剂LP-2000购于invitrogen公司;凋亡检测试剂盒购于Solarbio;电镜固定液:索莱宝;无水乙醇、丙酮购于国药集团化学试剂有限公司;812包埋剂购于SPI;凋亡检测试剂盒购于Solarbio公司。
1.2 实验方法
1.2.1 细胞的复苏、传代 从-80℃冰箱中快速取出细胞冻存管,立即放入37℃温水中融解;A549细胞复苏后常规培养、换液,当细胞生长至覆盖培养瓶约80%面积时,对细胞消化、传代后用于后续培养。
1.2.2 CCK-8 检测LPS对A549细胞存活率的影响 取对数生长期的细胞接种于96孔板中。浓度为1×104个/毫升,加入不同浓度药物,同时设置空白组、正常对照组,每组设3个复孔,37℃,5%CO2培养箱中培养24 h;加入CCK-8溶液后,37℃,5% CO2培养箱中孵育2 h;测450 nm处的吸光度。
1.2.3 药物处理分组 (1)A549细胞融合度达80%时,分别用不同浓度的LPS作用于A549细胞24 h,100 μg/ml处理不同时间;(2)随机将细胞分为:①空白组;②LPS组;③Si-HMGB1组;④Si-HMGB1+LPS组。Si-HMGB1处理组中先siRNA转染A549细胞后,加入100 μg/ml LPS 24 h。
1.2.4 细胞凋亡的检测 A549细胞培养、消化后,分为空白组和LPS组。严格按照流式细胞凋亡检测试剂盒说明书进行。
1.2.5 透射电镜法检测自噬超微结构 取对数生长期的A549细胞,加入100 μg/ml的 LPS,培养24 h后,随后取材、固定、脱水、渗透、包埋、切片、染色等步骤处理后透射电子显微镜下观察,采集图像分析。
1.2.6 Western blot检测相关蛋白表达 提取细胞的总蛋白,BCA试剂盒检测蛋白浓度。每组取等量蛋白行10%SDS-PAGE 凝胶电泳,转移凝胶至PVDF膜,室温封闭2 h,一抗4℃孵育过夜,TBST洗膜,二抗37℃孵育90 min,洗膜,ECL发光显影。通过Image J软件对蛋白印迹条带灰度值进行半定量分析,采用目标蛋白条带灰度值/β-actin条带灰度值来获得目标蛋白的相对表达水平。
2 结果
2.1 LPS对A549细胞存活率的影响 使用不同浓度的LPS作用于A549细胞24 h后,CCK-8 法检测结果见图1显示,剂量<100 μg/ml的LPS处理后,细胞活性无明显改变,与正常对照组(0 μg/ml)相比,差异无统计学意义(P>0.05),剂量达到100 μg/ml之后细胞存活率明显下降,差异有统计学意义(P<0.01),取此剂量用于后续ARDS肺泡上皮细胞损伤的细胞造模剂量。
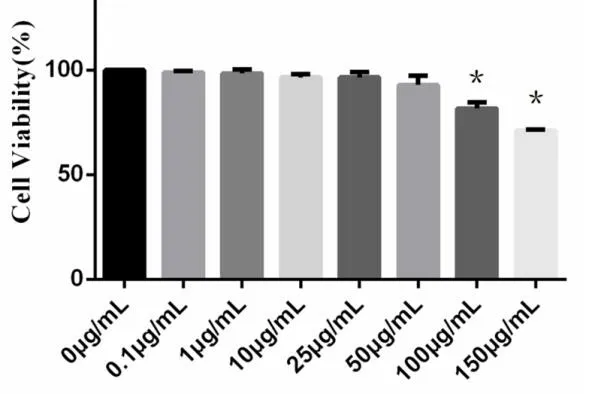
注:与空白对照组(0 μg/ml)相比,*P<0.01。图1 CCK8检测不同剂量的LPS对A549细胞活力的影响
2.2 最低细胞毒剂量的LPS对A549细胞损伤不依赖凋亡和坏死 为了进一步验证细胞存活率的下降是否依赖于凋亡和坏死,采用Annexin V-FITC 和PI双染法,检测100 μg/ml的LPS作用于A549细胞24 h的细胞凋亡和坏死情况。由图2散点图可见,LPS 处理组的B1、B2、B4与对照组比较,细胞数无明显增加,细胞凋亡率、坏死与对照组比较差异无统计学意义(P>0.05)。可见,浓度为100 μg/ml的LPS作用A549细胞之后,细胞存活率下降不依赖于凋亡和坏死。
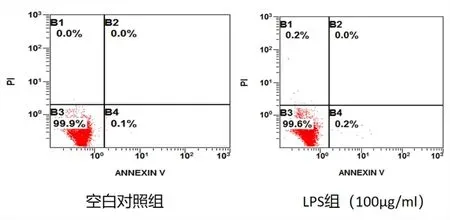
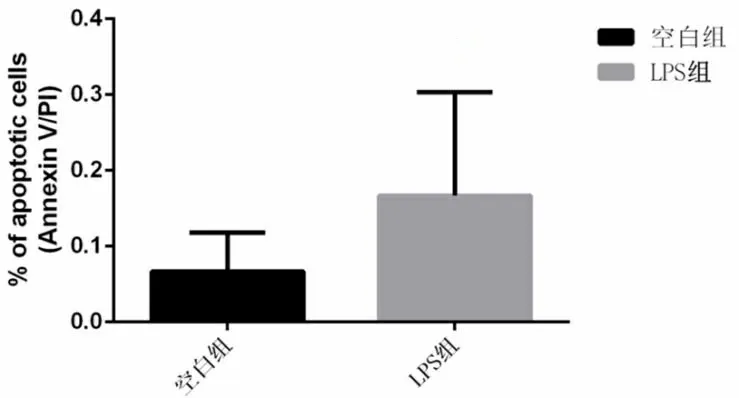
注:上图为空白组和LPS组的散点图,下图为两组细胞凋亡率统计分析结果。图2 流式细胞技术检测LPS对A549细胞凋亡影响
2.3 LPS诱导后A549细胞透射电镜观察细胞超微结构 透射电镜观察如图3所见:正常对照组中:未见典型结构自噬小体,自噬溶酶体(ASS)少量存在。LPS组中:线粒体数量较少,胞质中大量的自噬小体(AP)和自噬溶酶体,未见调亡小体形成,核膜完整。结果提示LPS 能引起 A549细胞自噬,结合上述流式细胞检测结果及自噬性细胞死亡的特征,LPS引起的细胞存活率下降为自噬性细胞死亡。
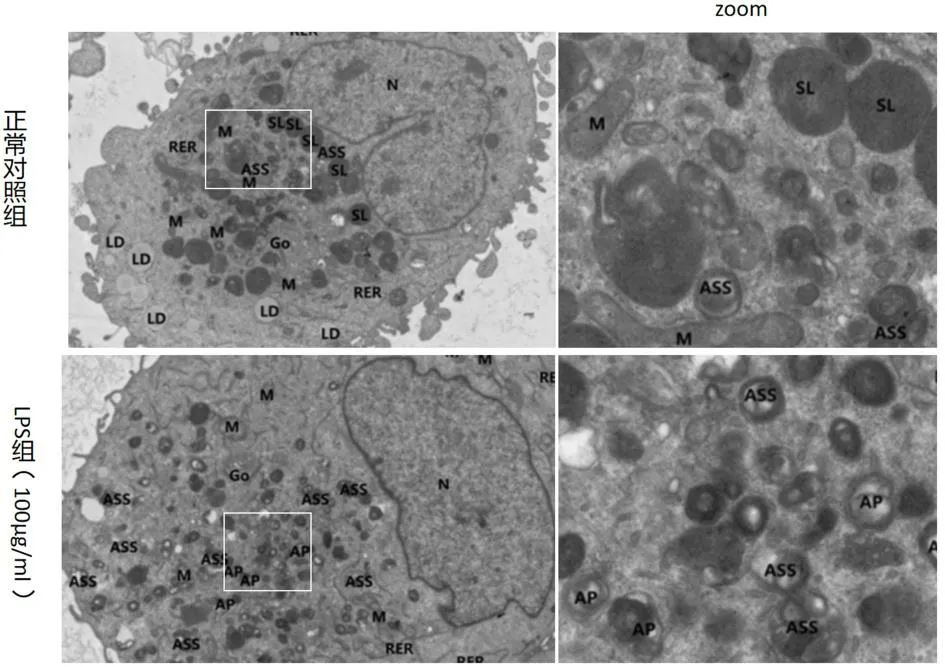
图3 LPS诱导后 A549细胞的透射电镜细胞超微结构
2.4 RNA干扰A549细胞HMGB1后各组蛋白表达比较 为了验证HMGB1是否可以介导LPS诱导的A549细胞自噬及自噬性细胞死亡,我们使用最低毒性剂量的LPS(100 μg/ml)刺激A549细胞24 h,联合使用siRNA 干扰HMGB1 的表达干预A549细胞,Western blot实验检测自噬相关蛋白。结果如图4所见:正常组的A549细胞仅有微量的HMGB1和自噬相关蛋白LC3B-Ⅱ表达,LPS诱导后明显增加A549细胞HMGB1和LC3B-Ⅱ的蛋白表达量。Si-HMGB1干预后,LC3B-Ⅱ/LCB3-1和HMGB1的蛋白表达量介于LPS组和空白组,与LPS组相比,差异有统计学意义(P<0.05)。Si-HMGB1能抑制LPS 诱导A549细胞LC3B-Ⅱ/LC3B-Ⅰ的表达。
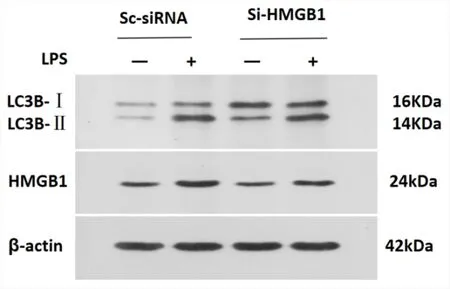

注:与空白组比,#P<0.01;与LPS组相比,★P<0.01;与LPS组相比,*P<0.05。图4 Si-HMGB1对A549细胞HMGB1和自噬蛋白表达的影响
3 讨论
ARDS 的病因复杂,有肺内因素的直接作用和肺外因素间接作用,其中脓毒症或脓毒性休克是 ARDS 发病的主要原因,也是急危重症病房死亡率很高的综合征。正常情况下,自噬能维护细胞稳态,有利于细胞的存活,起到清除细胞内垃圾的作用[4]。然而当刺激因素到达一定时间,刺激强度超过一定范围时,会出现不利于细胞存活的作用,正确认识细胞自噬的双重作用及其具体的分子机制有利于ARDS的防治[5-6]。
HMGB1广泛分布于肺、脑、肝、心、肾等各器官。在细胞核内,HMGB1可与DNA非特异性结合,参与复制、重组、转录和DNA修复等过程,参与多种生命活动,病理情况下,胞内HMGB1可通过主动分泌与被动释放进入胞外,进而参与炎性反应,HMGB1在炎症过程中起重要作用[7]。细胞外的HMGBl通过促进核因子(NF)-kB的核易位而导致炎症细胞因子的释放,从而诱导ARDS,参与细胞凋亡和自噬[8-9]。HMGB1作为脓毒症的晚期炎症因子,据报道,内毒素诱导动物模型中,HMGB1在诱导后8 h时表达明显增高,至32 h仍然维持较高水平[10]。有关HMGB1和自噬在ARDS肺上皮细胞损伤的研究表明,自噬激活剂可抑制LPS诱导的A549细胞的凋亡,并改善小鼠ARDS的肺损伤[11]。研究还发现LPS刺激A549 细胞产生自噬和ACD,自噬表达量依赖于LPS的作用的时间和浓度,自噬激活剂可加重细胞损伤[12]。可见,自噬对细胞具有双重作用。研究也发现,在氧化应激过程中,HMGB1能促进自噬,抑制HMGB1出核可以降低ARDS的自噬和减少细胞死亡[13]。HMGB1和自噬与ARDS的肺损伤发病机制关系密切。
本研究结果显示,正常组A549细胞自噬水平表达很低,使用最低剂量的细胞毒性的LPS作用于A549细胞24 h后HMGB1和自噬相关蛋白LC3B-Ⅱ/LC3B-Ⅰ的表达量增加,并出现不依赖于凋亡、坏死的细胞存活率下降。研究认为ACD的特征为:胞质中大量的自噬小体,无调亡小体形成和细胞核无变化,不依赖于caspase[14-15]。我们采用透射电镜观察到LPS可引起A549细胞自噬,且胞质中出现了大量的自噬小体和自噬溶酶体,未见调亡小体形成,核膜完整等ACD的特征。可见,100 μg/ml的LPS作用于A549细胞24 h后可出现ACD。为了进一步验证HMGB1与A549细胞自噬和自噬性细胞死亡关系,实验采用RNA干扰技术沉默HMGB1,结果通过干预后LPS诱导的A549细胞自噬相关蛋白LC3B-Ⅱ/LC3B-Ⅰ表达明显下降,提示HMGB1可介导LPS诱导A549细胞自噬与ACD。既往研究发现,当高水平的自噬持续刺激,超出阈值时,对细胞是不利的,参与疾病的发生发展[16],我们的研究与该研究相符。
综上所述,本研究发现LPS诱导A549细胞产生自噬及自噬相关的细胞死亡,可能参与肺泡上皮细胞损伤过程,抑制HMGB1可降低LPS诱导的A549细胞的自噬。由此推测,当脓毒症的病情发生发展到一定阶段,可引起肺泡上皮细胞ACD从而导致了ARDS的发生,由此可对ARDS患者进行自噬表达的检测,根据自噬表达量,通过干预HMGB1来调节自噬有望成为ARDS治疗的靶点。

