干细胞移植治疗早产儿脑白质损伤研究进展*#
应俊杰* 李世平 屈艺 母得志
(四川大学华西第二医院儿科/出生缺陷与相关妇儿疾病教育部重点实验室,四川 成都 610041)
早产儿是指出生时胎龄37周以内的新生儿,各器官系统发育尚不完善,并发症发生率和死亡率远远高于足月儿。据世界卫生组织报道,全世界范围内每年大约有1500万早产儿(约占新生儿的十分之一)。其中,中国早产儿数量居世界第二,高达117万多人,仅次于印度[1]。最近的研究发现,早产是5岁以内儿童死亡的主要原因,约占新生儿死亡的三分之一[2,3]。近年来,随着早产儿护理以及新生儿重症监护诊疗技术的革新,大大提升了早产儿以及极低体重早产儿(<1.5 kg)的存活率,但慢性神经功能障碍的早产儿比例也随之上升[4]。在存活的早产儿中,约有10%患儿具有明显的永久性运动功能障碍[5,6]。不仅如此,约25%~50%的早产儿神经发育受到影响,具体表现为认知和社会行为障碍,以及注意力和学习障碍,甚至5%~10%的早产儿出现脑瘫,严重影响了患儿以及家庭的生活,也给社会带来了沉重的负担[7-9]。
早产儿脑白质损伤(Preterm white matter injury,PWMI)是一种严重的新生儿脑损伤,会造成患儿神经系统后遗症,如脑瘫、视听功能异常、认知障碍等,目前临床上尚缺乏有效的治疗手段[7]。PWMI又可分为两种类别:脑室周围白质软化(Periventricular leukomalacia,PVL)和弥漫性白质损伤(Diffuse white matter injury,dWMI)。PVL多见于早产儿缺血缺氧性脑实质损伤,会引起脑室周围白质软化,少突胶质细胞受损,具体表现为局灶性脑白质损伤(Punctate white matter damage,PWMD),通过颅脑超声、CT、MRI等可直接观察到脑白质损伤影像学改变[10,11]。dWMI的发生则更为隐蔽,主要因脑白质微环境的改变,导致整个脑部的髓鞘形成受阻[12,13]。目前研究发现,约有80%PWMI都是以dWMI形式发生[13]。然而无论是PVL还是dWMI,目前都没有有效的治疗方案。近年来,干细胞移植已被应用于肾脏、心脏等多种器官损伤修复中,治疗效果显著[14,15]。在神经系统疾病的研究中,干细胞治疗也逐渐开展,迄今为止,已有超过200项应用各种干细胞方法治疗神经系统疾病的临床研究(Clinicaltrials.gov)登记在案,其中大多数已在成人多发性硬化症、中风和脊髓损伤等疾病治疗中应用。因此,干细胞移植也有望应用于儿童神经系统疾病的治疗,成为治疗PWMI的一种新方法。
本文综述了近年来PWMI的发生机制研究及干细胞治疗PWMI的研究现状,并分析了干细胞移植治疗PWMI的优化策略,旨在为干细胞治疗PWMI的临床应用提供参考。
1 早产儿脑白质损伤发生机制
在PWMI中,髓鞘形成障碍是区别于其他新生儿脑损伤的重要特征。髓鞘形成障碍主要由少突胶质细胞成熟异常引起。少突胶质细胞的发育通常包括四个阶段:起源于大脑内源性干细胞的神经组细胞(Neural progenitor cells,NPC),发育为少突胶质细胞前体细胞(Oligo-dendrocyte precursor cells,OPCs),当其迁移到特定的大脑区域后,OPCs增殖并分化为未成熟的少突胶质细胞 (Premyelinating oligodendrocytes,pre-OLs),并最终分化为髓鞘化成熟的少突胶质细胞(Myelinating oligo- dendrocyte,MO),直接参与神经髓鞘的形成[16]。
WMI 通常发生于人类胎龄23~32 周,此阶段正是OPCs向pre-OLs分化阶段[16],OPCs和pre-OLs对缺氧缺血(Hypoxia-ischemia,HI)十分敏感,如果胎儿在此阶段发生缺氧缺血,会严重影响OPCs的分化成熟,引起髓鞘形成减少,最终导致WMI的发生,见图1。
2 干细胞移植治疗早产儿脑白质损伤研究现状
干细胞是一类具有多向分化潜能的细胞,能够有效修复组织和器官损伤,并显著改善微环境[17,18]。目前研究应用的干细胞通常有间充质干细胞(Mesenchymal stem cells,MSCs)、诱导多能干细胞(Induced pluripotent stem cells,iPSCs)、胚胎干细胞(Embryonic stem cell,ESCs)等。鉴于PWMI发生由少突胶质细胞受损或发育障碍引起,干细胞移植有望对损伤的细胞进行修复。一方面,干细胞可以通过多向分化替代损伤的少突胶质细胞,对脑白质进行修复重建;另一方面,干细胞还能分泌重要的细胞因子,激活脑白质损伤的内源性修复,改善脑白质微环境,促进少突胶质细胞分化成熟[19]。此外,干细胞的免疫原性较低,尤其是MSCs几乎没有免疫排斥的问题出现。MSCs的主要组织相容性复合体(Major histocompatibility complex,MHC)Ⅰ类分子表达水平低,且不表达MHC-Ⅱ类分子及T细胞共刺激分子(B7-1、B7-2、CD40、CD40L)等。因此,不易激活宿主T细胞的免疫反应子,从而免于T细胞和自然杀伤细胞(NK细胞)的攻击[20]。鉴于干细胞的低免疫原性的特征,干细胞移植应用于临床的可行性大大增加。
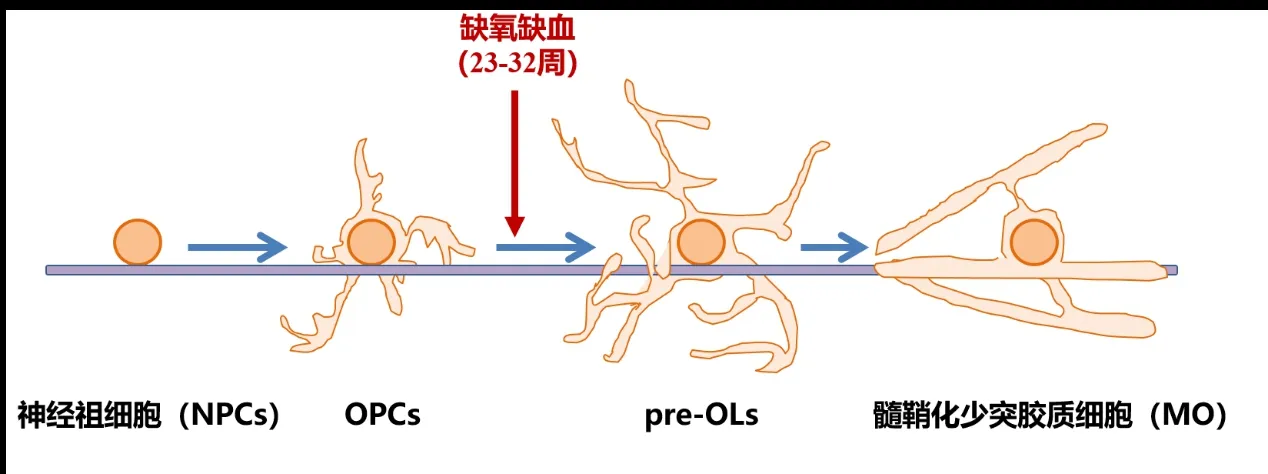
图1 少突胶质细胞发育各阶段示意图
尽管干细胞移植治疗PWMI具有理论的可行性,但干细胞在PWMI中的再生作用的证据仍然缺乏,目前尚无用于临床PWMI治疗的报道。近年来,研究者们在细胞水平及动物模型中的研究越来越多,并已逐渐涉及到大动物WMI模型的研究[21,22]。
2.1 细胞水平研究
干细胞移植治疗PWMI的细胞水平研究主要通过干细胞与OPCs共培养的方式进行,以探究干细胞对OPCs分化的影响。Zhang等通过设置直接接触和非接触(Transwell)两种共培养体系研究大鼠MSCs与OPCs共培养中的作用,发现直接接触和非接触共培养的MSCs都能够显著促进OPCs的分化,说明MSCs通过旁分泌作用间接调控OPCs分化[23]。此外,该研究还发现直接接触共培养体系中成熟的少突胶质细胞比例更高,表明除了旁分泌作用,MSCs 对OPCs的调控可能还存在其他途径。例如,在氧化应激后,MSCs能够通过微泡、缝隙连接或纳米管将线粒体转移到线粒体功能受损的细胞[24,25],提示MSCs对OPCs等细胞的作用可能更为丰富,其机制值得进一步探索。除OPCs以外,NSCs也具备分化为少突胶质细胞的潜能,因而也有研究通过大鼠NSCs与MSCs共培养,发现MSCs也会促进NSCs分化为少突胶质细胞[26]。
2.2 动物模型研究
大鼠是经典的WMI模型动物,广泛应用于国内外WMI临床前研究中。在PVL建模后1天,向新生大鼠单侧侧脑室注射MSCs,可观察到MSCs可以迁移到受损的两个半球,改善髓鞘形成,提高大鼠的运动能力[27]。最近的研究还发现,通过腹腔注射内脂多糖诱导出生后4天(P4)大鼠PVL,经脐带沃顿胶间充质干细胞(Wharton's jelly-derived mesenchymal stem cells,WJ-MSCs)治疗后,脑内促炎细胞因子的表达显著降低,并促进了MBP的表达[28]。此外,在dWMI模型的研究中,通过侧脑室注射WJ-MSCs,同样可以改善大鼠的运动能力,并促进髓鞘形成[29]。动物模型中的这些研究证实了MSCs对WMI的修复效果,具有重要的参考意义,但脑室内注射的方式缺乏临床适用性,需对治疗策略进行进一步优化。
3 优化干细胞治疗WMI的策略
3.1 干细胞选择
选择合适的干细胞,是有效应用干细胞移植手段治疗PWMI的首要问题。现阶段使用成人组织(脂肪组织、外周血、骨髓)和新生儿组织(胎盘和脐带)来源的间充质干细胞进行治疗的研究较多,包括:骨髓间充质干细胞(Bone mesenchymal stem cells,BMSCs)、人羊膜间充质干细胞(Human amniotic mesenchymal stromal cells,hAMSC)、脐带血间充质干细胞(Umbilical cord mesenchymal stromal cells,UCMSCs)等[30]。其中胎盘和脐带来源的MSCs具有较高的增殖和分化能力,并且自体干细胞移植可以有效规避免疫原性问题,是干细胞治疗WMI的优选之一。此外,由于WMI的受累细胞是少突胶质细胞,因此,可直接分化为少突胶质细胞的神经干细胞(Neural stem cells,NSCs)和OPCs也被认为对WMI极具治疗潜力,国内外已有相关团队正在开展相关临床前研究,但临床治疗效果需要更多研究结果支持,免疫原性问题也需要进一步解决。
3.2 移植途径选择
大小鼠WMI模型研究多采用侧脑室注射途径,手术创伤较大,难以用于临床治疗。所以除了干细胞的选择,临床治疗途径也至关重要。动脉或静脉注射的全身给药方式,可将干细胞通过血液循环运送到损伤的脑白质,但所需的干细胞浓度将远远大于局部给药,可行性较低。局部给药除了脑室内注射,腰椎穿刺也是临床常用的方法之一,能有效地将干细胞注入脑脊液。但腰椎穿刺手术同样会带来创伤,并可能引发相关并发症及术后感染。此外,鼻腔给药也是婴儿和儿童常用的一种给药途径,可将干细胞通过嗅觉神经输送至脑组织,给药过程无创。
最近的一项研究表明,在dWMI大鼠模型中通过鼻内注射WJ-MSCs 可观察到髓鞘的修复[31],表明经鼻途径注射干细胞能够有效减轻大鼠脑白质的损伤,但相关临床研究尚无报道,其有效性需要更多的研究验证。
3.3 基因工程技术的应用
利用基因工程技术干预干细胞中关键因子表达,能进一步提高干细胞治疗效果。例如成人大脑中动脉闭塞疾病中,与单纯的骨髓间充质干细胞治疗相比,用过表达BDNF、GDNF、HIF-1α或IL-10的改良骨髓间充质干细胞治疗,可有效改善脑功能,减少梗死面积[32,33]。因此,基因工程的应用有望为干细胞治疗PWMI提供更有效的新工具。
4 总结与展望
近年来,随着对干细胞的研究的深入,研究者们对干细胞来源、移植途径、免疫原性等多方面条件进行优化,干细胞移植技术在多种疾病治疗中安全性和有效性大大提高。干细胞移植治疗早产儿脑白质损伤的临床前研究也有了较大的进展,是一种极具潜力的治疗方法。

