对硝基苯酚的生物降解研究进展
夏丞垚,陈琼珍,沈文静,黄 彦,叶现丰,曹 慧,崔中利
(1.南京农业大学 生命科学学院 农业农村部农业环境微生物重点实验室,江苏 南京 210095;2.温州大学 生命与环境科学学院,浙江 温州 325035;3.生态环境部南京环境科学研究所,江苏 南京 210042)
随着人口增长和人类活动不断增加,人类在享受着化学品和天然矿质资源等带来的经济增长和物质保障的同时,也面临着超过1亿人接触有毒的有机和无机污染物的风险,以及每年上亿吨的化学废弃物进入环境的潜在危害[1]。对硝基苯酚(PNP)广泛用于医药、染料、农药、除草剂和杀菌剂等生产中[2]。在好氧环境中,甲基对硫磷、对硫磷等有机磷杀虫剂,可迅速降解为PNP[3]。这类化合物在环境中残留时间长,会对土壤及植物产生严重的危害[4]。
由于PNP具有高度水溶性,已在农业土壤、地表水、地下水、雨水、空气、活性污泥和工业废水中检测到,PNP的化学性质相对较为稳定,苯环的存在发挥关键作用。分子结构理论表明在苯环中存在着大 π 键,其结构由于苯环中 π 电子的离域作用而变得更加稳固。与此同时,苯环上的电子云密度受到苯环上的—NO2基团强烈的吸电子特性的影响而大大降低,使得亲电反应在一般条件下很难进行,并且对外界氧化酶的攻击有着一定的抵抗作用[5]。
多国环保机构先后将PNP纳入“优先控制污染物名单”中[6]。有研究表明PNP对多种非靶标生物产生毒性[7-8],如:PNP可诱导酿酒酵母有丝分裂重组或基因转换[9];在人类和动物中,它会引起高铁血红蛋白血症[10],在这种情况下,血液中存在的过量高铁血红蛋白可能会干扰血液携带氧气的能力;此外,PNP被证明可以诱导3种微藻菌株的抗氧化水平发生变化[4]。
1 PNP微生物降解资源
与传统的化学物理法或者土壤淋洗等修复方法相比,生物修复因其对污染物完全矿化,不造成二次污染,被认为是水土环境中PNP污染修复的理想方法[11]。其中利用微生物的污染物降解功能实现对污染物的分解是重要的手段,在环境绿色安全保护方面发挥着重要的作用。目前,许多能降解PNP的菌株被研究报道[12]。
由于芳香环上引入了硝基,PNP的生物降解非常困难。然而,微生物种类众多,代谢类型多样,分布广泛,研究人员从不同环境中分离筛选了大量PNP降解微生物。虽然这些微生物表现出降解这类化合物的能力,但在高浓度条件下,PNP会对许多降解菌产生毒害作用并抑制其生长,Sphingobacteriumsp.被证实对高浓度PNP(5 mmol/L)有良好的降解效果[13], 目前高浓度PNP降解菌鲜有报道,为了开发高效的微生物生物修复系统,有必要分离和筛选新的潜在微生物。
PNP降解菌株的研究主要集中在好氧细菌上,相关菌株的分离以及代谢通路都在不断被阐明。对于厌氧微生物的研究还未深入开展,主要原因是厌氧微生物的分离和纯培养需要严格的厌氧条件,操作复杂,难以控制。
2 PNP的微生物代谢途径和相关基因的研究现状
2.1 厌氧降解
降解PNP等芳香族化合物的厌氧菌少有研究报道,主要是由于其分离培养有着一定的困难,硝基芳香族化合物的厌氧降解大多以未经鉴定的混合菌群为基础,接种的微生物多为污水处理厂或厌氧污水处理系统的消化污泥。Oren等[14]首次报道了HaloanaerobiumpraevaknsDSM 2228和SporohalobactermarismortuiATCC 35420对PNP的厌氧降解作用,在H.praevaknsDSM 2228降解PNP的过程中,在硝基还原酶作用下,PNP首先被还原为对氨基苯酚(PAP),但未发现进一步降解。随后的研究也发现有多种微生物厌氧降解菌株得到分离,如Methanobacteriumformicium[15]、Methanogenic bacteria[16]等。由此可见,厌氧降解在生物处理中具有一定的应用前景。
在厌氧状态下,PNP首先被还原为对氨基苯酚,在有氧或无氧条件下,不管是纯培养还是混合培养都能继续降解[14, 17-18]。然而,也有研究提出不同观点,认为对氨基苯酚不能在厌氧反应器里进一步转化[19]。
Chen等[20]利用厌氧半固定床生物膜反应器(An-SFB-BR)处理高浓度PNP废水,当PNP进水从0提高到540 mg/L时,PNP的平均去除率为98%;经An-SFB-BR降解后,PNP的初级中间体对氨基苯酚(PAP)的转化率可达80%;16S rRNA测序结果表明,随着PNP浓度的逐渐增加,Methanobacterium丰度有所上升,这保证了PNP的去除效果。该研究为高浓度PNP废水的生物处理提供了一种经济的途径。
2.2 好氧降解
一些能够降解PNP的好氧微生物已被发现存在于环境生态位中。降解PNP的细菌代谢途径主要分为两类。一类是在革兰氏阴性菌如Burkholderiaspp、Moraxellaspp和Pseudomonasspp中的对苯二酚途径[21-23]。Simpson等[24]证实,Pseudomonasspp能将PNP转化为对苯二酚,并释放出亚硝基;对其中相关酶进行分离纯化发现,通过黄素蛋白单加氧酶催化释放出亚硝酸根是假单胞菌降解PNP的第一步,使PNP向对苯二酚转化[25]。另一类是在革兰氏阳性菌如Arthrobacterspp、Bacillusspp和Rhodococcusspp中的1,2,4-苯三酚途径[26-30],PNP通过4-硝基儿茶酚和1,2,4-苯三酚途径降解。
微生物种类和代谢多样性决定了PNP代谢途径和基因资源的多样性。目前的研究结果丰富了对微生物降解PNP通路的认知,微生物的代谢途径和编码基因在不同种属中有着很大的差别,现将对目前已经研究较为深入的菌属做如下分述。
2.2.1 假单胞菌属
Bang[31]对Pseudomonassp. ENV2030降解PNP进行深入研究后发现,Pseudomonassp. ENV2030降解PNP是通过对苯二酚途径进行的。代谢PNP的具体途径如图1所示。在4-硝基酚单加氧酶作用下,每氧化1分子PNP生成对苯二酚时,它同时消耗2分子NADPH,因此推测PNP第一步先氧化为对苯二醌,然后将对苯二醌在对苯二醌还原酶的作用下还原为对苯二酚,但并未在此研究中检测到对苯二醌。
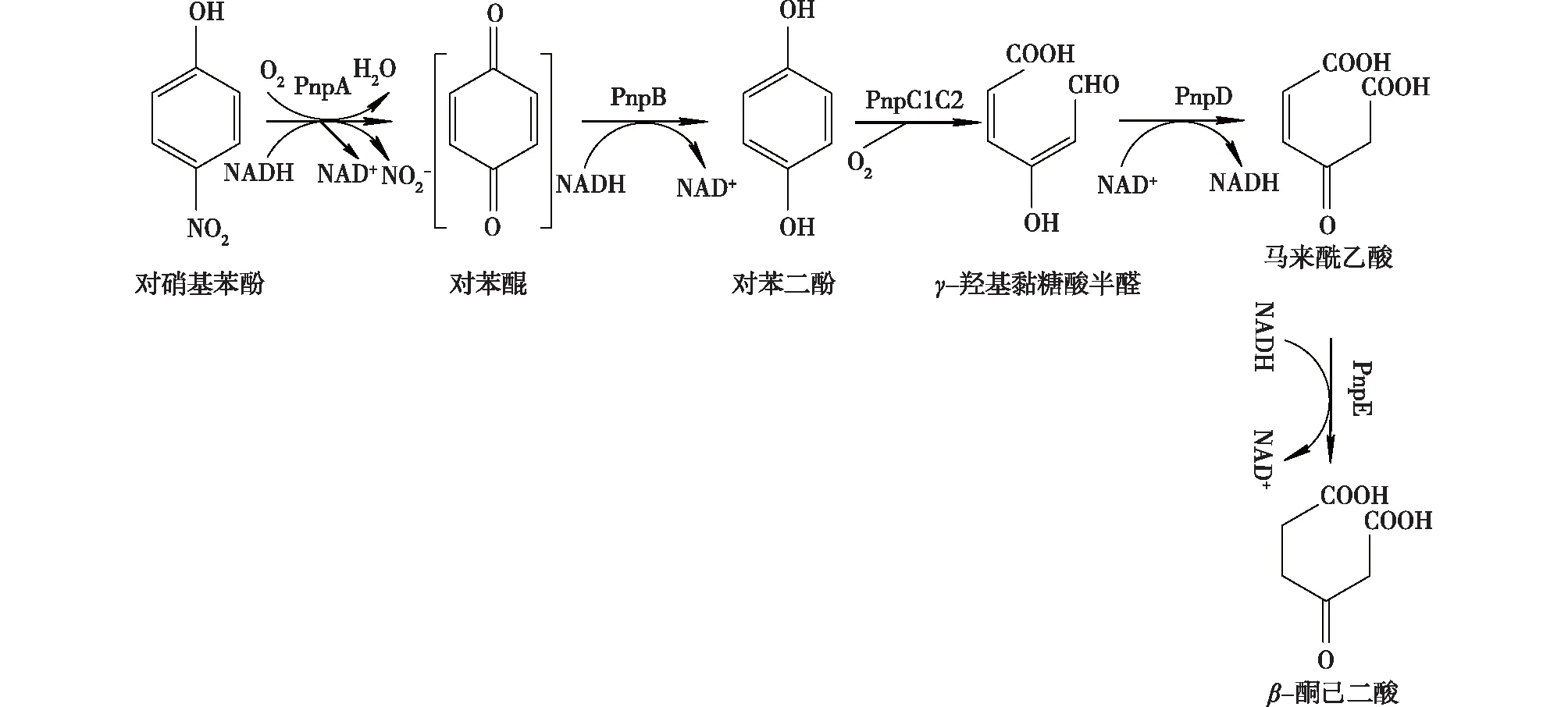
图1 Pseudomonas属的菌株中PNP的代谢途径[31]Fig.1 Proposed pathway for degradation of PNP by Pseudomonas[31]
张俊杰等[32-33]在Pseudomonassp. WBC-3中克隆得到PNP降解相关基因簇,菌株WBC-3利用PNP作为其碳、氮和能量的唯一来源,通过对苯二酚途径进行代谢,参与PNP分解代谢的基因位于3个不同的操纵子上:pnpA(编码PNP 4-单加氧酶)、pnpB(编码对苯醌还原酶)和pnpCDEFG(编码催化对苯二酚转化为对苯醌的酶)。在其随后的工作中,Zhang等[34]发现转录调控因子PnpR参与调控pnpR、pnpA、pnpB和pnpCDEFG等4个操纵子;后续的研究中,Wang等[35]发现另外一个靠近pnpR的基因编码的转录调控因子PnpM也参与了pnpCDEFG操纵子对WBC-3菌株降解PNP过程中对苯二酚降解途径的调节。
2.2.2 节杆菌属
Liu等[36]研究发现,节杆菌属Arthrobactersp.NyZ415降解PNP通过对苯二酚途径,第一步反应是在单加氧酶的催化下将PNP降解成羟基对苯二酚。与之不同的是,Chauhan等[37]则揭示了节杆菌Arthrobactersp. RKJ100另一条降解途径,PNP首先在未知酶的作用下被催化生成对苯醌,然后对苯醌被进一步降解为对苯二酚、γ-羟粘康酸半醛和β-酮基己二酸酯,最后β-酮基己二酸酯在三羧酸(TCA)循环中被代谢。
此外,Arthrobactersp.CN2和Arthrobactersp. JS443通过另一条途径来降解PNP[38-39]。PNP在Arthrobactersp.CN2中的单加氧酶作用下催化生成4-硝基邻苯二酚,再转化为1,2,4-苯三酚和马来酰乙酸酐,最后,马来酰乙酸被TCA循环降解。而在Arthrobactersp. JS443降解PNP过程中,PNP首先在单加氧酶作用下羟化生成4-硝基邻苯二酚和4-硝基间苯二酚;然后,4-硝基邻苯二酚和4-硝基间苯二酚在单加氧酶体系催化下反应生成1,2,4-苯三酚,进一步开环形成马来酰乙酸(maleylacetate);最后,马来酰乙酸经β-酮己二酸途径代谢[38]。Perry等[29]在Arthrobactersp. JS443中克隆得到PNP代谢的基因簇,该基因簇包含4个参与特定代谢的功能基因,与之前报道所不同的是,这个基因簇编码的酶系通过另一条代谢途径来进行PNP的降解;在Arthrobactersp. JS443中,在NpdA2的催化作用下,PNP先生成对苯醌后生成羟基对苯醌;在体内还原酶的作用下,生成对苯二酚和偏三苯酚,在NpdB作用下间三酚开环(图2)。因Arthrobactersp. JS443不能降解生成的对苯二酚使得其积累,这给在降解由C14标记的PNP过程中检测到对苯二酚一个合理的解释。
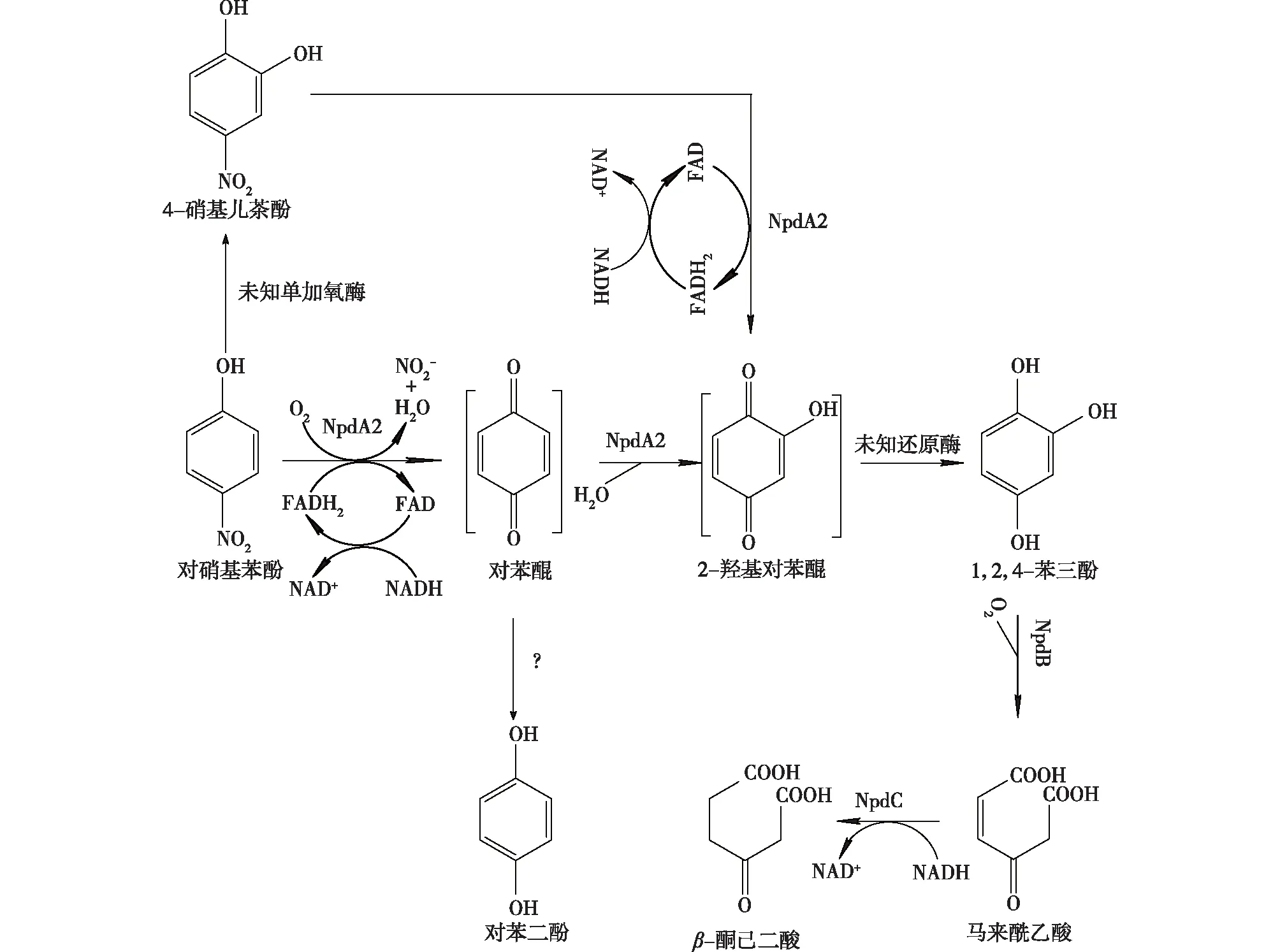
图2 Arthrobacter sp. JS443中通过1,2,4-苯三酚途径降解PNP[29]Fig.2 Proposed pathway for degradation of PNP via 1,2,4-benzenetriol by Arthrobacter sp. strain JS443[29]
2.2.3 红球菌属
目前有Rhodococcussp. PN1和RhodococcusopacusSAO101这2个Rhodococcus菌的菌株克隆到PNP降解相关基因的研究报道[26, 40]。Rhodococcussp. PN1和RhodococcusopacusSAO101与传统的革兰阳性菌PNP代谢途径是一致的。催化PNP代谢第一步的酶是一个异质双组分酶(对硝基苯酚单加氧酶),由2个亚基组成。黄素单加氧酶作为大亚基,还原酶是小亚基。在FAD和NADH存在下,对硝基苯酚单加氧酶首先催化PNP生成4-硝基儿茶酚,再经过脱硝基作用生成偏三苯酚。通过对体外表达的不同亚基活性的测定,目前认为苯环羟化和加氧脱硝基是大亚基的功能,而FAD的还原则是小亚基的主要功能,它提供还原力帮助大亚基发挥活性。Rhodococcussp. PN1中将对硝基苯酚羟化生成4-硝基儿茶酚的羟化酶在序列上与苯酚羟化酶和4-苯基乙酸3-羟化酶高度相似。RhodococcusopacusSAO101 PNP单加氧酶的NpcB组分与GeobacillusthermoglucosidasiusA7的还原酶PheA2同源性不高,只有32%,表明编码该酶的可能是一个新的基因。综上分析,研究者将异二组分酶PNP单加氧酶划分到黄素单加氧酶(TC-FDM)家族。
2.2.4 红细菌属
Rhodobactercapsulatus需要在较低的氧气浓度下完成PNP的降解,并非传统的光营养细菌通过还原途径进行厌氧降解[41],Roldan等[42]通过对光合细菌RhodobactercapsulatusE1F1的研究发现在该途径中,苯环开环之前硝基并未脱去,PNP在NADH依赖的单加氧酶作用下转化为4-硝基儿茶酚,然后通过邻位开环直接生成4-硝基酮己二酸,再经过脱硝基进入到相应代谢循环(图3),该途径不同于Moraxella[43]和Pseudomonas[44]中的途径,因为在这些途径中,硝基在苯环打开之前脱去。
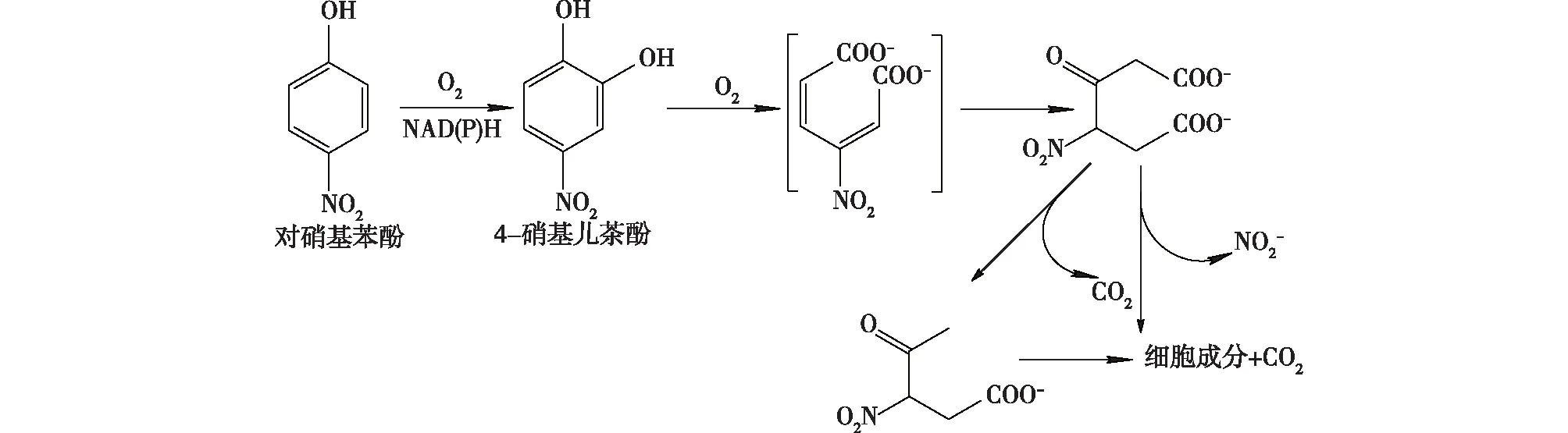
图3 Rhodobacter capsulatus中新的PNP代谢途径[41]Fig.3 Proposed pathway for the degradation of PNP by Rhodobacter capsulatus[41]
2.3 混合代谢途径
在假单胞菌和伯克霍尔德属PNP降解菌中存在着对苯二酚和1,2,4-苯三酚的混合降解途径(图4)。Pseudomonassp. WBC-3和P.putidaDLL-E4中缺少将PNP转化为4-NC的关键酶,但它们编码的PNP 4-单加氧酶具有将4-NC转化为1,2,4-苯三酚的能力,并通过1,2,4-苯三酚开环酶的作用进一步降解[45-46]。Burkholderia属不同菌株PNP代谢途径存在差异,B.cepaciaRKJ200降解PNP和4-NC的基因位于相同的降解性质粒上,PNP的降解是通过对苯二酚途径,4-NC则首先转化为1,2,4-苯三酚,再还原为对苯二酚进行降解[47],而在Burkholderiasp. SJ98中,PNP通过类似于革兰阳性菌的代谢途径进行降解[48]。
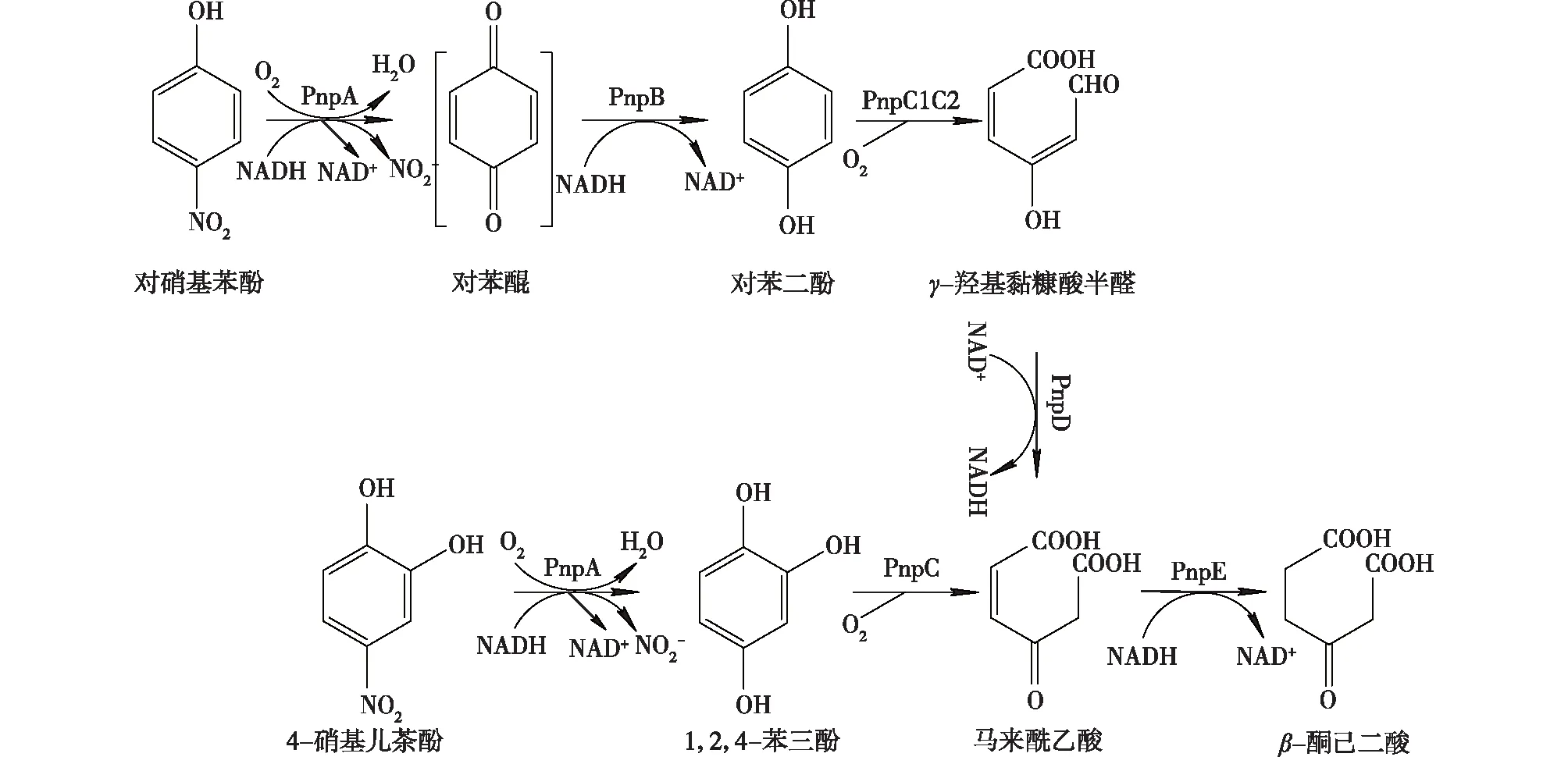
图4 假单胞菌和伯克霍尔德属中降解对硝基苯酚和4-硝基儿茶酚的混合途径[45,47]Fig.4 Mixed PNP and 4-NC degradation pathway in Pseudomonas and Burkholderia[45,47]
3 对硝基苯酚降解相关基因簇及其调控模式
由于受基因组大小的限制,原核生物中参与同一个生物学过程的相关基因往往以基因簇的方式组织在一起。虽然来源于不同的微生物,但微生物参与PNP降解的关键酶编码基因均以基因簇方式存在。PNP代谢可以分为上游代谢途径和下游代谢途径,上游代谢途径负责PNP脱硝基转化为对苯二酚或1,2,4-苯三酚,下游代谢途径负责对苯二酚或1,2,4-苯三酚的开环,最终产生β-酮己二酸进入TCA途径,被完全代谢。而革兰氏阳性细菌和革兰氏阴性细菌中对PNP代谢途径编码基因的组织方式存在明显不同。在革兰氏阳性菌Rhodococcussp.和Arthrobactersp.中,PNP在双组分4-对硝基苯酚单加氧酶NpcBA(NpsA1A2)[26, 28, 40]或NpdA1A2[29,37]的作用下转化为1,2,4-苯三酚,进而实现苯环的开环。在基因组中双组分单加氧酶往往与开环酶在一起形成基因簇(Arthrobactersp. JS44)或操纵元(Rhodococcus菌属)结构,但与开环后产物转化有关的下游途径则可能位于基因组的不同位置(图5)。
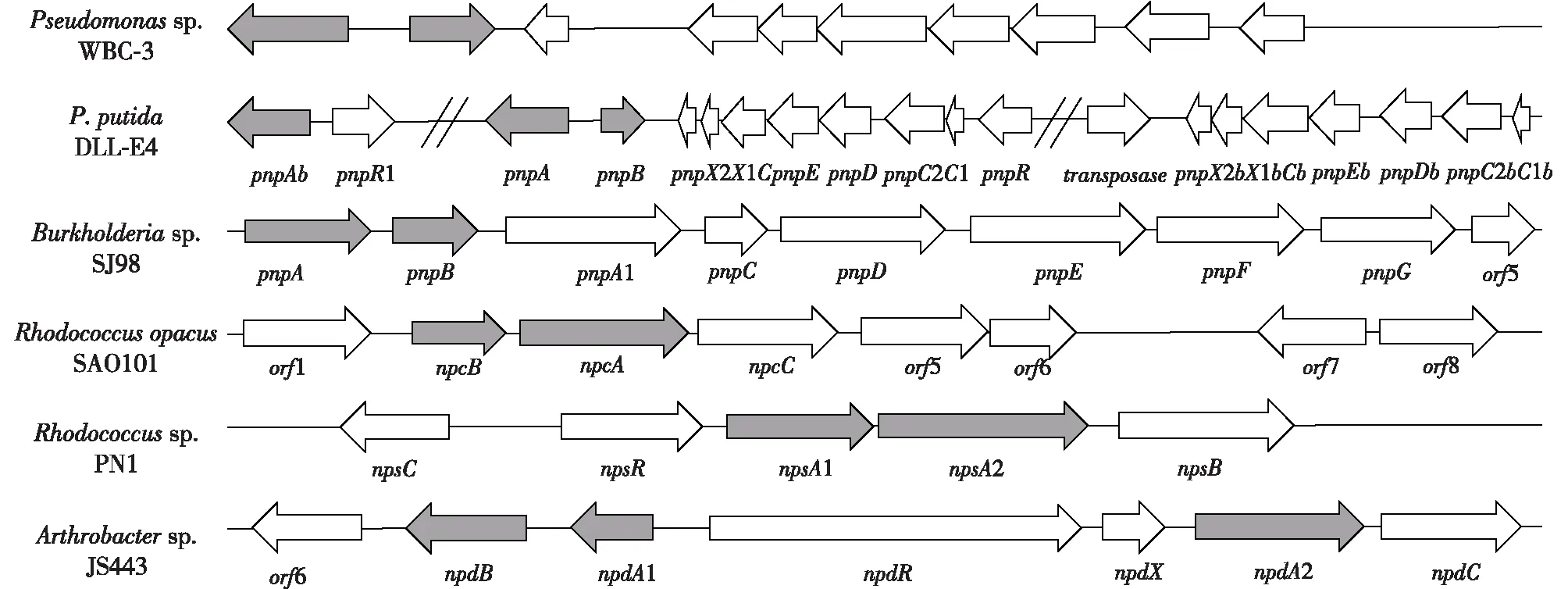
图5 不同菌株中对硝基苯酚降解基因簇组织方式[26,29,40,45-46,48]Fig.5 Organization of the degradation gene clusters in different strains[26,29,40,45-46,48]
革兰氏阴性PNP降解菌中,PNP代谢基因簇的组织结构非常类似。上游途径对硝基苯酚4-单加氧酶(PnpA)和醌还原酶(PnpB)与下游途径对苯二酚开环相关酶组织在一起形成1个基因簇,共同编码PNP代谢途径。Burkhoderia菌属中PNP代谢基因簇的组织方式与Pseudomonas菌属稍有不同,PnpA、PnpB和对苯二酚开环途径组成1个共转录的操纵元(图5)。P.putidaDLL-E4是一株能够高效降解PNP及其中间代谢产物对苯二酚(HQ)的菌株,DLL-E4基因组中含有2套PNP降解基因簇pnp和pnp1:第1套基因簇pnp包含基因pnpA、pnpB、pnpR、pnpC1、pnpC2、pnpD、pnpE、pnpC、pnpX1和pnpX2,第2套基因簇pnp1包含基因pnpAb、pnpC1b、pnpC2b、pnpDb、pnpEb、pnpCb、pnpX1b和pnpX2b。通过反转录PCR确定了PNP降解基因簇的组织形式。虽然pnp1操纵元与Pseudomonassp. WBC-3 PNP代谢操作元具有很高的同源性,但在菌株DLL-E4中,该操纵元失去了降解对苯二酚的能力[45]。
目前,有关PNP降解代谢的调控报道不多,Pseudomonassp. WBC-3中LysR家族的调控蛋白PnpR调控了PNP代谢的上下游代谢途径,在PnpA和PnpC的启动子区均可检测到PnpR的保守性结合序列GTT-N11-AAC[34],是1种比较特殊的LysR家族调控体系。P.putidaDLL-E4中存在着与PnpR同源性较高的调控蛋白PnpR[45],但关于其具体调控机制尚不明确。R.opacusSAO101中ORF1编码1个可能的LysR家族调控蛋白[26],该蛋白的调控功能及机制均未见报道。
4 微生物菌群设计与调控在PNP修复中的作用
降解性微生物进入环境受到其他微生物类群的影响,保持一定的群体数量是其高效降解的关键。因此,通过调控土壤环境中参与PNP降解的相关微生物群落结构,增强其降解效率和稳定性是PNP生物修复的可选途径。PNP高效降解菌Burkholderiasp. SJ98在进入人工污染土壤中能够显著改变细菌的群落结构,进而影响PNP的降解效率[23]。此外,外源添加营养物质(如葡萄糖)能够显著提高PNP的降解效率[49]。已有研究表明,多菌株协同作用与单一降解菌相比降解效率更好,稳定性更强[50]。因此,利用PNP降解相关菌株之间的协同代谢和互养关系,构建高效的PNP降解菌群将为开放环境中PNP的消除提供了更加高效的手段。然而,由于菌株之间复杂的相互作用关系,降解菌群的稳定性和构建方法等因素使得目前微生物菌群强化修复距离实际应用还存在一定的距离。
5 微生物与植物联合修复在PNP修复中的应用
虽然目前丰富的PNP降解性微生物种质资源为PNP生物修复提供了良好的基础,然而,由于自然环境中环境因子(温度、氧气、盐度等)和污染物理化性质的多变性以及微生物适应性等方面的影响[51],PNP降解性微生物进入环境中群体数量和生物活性受到限制。植物在绿色农业可持续发展中发挥重要的作用[52],植物能够为根际微生物降解污染物提供良好的生态位保护和可利用碳源,而根际微生物在减少污染物对植物的胁迫等方面为植物提供保护。假单胞菌 PN1能在PNP含量为90~155 mg/kg中的土壤中存活,具有高效的PNP去除效率,同时还能在干旱和盐碱胁迫条件下促进玉米的生长[53]。Romero等[54]通过对污染区定殖植物的根际微生物组装机制进行研究,在此基础上构建了人工菌群,显著增强了土壤原位修复的能力。基于菌植互作的污染物修复体系在河岸缓冲区的径流控制、垃圾填埋场、人工湿地等方面也显示出较好的潜力[55],然而其在水体和土壤环境中的微生物与植物介导的PNP修复还未引起足够的重视。
6 结论与展望
目前,国内外研究者在PNP降解菌资源挖掘、PNP生物降解机制、菌群调控等方面已经做了大量的工作。美国明尼苏达大学建立了生物催化-生物降解数据库(UM-BBD),涉及上千种污染物降解有关的微生物、酶和代谢途径等多方面内容,并以此为基础开发了相关的PNP降解菌剂。然而开放环境中的PNP降解以及实际应用依然存在诸多问题,主要归因于污染物降解菌在环境中适应性弱、定殖能力差、无法形成足够的群体等以实现污染物的消除,导致外源污染物降解菌在实际环境中的应用受限。在以菌剂形式开展土壤或者水体环境修复过程中,以PNP为代表的污染物在降解过程中形成的中间产物和最终产物,它们在环境中的迁移行为以及对微生物群落和植物的影响需要进一步研究。此外,污染物的转化涉及降毒再造的过程,在丰富的降解酶资源基础上,利用降解酶的催化选择性实现对污染物转化或者结构修饰,消除其毒性,增加其农业应用价值,为环境中PNP等污染物的生物修复提供更多的路径。

