质子泵抑制剂通过下调细胞周期相关基因诱导胃癌细胞周期阻滞并促进化疗增敏*
苏 萌 张 斌 陈 敏 王 雷 徐桂芳 吕 瑛 邹晓平&
南京医科大学鼓楼临床医学院1(210008) 南京大学医学院附属鼓楼医院消化内科2
背景:研究发现质子泵抑制剂(PPI)可增强胃癌细胞的化疗敏感性,抑制胃癌细胞增殖和侵袭。目的:探讨PPI是否系通过影响细胞周期相关基因表达对胃癌细胞发挥化疗增敏作用。方法:以不同浓度泮托拉唑处理人胃癌细胞株AGS和HGC27,CCK-8实验检测细胞活力,转录组测序结合KEGG富集分析明确PPI对胃癌细胞周期的影响,流式细胞分析、real-time PCR和蛋白质印迹法验证细胞周期及其相关基因表达变化。利用生物信息学网站分析主要细胞周期相关差异表达基因在胃癌组织中的表达及其与患者预后的关系。CCK-8实验检测PPI联合顺铂对转染FOXM1过表达质粒或空载质粒的胃癌细胞的增殖抑制效果。结果:PPI可有效抑制胃癌细胞体外增殖。转录组测序和KEGG富集分析显示经PPI处理的胃癌细胞G2/M期相关基因FOXM1、PLK1、AURKB等表达下调,并出现G2/M期阻滞,上述发现经流式细胞分析以及real-time PCR和蛋白质印迹法证实。生物信息学分析显示上述G2/M期相关基因在胃癌组织中的表达显著上调,并与预后不良相关。PPI联合顺铂对胃癌细胞的增殖抑制作用显著强于顺铂单药处理,但可被过表达FOXM1部分逆转。结论:PPI可通过下调细胞周期相关基因表达诱导G2/M期阻滞,从而增强胃癌细胞的化疗敏感性。
胃癌是最常见的恶性肿瘤之一,在全球癌症统计中,其发病率和死亡率分居第五和第三位,包括中国在内的东亚地区胃癌发病率普遍较高[1-2]。随着化疗药物和化疗方案的不断优化,晚期胃癌患者的生存期得以明显延长,但中位生存期仍难以超过1年,多药耐药是胃癌患者预后不良的主要原因之一[3]。有效逆转胃癌多药耐药、增强胃癌对化疗药物的敏感性一直是胃癌治疗的难点和研究热点。
质子泵抑制剂(proton pump inhibitors, PPIs)作为抑酸药,是治疗胃食管反流病、消化性溃疡等酸相关疾病的首选药物[4],近年发现其在肿瘤治疗方面也具有潜在应用价值。研究显示PPI可通过改变细胞内外pH值、增加细胞内活性氧水平等发挥增强肿瘤细胞化疗敏感性、促进肿瘤细胞凋亡等作用[5-9]。本课题组之前的研究已证实PPI预处理可增强胃癌细胞对化疗药物的敏感性,抑制胃癌细胞增殖和侵袭[10-11]。
肿瘤细胞具有快速、持续增殖的特性,活跃的细胞周期进程是其无限增殖的关键因素之一。影响细胞周期进程也是肿瘤化疗的关键作用机制,很多化疗药物系通过特定靶点影响肿瘤细胞周期进程,进而抑制肿瘤细胞增殖。本研究以PPI处理人胃癌细胞株,采用体外实验与生物信息学分析相结合的方法,探讨PPI是否系通过影响细胞周期相关基因表达诱导胃癌细胞周期阻滞,从而发挥化疗增敏作用,以期为阐明PPI抑制胃癌恶性生物学行为的可能作用机制提供更多理论依据。
材料与方法
一、细胞株和主要试剂
人胃癌细胞株AGS、HGC27购自中国科学院上海细胞库,使用10% RPMI 1640培养基,培养于37 ℃、5% CO2培养箱中,经观察细胞紧密排列、融合度达到80%~90%后进行后续实验。
泮托拉唑钠(Takeda GmbH);CCK-8细胞增殖和细胞毒性检测试剂、HiScript Ⅲ RT SuperMix for qPCR、SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司);TRIzol RNA分离试剂、Lipofect-amineTM3000转染试剂(Thermo Fisher Scientific);NEBNext®UltraTMⅡ RNA Library Prep Kit for Illu-mina®(New England Biolabs.);细胞周期检测试剂盒(南京福麦斯生物技术有限公司);RIPA裂解液、蛋白质定量试剂盒(碧云天生物);兔抗人叉头框蛋白M1(forkhead box M1, FOXM1)单克隆抗体、鼠抗人Polo样激酶1(Polo-like kinase 1, PLK1)单克隆抗体、兔抗人Aurora激酶B(Aurora kinase B, AURKB)单克隆抗体、HRP标记抗小鼠、抗兔IgG(Cell Signaling Technology, Inc.);兔抗人周期蛋白B1(cyclin B1, CCNB1)单克隆抗体、兔抗人周期蛋白依赖性激酶1(cyclin-dependent kinase 1, CDK1)单克隆抗体(南京巴傲得生物科技有限公司);鼠抗人β-actin单克隆抗体(Sigma-Aldrich, Merck KGaA); pcDNA3.1-HA-FOXM1过表达质粒为南京医科大学鼓楼临床医学院实验室保存。
二、方法
1. CCK-8实验:将2株胃癌细胞消化成细胞悬液,以每孔3 000细胞/100 μL接种于96孔板,24 h后加入不同浓度泮托拉唑,继续培养48 h。每一处理组设6个复孔,同时设置不予PPI处理的对照组和无细胞空白组。处理结束后弃去完全培养基,每孔加入100 μL含10% CCK-8的无血清培养基,孵育1~2 h。以酶标仪测定各孔450 nm处吸光度值(A值),计算细胞相对活力。细胞相对活力=(处理组A值-空白组A值)/(对照组A值-空白组A值)×100%。
2. 转录组测序:培养于6孔板中的AGS、HGC27细胞分别以含相应浓度泮托拉唑或不含泮托拉唑的完全培养基处理48 h,PBS洗涤3次,室温下TRIzol试剂提取总RNA。每一样品使用3 mg RNA作为RNA样品制备的输入材料,使用NEBNext®UltraTMⅡ RNA Library Prep Kit for Illumina®生成测序文库,库检合格后上机测序并行KEGG通路富集分析,筛选有显著意义的信号通路。
3. 细胞周期检测:收集经泮托拉唑处理48 h的胃癌细胞,同时设置不予PPI处理的对照组,根据试剂盒说明书进行操作,75%乙醇固定2 h,1 500×g离心5 min,弃去上清液,PI染色,37 ℃避光温浴30 min,上流式细胞仪检测。
4. 质粒转染和化疗药物干预:转染前一天将胃癌细胞在6孔板中铺板,铺板数量以24 h后细胞密度达到50%~70%为宜。根据试剂说明书进行操作,分别转染FOXM1过表达质粒pcDNA3.1-HA-FOXM1和空载质粒,24~72 h后更换新鲜完全培养基继续培养,用于后续实验。
将质粒转染后的胃癌细胞制成悬液,以每孔3 000细胞/100 μL接种于96孔板,予2 μmol/L顺铂(cisplatin, DDP)单药或40 μg/mL PPI+2 μmol/L DDP联合处理48 h,同时设置不予PPI处理的对照组和无细胞空白组,CCK-8实验检测细胞活力。
5. Real-time PCR:TRIzol试剂提取各组胃癌细胞总RNA,超微量光度计测定RNA浓度和质量,配置20 μL逆转录体系,将RNA逆转录为cDNA,行real-time PCR扩增,操作均按试剂说明书进行,目的基因PCR引物序列见表1。2-△△Ct法计算目的基因mRNA相对表达量。
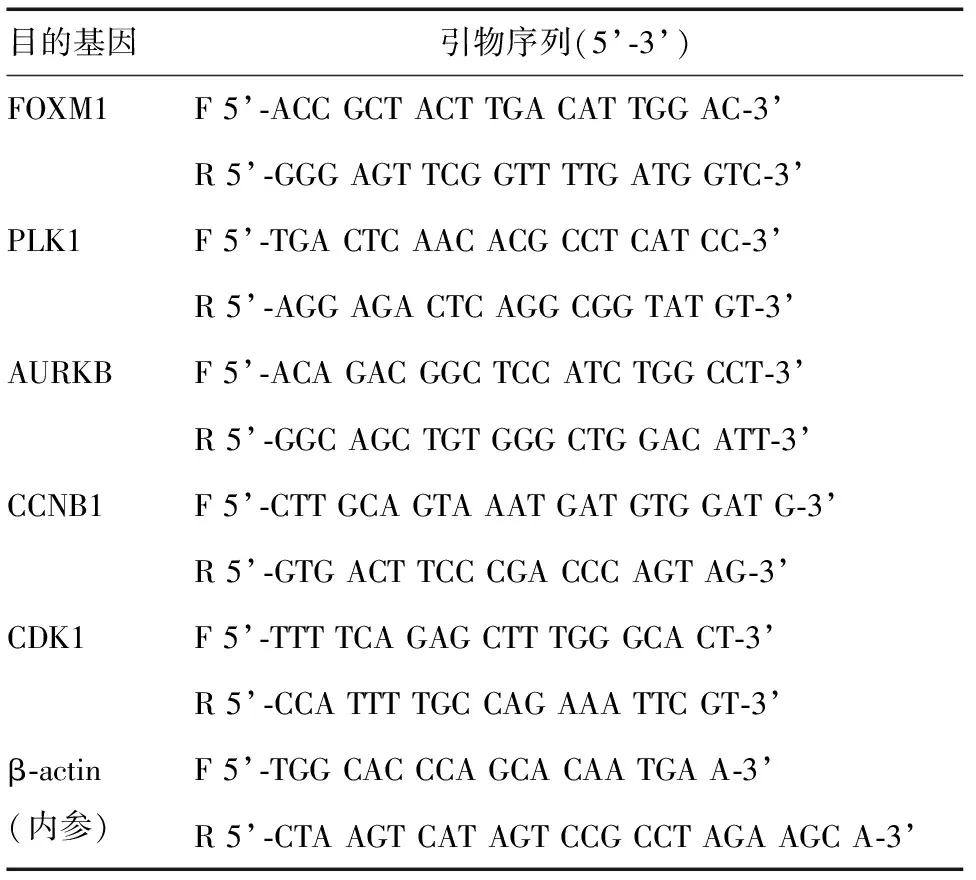
表1 Real-time PCR引物序列
6. 蛋白质印迹法:将RIPA裂解液、PMSF(100×)、蛋白酶抑制剂混合物(25×)以95∶1∶4的比例配制蛋白完全裂解液裂解各组胃癌细胞,低温高速离心10 min,取上清液,BCA法定量,高温变性样品蛋白。蛋白上样,行SDS-PAGE凝胶电泳(90 V 30 min, 120 V 60 min),预冷转膜缓冲液中200 mA 120 min转膜,5%脱脂牛奶常温封闭2 h,剪膜,4 ℃孵育一抗超过8 h,洗膜后室温孵育二抗2 h,洗膜后显影、定影。
7. 生物信息学分析:利用基因表达谱交互分析(Gene Expression Profiling Interactive Analysis, GEPIA)数据库(http://gepia.cancer-pku.cn/)和Kaplan-Meier Plotter(http://kmplot.com/analysis/)行细胞周期G2/M期相关基因表达水平分析和预后分析。
三、统计学分析
结 果
一、PPI抑制胃癌细胞增殖
CCK-8实验结果显示,AGS、HGC27细胞经PPI(>50 μg/mL)处理48 h后,细胞活力显著受抑,PPI抑制2株胃癌细胞的50%最低抑菌浓度(IC50)分别为127 μg/mL和88 μg/mL(图1),表明PPI可有效抑制胃癌细胞体外增殖。
二、PPI对胃癌细胞基因表达的调控
根据相应IC50值,分别以100 μg/mL和80 μg/mL PPI处理AGS和HGC27细胞,48 h后行转录组测序。AGS细胞中有9 959个基因表达发生变化,其中4 886个基因表达上调,5 073个基因表达下调;HGC27细胞有11 811个基因表达发生变化,其中5 726个基因表达上调,6 085个基因表达下调(图2A)。对2株胃癌细胞的差异表达基因取交集,KEGG通路富集分析显示细胞周期相关通路(调控细胞周期G2/M期转变、DNA复制、染色体分离等)变化最为显著(图2B)。
三、PPI通过调控细胞周期相关基因表达诱导胃癌细胞G2/M期阻滞
流式细胞分析显示,AGS、HGC27细胞分别经100 μg/mL和80 μg/mL PPI处理48 h后,均发生明显的G2/M期阻滞(P均<0.05;图3A)。对转录组测序数据进行分析,发现G2/M期相关基因FOXM1、PLK1、AURKB、CCNB1、CDK1表达水平均有不同程度的下调。以real-time PCR和蛋白质印迹法进行验证,结果证实上述基因在AGS、HGC27细胞中的表达可被PPI显著抑制(P均<0.05;图3B、3C),表明PPI可通过抑制细胞周期相关基因表达诱导胃癌细胞G2/M期阻滞。
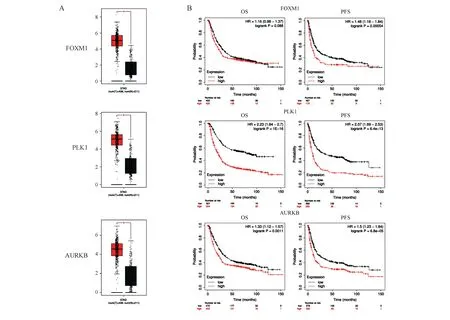
四、G2/M期相关基因在胃癌中的表达及其与预后的关系
利用GEPIA数据库提取癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库STAD(stomach adenocarcinoma)队列中的胃癌组织基因表达数据(n=408)和TCGA、基因型-组织表达数据库(Geno-type-Tissue Expression, GTEx)中的正常胃上皮组织基因表达数据(n=211)。与正常胃上皮组织相比,胃癌组织中G2/M期相关基因FOXM1、PLK1、AURKB表达均明显上调,差异有统计学意义(P均<0.05;图4A)。
利用Kaplan-Meier Plotter分析FOXM1、PLK1、AURKB基因表达与胃癌患者预后的关系,总生存期(overall survival, OS)和无进展生存期(progression-free survival, PFS)分析分别纳入875例和640例胃癌患者,结果显示,除FOXM1高、低表达组间OS无明显差异外,上述基因高表达者预后均明显差于低表达者,差异有统计学意义(P均<0.05;图4B)。
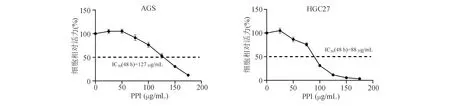
图1 PPI处理48 h后胃癌细胞相对活力(CCK-8实验)
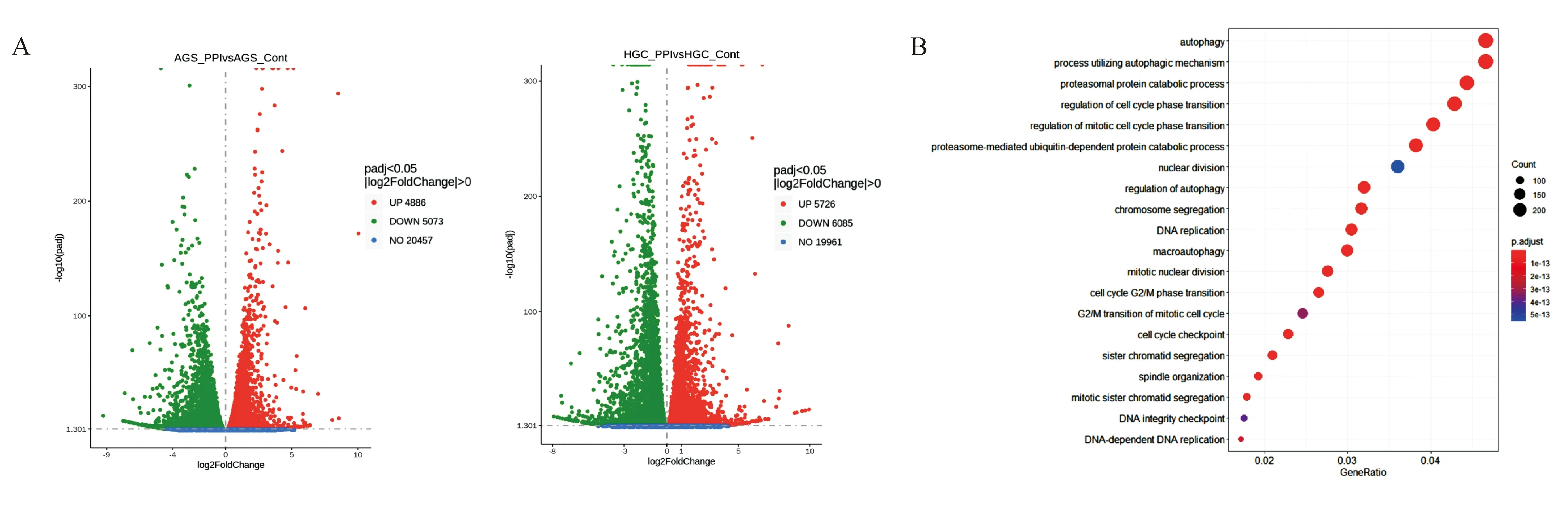
A:AGS、HGC27细胞经PPI处理后转录组测序火山图;B:2株胃癌细胞差异表达基因取交集后KEGG通路富集分析气泡图
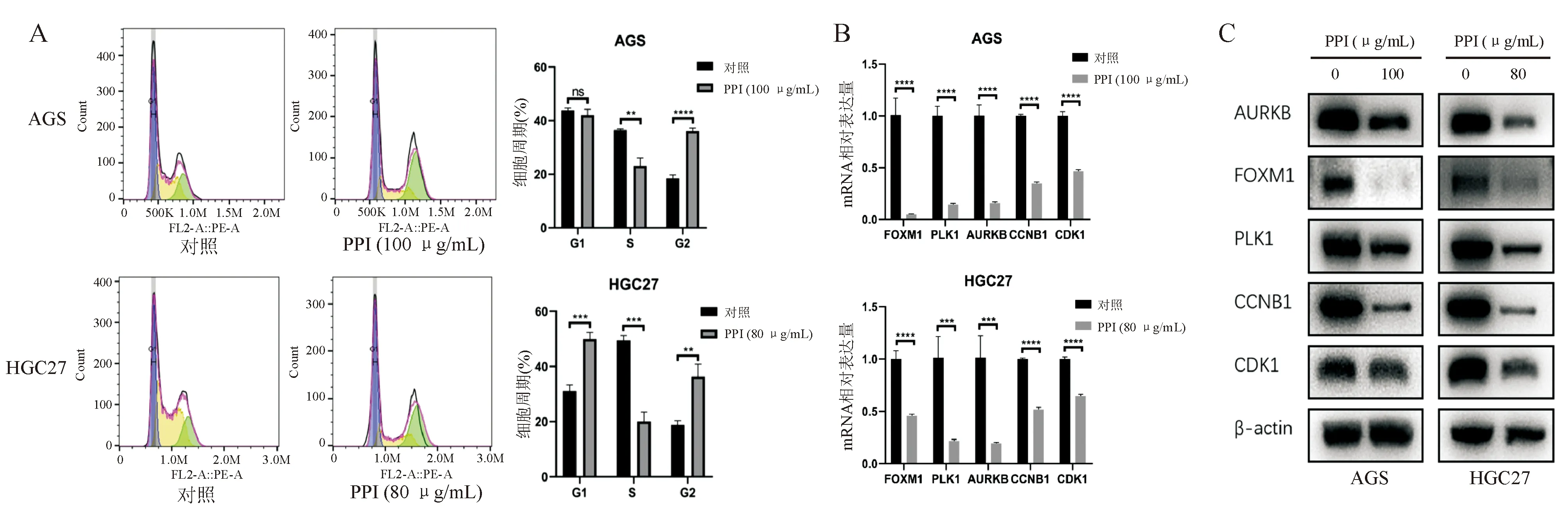
两组间比较,**P<0.01,***P<0.001,****P<0.000 1; ns, P>0.05
五、过表达FOXM1逆转PPI对胃癌细胞的化疗增敏作用
AGS、HGC27细胞转染FOXM1过表达质粒3 d后,以蛋白质印迹法验证转染效率,结果显示与转染空载质粒的对照组相比,转染FOXM1过表达质粒的胃癌细胞中FOXM1蛋白表达明显上调(图5A)。
转染空载质粒和FOXM1过表达质粒的胃癌细胞经2 μmol/L DDP单药或40 μg/mL PPI+2 μmol/L DDP联合处理48 h后,CCK-8实验结果显示,与DDP单药处理相比,PPI+DDP联合处理对胃癌细胞活力的抑制作用更为显著,而过表达FOXM1基因可部分逆转此种增殖抑制作用(图5B),表明过表达FOXM1能逆转PPI对胃癌细胞的化疗增敏作用。
两组间比较,*P<0.05
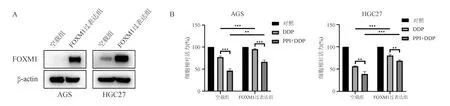
两组间比较,**P<0.01,***P<0.001
讨 论
胃癌是一个全球性的健康问题,全世界每年有100余万人被新诊断为胃癌。在过去50年中,尽管胃癌发病率和死亡率在全球范围内有所下降,但在世界大部分地区,胃癌仍然保持着75%的高病死率[12]。
近年来,有关PPI抑制肿瘤发生、发展的文献陆续发表。研究显示PPI预处理可通过抑制液泡-H+-ATP酶(vacuolar-H+-ATPase, V-H+-ATP酶)表达和活性、提高细胞外和溶酶体细胞器pH值、增加化疗药物在胞质内的停留时间、抑制自噬等机制提高肿瘤细胞对化疗药物的敏感性[6,13-15];此外,PPI还可通过影响游离脂肪酸合成抑制肿瘤细胞增殖,诱导细胞凋亡[16]。在幽门螺杆菌(Helicobacterpylori, Hp)相关胃癌中,PPI可通过抑制MAPK ERK1/2信号通路抑制Hp介导的肿瘤血管生成[17]。
本课题组前期也针对PPI抑制胃癌进行了一系列研究,相继证明PPI可通过影响胃癌中低氧诱导因子-1α(HIF-1α)的表达和分布抑制胃癌细胞增殖,诱导细胞凋亡[18];PPI可靶向STAT3、V-H+-ATP酶/mTOR/HIF-1α、Akt/GSK-3β/β-catenin等信号通路以及通过逆转上皮-间质转化(EMT)提高胃癌的化疗敏感性[10,19-20];PPI还可通过STAT3依赖的方式调节端粒酶逆转录酶(TERT)基因启动子区活性以抑制其表达,进而抑制胃癌细胞侵袭[11]。但迄今尚未就PPI对胃癌细胞周期的影响进行深入研究。
细胞周期阻滞是抑制肿瘤细胞增殖的关键策略之一,寻找并抑制其中的关键靶点有助于为肿瘤治疗和预防提供新思路。本研究利用转录组测序技术筛选经PPI处理的胃癌细胞的差异表达基因,发现调控细胞周期G2/M期的关键基因FOXM1、PLK1、AURKB、CCNB1、CDK1表达受抑,且对差异表达基因的KEGG富集分析也提示PPI处理可诱导胃癌细胞G2/M期阻滞。CCNB1和CDK1是参与促进肿瘤细胞周期进程的关键蛋白已为大量研究所确认。PLK1参与有丝分裂和胞质分裂的各个环节,在细胞周期G2/M期进程中发挥关键作用。AURKB可通过磷酸化PLK1介导染色体的精确分离[21-22]。FOXM1可通过促进G2/M期转变促进细胞有丝分裂进程[23-24]。本研究流式细胞分析证实PPI可诱导胃癌细胞发生G2/M期阻滞,应用real-time PCR和蛋白质印迹法对转录组测序差异表达谱进行验证,也证实了PPI作用于胃癌细胞可显著抑制上述调控G2/M期进程的重要分子表达。进一步的生物信息学分析提示胃癌组织中FOXM1、PLK1、AURKB基因表达显著高于正常胃上皮组织,且其高表达与预后不良显著相关。综合上述研究发现,FOXM1、PLK1、AURKB可能是PPI诱导胃癌细胞发生G2/M期阻滞,进而抑制胃癌进展的关键靶点。既往研究显示抑制PLK1、AURKB表达可抑制胃癌细胞增殖,诱导细胞凋亡,提高胃癌细胞对DDP的化疗敏感性[25-26],但未见抑制FOXM1是否会影响DDP对胃癌化疗效果的报道。为此,本研究对抑制FOXM1的化疗增敏作用进行了验证,结果显示过表达FOXM1可部分逆转PPI联合DDP对胃癌细胞增殖活性的抑制作用,表明PPI可通过抑制FOXM1表达增强其化疗敏感性。
综上所述,细胞周期相关基因FOXM1、PLK1、AURKB等在胃癌细胞中高表达并与预后不良相关;PPI可通过下调上述细胞周期相关基因表达诱导胃癌细胞发生G2/M期阻滞,从而增强胃癌细胞的化疗敏感性。PPI作为临床常用药物,具有较好的安全性[27],因此有望作为一种新的胃癌化疗增敏药物在胃癌临床治疗中发挥作用。本研究结果为PPI抑制胃癌恶性生物学行为的研究积累了更多的理论依据。

