MiR-21靶向调控PTEN对胃癌细胞增殖、凋亡和侵袭的影响*
李红敏 方 容 邹 琴
武汉市第四医院消化内科1(430030) 检验科2
背景:胃癌是一种常见的消化道恶性肿瘤,miR-21可调节磷酸酶及张力蛋白同源物(PTEN)蛋白表达,诱导多种肿瘤细胞凋亡。目的:探讨miR-21靶向调控PTEN对胃癌细胞增殖、凋亡和侵袭的影响。方法:将对数生长期SGC-7901细胞分为miR-21 mimic组、miR-21 inhibitor组、阴性对照组和空白对照组,采用RT-PCR和蛋白质印迹法分别检测miR-21和PTEN mRNA和蛋白表达,萤光素酶报告基因试验验证两者的靶向关系。将胃癌SGC-7901细胞分为空白对照组、NC组、miR-21组、PTEN组和miR-21+PTEN组,以CCK-8法检测细胞增殖活性,TUNEL法检测细胞凋亡情况,Transwell法检测细胞侵袭力,划痕实验检测细胞迁移力,蛋白质印迹法检测Ki-67、PCNA、cleaved caspase-3、Bcl-2、Bax、PTEN、p-PI3K/PI3K和p-Akt/Akt蛋白表达。建立裸鼠成瘤模型,检测过表达miR-21对移植瘤体积和质量的影响。结果:MiR-21可靶向负调控PTEN表达。与NC组相比,miR-21组细胞增殖、侵袭和迁移率升高(P<0.05),细胞凋亡率下降(P<0.05),Ki-67、PCNA、Bcl-2/Bax比例、p-PI3K/PI3K和p-Akt/Akt蛋白表达升高(P<0.05),PTEN、cleaved caspase-3表达下降(P<0.05);PTEN组细胞增殖、侵袭和迁移率下降(P<0.05),细胞凋亡率升高(P<0.05),Ki-67、PCNA、Bcl-2/Bax比例、p-PI3K/PI3K和p-Akt/Akt蛋白表达下降(P<0.05),PTEN和cleaved caspase-3表达升高(P<0.05)。与PTEN组相比,miR-21+PTEN组细胞增殖、侵袭和迁移率升高(P<0.05),细胞凋亡率下降(P<0.05),Ki-67、PCNA、Bcl-2/Bax比例、p-PI3K/PI3K和p-Akt/Akt蛋白表达升高(P<0.05),PTEN、cleaved caspase-3表达下降(P<0.05)。与对照组相比,过表达miR-21可增加裸鼠移植瘤的体积和质量(P<0.05)。结论:MiR-21可靶向负调控PTEN表达,激活PI3K/Akt信号通路,促进胃癌细胞增殖、侵袭和迁移,并抑制细胞凋亡。
胃癌是一种常见的消化道恶性肿瘤,早期主要表现为非特异性消化道症状,随疾病发展表现为疼痛、体质量减轻、贫血、恶病质等,预后较差[1]。目前,胃癌的治疗主要采用手术联合术前、术中和术后化疗的方式,但术后易发生复发和转移[2]。微RNA-21(miR-21)是miRNA家族的成员,参与调控多种细胞的增殖、分化和凋亡等生理过程,近年研究显示,miR-21在胃癌、肺癌、肝癌、乳腺癌等多种恶性肿瘤中均存在异常高表达[3-4]。既往有研究[5]显示,miR-21可靶向调控磷酸酶及张力蛋白同源物(phosphatase and tensin homologue, PTEN)的表达,诱导肝癌细胞凋亡。PTEN是一种肿瘤抑制基因,在胃癌细胞中异常低表达,可抑制胃癌细胞的增殖和侵袭[6]。Pan等[7]的研究显示,PTEN可抑制磷脂酰肌醇-3激酶/丝苏氨酸蛋白激酶(PI3K/Akt)信号通路的表达,抑制胃癌细胞的恶性生物学行为。但miR-21靶向PTEN调节胃癌细胞恶性生物学行为的具体机制尚不明确。本研究通过干扰miR-21,并分析miR-21靶向调控PTEN对胃癌细胞增殖、凋亡和侵袭的影响,旨在探讨miR-21靶向PTEN调节胃癌细胞恶性生物学行为的机制,从而为胃癌临床治疗和新靶向药物的研发提供一定的理论依据。
材料与方法
一、实验动物、主要试剂和仪器
1. 实验动物:20只SPF级BALB/c裸鼠,雄性,鼠龄4~5周,体质量(20±2) g,由北京维通利华实验动物技术有限公司提供。所有实验动物均饲养于武汉市第四医院实验动物中心,饲养期间各组小鼠自由饮水,饲喂普通维持饲料,由湖北省实验动物研究中心提供。饲养环境室温为22~25 ℃,模拟昼夜光照。所有操作均符合武汉市第四医院动物实验伦理学要求,且本批次裸鼠肿瘤体积的实验终点符合实验动物福利。
2. 实验试剂:MiR-21 mimic(正义链:5’-UAG CUU AUC AGA CUG AUG UUG A-3’,反义链:5’-AAC AUC AGU CUG AUA AGC UAU U-3’)、miR-21 inhibitor(正义链:5’-UCA ACA UCA GUC UGA UAA GCU A-3’, 反义链:5’-CAG UAC UUU UGU GUA GUA GUA CAA-3’)、miRNA-NC(5’-CAG UAC UUU UGU GUA GUA CAA-3’)、p-miR-Report质粒、PRL-K载体、慢病毒过表达载体pLV-DNA均由上海吉玛制药技术有限公司合成;细胞培养基RPMI-1640和胎牛血清购自上海沪震生物科技有限公司;pMIR-Report Luciferase质粒购自上海信裕生物科技有限公司;LipofectamineTM2000转染试剂购自上海钰博生物科技有限公司;萤光素酶报告基因试验检测试剂盒购自美国Promega公司;CCK-8检测试剂盒购自艾美捷科技有限公司;Transwell小室(包被Matrigel基底膜)购自美国BD公司;Bcl-2、Ki-67、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、Bax、cleaved caspase-3、PI3K、p-PI3K、Akt和p-Akt抗体均购自美国Santa Cruz公司;β-actin鼠单克隆抗体和HRP标记的二抗购自北京中杉金桥生物技术公司。
3. 实验仪器:7500实时荧光定量PCR仪、全自动酶标仪(Thermo Fisher Scientific);MF-ChemiBIS凝胶成像系统(DNR Bio-Imaging Systems)。
二、实验方法
1. 细胞培养和转染:人胃癌SGC-7901购自美国典型物种保藏中心。将SGC-7901细胞接种于含10%胎牛血清的RPMI-1640培养液,37 ℃、5% CO2条件下培养,隔天换液。将对数生长期细胞分为miR-21 mimic组、miR-21 inhibitor组、阴性对照组和空白对照组,应用LipofectamineTM2000试剂分别转染miR-21 mimic、miR-21 inhibitor、无意义的mimic,空白对照组不做任何处理。
2. RT-PCR检测miR-21和PTEN表达:Trizol法提取细胞总RNA,进行实时定量PCR。MiR-21上游引物:5’-TGC GGT AGC TTA TCA GAC TGA TG-3’,下游:5’-CCA GTG CAG GGT CCG AGG T-3’,以U6作为内参,上游引物:5’-CCC GGA CAC GTG GGC TCC C-3’,下游:5’- CAC ATC CCT GGA CAC AGT CCT AG-3’。反应条件:95 ℃预热5 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸10 min,共30个循环。PTEN上游引物:5’-AGG GAG TCA CAA TTC CCA GTC-3’,下游:5’-AGG TTT CCT CTG GTC CTG GTA T-3’,以GAPDH为内参,上游引物:5’-TGA ACG GGA AGC TCA CTG G-3’,下游:5’-GCT TCA CCA CCT TCT TGA TGT C-3’。反应条件:95 ℃预热5 min;95 ℃变性10 s,52 ℃退火20 s,72 ℃延伸10 min,30个循环。采用2-ΔΔCt法计算miR-21和PTEN的相对表达水平。
3. 萤光素酶报告基因试验验证miR-21与PTEN的靶向关系:根据miRNA靶点预测软件,miR-21可与PTEN mRNA的3’-UTR区420~437位点内的部分碱基互补配对(图1),体外合成含该位点(PTEN 3’-UTR WT)及其位点突变体(PTEN 3’-UTR MUT)的pMIR-Report Luciferase质粒。将该质粒、PRL-K载体混匀,与miR-21 mimic共转染SGC-7901细胞,mimic NC组转染miR-NC,培养48 h后测定萤光素酶活性,步骤严格按照试剂盒说明书进行操作。
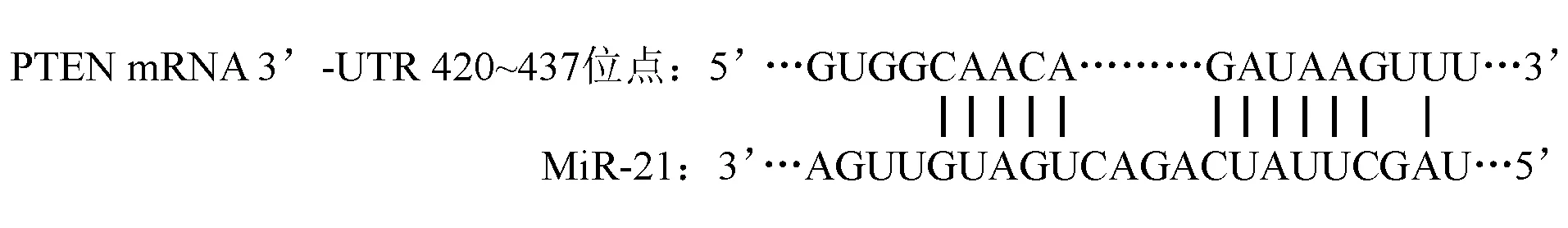
图1 MiR-21与PTEN mRNA的3’-UTR区碱基互补配对
4. 实验分组:将对数生长期SGC-7901细胞分为空白对照组、NC组、miR-21组、PTEN组和miR-21+PTEN组。转染前24 h接种细胞,NC组转染无意义mimic,miR-21组转染miR-21 mimic,PTEN组转染PTEN,miR-21+PTEN组转染PTEN和miR-21 mimic。
5. CCK-8法检测细胞增殖:取各组转染后的对数生长期SGC-7901细胞,以1×106个/孔接种于96孔板;置于37 ℃、5% CO2培养箱中培养48 h;检测波长为570 nm处各孔的吸光度(A)值,计算细胞增殖率。细胞增殖率(%)=(转染组细胞A值/对照组细胞A值)×100%。
6. TUNEL法检测细胞凋亡:取各组转染后的对数生长期SGC-7901细胞,调整细胞浓度为1×105个/mL,接种于12孔板。培养48 h后,制作细胞涂片,进行TUNEL染色,实验步骤严格按照试剂盒说明书进行操作,显微镜下观察阳性细胞数。
7. Transwell法检测细胞侵袭力:取各组转染后的对数生长期SGC-7901细胞,取100 μL稀释的细胞悬液(2×105个/mL)加于Transwell上室(包被Matrigel基底膜),上室加入无血清培养基,37 ℃ 5% CO2条件下培养48 h后取出Transwell小室,进行常规的固定、染色,观察计数膜的下室面表面的细胞。
8. 划痕实验检测细胞迁移力:取各组转染后的对数生长期SGC-7901细胞,接种于6孔板(1×105个/mL)。常规培养,待细胞铺满孔底单层,采用无菌枪头在皿底中间划一直线,拍照,洗涤3次,继续培养12 h,显微镜下观察培养前后划痕宽度,计算细胞的迁移率。
9. 蛋白质印迹法检测蛋白表达:取各组转染后的对数生长期SGC-7901细胞,提取各组细胞总蛋白,以β-actin为内参,检测PTEN(1∶1 000)、Ki-67(1∶500)、PCNA(1∶500)、Bcl-2(1∶500)、cleaved caspase-3(1∶500)、Bax(1∶500)、p-PI3K(1∶1 000)、PI3K(1∶1 000)、p-Akt(1∶1 000)、Akt(1∶1 000)蛋白表达,电化学发光法显影,凝胶成像系统分析目的蛋白的表达。
10. 裸鼠移植瘤模型建立和分组:20只SPF级裸鼠预饲养1周后,随机分为对照组和miR-21组,每组各10只。取NC组和miR-21组对数生长期SGC-7901细胞,制成1×107个/mL的单细胞悬液,分别注射于对照组和miR-21组裸鼠右侧腋下,建立裸鼠移植瘤模型,肉眼可见皮下成瘤,即为造模成功。每周测量一次小鼠肿瘤,计算肿瘤体积,肿瘤体积(cm3)=0.5×最小表径2×最大表径。5周末处死小鼠,切除肿瘤并称重。蛋白质印迹法检测移植瘤组织中PTEN蛋白表达。
三、统计学分析
结 果
一、MiR-21抑制PTEN表达
空白对照组与阴性对照组miR-21、PTEN mRNA和蛋白表达无明显差异(P>0.05);与阴性对照组相比,miR-21 mimic组miR-21 mRNA表达显著增加(P<0.05),PTEN蛋白表达显著降低(P<0.05);miR-21 inhibitor组miR-21 mRNA表达显著下降(P<0.05),PTEN蛋白表达显著增加(P<0.05;图2)。由此可见,miR-21 mimic组和miR-21 inhibitor组转染成功。
二、MiR-21可靶向负调控PTEN表达
转染PTEN 3’-UTR MUT质粒后,miR-21 mimic组和mimic NC组PTEN萤光素酶活性无明显差异;转染PTEN 3’-UTR WT质粒后,miR-21 mimic组PTEN萤光素酶活性显著低于mimic NC组(P<0.05;图3)。
三、MiR-21促进胃癌细胞SGC-7901增殖
CCK-8实验结果显示,与NC组相比,miR-21组细胞增殖率显著升高(P<0.05),PTEN组细胞增殖率显著下降(P<0.05)。与PTEN组相比,miR-21+PTEN组细胞增殖率显著升高(P<0.05;图4)。蛋白质印迹法结果显示,与NC组相比,miR-21组细胞Ki-67和PCNA蛋白表达显著升高(P<0.05);PTEN组细胞Ki-67和PCNA蛋白表达显著下降(P<0.05)。与PTEN组相比,miR-21+PTEN组细胞Ki-67和PCNA蛋白表达显著升高(P<0.05;图5)。
四、MiR-21抑制胃癌细胞SGC-7901凋亡
TUNEL染色结果显示,与NC组相比,miR-21组细胞凋亡率显著下降(P<0.05),PTEN组细胞凋亡率显著升高(P<0.05)。与PTEN组相比,miR-21+PTEN组细胞凋亡率显著下降(P<0.05;图6)。蛋白质印迹法结果显示,与NC组相比,miR-21组细胞Bcl-2/Bax比例显著升高(P<0.05),cleaved caspase-3表达显著下降(P<0.05);PTEN组Bcl-2/Bax比例显著下降(P<0.05),cleaved caspase-3表达显著升高(P<0.05)。与PTEN组相比,miR-21+PTEN组Bcl-2/Bax比例显著升高(P<0.05), cleaved caspase-3表达显著下降(P<0.05;图7)。
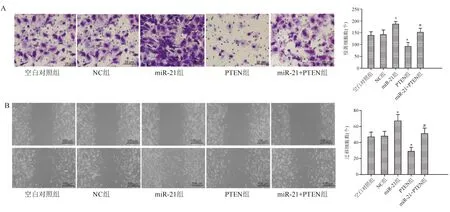
五、MiR-21促进胃癌细胞SGC-7901侵袭和迁移
Transwell实验和划痕实验结果显示,与NC组相比,miR-21组细胞侵袭率和迁移率显著升高(P<0.05),PTEN组细胞侵袭率和迁移率显著下降(P<0.05)。与PTEN组相比,miR-21+PTEN组细胞侵袭率和迁移率显著升高(P<0.05;图8)。
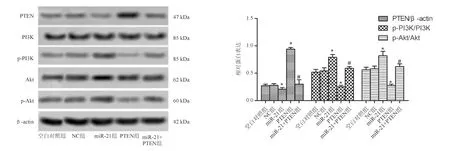
六、MiR-21靶向PTEN促进胃癌细胞SGC-7901 PI3K/Akt的磷酸化
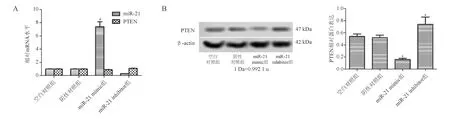
*与阴性对照组比较,P<0.05
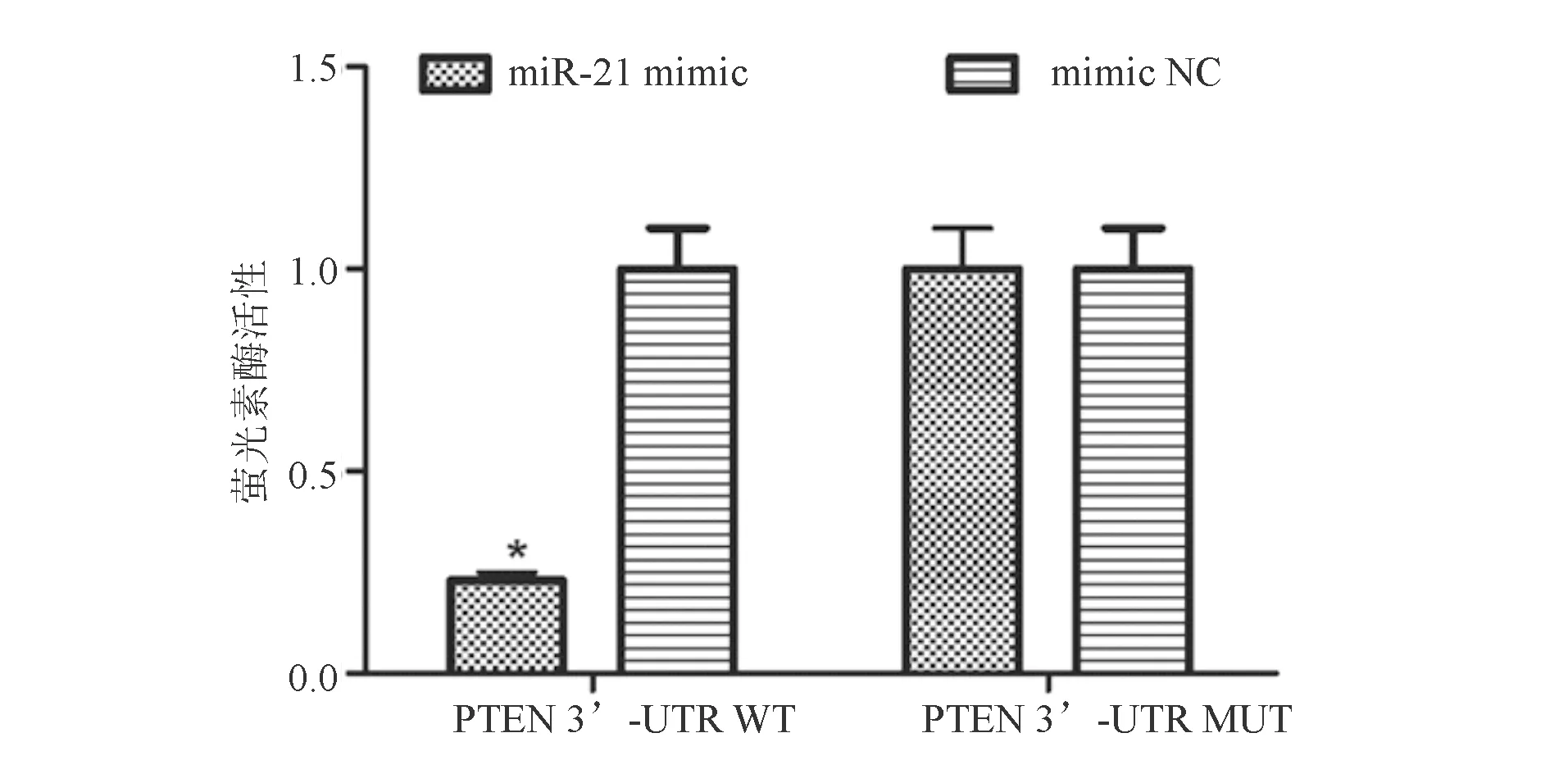
*与mimic NC组比较,P<0.05
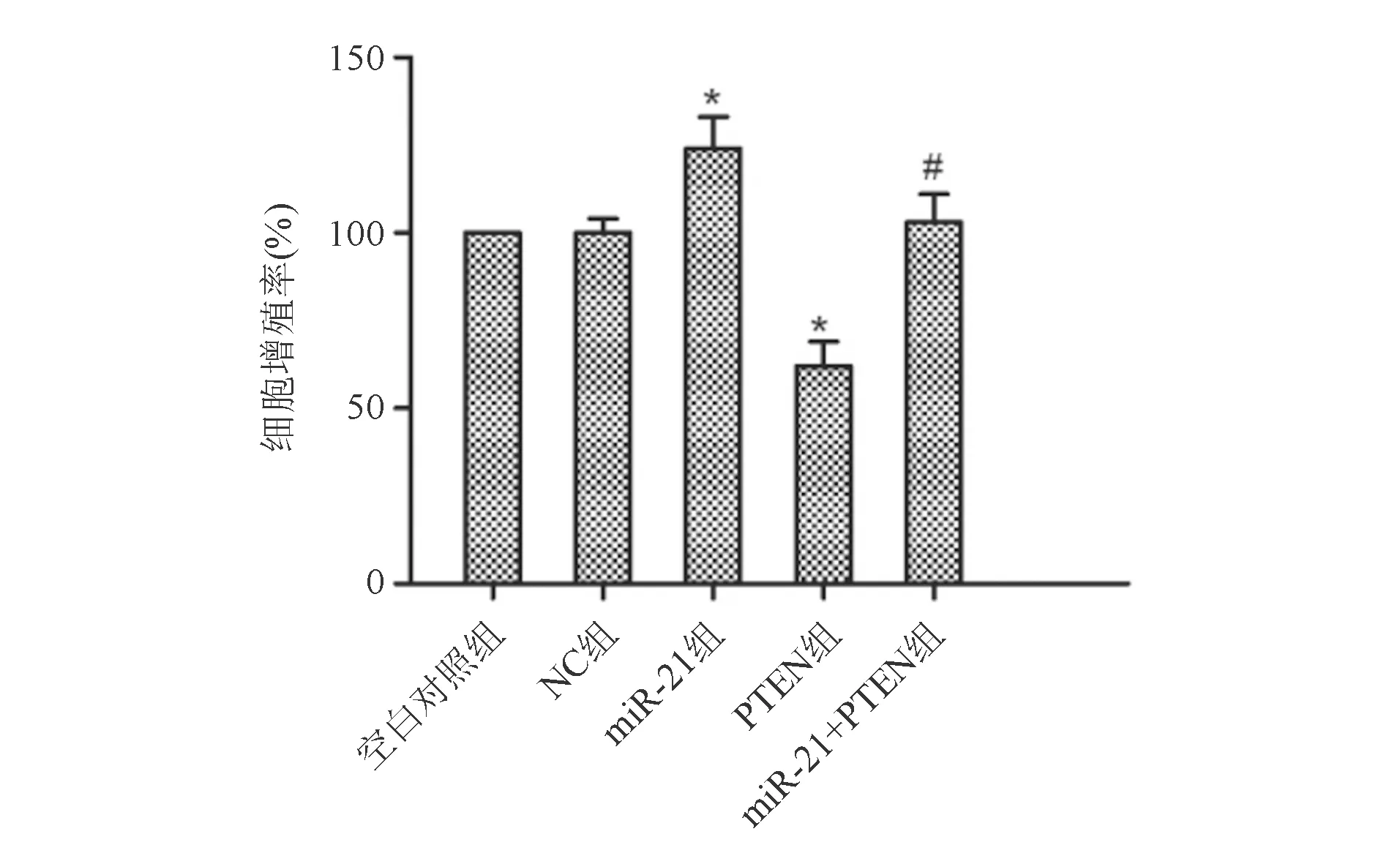
*与NC组比较,P<0.05;#与PTEN组比较,P<0.05
蛋白质印迹法结果显示,与NC组相比,miR-21组PTEN蛋白表达显著下降(P<0.05),p-PI3K/PI3K和p-Akt/Akt蛋白表达显著升高(P<0.05);PTEN组PTEN蛋白表达显著升高(P<0.05),p-PI3K/PI3K和p-Akt/Akt蛋白表达显著下降(P<0.05)。与PTEN组相比,miR-21+PTEN组PTEN蛋白表达显著下降(P<0.05),p-PI3K/PI3K和p-Akt/Akt蛋白表达显著升高(P<0.05;图9)。
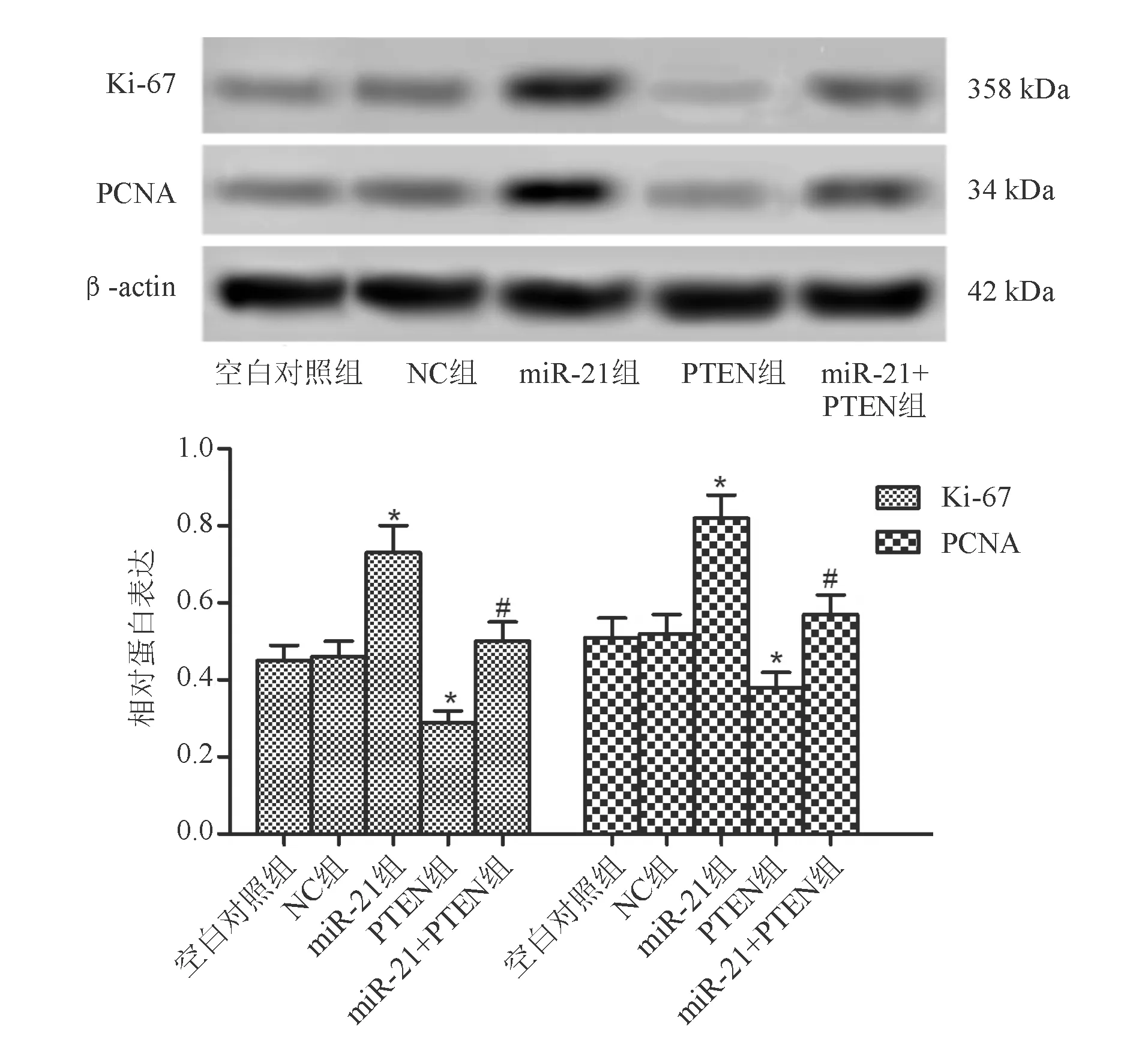
*与NC组比较,P<0.05;#与PTEN组比较,P<0.05
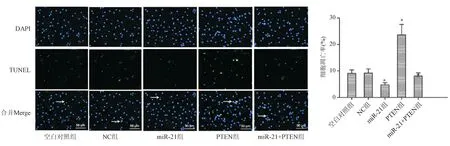
*与NC组比较,P<0.05;#与PTEN组比较,P<0.05
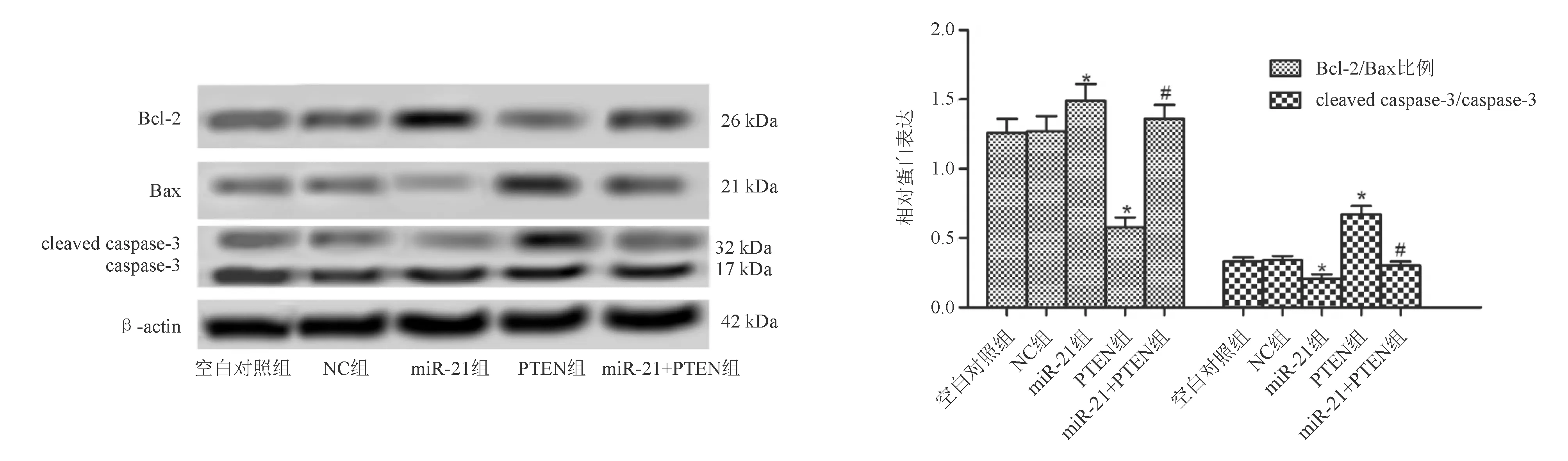
*与NC组比较,P<0.05;#与PTEN组比较,P<0.05
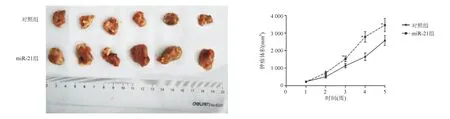
七、过表达miR-21促进裸鼠移植瘤的生长
裸鼠移植瘤结果显示,造模5周末,miR-21组裸鼠移植瘤质量显著高于对照组[(3.67±0.82) g对(2.84±0.41) g,P<0.05],PTEN蛋白表达明显降低(0.27±0.06对0.56±0.10,P<0.05)。造模后第3、4、5周,miR-21组裸鼠移植瘤体积显著大于对照组(P<0.05;图10)。
讨 论
MiRNA是一类具有调控作用的非编码RNA,可调节靶mRNA降解或翻译抑制,参与调控肿瘤的进展。MiR-21参与调控多种肿瘤的增殖、侵袭等恶性生物学行为[8]。刘梦涵等[9]的研究发现,miR-21可能通过负调控PTEN表达来抑制PI3K/Akt信号通路,调节白血病K562细胞的增殖和凋亡过程。但其在胃癌细胞中的作用机制尚不清楚。SGC-7901细胞是来源于胃癌患者淋巴结转移灶的恶性程度较高的细胞,目前已被广泛用于体外药物药效的研究,为临床新药开发和研究提供支持[10]。本研究对胃癌SGC-7901细胞中miR-21与PTEN之间的靶向关系进行验证发现,miR-21可在蛋白质水平上负调控PTEN表达,但对PTEN mRNA水平无明显影响,提示miR-21可能通过抑制PTEN的蛋白质翻译过程,靶向负调控PTEN。PTEN是一个具有双特异性磷酸酶活性的抑癌基因,在维持细胞结构、调控细胞内信号转导中具有重要作用[11]。多项研究显示,PTEN可能通过调节机体多条重要的信号转导通路来调节癌细胞的生物学行为[12-13]。本研究中,PTEN过表达可抑制胃癌细胞的增殖活性,miR-21和PTEN共同过表达可抵消PTEN对细胞增殖的抑制作用,提示miR-21可靶向负调控PTEN蛋白表达,促进SGC-7901细胞的增殖。本研究发现,PTEN过表达可抑制胃癌细胞中Ki-67和PCNA表达,miR-21和PTEN共同过表达可抵消PTEN的抑制作用,提示miR-21可靶向负调控PTEN表达,促进胃癌细胞Ki-67和PCNA表达。Ki-67和PCNA均为细胞增殖相关蛋白,其水平随着细胞有丝分裂进程而变化,可反映肿瘤细胞的增殖活性[14],提示miR-21可靶向负调控PTEN表达,调控增殖相关蛋白的表达,促进胃癌细胞增殖。
*与NC组比较,P<0.05;#与PTEN组比较,P<0.05
*与NC组比较,P<0.05;#与PTEN组比较,P<0.05
*与对照组比较,P<0.05
本研究中,PTEN过表达可抑制SGC-7901细胞Bcl-2/Bax比例,促进cleaved caspase-3表达,促进细胞凋亡;miR-21和PTEN共同过表达可抵消PTEN对胃癌细胞凋亡相关蛋白的调节作用,抑制胃癌细胞凋亡,提示miR-21可靶向负调控PTEN表达,抑制胃癌细胞凋亡。Bcl-2、Bax是一组调控线粒体膜通透性的蛋白,一旦细胞接收到外部信号刺激时,Bax会转位至线粒体细胞膜,激活凋亡级联反应,活化的caspase-3可启动细胞凋亡程序[15-16]。陈华等[17]的研究显示,PTEN可调控胃癌细胞的有丝分裂周期,诱导细胞凋亡。本研究结果显示miR-21可靶向负调控PTEN表达,抑制胃癌细胞凋亡。PTEN过表达可抑制胃癌细胞的侵袭和迁移,miR-21和PTEN共同过表达可抵消PTEN对胃癌细胞侵袭和迁移的抑制作用,提示miR-21可靶向负调控PTEN表达,促进胃癌细胞的侵袭和迁移。Wu等[18]的研究显示,PTEN可调节下游Akt/mTOR表达,抑制胃癌细胞的侵袭和迁移,提示miR-21可靶向负调控PTEN表达,调节细胞的重要信号转导通路,调控胃癌细胞的侵袭和迁移。
有研究表明PTEN可阻断PI3K/Akt信号通路,抑制多种肿瘤细胞的恶性增殖[19]。PI3K/Akt信号通路可调控细胞的生长、增殖、凋亡等多种病理生理过程,是肿瘤发生和进展的关键信号通路[20]。PTEN的脂质磷酸酶活性可使质膜的磷脂酰肌醇三磷酸去磷酸化,抑制PI3K的磷酸化,阻断下游Akt的磷酸化,进而阻断下游激酶的活性[21]。本研究结果显示,PTEN过表达可抑制胃癌细胞PI3K和Akt的磷酸化,miR-21和PTEN共同过表达可抵消PTEN对胃癌细胞PI3K和Akt磷酸化的抑制作用,提示miR-21可靶向负调控PTEN表达,促进胃癌细胞PI3K和Akt的磷酸化。Wang等[22]的研究显示,PTEN可抑制胃癌细胞PI3K和Akt的磷酸化,参与调控胃癌细胞的增殖、侵袭和凋亡,提示miR-21可靶向负调控PTEN表达,激活PI3K/Akt信号通路,促进胃癌细胞增殖、侵袭,并抑制细胞凋亡。
综上所述,miR-21可靶向负调控PTEN表达,激活PI3K/Akt信号通路,调控细胞增殖、凋亡相关蛋白的表达,促进胃癌细胞增殖、侵袭和迁移,抑制细胞凋亡。但本研究仅初步探讨了miR-21靶向负调控PTEN对胃癌SGC-7901细胞的影响,后期将进一步分析miR-21在其他胃癌细胞中的作用。

