哺乳动物毛囊周期性生长调控机制的研究进展
张 稳,刘罗兰,冯登侦,李新海
(宁夏大学农学院,中国宁夏银川750021)
毛发是哺乳动物皮肤的衍生物,由凹陷于皮肤真皮层的毛囊产生,具有冷热隔离、物理保护、社交互作及感官感应等诸多生物学功能[1],是毛用动物的重要经济性状,其产量和质量直接影响着养殖户的经济效益。毛囊作为产生毛发的基本单位,其周期性生长对毛纤维的发生、生长、脱落及再生具有关键作用。现已发现毛囊的生长发育受内分泌激素褪黑素以及一系列基因和信号通路如Wnt/β-catenin、骨形态发生蛋白质(bone morphogenetic protein,BMP)、成纤维细胞生长因子5(fibroblast growth factor 5,FGF5)的调控。随着高通量测序技术的应用普及,许多研究转向非编码RNA对毛囊周期性生长的调控,目前已有一些关于微RNA(microRNA,miRNA)及长链非编码RNA(long non-coding RNA,lncRNA)在毛囊生长期、退行期、休止期差异表达及靶基因调控的研究。此外,近期研究显示毛囊的生长发育及周期性活动还涉及糖酵解酶、胶原蛋白、干细胞及免疫T细胞。本文简要描述了毛囊的周期性生长活动,论述了褪黑素在毛囊生长发育中的作用以及调控毛囊周期性生长的基因及信号通路、非编码RNA和其他毛囊生长发育相关的蛋白质/细胞,以期为全面揭示毛囊周期性生长的调控机制、提高毛用经济动物绒毛的产量和质量以及治疗人类毛囊疾病等提供参考。
1 毛囊的周期性生长
毛囊是哺乳动物皮肤特殊的附属器官,位于皮肤的真皮层。毛囊发生于哺乳动物胚胎期,主要依赖于真皮细胞和上皮细胞之间传递的一系列信号分子[2~3]。不同哺乳动物的毛囊形态千差万别,但都具有毛球、毛干、内根鞘、外根鞘等基本结构(图1)[4]。依照形成时间与结构功能特点,毛囊可分为初级毛囊(primary follicle,PF)和次级毛囊(secondary follicle,SF)。初级毛囊由上皮细胞和真皮层细胞分化发育形成,次级毛囊由发育中的初级毛囊分化而来[5~6]。
哺乳动物毛囊呈周期性生长,毛囊循环经历着生长期、退行期、休止期,各个时期的形态变化存在很大差别[7](图1),这一重要生理特征与毛囊干细胞(hair follicle stem cell,HFSC)周期性的生长、增殖、分化及真皮乳头细胞与上皮细胞之间的信号互作密切相关[8~9]。以内蒙古绒山羊为例,其初级毛囊周期性变化不明显,但次级毛囊具有明显的季节性周期变化。在生长期,毛囊底端真皮乳头细胞发出的增殖信号诱导毛母质细胞快速增殖分化并向真皮层延伸形成毛干和内根鞘[10~11],毛囊形态结构处于动态平衡。随后,真皮区域的毛囊可再生部位的毛母质细胞增殖减少,毛球发生萎缩,毛干停止分化并形成杵状毛发,进入退行期。接着,毛囊进入细胞活动程度最低的休止期[12]。在休止期末期,毛球开始再生,HFSC分化并进行增殖,毛囊再生部分进行重建,进入下一轮的生长期。此时杵状毛干会因新毛干的产生被顶出皮肤表层,直至脱落。不同哺乳动物毛囊周期性生长的3个时期的持续时间长短不同,表1对几种哺乳动物毛囊生长不同时期的持续时间进行了概括[13~16]。

表1 不同哺乳动物毛囊生长周期不同阶段的持续时间Table 1 Duration of different stages of hair follicles in different mammals
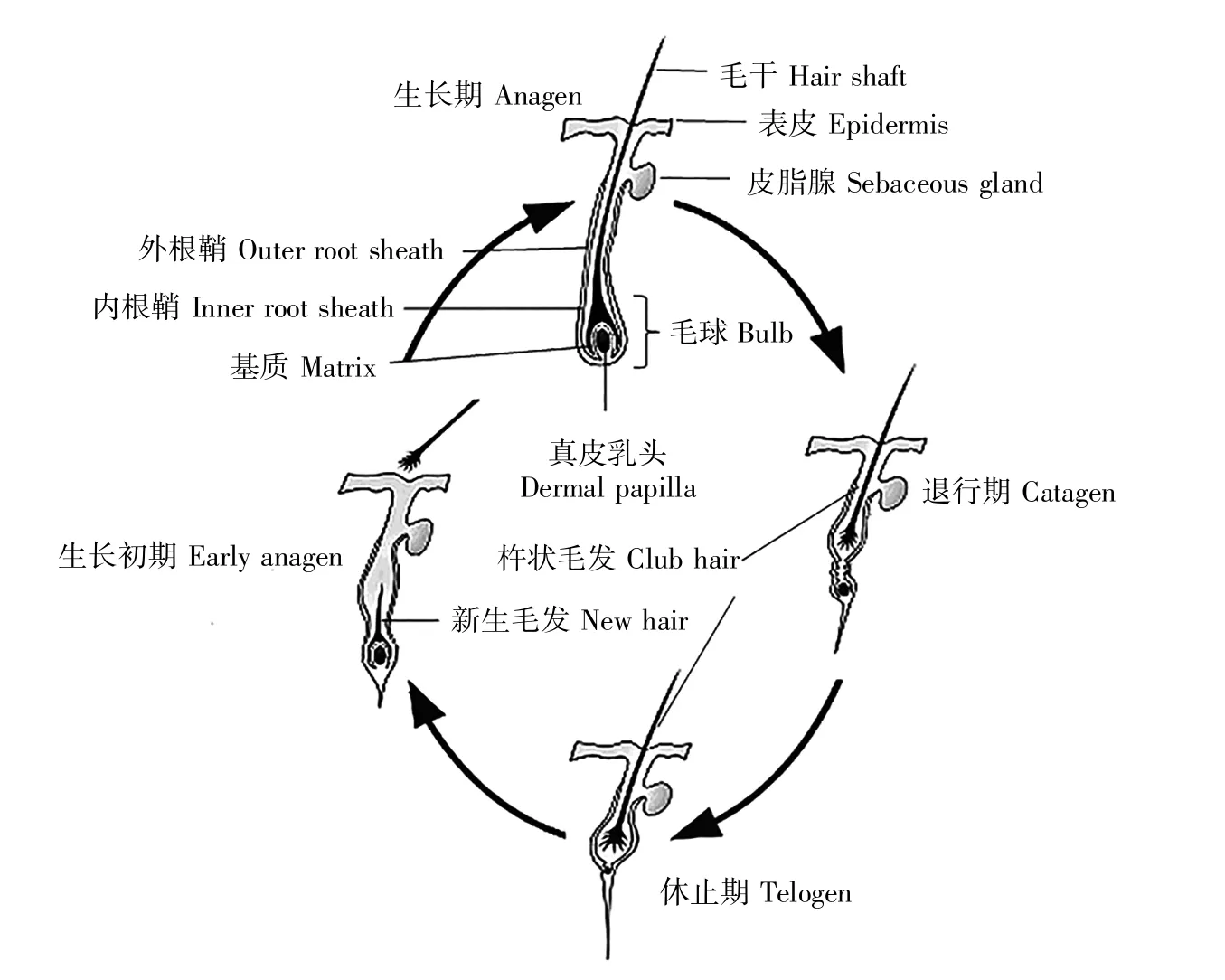
图1 毛囊组织结构及生长周期[4,7]Fig.1 Structure and periodic growth of hair follicles[4,7]
2 毛囊周期性生长的调控机制
毛囊的周期性生长是在一个极其复杂的调控网络下进行的,由一系列调控因子共同参与,包括褪黑素、毛囊生长发育相关的基因及信号通路、非编码RNA和毛囊细胞活动相关的一些蛋白质/细胞等。
2.1 褪黑素与毛囊生长发育
褪黑素是主要由松果体和视网膜分泌的一种高度保守的吲哚类激素[17],在哺乳动物皮肤中也能合成和代谢[18~20],广泛存在于多种动植物组织和器官内,通过与其受体MTR(melatonin receptor)结合发挥着重要的生物学作用。研究发现,褪黑素在调节不同哺乳动物皮毛生长中发挥重要作用(表2)[21~26]。早在1969年,Rust等[21]在使用外源褪黑素促使白鼬过早成熟、诱导蜕皮时就发现了褪黑素在动物季节性换毛中的重要作用。Allain等[27]在给成年雌貂埋植或者口服褪黑素时发现,其毛囊数目和毛产量大大增加,人们在獭兔[28]和内蒙古绒山羊[29~30]的研究中得到类似结果。Frank等[31]发现,经褪黑素治疗的脱毛博美犬在数月后出现了毛发再生和增多,说明褪黑素能够促进哺乳动物毛发生长、毛囊密度增加以及诱导毛发再生。针对济宁青山羊的研究报道,MTR-1A在大猾皮中的表达水平极显著高于其在胚胎期、小猾皮、成年羊背部皮肤中的表达水平,说明MTR-1A在促进初级毛囊毛纤维生长和次级毛囊发育起始阶段起正向作用[32]。由此可见,褪黑素在多种哺乳动物毛皮生长中具有正向调控作用,将其科学应用到毛皮用经济动物的养殖中,有可能带来可观的经济收益。

表2 褪黑素在不同哺乳动物皮毛生长中的作用Table 2 The role of melatonin in the fur growth of different mammals
研究报道,埋植褪黑素能够缩短内蒙古绒山羊次级毛囊的生长周期,促进绒毛生长,提高绒毛产量,并推迟脱绒时间,但对初级毛囊生长周期和粗毛长度无显著影响[33],这与常子丽[34]在内蒙古绒山羊中的研究结果以及黄冬维等[35]在长毛兔上的研究结果具有一致性。此外,埋植褪黑素使Wnt10b在次级毛囊外根鞘和连接组织鞘中的表达提前1~2个月,进而使新绒毛的生长提前[33]。付绍印等[36]发现,在绒毛兴盛前期(6月份)埋植褪黑素下调了 miR-203、miR-205、miR-96、miR-183、miR-199a的表达,并提前诱发了绒毛的二次生长,其中miR-96的下调能够提高毛囊细胞活性,抑制毛囊细胞凋亡,推测褪黑素与转录后调控因子miRNAs相互联系,共同作用于皮肤毛囊生长周期,影响绒毛生长。Notch信号通路是已知的能够调节HFSC生长分化和增殖的通路,该通路受到Numb、Deltex等基因的调控。张宁宁[37]发现,不同浓度的褪黑素均能影响HFSC以及Notch信号通路相关基因Notch1、Hes-1、Numb和Deltex的表达趋势,推测褪黑素可能与Notch通路相关基因相互作用影响HFSC的活动,从而调节毛囊生长周期。此外,Ge等[38]通过对褪黑素处理的陕北绒山羊背部皮肤次生毛囊干细胞(gsHFSC)进行lncRNA测序发现,褪黑素的介导影响了黏着斑和胞外基质受体通路相关的基因,促进了毛囊的生长;其中lncRNA TCONS_00255106和TCONS_00206163分别靶向影响了毛囊相关基因COL4A2和THBS2的表达趋势,推测褪黑素能够影响毛囊形态发生相关基因,并通过lncRNA调控靶基因表达,影响HFSC自我更新。Jin等[39]通过体外培养不同浓度、不同时间褪黑素处理的辽宁绒山羊成纤维细胞以及测序分析各组细胞中lncRNA和mRNA的差异表达发现,0.2 g/L褪黑素处理72 h对羊绒生长最有利,且褪黑素通过上调lncRNAMTC的表达促进成纤维细胞增殖,其过表达激活了具有相同促进作用的核因子κB(nuclear factor-κB,NF-κB)信号,推测褪黑素通过提高lncRNAMTC的表达激活NF-κB信号,从而控制毛囊生长发育和毛发生长。由此可知,褪黑素并不是单独影响毛发生长的,它通过与相关调控因子互作,共同调节动物毛发生长,但其作用机制仍不明确,有待进一步研究。总的来讲,多角度联合探索褪黑素在动物皮毛中的作用机制有助于更好地理解影响动物毛皮品质的因素,为生产实践提供理论基础。
2.2 毛囊生长发育相关的信号通路
近年来,关于毛囊生长发育调控信号通路的研究越来越多,尤其是 Wnt/β-catenin、BMP和FGF5信号通路。Huelsken等[40]发现,表皮中βcatenin基因发生突变会导致小鼠毛囊基板形成受阻;即使在毛囊初次形成后敲除β-catenin基因,在一次生长周期后毛囊仍会出现生长缺失。与该结果类似,Tao等[41]发现敲除小鼠毛囊真皮乳头中的β-catenin基因导致毛母质细胞凋亡,毛囊提前进入退行期,且激活真皮层的Wnt/βcatenin信号能够调控HFSC的毛发诱导能力并诱发皮肤的纤维化,与下游的BMP及FGF等信号通路交互调控异位毛囊的发生。马森[42]发现,Wnt/β-catenin通路的上游基因 Wnt3、β-catenin和Tef3等的表达在陕北绒山羊毛囊生长前期缓慢上调,在生长旺盛期达到最高,并在退行期至休止期逐渐下降。这些研究说明,Wnt/β-catenin在毛囊生长过程中起到正向调控作用,能够促进毛囊生长初期基板形成、激活HFSC,使毛囊进入生长期(毛囊再生阶段)。相关研究显示,Wnt/β-catenin下游信号中表达于表皮层的BMP2和真皮层的BMP4、BMP7在毛囊形成初期抑制基板的形成[43],且当BPM2基因表达于小鼠皮下脂肪和真皮层时,其在休止期早期的表达水平较高,而末期没有表达[44]。Song等[45]通过qRT-PCR和Western-blot实验发现,BMP2基因和BMPR-IA(BMPⅠ型受体)基因在牦牛皮肤毛囊休止期的表达量水平高,而BMP的拮抗剂Noggin在生长期前期和中期的表达水平显著高于休止期。Noggin通过抑制BMP信号促进毛囊生长,当位于毛囊真皮凝聚物中的Noggin过量表达时,真皮层中BMP抑制Wnt信号的抑制环境消失,从而促进HFSC的活化,使毛囊进入下一轮周期的生长期[45~46]。这些结果表明,BMP和Noggin在毛囊周期中的表达具有时空差异性,可作为毛囊休止期的标记信号。需要指出的是,相关研究对0~6周龄不同时期水貂皮肤组织内的BMP2表达水平进行了分析,发现在水貂不同周龄皮肤中BMP2表达较为稳定,推测BMP2对0~6周龄水貂毛囊发育无直接影响[47]。这说明BMP2在不同物种毛囊发育时期中的作用存在差异。同样能够抑制毛囊生长的FGF5蛋白是迄今已知的最强劲的促进毛囊从生长期向退行期转化并进入休止期的调控因子。Higgins等[48]利用重组FGF5基因处理人皮肤毛囊,发现其在2~4 d后提前进入退行期,而对照组毛囊则在5~7 d进入退行期,提示FGF5基因能够启动毛囊退行期,抑制毛发生长。研究显示,FGF5基因突变会引起猫和狗的毛发长度发生改变[49~50],这与梁东[51]发现的水貂绒毛长度与FGF5基因表达水平呈负相关的结果一致。FGF5基因过表达会增加BMP4 mRNA的表达,从而抑制Noggin表达,导致毛发生长受到抑制[52],这说明FGF5与BMP信号互作,共同抑制毛囊的生长期活动。有意思的是,赵德超等[53]研究发现埋植褪黑素会提高FGF5基因的表达,导致绒山羊毛囊生长期提前,促进绒山羊羊绒的生长,这与He[52]、Higgins[48]等的研究结果不一致,说明FGF5在不同物种和不同处理条件下对毛囊的生长调控作用存在差异,其具体作用机制需要进一步探究。
除此之外,TGF-β(transforming growth factorβ)、Notch、SHH(sonic hedgehog)等信号通路也都在毛囊的生长发育过程中起重要作用。各信号通路相互协调,共同参与毛囊的生长发育。这些相关研究可为人为调控毛用经济动物的毛囊生长周期从而提高绒、毛产量和质量提供理论与实验基础。
2.2 非编码RNA对毛囊生长发育的调控
2.2.1 miRNA调控毛囊生长发育
miRNA是一类长度为20~24 nt的内源性非编码RNA分子,在多种真核生物中均有分布[54]。已知的miRNA生物学功能有调控胚胎发生、器官分化、个体发育[55]以及多个信号通路、代谢过程[56]等。近年来研究发现,miRNA参与哺乳动物毛囊的生长发育,而且关于miRNA参与小鼠、绵羊、山羊等哺乳动物皮肤毛囊发育和周期性生长的报道越来越多。
Yi等[57]首次描述了miRNA在皮肤中的特征,并证明其在胚胎发育过程中参与单层上皮多能干细胞分化形成表皮及其附属物的生物学过程。研究报道,miRNA成熟所需的酶基因(Dicer基因)被敲除后,发育中的毛囊细胞发生非正常的凸起,出现毛囊形态的异常[57],说明miRNA参与构建毛囊细胞形态。Liu等[58]发现,miR-195可能通过靶向调控Wnt/β-catenin通路中的SMAD2(mothers against decapentaplegic homolog 2)和FZD6(Frizzled 6)基因而在毛囊发生初期促进毛囊生长。相关研究利用测序技术分析了内蒙古绒山羊皮肤毛囊3个生长时期的miRNA,得到生长期、退行期、休止期特异表达的miRNA分别为15个、8个和7个,说明差异表达的miRNA可能通过调节毛囊细胞活动影响毛囊周期,其在毛囊时期的转换过程中可能发挥重要作用[59]。这有利于筛选鉴定毛囊生长阶段的miRNA分子标记。同时,通过人为干预相关miRNA调控靶基因的表达调节毛囊生长进程,可在一定程度上避免季节因素对毛囊生长周期的影响,从而得到高产高质的绒、毛。
2.2.2 lncRNA调控毛囊生长发育
lncRNA是一类长度超过200 nt且本身不具有编码能力的非编码RNA[60]。研究发现,lncRNA在表观遗传水平(如基因组印记、染色质修饰、剂量补偿效应)、转录及转录后水平、核内运输等重要过程发挥调控作用[61~63]。随着高通量测序技术的发展,lncRNA在毛囊生长发育中的研究也已获得一定成果,其中关于绒山羊皮肤毛囊的研究颇多。
研究证明,相关lncRNA在绒山羊毛囊周期性生长过程的表达具有时间特异性。针对陕北绒山羊皮肤毛囊周期性生长的lncRNA的研究发现,198个lncRNA在生长期和休止期差异表达。其中,lnc_00092、lnc_000183、lnc_000406 和 lnc_000559为休止期特异表达的lncRNA;lnc_000173为生长期特异表达的lncRNA,可作为生长时期鉴定的标记lncRNA[64]。Bai等[65]通过研究辽宁绒山羊次级毛囊生长期和休止期的转录模式发现,6种已知的lncRNA(lncRNA-599618,-599556,-599554,-599547,-599531和-599509)在生长初期的表达显著高于休止期,且均在毛囊生长期的Wnt信号通路中高表达,而4种已知的lncRNA(lncRNA-599528,-599518,-599511和-599497)在休止期的表达显著高于生长期,这说明生长期高表达的6种lncRNA可能与Wnt信号协同作用,促进毛囊基板形成及HFSC的激活、分化和增殖,从而促进绒毛纤维生长,而休止期高表达的lncRNA可能参与抑制HFSC的分化,从而使毛囊处于休眠状态。这些结果为进一步揭示lncRNA在其他哺乳动物皮肤毛囊中的周期转换机制提供了借鉴。
研究发现,lncRNA可通过调节下游靶基因的表达调控毛囊的生长发育。Zhou等[66]利用多组学方法,通过顺式和反式调节研究了lncRNA的靶基因,发现角蛋白基因和角蛋白相关基因KRT38、KRT4、KRTAP15-1、KRTAP13-1及 KRTAP3-1在毛囊生长期的表达高于退行期,而KRT2、KRTDAP、KRT77和KRT80则相反,推测lncRNA通过靶向调控毛囊相关角蛋白影响毛囊生长周期进程。Si等[67]通过细胞转染实验发现,PlncRNA-1转染会显著促进HFSC的细胞周期、增殖和分化,且引起 TGF-β1、Wnt3和 β-catenin基因表达的上调。此外,TGF-β1的抑制剂会导致HFSC中Wnt和β-catenin的表达水平降低,并抑制HF-SC的细胞周期,降低由PlncRNA-1转染诱导的细胞周期的加速。这一结果说明PlncRNA-1可通过TGF-β1基因介导的Wnt/β-catenin信号通路调节HFSC的细胞周期,影响其增殖和分化。Cai等[68]发现,lncRNA5322转染后通过上调PI3K/Akt信号促进miR-21表达,并诱导HFSC的增殖和分化,其中miR-21是lncRNA5322在HFSC分化时的直接靶标,提示miRNA与lncRNA协同作用促进毛囊生长。
此外,上文也提到lncRNA能通过调控基因的靶向表达,或通过褪黑素介导,调节毛囊生长周期的活动。而且,有研究证实lncRNA在毛囊真皮乳头细胞的分化、真皮凝聚物和毛囊基板的形成及HFSC的增殖与分化中有重要的作用,是次级毛囊发生时的必需因素[69]。由此可见,lncRNA在毛囊生长发育中发挥重要作用,并通过参与调控毛囊生长相关基因的表达、与多种信号通路互作以及褪黑素的介导发挥生物学功能。因此,通过高通量测序技术、生物信息学手段及分子实验技术分析lncRNA在毛囊生长发育过程中的作用机制并构建其与其他相关调控的互作网络,对了解毛囊生长发育的分子机理尤为重要。
2.3 毛囊生长发育相关的其他蛋白质/细胞
2.3.1 ⅩⅦ型胶原蛋白
ⅩⅦ型胶原蛋白是半桥粒的主要成分之一,由COL17A1基因编码,因此也被称为COL17A1蛋白。已有研究证实,COL17A1蛋白参与维持HFSC的自我更新[70]。Matsumura等[71]以小鼠为研究对象发现,过表达COL17A1蛋白的年老小鼠仅有较少毛囊发生萎缩,且脱毛现象减轻,HFSC活性高,而正常表达COL17A1蛋白的年老小鼠的毛囊大面积萎缩且脱毛严重,HFSC活性低,同时皮肤弹性变差。这说明在COL17A1蛋白的介导下毛囊中HFSC的老化情况得到抑制,从而有助于减少脱发和皮肤衰老。这一发现对治疗人类脱发和延缓皮肤衰老具有重要意义。Liu等[72]发现COL17A1蛋白表达水平的高低会影响上皮干细胞的生存能力,高表达COL17A1的表皮干细胞竞争力强,并可加快毛囊的生长发育及生长周期的更替。这些研究说明COL17A1蛋白的表达会影响毛囊细胞的生存能力,从而影响毛囊周期进程。这为人工参与并调控人以及皮毛用动物(如水貂、长毛兔、绒山羊)的毛囊生长周期提供了新的实验方向,可能有助于解决人类脱发问题以及获得高产高质的皮毛商品。
2.3.2 乳酸脱氢酶
乳酸脱氢酶(lactate dehydrogenase,LDH)是一种能够催化NADH依赖性丙酮酸还原成乳酸和NAD+依赖性乳酸氧化成丙酮酸的糖酵解酶,其能够促进HFSC活化,而HFSC的活化和增殖是促进毛囊周期更新的先决条件[73~74]。Flores等[74]以小鼠为研究对象,通过酶比色法发现,LDH在HFSC中的活性明显比在其他皮肤细胞中高,且在HFSC大量富集。当LDH缺乏时,HFSC无法被激活;相反,当促进乳酸产生时,HFSC被快速激活,毛囊进入新的循环周期,推测乳酸的产生是HFSC激活的关键因素,影响毛囊周期的更替。该结果有助于进一步探究HFSC活动对毛囊周期性生长的调控机制。
2.3.3 调节性T细胞
调节性T细胞(regulatory T cells,Tregs)是一类与机体免疫抑制相关的T细胞亚群,在维持机体免疫稳态、肿瘤免疫、移植耐受等方面具有重要的调节功能[75]。小鼠和人类皮肤组织中都含有大量的Tregs[76~77],且皮肤中的Tregs在毛囊附近富集[76,78],能够促进毛囊休止期向生长期的转换。Ali等[79]通过RNA-seq发现,缺乏Tregs的小鼠HFSC中与细胞增殖相关的基因比Tregs丰富的对照组明显减少,这说明Tregs可通过促进细胞增殖基因的表达加快HFSC的激活和分化,使得毛囊生长期提前,从而提高绒、毛的产量。以上结果从免疫T细胞的角度揭示了HFSC的活动规律,但其与相关基因的互作机制仍需进一步探究。
上述结果说明毛囊的周期性生长过程涉及到许多蛋白质/细胞,它们通过直接或间接的相互作用影响毛囊细胞的生长活动,尤其是HFSC,从而调控毛囊的生长周期。虽然一些关于毛囊周期性生长的新研究在糖酵解酶和免疫细胞方面已经有所突破,但它们大多集中在对HFSC活动的影响上,具体的调控机制有待进一步探究。另外,目前相关研究多是在小鼠中进行的,考虑到物种间毛囊生长发育的差异性,在人、绒山羊、兔子、水貂等哺乳动物中的研究仍需要继续推进。
3 结语与展望
毛发作为哺乳动物皮肤的重要衍生物,是羊、兔、水貂等哺乳动物的重要经济性状,具有重要的研究意义。毛囊作为产生毛发的微小器官,其周期性生长主要受到褪黑素的节律调节。此外,miRNA、lncRNA、胶原蛋白、糖酵解酶及T细胞等众多因素也参与其调控,各因子之间通过促进、抑制或间接靶向等作用调控毛囊生长发育。近年来,褪黑素、相关基因及信号通路在哺乳动物毛囊周期性生长上的研究成果颇丰,但从非编码RNA靶向基因调控、非编码RNA-mRNA调控网络构建、代谢途径和免疫反应角度研究毛囊生长发育的报道较少,其具体调控机制仍需进一步挖掘。由于HFSC是毛囊生长周期更替的关键因素,对毛囊再生意义非凡,因此深入研究HFSC的激活机制有重要意义。其中,从基因互作、乳酸代谢途径及免疫反应等角度全方位揭示哺乳动物HFSC的活化机制亟待进行。
高通量测序技术的飞速发展为进一步解析哺乳动物毛囊生长发育的分子调控机制提供了有利工具。利用转录组技术进一步深入探究毛囊周期性生长转录水平上的分子调控机制;结合多组学技术分析并构建转录后水平调控模式;通过细胞水平和活体验证来全方位解析毛囊生长发育规律,并将其应用到生产实践中,可为进一步改善兔、绒山羊、水貂等毛用哺乳动物的毛皮品质提供科学的理论指导和研究方向。

