基于PI3K/Akt通路研究理中汤治疗胃溃疡大鼠的作用机制*
陈永祥,王明娟,周舟
1.河南中医药大学第三附属医院,河南 郑州 450008;2.河南中医药大学第一附属医院,河南 郑州 450001
胃溃疡(gastric ulcer,GU)属于常见的消化性溃疡疾病,是发生在胃窦、胃角、贲门、裂孔疝等部位的炎性坏死性疾病[1]。物理及化学因素引起的胃黏膜氧化应激与炎症反应均为GU发病的主要原因[2]。GU病程较长且病情易反复,若不及时治疗可能演变为胃穿孔,危及患者的生命安全[3]。中医学归结“寒、热、虚、实”等因素实施辨证论治,在GU的临床治疗中取得了一定的成效[4]。理中汤是《伤寒论》中的温中名方,有温中祛寒、补虚回阳之效。本研究旨在探讨理中汤对大鼠醋酸性GU的保护作用。
1 材料
1.1 动物50只3月龄SPF级雄性SD大鼠,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,动物合格证号:SCXK2006009。饲养在22~25℃室温,相对湿度45%~55%环境,自由进食饮水,自然光照,处理方法遵守动物伦理原则。
1.2 药物与试剂理中汤(由附子、人参、干姜、白术、炙甘草组成,购自湖南中医药大学附属第一医院);雷尼替丁(北大医药股份有限公司,批号:200506);PI3K、Akt、GAPDH抗体(美国CST公司,货号分别为:6342S、4968S、3263S);水合氯醛(上海泽叶生物科技有限公司,货号:ZY-6604);冰醋酸(上海高创化学科技有限公司,货号:0714-2.5L);肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)试剂盒(上海广锐生物科技有限公司,货号分别为:DS-535、DS-309、DS-320);BCA定量检测试剂盒(南京凯基生物发展有限公司,批号:KGP856);DMSO(美国Sigma公司,D5879);Marker(Fermentas公司,货号:26384);ECL荧光底物(北京全式金生物技术有限公司,货号:DW102-04);Trizol试剂(Takara公司,批号:A4537);RNA提取试剂盒(德国QIAGEN,货号:);逆转录试剂盒(日本TaKaRa公司,货号R6943);RIPA裂解液(日本TaKaRa,货号:RR3792);引物合成(上海生工生物工程有限公司)。
1.3 仪器DMLS2型显微镜(德国Leica公司);TP1020型生物组织脱水机(德国Leica公司);NP-B型生物组织包埋机(德国Leica公司);RM2235型切片机(德国Leica公司);电泳仪、转膜仪(美国Bio-Rad公司);7500型实时荧光定量PCR仪(美国ABI公司);实时荧光定量PCR试剂盒(日本TaKaRa公司)。
2 方法
2.1 动物分组与建模大鼠适应性饲养1周,采用双盲法对大鼠进行随机分组,即正常对照组、模型组、理中汤低剂量组、理中汤高剂量组与雷尼替丁组,每组10只。采用乙酸注射法制备GU大鼠模型,具体方法[5-6]:术前大鼠禁食不禁水24 h,腹腔注射10%水合氯醛(20 mg·kg-1)进行麻醉,然后将大鼠固定在动物手术台上,剃除腹壁毛后进行常规消毒。沿剑突向下切开腹壁(约2 cm)将胃剥离,采用微量注射器于胃壁肌层处注入20μL乙酸,出现半透明白斑后将胃送回腹腔,切口用生理盐水清洗,之后覆盖网膜并将腹壁缝合,正常对照组注射同体积的生理盐水。
2.2 给药方法术后1 d给予各组大鼠药物灌胃治疗,成人理中汤临床剂量约为1 g·kg-1,根据动物体表面积换算法大鼠的给药剂量约6 g·kg-1,故本研究设置理中汤低剂量为6 g·kg-1,理中汤高剂量为12 g·kg-1,雷尼替丁剂量为0.3 g·kg-1,正常对照组与模型组给予同体积的生理盐水灌胃,均连续给药2周。
2.3 指标检测
2.3.1 大鼠血清炎性因子的检测 末次给药1 h后采用水合氯醛麻醉大鼠,取大鼠血清,ELISA法检测大鼠血清炎性因子TNF-α、IL-1β、IL-6水平。
2.3.2 HE染色观察大鼠胃组织病理变化情况 每组随机3只大鼠,取其胃组织于固定液(Bouin+福尔马林)中,待蛋白质变性后将固定液冲洗干净;石蜡包埋切片,烘干切片后脱蜡经梯度乙醇脱水;苏木素染色10 min,冲洗后盐酸乙醇分化,冲洗干净后伊红染色30 s,脱水透明封片后镜检,观察大鼠胃组织病理变化。
2.3.3 RT-PCR法检测大鼠胃组织PI3KmRNA、AktmRNA水平 每组随机选择3只大鼠,取胃组织样本,通过Trizol法提取总RNA,采用核酸定量分析仪检测RNA浓度,检测吸光度,(260 nm处)/(280 nm处)均在1.8~2.0,反转为cDNA扩增。内参基因为β-actin,参考试剂盒说明书设置各项参数,95℃预变性2 min→95℃变性15 s→60℃退火60 s,循环40次,65℃终末延伸5 s。记录扩增曲线,通过比较2-ΔΔCt值法计算相对表达量。具体的引物序列见表1。

表1 引物序列
2.3.4 Western Blot检测大鼠胃组织PI3K、Akt蛋白表达 每组随机选择3只大鼠,取胃组织,充分剪碎后加入裂解液(PMSF+RIPA)制备成匀浆,冰浴后离心。取上清液通过BCA试剂盒进行蛋白定量,SDS-PAGE凝胶电泳,按1∶1 000比例加入一抗兔抗多克隆PI3K、Akt抗体与二抗山羊抗兔IgG,转膜、显色、成像,采用Quantityone软件扫描各条带灰度,对蛋白表达量进行分析。
2.4 统计学分析采用SPSS 21.0统计软件进行数据分析,计量数据资料以(±s)表示,组间比较采用单因素方差分析,数据进行方差齐性检验。组间两两比较采用LSD-t检验法,P<0.05表示差异有统计学意义。
3 结果
3.1 大鼠血清炎性因子的检测与正常对照组比较,模型组大鼠血清TNF-α、IL-1β、IL-6水平均明显升高(P<0.05),与模型组比较,理中汤低、高剂量组与雷尼替丁组血清TNF-α、IL-1β、IL-6水平均明显下降(P<0.05)。见表2。
表2 对大鼠血清TNF-α、IL-1β、IL-6水平的影响 (±s,ng·L-1)

表2 对大鼠血清TNF-α、IL-1β、IL-6水平的影响 (±s,ng·L-1)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05
组别 n 剂量/g·kg-1 TNF-α IL-1βIL-6正常对照组10 - 2.58±0.11 3.45±0.16 2.70±0.13模型组 10 - 4.27±0.23* 4.78±0.20* 3.55±0.26*理中汤低剂量组 10 6 3.91±0.25 4.58±0.26 3.41±0.09理中汤高剂量组 10 12 3.16±0.18# 4.10±0.28# 3.10±0.27#雷尼替丁组 10 0.3 3.48±0.10# 4.25±0.34# 3.22±0.28#
3.2 大鼠胃组织病理变化正常对照组大鼠胃黏膜组织结构排列整齐,未出现充血、水肿等症状;模型组大鼠胃黏膜腺体消失,出现明显的瘢痕组织与坏死层,充血、水肿症状较为严重;理中汤低、高剂量组与雷尼替丁组可见坏死层减少,胃黏膜腺体水增加,充血、水肿症状明显减轻。见图1。

图1 大鼠胃组织病理变化(HE,×100)
3.3 RT-PCR法检测大鼠胃组织PI3K mRNA、Akt mRNA水平与正常对照组比较,模型组大鼠胃组织PI3KmRNA、AktmRNA水平均明显升高(P<0.05);与模型组比较,理中汤低、高剂量组与雷尼替丁组均可降低大鼠胃组织PI3KmRNA、AktmRNA水平(P<0.05)。见表3。
表3 对大鼠胃组织PI3K mRNA、Akt mRNA水平的影响 (±s)

表3 对大鼠胃组织PI3K mRNA、Akt mRNA水平的影响 (±s)
注:与正常对照组比较,*P<0.05;与模型组比较,#P<0.05
组别 n 剂量/g·kg-1 PI3K mRNA AktmRNA正常对照组3- 1.00±0.00 1.00±0.00模型组 3 - 1.38±0.04*1.35±0.04*理中汤低剂量组 3 6 1.28±0.02 1.26±0.03理中汤高剂量组 3 12 1.21±0.03#1.12±0.01#雷尼替丁组 3 0.3 1.25±0.05#1.21±0.02#
3.4 Western Blot检测大鼠胃组织PI3K、Akt蛋白表达与正常对照组比较,模型组大鼠胃组织PI3K、Akt蛋白表达均明显上调(P<0.05);与模型组比较,理中汤低、高剂量组与雷尼替丁组均可明显下调大鼠胃组织PI3K、Akt蛋白表达(P<0.05)。见表4、图2。
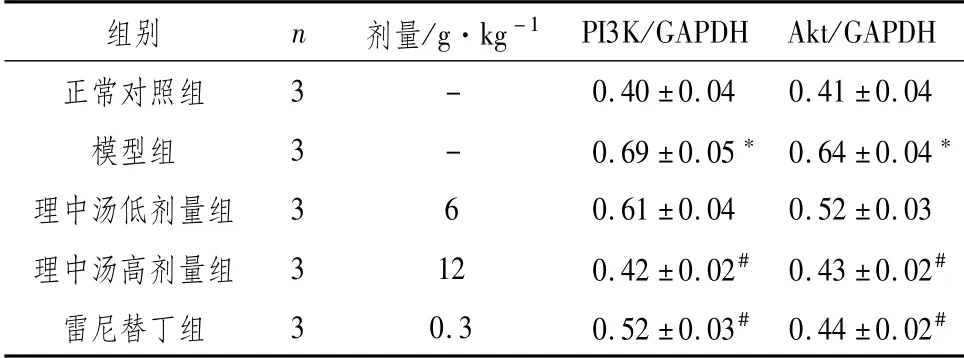
表4 对大鼠胃组织PI3K、Akt蛋白表达的影响

图2 大鼠胃组织PI3K、Akt蛋白表达
4 讨论
GU是一种常见多发病,幽门螺杆菌感染、药物及饮食因素、应激精神因素、遗传因素等均可诱发GU[7]。具有易感倾向人群受到不良因素刺激时,巨噬细胞与淋巴细胞被激活并释放TNF-α、IL-1β、IL-6等炎性细胞因子[8-9]。TNF-α参与调节免疫细胞活化炎症反应,其水平异常上调可改变血管通透性并诱导产生凝血酶,促使胃黏膜微血管在炎症发生时形成微血栓引起黏膜微循环障碍,同时还会进一步促进IL-6等炎性细胞因子的释放,加重胃损伤[10-11]。IL-6可调节T细胞活化[12],大量炎症细胞聚集可导致粒细胞呼吸爆发并产生大量活性氧加重炎症反应[13],活化的中性粒细胞又可分泌TNF-α等炎性细胞因子,扩大炎症反应[14]。GU病理过程中,IL-1β可以趋化炎性细胞在病灶部位聚集并促使白细胞黏附分子表达,其自身水平也会明显上调,可作为判断GU严重程度的指标[15]。研究发现,理中汤可下调大鼠胃组织PI3K、Akt蛋白表达,降低胃组织PI3KmRNA、AktmRNA水平说明PI3K/Akt信号通路参与了大鼠GU病理变化过程[16]。PI3K/Akt信号通路是调节细胞代谢、分化、增殖、凋亡的重要通路[17],其中PI3K是一种胞内磷脂酰肌醇激酶,与v.sre和v.ras等癌基因产物相关,本身具有磷脂酰肌醇激酶与丝氨酸/苏氨酸激酶活性[18]。Akt是丝氨酸/苏氨酸特异性蛋白激酶,参与细胞增殖、细胞迁移、细胞凋亡等过程[19]。PI3K由催化亚基p110与调节亚基p85构成,其被激活时,p110可诱导PIP2转变为PIP3与Akt结合促使其活化[20]。PI3K、Akt基因及蛋白异常表达会促进细胞发生凋亡并推动GU疾病进展。
中医学并无GU的病名记载,但根据其节律性、周期性上腹疼痛的特点,可将其归于“胃脘痛”“胃痛”等范畴[21]。胃脘痛的病机在于脾胃虚弱、肝胃失和、外邪犯胃,脾胃虚寒是GU的常见类型[22]。随着人们生活品质的提高与饮食结构的变化,长期的饮食不节与身心压力均会引起脾胃虚寒,久而成疾[23]。《伤寒论》中记载理中汤具有补气健脾、补虚回阳的功效,方中人参补脾益肺、大补元气,用于治疗脾虚食少、体虚欲脱之症;干姜回阳通脉、温中逐寒,可发诸经之寒气,治感寒腹痛[24]。药理学研究,白术、甘草具有抗炎镇痛、抗消化道溃疡的作用[25-26]。诸药配伍可补益脾肾、中阳建运,下降浊阴、上升清阳,标本兼治,疗效显著。
研究发现,附子理中汤可以有效改善GU模型大鼠消瘦、饮食下降等症状,并保护胃黏膜细胞,减轻其水肿、炎性细胞浸润等,对胃组织起到保护作用[27]。有研究认为,PI3K、Akt基因及蛋白表达水平异常会促进炎性细胞因子释放并诱导胃黏膜细胞发生凋亡,从而加重GU病情[28]。陈小娟等[29]指出,加速胃黏膜溃疡修复需要下调炎性因子表达水平,调节TLR-2/MyD88信号通路。夏菁等[30]指出,吴茱萸碱可以通过调节Hedgehog信号通路,减轻炎症反应与氧化应激损伤从而起到保护胃黏膜的作用。
GU的发生与炎症反应相关,且通过干预某些信号通路能够降低炎性细胞因子表达水平,从而起到改善GU的效果。治疗GU的关键在于通过调节信号通路抑制炎症反应等对胃组织的不良刺激,从而改善GU病情。
综上所述,理中汤可明显降低胃溃疡大鼠血清炎症水平,下调大鼠胃组织PI3K、Akt蛋白表达,可能与调控PI3k/Akt通路有关。但诱发GU的机制多样,涉及的信号通路也较为复杂,理中汤抗乙酸所致GU的具体作用过程还需进一步进行研究。

